南海北部近6 Ma以来中层水体演化的底栖有孔虫证据①
周 洋 陈 芳 苏 新 刘 坚 庄 畅
(1.国土资源部海底矿产资源重点实验室 广州海洋地质调查局 广州 510075;2.中国地质大学海洋地质学院 北京 100083)
晚中新世以来全球气候变化和海洋循环系统均发生重要转型,全球气候从晚中新到上新世的“温室地球”环境转变为晚更新世的“冰室地球”环境,而世界大洋水体亦在三维尺度经历了复杂的演变[1]。在此剧烈演变过程中,海洋循环系统的变迁被认为在全球气候系统演变中扮演着至关重要的驱动和调节作用,深入理解古深海循环状况及水体的物理化学性质对气候变化机制研究有着重要的指示作用。有关晚中新世以来南海中深层水体循环演化和沉积环境研究,前人做了大量的工作,以南海北部下陆坡及海盆区 ODP184航次钻孔的研究相对较多[2,3],但由于缺乏钻孔岩芯资料,很少涉及有中陆坡到陆架区的相关研究。SH7B孔位于南海北部中陆坡神狐海域(图1),该站位水深1 108 m,处于南海中层水和深层水的交界处(约1 000 m)附近,是南海至今为止陆坡区不可多得的钻获晚中新世以来地层的岩芯钻孔之一。该钻孔沉积物中富含大量底栖有孔虫且保存较好。由于底栖有孔虫生活在水和沉积物界面附近,对海底沉积环境的变化极其敏感,因此可以利用海底沉积物中的底栖有孔虫组合和壳体记录的氧碳同位素特征对地史时期海底的沉积环境进行重建,包括底层水体的氧含量与流通状况,海水表层输出古生产力及深部水团结构演化历史等[4]。本文通过对SH7B钻孔底栖有孔虫群落结构特征进行研究,并结合壳体同位素值分析结果,初步探讨南海北部陆坡SH7B孔底层水体环境相对应的南海中层水体晚中新世以来的演变历史。段取样不连续,底栖有孔虫组合变化较大,因此利用SPSS软件进行因子分析和聚类分析,识别出不同的生物组合。利用各组合中底栖有孔虫优势属种所指示的生态环境意义,并参照其他相关指标对南海北部陆坡中层水体的演化进行综合分析。
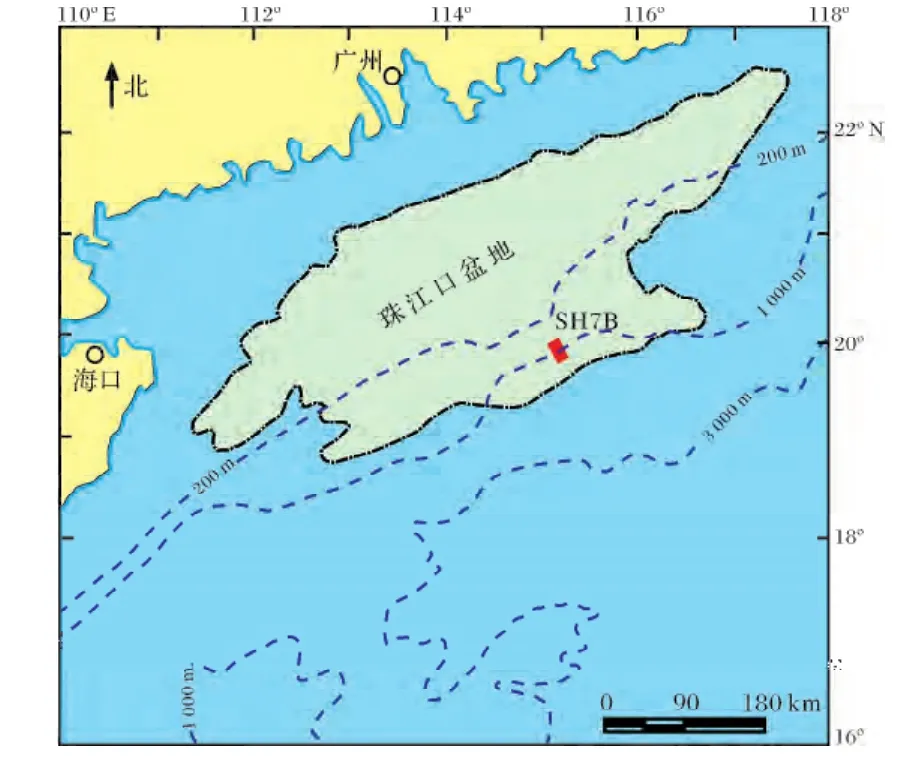
图1 研究钻孔SH7B地理位置(图中虚线为水深等值线,据文献[5]修改)Fig.1 Location of the study Core SH7B(dashed-line contour showing water depth,modified from reference[5])
1 研究材料和方法
SH7B孔取样深度为194.18 m,但由于取芯率的原因,该钻孔部分层段岩芯缺失。本文尽可能对所取岩芯进行分析。其中,0~23.35 m连续取样,23.35~96.00 m未取芯,96.00~194.18 m间断取样,最大间隔27 m。
对该钻孔175个样品进行有孔虫分析,取干重40 g,将样品置于烧杯后,不加任何化学分散剂,在自来水中浸泡1~2天至完全散开,水洗过250目的铜筛(孔径为0.063 mm),留取筛上样品在60°C以下烘干,再用100目(孔径0.154 mm)的铜筛干筛粗组分,对大于0.154 mm的底栖有孔虫个体进行全部鉴定,同时挑选底栖有孔虫Uvigerina spp.送同济大学海洋地质国家重点实验室进行壳体δ18O值和δ13C测试,相关方法前期发表论文已有叙述[5],本文不再赘述。
对鉴定结果进行统计分析,并计算其丰度、分异度,内生种、表生种含量等参数。由于本钻孔部分层
2 研究结果
2.1 年代地层框架
主要依据浮游有孔虫和钙质超微化石的生物地层事件[6],并参照底栖有孔虫 Uvigerina spp.的 δ18O和δ13C值曲线与南海北部ODP1148钻孔氧同位素曲线的[7]对比结果,确定了SH7B孔的年代地层框架。该孔揭示的最老地层达中新统。其中0~23.35 m揭示了MIS8期以来的沉积,上新统/更新统界线位于104.85 m之下,年龄为1.806 Ma,中新统/上新统界线位于171.20 m处,年龄为5.332 Ma(图2)。SH7B孔最底层样品中仍见有大量浮游有孔虫Globorotalia tumida tumida,根据该种初现面生物地层年龄为5.8 Ma[8]判断,SH7B孔最底层样品沉积年代小于5.8 Ma(图2)。
2.2 同位素数据结果
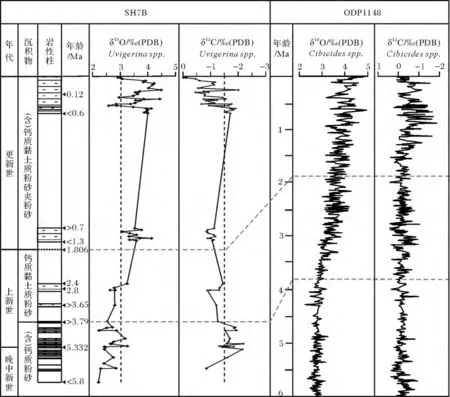
图2 SH7B孔年代地层框架及底栖有孔虫氧碳同位素记录Fig.2 Chronological framework,oxygen and carbon isotope records of benthic foraminiferal in Core SH7B
氧同位素δ18O值在晚中新世晚期到上新世早期5.8~2.8 Ma变化不大,其变化范围为 2.21‰~3.26‰,平均值为2.62‰。晚上新世2.8~2.4Ma底栖有孔虫氧同位素快速增长约8%,平均值为2.85‰。虽然该岩芯上新世部分层段未取芯,样品缺失,但还是可以看出氧同位素曲线整体呈增长趋势。早更新世(1.3~0.7 Ma)虽然样品较少,但氧同位素值整体相对较高,其平均值为3.54‰。晚更新世氧同位素波动频繁,其变化范围为2.58‰~4.49‰,平均值为3.63‰。(图 2)。
碳同位素波动变化亦较频繁,但与氧同位素变化并未呈现完全相反的趋势(图2)。晚中新世到早上新世5.8~3.79 Ma对应氧同位素的相对的低值,碳同位素整体偏负,其变化范围为-0.85‰~-2.19‰,平均值为-1.6‰;晚上新世约3.65 Ma以来碳同位素值与氧同位素值变化趋势相反,其在3.65~2.8 Ma快速增长约25%,平均值为-1.19‰。早更新世虽然样品较少,但碳同位素值相对较为稳定,其平均值为-1.01‰。晚更新世碳同位素波动频繁,其变化范围为-2.01‰~-0.03‰,平均值为-1.11‰。
2.3 底栖有孔虫群落结构特征
底栖有孔虫鉴定结果表明,SH7B孔不同样品中底栖有孔虫含量及属种组成变化较大。其丰度介于8~216个/40 g间,简单分异度低于60,而底栖有孔虫内生种含量均大于50%(图3)。三大类壳质中,以玻璃质含量占绝对优势,瓷质壳和胶结壳相对较少(图 3)。
共鉴定出底栖有孔虫35属56种,平均百分含量大于10%的部分优势属种分布情况如图4所示。由于少量属种仅在个别样品中出现,而同一属种在不同层位含量变化亦较大,为了更好地分析该钻孔中底栖有孔虫属种分布特征,将具有相同生态环境意义的部分种合并到属,选取至少在三个样品中百分含量超过2%的属种,利用SPSS软件进行相关统计分析。为了避免分析软件引起的不必要的误解,舍去鉴定底栖有孔虫总数(统计量)小于40枚的部分样品,使用沃德最小变量协方差矩阵和正交最大方差旋转法对总共128个样品中的34个属种进行Q型聚类和R型因子分析,识别出4个不同的生物组合(图3,5)和4个主因子,这4个主因子总共解释了总方差的63.69%。不同组合中对主因子贡献较大的属种及相应荷载值见表1。
以上相关分析统计结果表明,晚中新世到上新世底栖有孔虫组合相对稳定单一,由组合4组成(图3),但组合4内部群落结构各指标有少许差异。晚中新世晚期到早上新世5.8~3.79 Ma,底栖有孔虫丰度、分异度相对较低,群落结构中内生种占绝对优势,平均含量为 85.84%,表生种较少,平均含量为14.06%;壳体类型多为列式壳或长柱状壳体,以玻璃质和胶结类为主,瓷质壳含量多在8%以下;而3.79~2.4 Ma底栖有孔虫表生种所占比例有所上升,平均含量上升到20.56%,底栖有孔虫丰度、分异度增加。更新世底栖有孔虫主要由组合1、组合2、组合3构成,组合4仅在更新世早期个别样品中出现(图3),底栖有孔虫丰度、分异度及壳体组成变化频繁(图3)。
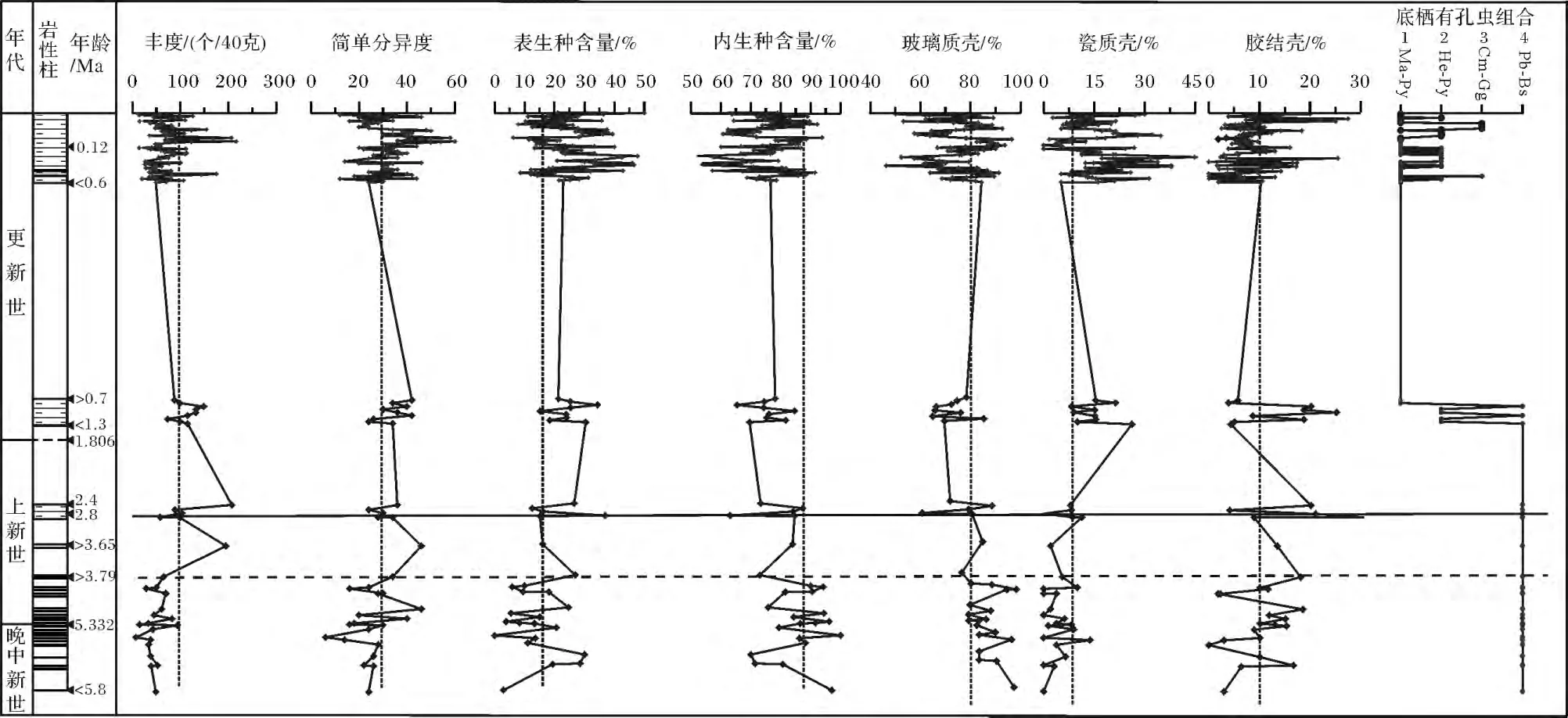
图3 SH7B孔底栖有孔虫群落结构特征Fig.3 The characters of benthic foraminiferal communities in Core SH7B
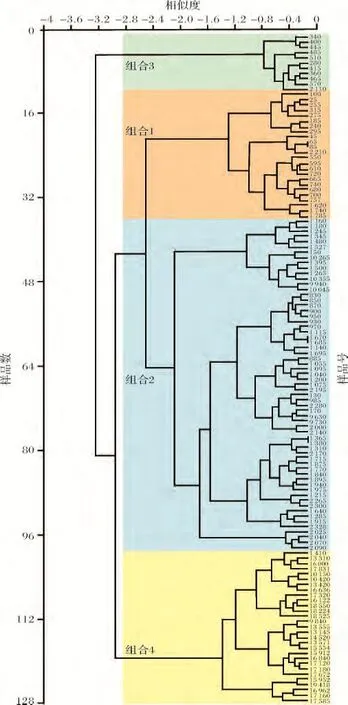
图5 SH7B孔底栖有孔虫聚类分析结果Fig.5 The result of clustering analysis of benthic foraminifera from Core SH7B
3 底栖有孔虫群落生态环境分析
因子和聚类分析识别出4个不同的生物组合,分别代表了4种不同的沉积环境(图3,5、表1)。根据群落中主要底栖有孔虫属种的生态环境意义对不同组合所代表的沉积环境进行分析:
底栖有孔虫组合1(Ma-Py)以Melonis占有绝对优势,该属主要包括M.berleeanu和M.affinis。其中,M.berleeanu为大的表生机会种,被认为在陆源植物型碳屑类有机质高持续供给的环境下含量较高[9],而M.affinis在南海为高生产力属种,在高有机质供给的一般含氧量环境下占优势[10];Pyrgo spp.、Martinottiella communis分别为表生种和胶结壳体机会种,在富氧环境和中等到低有机碳通量环境下占优势,这两个种在一定程度上被认为是富氧环境的指示剂;Planulina wuellerstorfi是典型的喜氧深水种,常见于高氧、高能或低有机碳含量的水体中[11];该组合中出现的Uvigerina spp.一般在浅内生微环境中富集,在高能沉积物中繁盛,该属受氧含量的限制低,在有机炭富集的沉积物中,其生存不受氧含量的限制。该底栖有孔虫组合代表了有持续低到中等有机质供给的富氧环境到一般氧含量环境,同时受陆源植物型碳屑输入及季节性有机质供给影响明显。
组合2(He-Py)中Hoglundina elegans最初被认为主要受营养量的控制,在中等到富营养环境[9]下富集,它的持续出现表明了有机质到达海底的持续性,代表高的表层初级生产力环境[12]。另有研究表明该种在一般缺氧环境[13]和缺氧环境下仍可生存[14];该组合中 Pyrgo spp.、Lenticulina spp.在南海均为中层水体中的常见表生种,在富氧环境下富集;而有关Nodosaria spp.微生境的描述较少、该种为长柱型壳体,推断该种可能为浅内生种,在中等到高有机炭的一般缺氧环境下占优势[15];Cassidulina spp.在SH7B孔中主要包括C.carinata和C.crassa,其中C.carinata是高有机质通量沉积环境中的主要种[16],是喜营养类底栖有孔虫;而C.crassa在印度洋被发现在低到中等有机碳通量环境下占优势[17]。该组合中底栖有孔虫以内生种和外生种混杂出现为特征,表明沉积环境复杂多变,整体为中等有机质供给的一般氧含量环境,受季节性有机碳供给的影响相对较小。
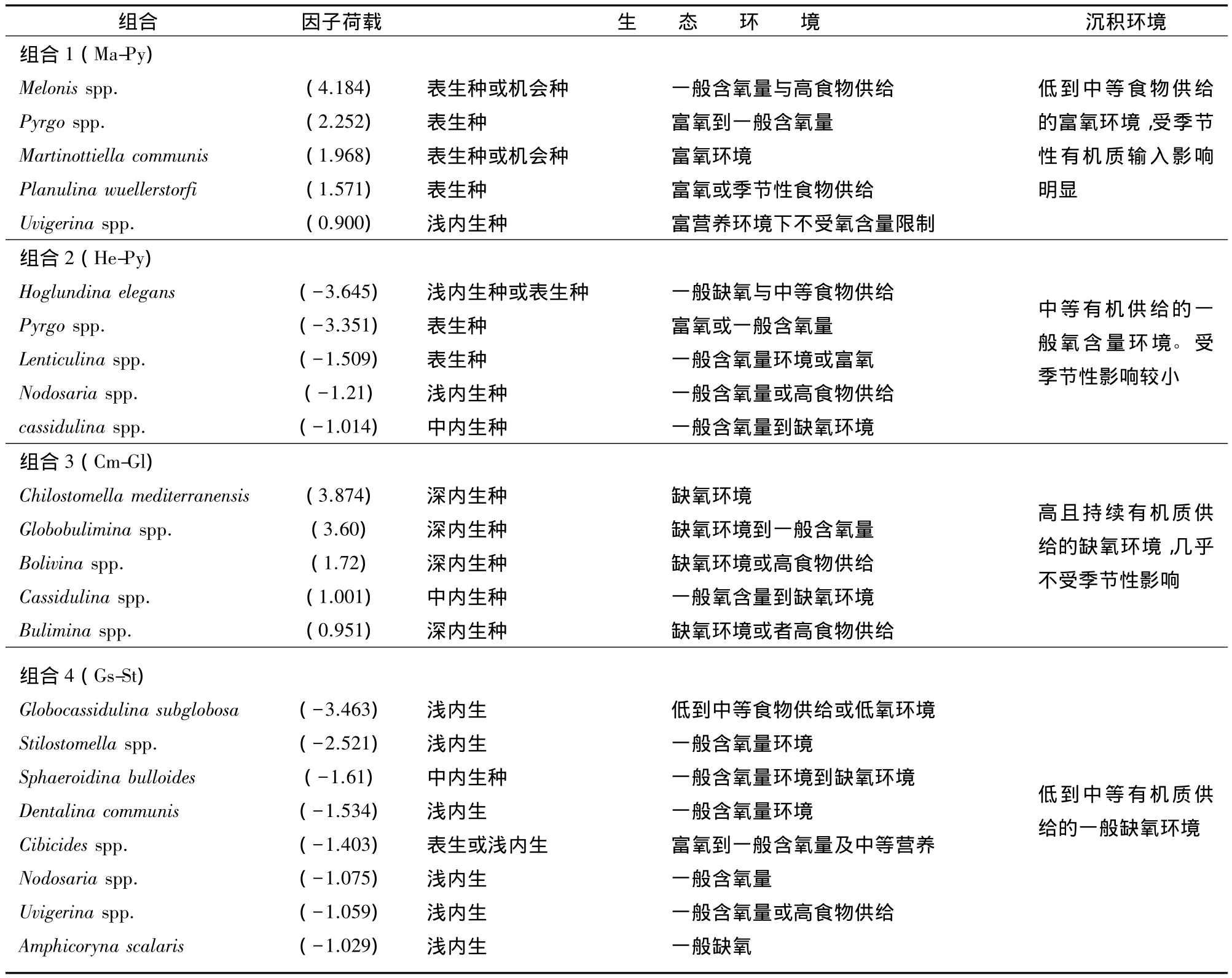
表1 SH7B孔底栖有孔虫组合及其对沉积环境的指示Table 1 Benthic foraminiferal assemblages of Core SH7B and their interpreted environments
组合 3(Cm-Gl)中 Chilostomella mediterranensis、Globobulimina spp.、Bolivina spp.均为深内生种,这些种在持续有机质供给的缺氧环境下占绝对优势,通常指示表层生产力较高、有大量食物供应的水体环境[18,19];该组合中 Bulimina spp.在 SH7B 孔中主要包括了Bulimina marginata和Bulimina striata。目前有关B.striata种生态环境的描述论述较少,该种与B.marginata为形态学上的相似种,反映了高的表层生产力条件下的持续有机质供给环境。该组合中所出现的属种均为内生境种,共同反映了有高且持续的有机质供给的缺氧环境,几乎不受季节性有机质供给的影响或影响较少。
组合4(Gs-St)中 Globocassidulina subglobosa在以往相关研究中多被认为是低到中等有机碳通量[20]或低氧环境的指示种[21],在SH7B晚中新世到上新世岩芯中该种为优势种,所占因子荷载值较高;Stilostomella spp.为该组合中第二大优势种,该种为浅内生种,在印度洋、太平洋、大西洋晚中新世到上新世地层中大量出现[22],大量的Stilostomella还可能与表层高生产力或者底流不畅有关,指示分层差、通气差、低氧的底层水体环境[2,21];Sphaeroidina bulloides为南海中层水体中的常见种,对食物供给和氧含量有较大适应区间,受食物供给和氧含量水平不同往往表现出不同的壳体大小分布特征[23],该种在SH7B孔中多以小个体出现。对于该组合中有关Dentalina communis、Amphicoryna scalaris微生境的研究相对较小,但这两个种与Nodosaria spp.为形态学上的相似种,均为长柱形壳体,这些种通常在中等到高有机炭含量的一般含氧量环境下占优势。该组合中所出现的Uvigerina spp.通常大量出现于温暖、低氧、高营养的中层水,在现代西太平洋和南海的中深层水体中有较高的比值[10,23]。该组合中出现的 Cibicides在多种沉积环境下均有出现,通常认为其为表生种,喜欢生存于高能的沉积物表面[24],而在受较强底流影响下的高季节性低营养环境[22,25],和在低溶解氧和低食物供给的环境影响下亦较为繁盛[23,26]。Cibicides种群在 SH7B上新世早期约3.79 Ma以来地层中的含量逐渐升高,常与Oridorsalia umbonatus和Gyroidina spp.等富氧种和机会种同时出现(图4),指示底层水体中氧含量稍有增加或季节性有机质输入的增强。中新世晚期和上新世早中期底栖有孔虫组合4(Gs-St)占优势,整体反映低到中等有机质供给的一般缺氧环境,季节性有机质的输入和氧含量在上新世逐渐增强。
4 讨论
4.1 晚中新世到早上新世沉积环境演变
底栖有孔虫氧同位素值常被用来指示全球冰盖消融及海平面变化特征。根据SH7B孔底栖有孔虫氧同位素值判断,5.8~2.8 Ma氧同位素平均值相对较低(图6),指示气候相对温暖且海平面相对较高,氧同位素曲线波动不大,指示当时气候虽有波动,但程度有限。在2.8 Ma后氧同位素平均值急剧减少(图6),指示气候急剧转冷。
SH7B孔晚中新世到早上新世5.8~2.8 Ma底栖有孔虫组合并没有发生明显变化(图6),底栖有孔虫组合所出现的属种多为中陆坡区一般营养及低氧环境下的常见类型,总体与该时期印度、太平洋海区中层水体所出现的壳体类型相似[27,28]。底栖有孔虫组合指示当时底层水体为低到中等有机质供给的一般缺氧环境。
4.1.1 5.8~3.79 Ma底栖有孔虫群落结构对“生物勃发”事件的响应
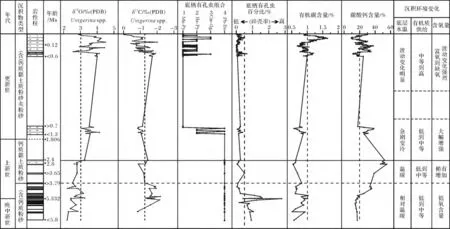
图6 SH7B孔底层水体沉积环境综合分析Fig.6 The analysis of bottom-water sedimentary environments on Core SH7B
对应底栖有孔虫壳体氧同位素5.8~2.8 Ma的相对低值和稳定的底栖有孔虫组合,底栖有孔虫壳体碳同位素及底栖有孔虫群落结构其他各指标却在3.79 Ma前后发生显著变化。5.8~3.79 Ma底栖有孔虫壳体碳同位素值极端偏负,平均约为-1.6‰;底栖有孔虫丰度、分异度较低,内生种含量相对较高,表生种的含量较低,所出现属种以低氧水体中常见的内生种为主(图4),同时碳酸钙的百分含量较低而底栖有孔虫占全群的百分比(通常可以代替有孔虫碎壳率指标用来指示壳体的保存状况)达全岩芯的最高值(图6),指示该时期浮游钙质生物生产力较低或者钙质壳体的保存状况恶化。镜下观察见浮游有孔虫壳体碎壳率极高,证明强烈溶解作用的存在。SH7B孔5.8~3.79 Ma底栖有孔虫群落结构特征和壳体碳同位素极端偏负及其对应的强烈的碳酸盐溶解作用在南海ODP184航次的其他钻孔中亦有揭示。南海北部ODP1148站位浮游有孔虫碎壳率和底栖有孔虫百分含量从5.4 Ma起急剧上升,在 4.8~3.4 Ma达顶峰[29],1148A孔发生以5.8 Ma为中心的多期次碳同位素负偏移现象[3]。南海南部ODP1143站位碳酸盐沉积在5~4.6 Ma亦受到很强的溶解作用影响[30],这些现象似乎表明这一时期发生的碳同位素偏负和壳体溶解现象在南海北部和南部具有相似性与可比性。
南海北部陆坡区SH7B孔5.8~3.79 Ma有孔虫壳体溶解及碳同位素负偏移现象发生在晚中新世到早上新世间歇性的相对温暖期,该时期南海南部ODP1143钻孔研究资料表明该时期(6~4 Ma)气候相对较暖,陆地植被扩大,陆源物质的化学风化强度急剧降低,南海表层输入的陆源营养盐减少,导致反映表层生产力的硅质生物相对贫乏[30]。南海北部陆坡区SH7B站位该时期硅藻及放射虫等硅质生物的缺失亦证实当时相对较低的陆源营养物质输入和较低的表层古生产力[5]。温暖期较低的表层古生产力环境下发生的壳体溶解和碳同位素偏负现象可能由于水团性质发生变化而引起,这一现象在赤道太平洋[31,32],大西洋[33],南太平洋[34],印度洋[35]均有发现,推测当时底层水体性质的变化可能是影响SH7B孔3.79 Ma前后底栖有孔虫群落结构指标及壳体碳同位素差异的主要因素。
南海北部陆坡SH7B孔5.8~3.79 Ma浮游有孔虫壳体的强烈溶解作用及底栖有孔虫壳体碳同位素值偏负事件与广泛分布于印度洋、太平洋海区晚中新世到上新世的“生物勃发”事件(9.0~3.5 Ma)[36]相对应,对应于该“生物勃发期”的后期阶段或即将结束期。“生物勃发”期的大洋水体浅表层高含量的营养物质和大量硅质生物沉降到海底的过程中发生的耗氧分解反应降低了海水和沉积物界面附近可利用的溶解氧含量,在此过程中释放的CO2会导致水体偏酸,增加了海底碳酸钙的溶解,同时有机质的氧化影响了孔隙水中的溶解无机碳的碳同位素值,导致底栖有孔虫壳体的碳同位素值偏负。但由于受大洋环流影响程度不同,不同水团运移距离和滞留时间长短有所差异,导致不同区域水体中CO2含量变化引起的碳酸钙的溶解强度及底栖有孔虫壳体的碳同位素偏负现象在各地持续时间长短和偏负程度上有一定差异。
南海北部陆坡底层水体的化学性质在5.8~3.79 Ma可能受太平洋中层水团影响而发生变化。由于构造运动的影响,印尼海道在6~4 Ma逐渐关闭[37],逐渐阻断了印度洋与太平洋的水体交换,但当时南海与西太平洋中层水及深层水体的连通性仍较强[38]。晚中新世晚期,太平洋中深层水体受到“地中海盐度危机”和南极冰盖阶段性短暂扩张造成的北大西洋底层水和南大洋深部温盐环流改组的影响,其流通性逐渐减弱[38],使得受“生物勃发”影响的缺氧的太平洋中层水和深层水在南海的滞留时间增加,在一定程度上增强了碳酸钙的溶解,并导致底栖有孔虫壳体的碳同位素更为负偏。对比南海ODP184航次其他钻孔,SH7B孔5.8~3.79 Ma底栖有孔虫属种组成有明显差异,底栖有孔虫丰度和分异度更低,内生种含量大于60%,且壳体的碳同位素更为偏负,推测可能与SH7B孔更接近于南海中层水体的氧最小值区(oxygen minimum zone)有关,相对于水深更深的南海ODP184航次的其他钻孔而言,中层水体中的氧含量比深层水体更低。
4.1.2 3.79~2.4 Ma底层水体的沉积环境
3.79~2.4 Ma,对应沉积物中底栖有孔虫百分比的急剧降低,即壳体碎壳率的降低,沉积物中碳酸钙含量急剧增高达到全岩芯最高值(图6),底栖有孔虫壳体碳同位素值增大均指示水体的溶解作用和腐蚀程度逐渐减弱。碳酸钙平均含量达50%,高于现今表层样碳酸钙30%的平均含量(图6),说明这一时期南海钙质生物生产力相对较高,或受陆源物质的稀释作用影响较现今弱。底栖有孔虫的丰度、分异度急剧升高,指示海水表层输出到海底的有机质逐渐增高或底层水体的含氧状况有所好转。3.79~2.4 Ma底栖有孔虫所出现的属种组合未发生明显改变,整体仍以内生种为主,其含量仍占75%以上,但表生种所占比例有所提高,平均含量由14.06%上升至20.56%,部分喜氧的表生种O.umbonatus和Gyroidina spp.类型开始出现(图4),指示南海中陆坡底层水体性质开始发生细微变化,底层水体溶解氧含量有增大趋势。这可能与4~2 Ma时巴拿马海道逐渐关闭,南极冰盖阶段性快速消融,引起大洋环流格局的改变,太平洋水体的流通性又逐渐增强,进入南海的中层水和深层水体氧含量有所增加,SH7B孔底层水体的缺氧状况稍有缓和,但缓和程度有限,还不足以彻底改变底栖有孔虫组合。当然,由于该钻孔取芯率的限制,部分层位由于没有样品,导致分辨率相对较低,相关结论需进一步验证。
4.2 晚上新世及更新世底栖有孔虫组合特征及环境指示意义
晚上新世,随着喜马拉雅山快速隆起及北半球冰盖的形成,全球气候由早上新世相对温暖、均一的环境变为晚上新世及更新世具有典型冰期—间冰期旋回的极端气候环境[38]。SH7B孔底栖有孔虫壳体δ18O值在晚上新世2.4 Ma后急剧增加(图6),指示北半球冰盖进一步扩大,深海温度急剧变冷,海底水循环加强。碳酸钙含量自2.4 Ma之后显著降低,表明南海北部陆源物质的输入量受喜玛拉雅山和台湾隆起的影响显著增强。
自早更新世0.6 Ma以来,底栖有孔虫壳体δ18O值与δ13C值、碳酸钙和有机碳含量、底栖有孔虫群落结构内部各指标均波动变化频繁(图6),这一特征与南海ODP148航次其他钻孔的研究记录相似,均指示底层水体沉积环境受气候波动变化及海平面升降影响明显[39]。这一时期,东亚季风区的陆地黄土沉积和海洋沉积物均指示东亚季风强度显著增强,季风强度变化必然引起表层环流及表层输出古生产力等一系列古海洋变化。同时晚上新世以来台湾的隆起逐渐阻隔了南海与西太平洋深层水体交换强度,南海中层水体演化主要受东亚季风强度和海平面变化引起的西太平洋中层水对南海影响程度变化共同控制。
对应陆源有机质的供给和海平面的波动变化,SH7B孔底栖有孔虫组合自0.6 Ma以来主要以Cm-Gl,He-Py,Ma-Py交替出现为特征(图6)。氧同位素高值期对应冰期相对低海平面期,该时期碳酸钙含量较低,表明陆源物质输入量相对较大,持续较高的陆源输入物质带来大量的营养成分,引起沉积区表层生产力增高,大量有机质沉降到海底耗氧分解引起底层水体缺氧,同时海平面下降亦可能使南海与太平洋水体的交换程度减弱,两者共同导致南海北部陆坡区高有机质输入的缺氧状况。该时期东亚冬季风持续强盛,且几乎不受季节性影响,SH7B孔底栖有孔虫Cm-Gl组合中出现的种类均为在高且持续有机质供给的低氧或缺氧环境下出现的内生种。
氧同位素低值期对应相对高海平面的温暖间冰期,该时期SH7B孔碳酸钙含量较高,表明陆源物质输入量相对较少,表层输出到海底的有机质相对较低,同时海平面上升使相对富氧的太平洋深层水对南海影响增强,使得南海北部陆坡在间冰期底层水体以低到中等有机质供给的富氧环境到一般氧含量环境为特征。底栖有孔虫组合Ma-Py中表生种和机会种繁盛,指示南海北部陆坡可能受间冰期季节性输入有机质供给影响明显。
底栖有孔虫组合He-Py指示了中等有机质供给的一般氧含量环境,受季节性影响不明显。该组合中内生种和表生种同时出现,为冰期Cm-Gl与间冰期Ma-Py组合间的过渡类型。
5 结论
对南海北部SH7B孔晚中新世以来沉积物中底栖有孔虫壳体氧碳同位素特征和群落结构进行分析,结果表明晚中新世晚期到上新世早期的相对温暖期,底栖有孔虫组合Globocassidulina subglobosa-Stilostomella spp.(Gs-St)代表低到中等有机质供给的一般缺氧环境。该时期南海北部SH7B孔所在的陆坡区陆源物质输入量有限,表层生产力相对较低,中层水体氧含量水平整体较低。5.8~2.8 Ma南海与开发大洋的连通性较好,太平洋中层水体对南海影响较强,南海北部陆坡区底栖有孔虫分布主要受全球构造活动和南极冰盖消长引起的全球大洋环流的流通状况和太平洋水体性质变化影响明显。5.8~3.79 Ma南海流通性较差,其中层和浅深层水体受太平洋偏腐蚀性的缺氧中深层水体影响较大。3.79~2.8 Ma南海北部陆坡中层水体流通性虽有改观,但水体氧含量仍偏低,直到2.4 Ma以后中层水体含氧量才大幅增强。
2.4 Ma后,受喜马拉雅山和台湾快速隆起影响,南海与大洋水体间连通性减弱,南海北部陆坡区沉积环境受季风强度和陆源物质输入影响加强。底栖有孔虫组合主要以Chilostomella mediterranensis-Globobulimina spp.(Cm-Gl),Hoglundina elegans-Pyrgo spp.(He-Py),Melonis affinis-Pyrgo spp.(Ma-Py)组合交替出现为特征,其分布主要受东亚季风强度和海平面变化引起的陆源有机质输入量的多寡和南海中深层水体的循环状况共同控制。
致谢 感谢同济大学海洋地质国家重点试验室为本次研究提供氧碳同位素测试,感谢评审专家的宝贵建议。
References)
1 汪品先.古海洋学概论[M].上海:同济大学出版社,1989:81-104[Wang Pinxian.Introduction to Paleoceanography[M].Shanghai:Tongji University,1989:81-104]
2 Li Qianyu,Zhao Quanhong,Zhong Guangfa,et al.Deep water ventilation and stratification in the Neogene South China Sea [J].Journal of China University of Geosciences,2007,18(2):95-108
3 赵泉鸿,汪品先,成鑫荣,等.中新世“碳位移”事件在南海的记录[J].中国科学(D 辑):地球科学,2001,31(10):808-815[Zhao Quanhong,Wang Pinxian,Cheng Xinrong,et al.A record of Miocene carbon excursions in the South China Sea [J].Science China(Seri.D):Earth Science,2001,31(10):808-815]
4 Jorissen F J,Destigter H C,Widmark J G.A conceptual model explaining benthic foraminifera microhabitats[J].Marine Micropaleontology,1995,26(1/2/3/4):3-15
5 陈芳,苏新,周洋,等.南海北部陆坡神狐海域晚中新世以来沉积物中生物变化及意义[J].海洋地质与第四纪地质,2009,29(2):1-8[Chen Fang,Su Xin,Zhou Yang,et al.Variations in biogenic components of Late Miocene-Holocene sediments from Shenhu area in the South China Sea and their geological implication[J].Marine Geology& Quaternary Geology,2009,29(2):1-8]
6 陈芳,苏新,周洋.南海神狐海域水合物钻探区钙质超微化石生物地层与沉积速率[J].地球科学,2013,38(1):1-8[Chen Fang,Su Xin,Zhou Yang.Late Miocene-Pleistocene calcareous nannofossil biostraphy of Shenhu gas hydrate drilling area in the South China Sea and variations in sedimentation rates[J].Earth Science,2013,38(1):1-8]
7 Jian Z,Cheng X,Zhao Q,Wang J,et al.Oxygen isotope stratigraphy and events in the northern South China Sea during the last 6 million years[J].Science China(Seri.D):Earth Science,2001,44(10):952-960
8 李前裕,Lucas L,汪品先.新近纪海相生物地层年龄新编[J].地层学杂志,2007,31(3):790-802[Li Qianyu,Lucas L,Wang Pinxian.New ages for Neogene marine biostratigraphic events[J].Journal of Stratigraphy,2007,31(3):790-802]
9 Abu-Zied R,Rohling E J,Jorissen F J,et al.Benthic foraminiferal response to changes in bottom-water oxygenation and organic carbon flux in the eastern Mediterranean during LGM to Recent times[J].Marine Micropaleontology,2008,67(1/2):46-68
10 Zhiming Jian,Lüjang Wang.Late Quaternary benthic foraminifera and deep water paleoceanography in the South China Sea[J].Marine Micropaleontology,1997,32(1/2):127-154
11 Murry J W.Ecology and palaeoecology of benthic foraminifera[M].Longman:Harlow,1991:397-399
12 Bhaumik A K,Gupta A K.Deep-sea benthic foraminifera from gas hydrate-rich zone,Blake Ridge,Northwest Atlantic(ODP Hole 997A)[J].Current Science,2005,88(12):12-22
13 Corliss B H,Chen C.Morphotype patterns of Norwegian Sea deep-sea benthic foraminifera and ecological implications[J].Geology,1988,16(8):716-719
14 周洋,陈芳,苏新,等.南海东沙海域HD319岩芯富甲烷环境底栖有孔虫群落结构[J].海洋地质与第四纪地质,2009,29(3):1-8[Zhou Yang,Chen Fang,Su Xin,et al.Benthic foraminifera and stable isotopic composition of gas hydrate-bearing sediments from Shenhu area in the Northern South China Sea[J].Marine Geology& Quaternary Geology,2009,29(3):1-8]
15 Corliss B H.Distribution of Holocene deep-sea benthonic foraminifera in the southwest Indian Ocean[J].Deep-Sea Research,1983,30(2A):95-117
16 Derjk S,Jorissen F J,Rohling E J,et al.Organic flux control on bathymetric zonation of Mediterranean benthic foraminifera [J].Marine Micropaleontology,2000,40(3):151-166
17 Fontanier C,Jorissen F J,Licari L,et al.Live benthic foraminiferal faunas from the bay of Biscay:faunal density,composition and microhabitats[J].Deep-Sea Research I,2003,49(4):751-785
18 Gooday A J.The biology of deep-sea foraminifera:a review of some advances and their applications in paleoceanography [J].Palaios,1994,9(1):14-31
19 Schmiedl G,Mackensen A,Muller P J.Recent benthic foraminifera from the eastern South Atlantic Ocean:dependence on food supply and water masses[J].Marine Micropaleontology,1997,32(3/4):249-287
20 Li Tiegang,Xiang Rong,Sun Rongtao,et al.Benthic foraminifera and bottom water evolution in the middle-southern Okinawa Trough during the last 18 ka[J].Science China(Seri.D):Earth Science,2005,48(6):805-814
21 Kaiho K.Benthic foraminiferal dissolved oxygen index and dissolved oxygen levels in the modern ocean[J].Geology,1994,22(8):719-722
22 Gupta A K,Thomas E.Initiation of Northern Hemisphere glaciation and strengthening of the northeast Indian monsoon:Ocean Drilling Program Site 758,eastern equatorial Indian Ocean [J].Geology,2003,4(31):47-50
23 Miao Q,Thunell R C.Recent deep-sea benthic foraminiferal distributions in the South China and Sulu Sea[J].Marine Micropaleontology,1993,22(1/2):1-32
24 Gooday A J.Deep-sea benthic foraminiferal species which exploit phytodetritus:characteristic features and controls on distribution [J].Marine Micropaleontology,1993,22(3):187-205
25 Lutze G F,Coulbourn W T.Recent benthic foraminifera from the continental margin of Northwest Africa:community structure and distribution[J].Marine Micropaleontology,1984,8(5):361-401
26 Rathburn A E,Corliss B H.The ecology of living(stained)deep-sea benthic foraminifera from the Sulu Sea[J].Paleoceanography,1994,9(1):87-150
27 Gupta A K,Thomas E.Latest Miocene-Pleistocene productivity and deep-sea ventilation in the northwestern Indian Ocean(Deep Sea Drilling Project site 219)[J].Paleoceanography,1999,14(1):63-73
28 Kawagata S,Hayward B W,Gupta A K.benthic foraminiferal extinctions linked to late Pliocene-Pleistocene deep-sea circulation changes in the northern Indian Ocean(ODP sites 722 and 758)[J].Marine Micropaleontology,2006,58(3):219-242
29 陈晓良,赵泉鸿,翦知湣.南海北部ODP1148站中新世以来的碳酸盐含量变化及其古环境意义[J].海洋地质与第四纪地质,2002,22(2):69-74[Chen Xiaoliang,Zhao Quanhong,Jian Zhimin.Carbonate content changes since the Miocene and paleoenvironmental implications,ODP site 1148,Northern South China Sea[J].Marine Geology and Quaternary Geology,2002,22(2):69-74]
30 Zhang Lili,Chen Muhong,Xiang Rong,et al.Productivity and continental denudation history from the South China Sea since the late Miocene[J].Marine Micropaleontology,2009,72(1/2):76-85
31 Farrell J W,Raffi I,Janecek T R,et al.Late Neogene sedimentation patterns in the eastern Equatorial Pacific Ocean[G].Proc Ocean Drill Program Sci Results,1995,138:717-756
32 Berger W H,Leckie R M,Janecek T R,et al.Neocene carbonate sedimentation on Ontong Java Plateau:highlights and open questions[G].Proc Ocean Drill Program Sci Results,1993,130:711-744
33 Diester H L,Billups K,Emeis K C.Late Miocene biogenic bloom in search of the late Miocene–Early Pliocene“biogenic bloom”in the Atlantic Ocean(Ocean Drilling Program Sites 982,925,and 1088)[J].Paleoceanography,2005,20(4):1-13
34 Muller D W,Hodell D A,Ciesielsk P F.Late Miocene to earliest Pliocene(9.8-4.5Ma)paleoceanography of the subantarctic southeast Atlantic:stable isotope,sedimentologic and microfossil evidence[G]∥ Proc Ocean Drill Program Sci Results,1991,114:459-472
35 Gupta A K,Dsa M,Bhaskar K.South Equatorial Current(SEC)driven changes at DSDP Site 237,Central Indian Ocean,during the Plio-Pleistocene:Evidence from Benthic Foraminifera and stable isotopes[J].Journal of Asian Earth Sciences,2006,28(4/5/6):276-290
36 Gerald R D,Robert M O.The Latest Miocene–Early Pliocene biogenic bloom:A revised Indian Ocean perspective[J].Marine Geology,1999,161(1):75-91
37 Srinivasan M S,Sinha D K.Early Pliocene closing of the Indonesian Seaway evidence from north-east Indian Ocean and Tropical Pacific deep sea cores[J].Journal of Asian Earth Science,1998,16(1):9-44
38 汪品先,翦知湣,赵泉鸿,等.南海演变与季风历史的深海证据[J].科学通报,2003,48(22):2228-2239[Wang Pinxian,Jian Zhimin,Zhao Quanhong,et al.Evolution of the South China Sea and monsoon history revealedin deepsea records[J].Chinese Science Bulletin,2003,48(22):2228-2239
39 Huang Baoqi,Jian Zhimin,Wang Pinxian.Benthic foraminiferal fauna turnover at 2.1Ma in the northernSouth China Sea [J].Chinese Science Bulletin,2007,52(6):839-843

