RECK及MMP-2在皮肤血管瘤组织中的表达及意义
刘 涓
(武汉大学人民医院老年病科 武汉430060)
皮肤血管瘤是婴幼儿最常见的良性血管肿瘤, 是由血管形成异常而引起的疾病,血管瘤的自然病程经历增生期、退化期和退化完成期三个阶段。血管瘤属良性肿瘤,通过未成熟的内皮细胞弥散增殖而快速生长,之后自发消退。一般认为毛细血管内皮细胞的增生与消退是血管瘤生长和消退的关键原因[l,2]。虽然大多数血管瘤能自发消退,但是一些血管瘤病变可严重损坏正常组织,并产生并发症。往往给患者及其家人带来极大痛苦,但关于血管瘤的发病机制,目前还未明了,因此对于皮肤血管瘤的临床治疗也是目前急待解决的关键问题。
逆转诱导蛋白(reversion-inducing-cystein-rich protein with kazalmotifs,RECK)基因是近年来新发现的转录抑制基因,可以通过抑制多种MMPs的表达,抑制肿瘤的侵袭及转移[3]。基质金属蛋白酶(matrixmetallo proteinases,MMPs)可以降解细胞外基质,有研究表明,MMP2的表达水平同肿瘤的侵袭和恶性程度密切相关,TIMP-2作为 MMP-2的抑制剂,通过多种方式抑制 MMP-2的活性[4]。但RECK及MMP-2在皮肤血管瘤组织中的表达尚未见报道。
本文应用免疫组织化学方法和图像分析技术检测了血管瘤增生期、退化期以及正常皮肤组织中RECK及 MMP-2的表达水平,探讨 RECK 及MMP-2在血管瘤发生、发展过程中的作用机制,为临床上治疗血管瘤提供实验依据。
材料和方法
1.材料
1.1材料来源
收集武汉大学人民医院病理科2008年-2011年皮肤毛细血管瘤存档蜡块40例,其中男性15例,女性25例。这些血管瘤所在的部位有头皮、前额、眼睑、耳背、颈部、背部、上臂、大腿、手和足的皮肤等。患者术前均未做任何辅助性治疗。
1.2 材料分组
将所有标本进行免疫组织化学S-P法检测增殖细胞核抗原(proliferating cell nuclear antigen,PCNA),按Mulliken分类标准并结合PCNA的表达进行分组:石蜡标本中增生期血管瘤22例,退化期血管瘤18例。另取距癌组织5cm外的周围正常皮肤组织5例作对照。
1.3 主要试剂
即用型鼠抗人PCNA单克隆抗体、鼠抗人RECK及MMP-2单克隆抗体(购于北京中杉生物技术有限公司);超敏即用型SP通用型免疫组织化学试剂盒(购于福州迈新公司);DAB显色试剂盒及多聚赖氨酸(购于北京中杉生物技术有限公司)。
2.方法
2.1 免疫组织化学SP法检测RECK及MMP-2和PCNA相关抗原
具体步骤:(1)4μm组织切片常规脱蜡入水;(2)抗原修复(柠檬酸缓冲液微波抗原修复法);(3)滴加3%过氧化氢,37℃湿盒孵育10min以抑制内源性过氧化物酶活性;(4)正常羊血清37℃湿盒孵育10min以减少非特异性背景;(5)分别滴加一抗;(6)滴加链霉素抗生物素蛋白-过氧化物复合物37℃湿盒孵育;(7)滴加新鲜配置的DAB显色液显色;(8)苏木素复染;(9)梯度酒精脱水,二甲苯透明,中性树胶封片并镜检;(10)用PBS代替一抗作为阴性对照组,购买的阳性片作为RECK及MMP-2的阳性对照组,人正常皮肤表皮作为PCNA的阳性对照组。
2.2 免疫组织化学结果判断
(1)RECK及 MMP-2都是以细胞核或胞浆出现棕黄色颗粒为阳性反应,PCNA以细胞核出现棕黄色颗粒为阳性反应。阴性对照组除细胞核染成蓝色外,应无棕黄色反应物。
(2)采用HPIAS-1000高清晰度彩色病理图文报告管理系统(同济千屏影像公司)对RECK及MMP-2的表达进行定量分析,每张切片随机选取5个完整而不重叠的高倍镜视野(×400),测定每个视野下阳性反应的平均光密度、阳性反应面积和所有细胞总面积,计算阳性面积率。以每例5个视野的平均光密度、阳性面积率的平均值作为该例的测量值。(阳性面积率=单位面积中阳性反应的总面积/单位面积中细胞的总面积×100%)
2.3 统计学处理
数据以均数±标准差表示,用SPSS11.5软件对各组免疫组织化学反应阳性颗粒的平均光密度、阳性面积率做单因素方差分析和SNK(q)检验,检验水准α为0.05。
结 果
1.PCNA的表达
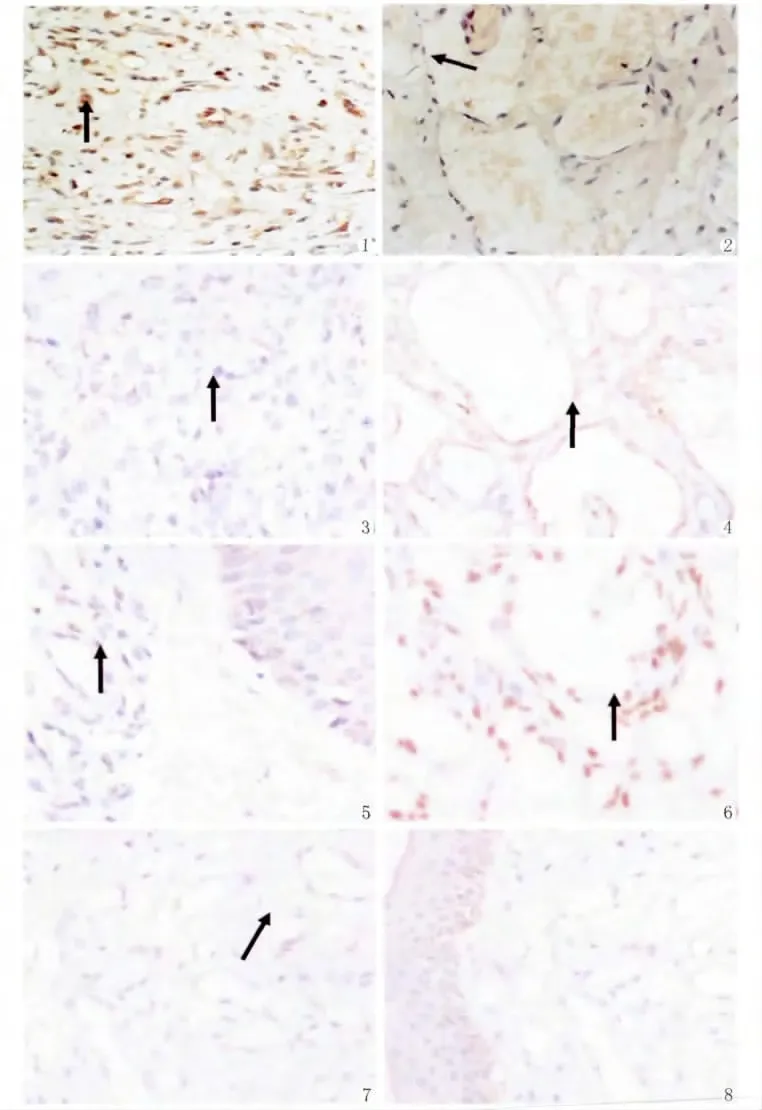
增生期血管瘤内皮细胞核肥大,核内弥漫分布棕黄色颗粒,PCNA表达强(图1);退化期血管瘤内皮细胞核扁平,胞核内有少量棕黄色颗粒,PCNA表达弱(图2)。
2.RECK的表达
增生期血管瘤内皮细胞核或胞浆内有少量的棕黄色颗粒,RECK呈低表达(图3);退化期血管瘤内皮细胞胞核或胞浆内有较多棕黄色颗粒,RECK呈高表达(图4);正常皮肤组织内皮细胞核或胞浆内有较多棕黄色颗粒,RECK呈高表达(图5)。图像分析结果见表1。增生期组RECK的表达明显低于退化期组和正常皮肤组织组(P<0.05),而后两组比较差异无统计学意义(P>0.05)。(表1)
表1 血管瘤不同时期RECK表达的平均光密度和阳性面积率()Table 1 The average optical density and the rate of RECK positive area of in differ period of human dermal hemangiomas()
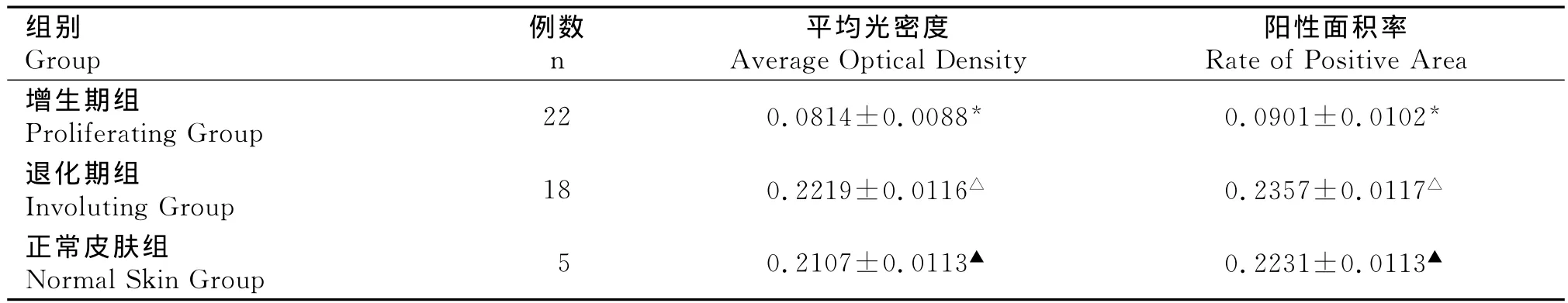
表1 血管瘤不同时期RECK表达的平均光密度和阳性面积率()Table 1 The average optical density and the rate of RECK positive area of in differ period of human dermal hemangiomas()
* 增生期组与退化期组比较,P<0.05;(Comparison between proliferating hemangiomas and involuting hemangiomas)*P<0.05;△ 退化期组与正常皮肤组比较,P>0.05;(Comparison between involuting hemangiomas and normal skin tissue)△P>0.05;▲ 正常皮肤组与增生期组比较,P<0.05(Comparison between proliferating hemangiomas and normal skin tissue)▲P<0.05
阳性面积率Rate of Positive Area增生期组Proliferating Group 22 0.0814±0.0088* 0.0901±0.0102组别Group例数n平均光密度Average Optical Density*退化期组Involuting Group 18 0.2219±0.0116△ 0.2357±0.0117△正常皮肤组Normal Skin Group 5 0.2107±0.0113▲ 0.2231±0.0113▲
3.MMP-2的表达
增生期血管瘤内皮细胞核或胞质内有较多棕黄色颗粒,MMP-2表达强(图6);退化期血管瘤内皮细胞胞核或胞质内有较少的棕黄色颗粒,MMP-2表达弱(图7);正常皮肤组织内皮细胞核或胞浆内有少量的棕黄色颗粒,MMP-2表达弱(图8)。图像分析结果见表2。增生期血管瘤内皮细胞MMP-2的表达显著高于退化期血管瘤内皮细胞和正常组织(P<0.05),而后两组比较差异无统计学意义(P>0.05)(表2)。
表2 血管瘤不同时期MMP-2表达的平均光密度和阳性面积率()Table 2 The average optical density and the rate of MMP-2positive area of in differ period of human dermal hemangiomas()
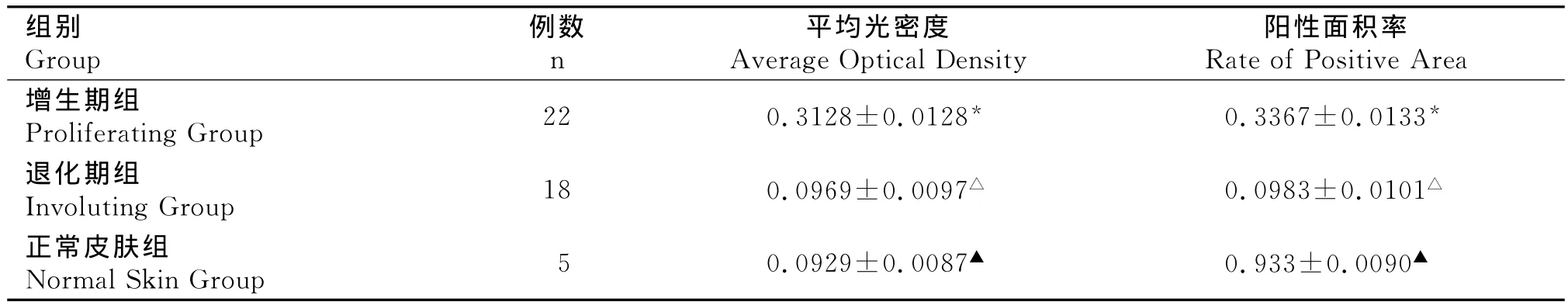
表2 血管瘤不同时期MMP-2表达的平均光密度和阳性面积率()Table 2 The average optical density and the rate of MMP-2positive area of in differ period of human dermal hemangiomas()
*增生期组与退化期组比较,P<0.05;(Comparison between proliferating hemangiomas and involuting hemangiomas)*P <0.05;△ 退化期组与正常皮肤组比较,P>0.05;(Comparison between involuting hemangiomas and normal skin tissue)△P>0.05;▲ 正常皮肤组与增生期组比较,P<0.05;(Comparison between proliferating hemangiomas and normal skin tissue)▲P<0.05
阳性面积率Rate of Positive Area增生期组Proliferating Group 22 0.3128±0.0128* 0.3367±0.0133组别Group例数n平均光密度Average Optical Density*退化期组Involuting Group 18 0.0969±0.0097△ 0.0983±0.0101△正常皮肤组Normal Skin Group 5 0.0929±0.0087▲ 0.933±0.0090▲
3.血管瘤组织中RECK和MMP-2表达的相关性
血管瘤组织中RECK与MMP-2的表达呈负相关(P<0.01,r=-0.625)。
讨 论
皮肤血管瘤是一种常见的良性肿瘤,在婴幼儿中发病率较高,新生儿的患病率为1.1%-3.8%,至1岁时可高达10%。血管瘤的自然病程包括增生期、退化期和退化完成期三个阶段。目前血管瘤的发病机制还不完全清楚[5-7],血管瘤可发生于身体各处,尤以头颈部多见,但也见于内脏。一些血管瘤可致严重毁容并破坏正常组织,甚至危及生命[8]。目前关于治疗血管瘤方法的成效并不十分显著,一些治疗模式的副作用也限制了其应用。因此探讨皮肤血管瘤的发病机制对临床上治疗血管瘤有着重要的意义。
金属基质蛋白酶(martixmeatllporoteinases,MMPs)是一组具有酶活性的蛋白质,广泛存在于细胞外基质中,它在维持细胞外基质(extracelluarma-trix,ECM)包括胶原纤维(纤维状的非纤维状的)、纤维连接蛋白、层粘连素、基膜以及基质糖蛋白的代谢中起到了关键的作用,一种 MMPs通常可以直接降解某一种或几种ECM,也可通过激活其它类型的MMPs而发挥作用。细胞外基质(ECM)成分的降解是肿瘤侵袭和及转移的必要条件,MMPs几乎能够降解细胞外基质的所有成分[9-12]。因此,MMPs是一组非常重要的蛋白质。MMP-2属Ⅳ型胶原酶类,主要降解明胶、纤维蛋白、基底膜Ⅳ、Ⅴ和Ⅳ型胶原,在肿瘤细胞突破基底膜屏障和浸润转移过程中起着重要作用。
本实验研究结果显示:增生期血管瘤组织中MMP-2的表达水平明显高于退化期和正常组织的表达水平。结果提示 MMP-2参与了血管瘤的发生。并且在肿瘤血管形成过程中,MMP-2均发挥着重要作用。
RECK(伴有Kazal域的富含半胱氨酸的逆转诱 导 蛋 白 reversion-inducing-cystein-rich protein with kazalmotifs)基因是近年来新发现的转录抑制基因,可以通过抑制多种 MMPs的表达,从而抑制肿瘤的侵袭及转移。RECK基因是编码971个氨基酸的膜表面蛋白,定位于人染色体9p12-13,整个基因的长度约87kb,其中包含21个外显子,20个内含子,共有13个单核苷酸多态性(single nucleotide polymorphism,SNP),其中4个位于基因编码区域(外显子1,9,13,15),而另外9个位于内含子区域(内含子5,8,10,12,15,17),其转录子大小为4.6kb[l3-15]。研究表明,在无 RECK 基因表达的情况下,MMP的过表达可导致细胞外基质(extracellularMatrix,ECM)过度降解,血管及周围组织完整性降低,促进新生血管形成;相反,RECK基因的高表达可抑制新生血管的形成。因此,RECK基因及MMP的相互调节对于肿瘤新生血管形成起着重要作用,在体内多种正常组织的细胞中均有比较高水平的表达[l6-18]。因此 RECK 能够抑制 MMP-2诱导的血管生成作用。
肿瘤的发生和发展是以肿瘤细胞与其周围细胞外基质(extracellular matrix,ECM)之间相互作用的严重紊乱为变化特征的。
本研究发现,RECK基因主要在增生期血管瘤低表达,提示RECK可抑制至少3个MMP家族成员的活性,包括:MMP-2,MMP-9 及 MT1-MMP,此外,RECK基因还与血管生成密切相关,其适量表达能抑制血管的生成。RECK在血管瘤组织中呈低表达说明RECK通过抑制MMP-2的活性,从而影响了ProMMP-2的活化。RECK 对 MMP-2的抑制作用发生在翻译后水平,即抑制MMP-2从细胞的释放以及直接抑制其蛋白水解活性最终抑制了MMP-2的总量及活性从而发挥抗肿瘤作用。RECK基因的低表达参与了血管瘤的发生、发展。
RECK是MMPs的一种新型抑制剂,关于RECK与MMP-2相关性,本研究进行了直线相关分析(P<0.01,r=-0.625),结果证实两者具有直线负相关关系,也就是MMP-2随着RECK的表达增多而表达减少,证实了RECK具有抑制MMP-2的作用,说明在血管瘤的发生机制中确实存在着RECK与MMP-2的调节机制。
RECK基因在肿瘤血管生成方面的抑制作用直接关系到患者的预后,RECK与MMP-2呈明显的负相关,在RECK基因表达降低的病例中 MMP-2呈现出显著的升高,而MMP-2具有明显的促进肿瘤血管生成的作用,从而为肿瘤的发展提供了依据,同时也证实了RECK基因和MMP-2具有相关性,RECK基因能够通过影响MMP-2信号传导通路而达到抑制血管瘤血管生成的作用。
[1]Jinnin M,Ishihara T,Boye E,et al.Recent progress in studies of infantile hemangioma.The Journal of Dermatology,2010,37(4):283-298
[2]Shan G,Tang T,Zhang D.Expression of HLA-G in hemangioma and its clinical significance.J Huazhong Univ Sci Technolog Med Sci,2012,32(5):713-718
[3]Shan Zhong,Guohua Yang,Cong Xia.Expression of HLA-G in hemangioma and its clinical significance.J Huazhong Univ Sci Technolog Med Sci,2009,29(5):614-619
[4]Stiles JM,Rowntree RK,Amaya C,et al.Gene expression analysis reveals marked differences in the transcriptome of infantile hemangioma endothelial cells compared to normal dermal microvascular endothelial cells.Vasc Cell,2013,25,5(1):6-11
[5]Shan S,Shan G,Zhang D.Treatment of hemangioma by transfection of antisense VEGF gene.J Huazhong Univ Sci Technolog,2009,29(3):335-339
[6]Mai HM,Zheng JW,Wang YA,et al.CD133selected stem cells from proliferating infantile hemangioma and establishment of an in vivo mice model of hemangioma.Chin Med J(Engl),2013,126(1):88-94
[7]Stiles J,Amaya C,Pham R,et al.Propranolol treat-ment of infantile hemangioma endothelial cells:A molecular analysis.Exp Ther Med,2012,4(4):594-604
[8]Bourdelat D,Melki E,Mazzola C,et al.Congenital prenatal hemangioma:diagnosis and treatment.Arch Pediatr,2010,17(4):383-638
[9]Ekbote AV,Danda S,Zankl A,et al.Patient with mutation in the matrix metalloproteinase 2(MMP2)genea case report and review of the literature.J Clin Res Pediatr Endocrinol,2014,6(1):40-46
[10]Jacob-Ferreira AL,Schulz R.Activation of intracellular matrix metalloproteinase-2by reactive oxygen-nitrogen species:Consequences and therapeutic strategies in the heart.Arch Biochem Biophys,2013,540(1-2):82-93
[11]Chien MH,Lin CW,Cheng CW,et al.Matrix metalloproteinase-2as a target for head and neck cancer therapy.Expert Opin Ther Targets,2013,17(2):203-216
[12]Ali MA,Fan X,Schulz R.Cardiac sarcomeric proteins:novel intracellular targets of matrix metalloproteinase-2in heart disease.Trends Cardiovasc Med.2011,21(4):112-118
[13]Zhou X,Huang S,Jiang L,et al.Expression of RECK and MMP-2in salivary adenoid cystic carcinoma:Correlation with tumor progression and patient prognosis.Oncol Lett,2014,7(5):1549-1555
[14]Guo H,Li Q,Li W,et al.miR-96downregulates RECK to promote growth and motility of non-small cell lung cancer cells.Mol Cell Biochem,2014,390(1-2):155-160
[15]Zhang J,Kong X,Li J,et al.miR-96promotes tumor proliferation and invasion by targeting RECK in breast cancer.Oncol Rep,2014,31(3):1357-1363
[16]Benzon Z,Prusac IK,ZekicˊS,et al.Immunohistochemical expression of RECK protein in placental membranes of the preterm delivery with and without chorioamnionitis.Histol Histopathol,2014,29(5):629-633
[17]Hong KJ,Wu DC,Cheng KH,et al.RECK inhibits stemness gene expression and tumorigenicity of gastric cancer cells by suppressing ADAM-mediated Notch1 activation.J Cell Physiol,2014,229(2):191-201
[18]Lin HY,Chiang CH,Hung WC.STAT3upregulates miR-92ato inhibit RECK expression and to promote invasiveness of lung cancer cells.Br J Cancer,2013,109(3):731-738
图 版 说 明
图1 增生期血管瘤PCNA的表达 增生的内皮细胞核内弥漫分布棕黄色颗粒(→),PCNA表达强,S-P×400
图2 退化期血管瘤PCNA的表达 内皮细胞核内有少量棕黄色颗粒(→),PCNA表达弱,S-P×400
图3 增生期血管瘤RECK的表达 内皮细胞胞浆内有少量棕黄色颗粒(→),RECK表达弱(→),S-P×400
图4 退化期血管瘤RECK的表达 内皮细胞胞浆内有较多棕黄色颗粒,RECK表达强,S-P×400
图5 正常对照组RECK的表达 内皮细胞胞浆内有较多棕黄色颗粒(→),RECK表达强,S-P×400
图6 增生期血管瘤MMP-2的表达 血管瘤内皮细胞核或胞质内有较多棕黄色颗粒(→),MMP-2表达强,S-P×400
图7 退化期血管瘤MMP-2的表达 血管瘤内皮细胞胞核或胞质内有较少棕黄色颗粒,MMP-2表达弱或无表达(→),S-P×400
图8 正常组MMP-2的表达 血管内皮细胞胞核或胞质内有较少棕黄色颗粒,MMP-2表达弱或无表达(→),SP×400
EXPLANATION OF FIGURES
Fig.1PCNA expression in proliferating hemangioma.There were plenty of brown particles in the nucleus of proliferating endothelial cells,which showed PCNA expressed strongly(→).S-P×400
Fig.2PCNA expression in involuting hemangioma.There were few brown particles in the nucleus of less endothelial cells,which showed PCNA expressed weakly(→).S-P×400
Fig.3RECK expression in proliferating hemangioma.There were few of brown particles in cytoplasm the of proliferating endothelial cells,RECK expressed weakly(→).S-P×400
Fig.4RECK expression in involuting hemangioma.There were plenty brown particles in cytoplasm the of involuting endothelial cells,RECK expressed strongly(→).S-P×400
Fig.5RECK expression in normal skin Group.There were plenty brown particles in cytoplasm the of in normal skin endothelial cells,RECK expressed strongly(→).S-P×400
Fig.6MMP-2expression in proliferating hemangioma.There were plenty of brown particles in cytoplasm the of involuting endothelial cells,MMP-2expressed strongly(→).SP×400
Fig.7MMP-2expression in involuting hemangioma.There were few brown particles in cytoplasm the of involuting endothelial cells,MMP-2expressed weakly(→).S-P×400
Fig.8MMP-2expression in normal skin Group.There were few brown particles in cytoplasm the of in normal skin endothelial cells,MMP-2expressed weakly(→).S-P×400