海岸单叶蔓荆沙埋胁迫下碳水化合物变化与其耐沙埋的关系
周瑞莲,杨淑琴,贾有余,黄清荣,解卫海,刘晓凤
1 鲁东大学生命科学学院,烟台 264025 2 内蒙古农牧科学院资源环境与检测技术研究所,呼和浩特 010030
海岸单叶蔓荆沙埋胁迫下碳水化合物变化与其耐沙埋的关系
周瑞莲1,*,杨淑琴1,贾有余2,黄清荣1,解卫海1,刘晓凤1
1 鲁东大学生命科学学院,烟台 264025 2 内蒙古农牧科学院资源环境与检测技术研究所,呼和浩特 010030
选择烟台海岸沙地抗沙埋强的单叶蔓荆(Vitextrifoliavar.simplicifolia)为试材,在自然环境条件下根据单叶蔓荆匍匐茎长度进行了轻度(1/3茎长)、中度(2/3茎长)和重度半埋以及全埋处理。在沙埋20d后,测定了不同沙埋处理下匍匐茎各段上匍匐茎长度、枝条高度、不定根长度,以及可溶性糖、淀粉、纤维素含量,以探讨单叶蔓荆碳水化合物变化和转化在其耐沙埋中作用。结果显示,在轻度、中度半埋和全埋下单叶蔓荆匍匐茎长度均显著大于对照,被沙埋匍匐茎处有大量不定根生成;同时,可溶性糖和淀粉含量增高和纤维素含量下降,尤其是生长最快的匍匐茎顶部(如轻度半埋),茎中可溶性糖较低、淀粉增加最多,纤维素最低。但是被重度半埋和全埋的匍匐茎生长较少,茎中纤维素含量较多、淀粉含量较少。研究表明,沙埋是一种胁迫,它损伤叶片、扰乱碳水化合物代谢平衡。 但它又是胁迫信号使植物产生适应性反应,它使未遭沙埋的匍匐茎顶端通过加速碳水化合物转化、分解纤维素、提高淀粉和可溶性糖含量,为顶端生长提供能量和营养,以加速匍匐茎快速生长摆脱沙埋。同时沙埋部位枝叶通过分解其纤维素,产生更多的可溶性糖和淀粉为匍匐茎不定根生长提供能量。因此,沙埋后匍匐茎内碳水化合物的转化是其快速生长和摆脱沙埋的能量来源而在其适应沙埋生长中起重要作用。单叶蔓荆对沙埋的适应性反应表现了其具有表型可塑性特性,该特性是其沙埋后维护匍匐茎顶部快速生长、不定根形成、碳水化合物转化以及具有较高抗沙埋能力的关键。
沙埋;单叶蔓荆;碳水化合物;抗沙埋
单叶蔓荆(Vitextrifoliavar.Simplicafolia.)又名蔓荆子,系马鞭草科牡荆属落叶小灌木,其发达的根系和匍匐茎已成为海岸沙地上防风固沙,沙荒绿化的先锋植物[1],特别适用于沙地和碱性土壤的改良和地区绿化[2-3]。目前,人们已经研究了单叶蔓荆生态效益[2-3]、营养器官的形态结构[4-5],而且还研究了其抗沙埋生理机理[6]和抗沙埋生长对策[7]。但目前尚不清楚作为维护植物代谢和生长的碳水化合物在其沙埋适应中的作用。虽然对其他沙生植物耐沙埋机理的研究有些报道,并且研究发现适度沙埋有利于沙生植物种子萌发和定植[8-9],在沙埋情况下沙生植物的形态、生长和繁衍均可表现出一定的可塑性[9-10],但仍不清楚沙埋过程中植物的生长与碳水化合物转化的关系。
植物体中的碳水化合物包括结构性碳水化合物(木质素、纤维素和半纤维素等)和非结构碳水化合物(葡萄糖、果糖、淀粉、蔗糖、果聚糖和甘露醇等),前者是植物体形态建成的主要成分,后者则是植物生命活动的重要反应物[11]。 它们对植株的生长有重要的影响[12],其储存和转移对植物响应环境胁迫过程起关键作用[11-13]。沙埋下,单叶蔓荆匍匐茎叶中是否发生碳水化合物转化和重新分配,以及这种转化规律在其抗沙埋生长中作用是什么呢?目前国内外尚未见报道。
对非结构碳水化合物在植物适应逆境环境中作用的相关研究发现,牧草[14]、白三叶[15]、冬小麦[16]在低温和融冻胁迫、互花米草[17]在盐胁迫下叶片可溶性糖含量增高。增加的可溶性糖起渗透调节作用在防止细胞失水和维护细胞水分平衡上起重要作用。同时,多年生牧草在长期对高寒环境的适应中,根中淀粉和可溶性糖含量在晚秋增高,在冬季下降[14],这些物质不仅能降低冰点、阻止细胞结冰、防止细胞膜因结冰受到伤害,而且它还是冬季植物生活所依赖的能源物质。另外,研究还发现,植物地上部叶片减少时,茎中可溶性碳水化合物含量则上升[18-19]。 海草在地上大部分生物量被摄食后, 海草地下茎中非结构性碳水化合物就向地上转移补偿地上芽、促进叶片生长和植株的恢复[20]。这种非结构性碳水化合物的转移在海草受动物摄食后光合组织再生中起着重要的作用。在光限制条件下,植物通过地下根茎非结构性碳水化合物向地上转移来支持叶的生长[21-22]。研究表明,植物根部碳水化合物是植物在逆境条件下和恢复生长阶段,根和叶重新生长的重要物质来源。然而,就研究材料来说,上述研究大多集中于海草、作物等草本植物,而对木本植物研究较少;就研究内容来说,大多集中于逆境条件下非结构碳水化合物变化与植物再生的关系,而对结构性碳水化合物研究较少。而作为结构性碳水化合物的纤维素,它和淀粉具有相同结构单元并可分解为葡萄糖,成为营养能量物质。作为小灌木的单叶蔓荆匍匐茎内存在有大量结构性碳水化合物(纤维素),它们是否参与了沙埋后植株的快速恢复生长呢?
本文拟通过对烟台海岸沙滩单叶蔓荆不同厚度沙埋下枝条生长和碳水化合物含量动态变化的分析,揭示不同厚度沙埋下单叶蔓荆茎叶碳水化合物含量变化与其抗沙埋生长的关系,以及在单叶蔓荆沙埋后再生中作用,以丰富沙漠植物抗沙埋科学理论,为海岸单叶蔓荆的开发利用和种群管理提供理论依据。
1 材料与方法
1.1 研究区自然概况
试验分别在2010和2011年的夏季6—8 月,在烟台市夹河带东部海岸沙滩上进行。烟台市地处山东半岛中部,位于119°34′—121°57′E,36°16′—38°23′N。该地区具有温带季风气候。年平均降水量为651.9 mm,7—8 月降雨量占49%;年平均气温11.8 ℃,最热月为8 月(24.6 ℃),历年极端最高气温38.4 ℃。 年平均风速内陆地区3—4 m /s,沿海地区 4—6 m /s。土壤pH为 4.22—6.79。海岸沙滩土壤多为风沙土。 研究区天然群落以耐沙埋植物为主,主要有筛草(Carexkobomugi)、单叶蔓荆 (Vitextrifoliavar.simplicifolia)等。
1.2 研究方法
1.2.1 单叶蔓荆生物学特性
单叶蔓荆属于落叶小灌木。在适宜的气候条件下,它能通过匍匐茎快速延伸生长覆盖地面,抑制其他杂草生长,形成纯度较高的单叶蔓荆群落,是优良的地被植物,具有很强的抗风、抗旱、抗盐碱能力。但在海岸沙地由于受海风影响其植株低矮。
1.2.2 沙埋试验设计
本研究试验设计与 “海滨沙地单叶蔓荆匍匐茎对沙埋适应生长对策”的相同。同一沙埋试验下,该文侧重于报道沙埋过程中匍匐茎、枝条、不定根生长动态、以及经历不同厚度沙埋处理20d后匍匐茎各段可溶性糖、淀粉和纤维素含量变化。
本研究依据自然沙埋现象对单叶蔓荆匍匐茎进行了不同厚度(横向-以枝条高为准)和不同长度(纵向-匍匐茎长度为准)两因子交叉沙埋处理方式。横向沙埋即根据匍匐茎中部枝条高度(平均10cm)设立半埋(沙埋至1/2 枝高处)和全埋(沙埋全部枝条)。纵向沙埋即根据匍匐茎长度设立。先将匍匐茎均分为3段,从主根到匍匐茎顶端依次为:基部(主根-匍匐茎1/3处)、中部(匍匐茎1/3处—2/3处)、和顶部(2/3处—顶端)。纵向沙埋处理为:轻度沙埋(沙埋基部)、中度沙埋(沙埋基部和中部)和重度沙埋(沙埋整个匍匐茎)。纵向和横向两因子交叉沙埋处理有:轻度半埋(基部埋至1/2枝高)、中度半埋(基部和中部埋至1/2枝高)和重度半埋(整个匍匐茎埋至1/2枝高);轻度全埋(基部全埋)、中度全埋(基部和中部全埋)和重度全埋(整个匍匐茎全埋)。
1.2.3 标记试验材料
在沙埋前对测试材料进行标记:(1)标记试验地,在海岸沙滩上选择单叶蔓荆密集生长地块为试验地,并除去杂草,将样地插牌作标记;(2)标记测试植株,在试验地上选择匍匐茎长度相对一致的植株为试验材料并挂标签。每种沙埋处理标记8株植物,同时另选不进行沙埋处理的8株为对照;(3)标记植株近地表部位和匍匐茎上枝条1/2处,以及匍匐茎基部、1/3处、2/3处,用记号笔和红线绳将选定部位进行标记,以便测量沙埋后植株高度和匍匐茎各段生长动态。
1.2.4 沙埋处理
按照沙埋试验设计,分别采用株高1/2和整株高度的纸壳制成不同高度和长度的方框。如中度半埋,纸框体积为高5 cm,宽30cm,长为匍匐茎基部加中部长度的纸框。 沙埋时将待沙埋植株用相应纸框圈起。然后收集地表干沙,并一边覆沙,一边尽量让植株上叶片自然展开。沙埋后在纸框外部继续覆沙与地面成斜坡,以防雨水冲刷。
1.2.5 试验观测
试验观测发现,在不同厚度和程度沙埋处理20d后,匍匐茎长度和枝条高度在不同厚度沙埋处理间及与对照间已呈现明显差异,故在沙埋处理20d后中止沙埋处理,并将所有标记并观测过的植物整株带回实验室。每个处理包括5 个标记的匍匐茎。在匍匐茎各部位链接点处(沙埋前已用记号笔标记)用剪刀剪开,同时将同一部位上的匍匐茎、不定根和枝条茎叶剪开,分别烘干称重。并分别测定了每一个匍匐茎各段上茎叶根中可溶性糖、淀粉和纤维素含量。各指标测定均重复3 次以上。
1.2.6 测定方法
可溶性糖、淀粉和纤维素按赵世杰法[23]。
1.3 数据处理
实验数据采用5个标记的匍匐茎与每个指标重复测试3个以上的平均值±标准误(mean±SE)表示,所有数据用EXCELL处理后用SPSS 11.5软件对不同程度沙埋间,匍匐茎各段数据进行了差异显著性分析和多重比较。
2 结果与分析
2.1 不同厚度沙埋20d,单叶蔓荆匍匐茎长度, 不定根长度和枝条高度比较
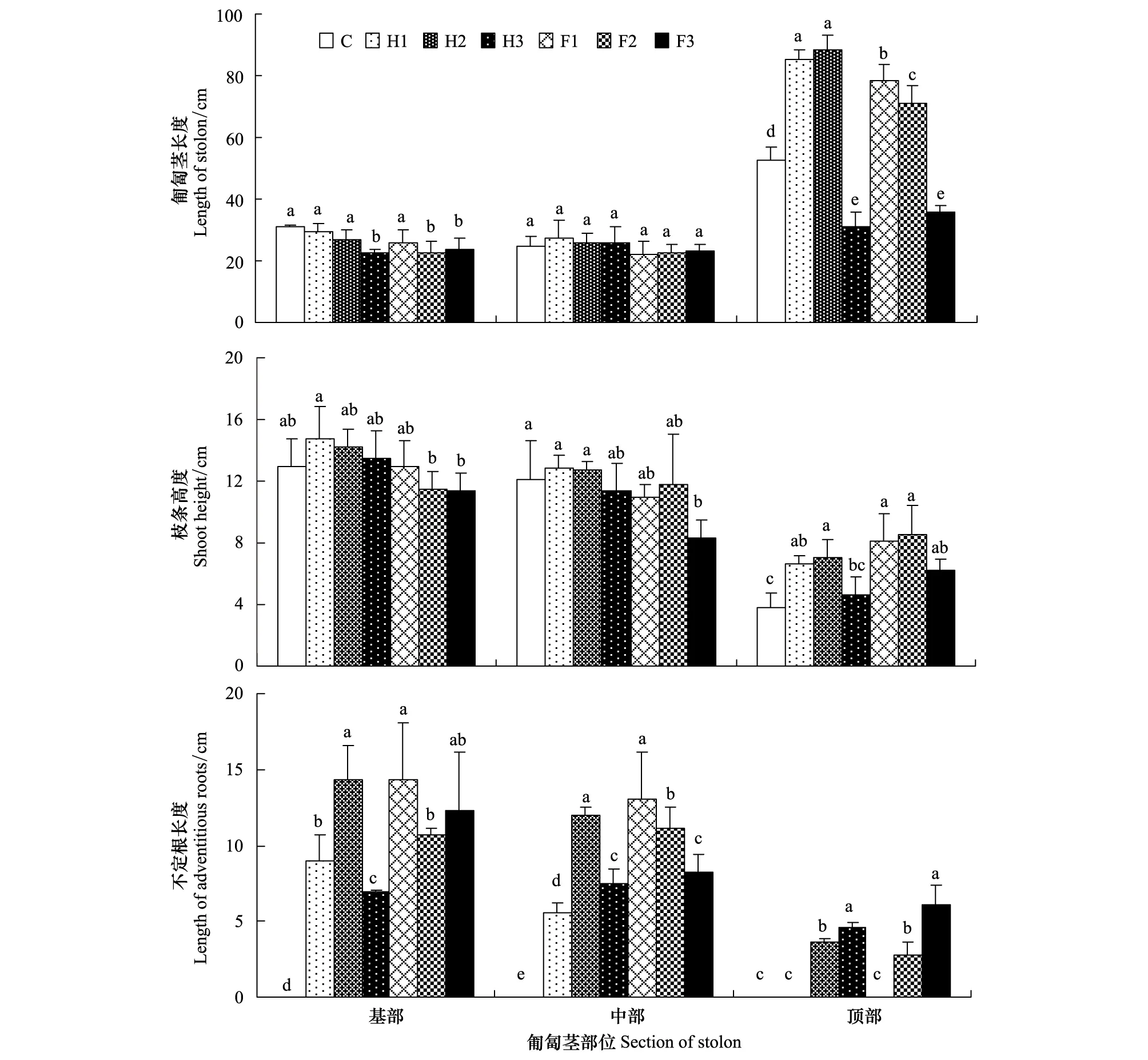
图1 不同厚度沙埋20d单叶蔓荆匍匐茎长度、不定根长度和枝条高度比较Fig.1 Comparison of the length of stolon and adventitious roots and shoot height of Vitex trifolia var. simplicifoli under different level treatments of sand burial after 20daysC:对照;H1:轻度半埋; H2:中度半埋; H3:重度半埋; F1:轻度全埋;F2:中度全埋;F3:重度全埋;图中字母表示不同沙埋处理间差异显著比较,其中字母相同表示沙埋处理间差异不显著,字母不相同表示沙埋处理间差异显著(P<0.05)
沙埋前匍匐茎基部、中部和顶部各段标记长度相近。沙埋20d后,沙埋处理组和对照匍匐茎基部和中部长度基本没有变化,只有顶部增长明显(图1)。其中,对照顶部较基部和中部长约1倍。与对照相比,在轻度和中度半埋下,匍匐茎顶部长度分别较对照长61.9%和68.2%;在轻度和中度全埋下,匍匐茎顶部长度分别较对照高49.1%和34.9%, 均与对照差异显著(P<0.05)。 而重度半埋和重度全埋分别使匍匐茎顶部生长受抑,较对照降低了41%和31.4%。
沙埋20d,匍匐茎基部、中部上的枝长高度与对照相比差异不大,而顶部增加明显。与对照相比,在轻度和中度半埋下顶部枝条高度分别较对照高73.7%和84.2%;在轻度和中度全埋下,顶部枝长高度分别较对照高113.2%和123.7%,均与对照差异显著(P<0.05)。而重度半埋和重度全埋下顶部枝长高度分别较对照降低21.1%和63.2%。
沙埋20d,对照和没有受沙埋的匍匐茎顶部(轻度半埋和全埋)无不定根生长,而在受沙埋的匍匐茎部位上长出不定根,并且在近沙埋部位处也长出不定根。如轻度半埋和全埋,在受沙埋的基部和没有受沙埋的中部均有不定根长出,中度半埋和全埋的匍匐茎在没有沙埋的顶部也长出不定根,只是沙埋部位的根长度较没有沙埋部位的长。另外重度半埋和全埋的匍匐茎上虽然均有不定根,但生长较慢导致不定根长度略低于其他沙埋处理。
2.2 沙埋对匍匐茎各部位根茎叶总碳水化合物影响
总碳水化合物,即结构性碳水化合物(纤维素)和非结构性碳水化合物(可溶性糖和淀粉)之和。研究表明,对照匍匐茎茎中碳水化合物在基部和中部含量差异不大,顶部略高,而叶中碳水化合物从基部到顶部趋于下降,其中基部比顶部高49%(表1)。但匍匐茎各部位叶片碳水化合物含量均高于茎部,并差异显著(P<0.05)。
匍匐茎在中度和重度半埋20d,茎叶中碳水化合物总量分别较对照增加12%、33%,整个匍匐茎根茎叶总碳水化合物较对照分别增加54%和45%,而轻度沙埋下略有降低(表1)。匍匐茎在全埋处理下,除了轻度全埋使匍匐茎中总碳水化合物含量提高了52%外,中度和重度全埋均使匍匐茎中总碳水化合物含量下降。
同一匍匐茎上沙埋部位总碳水化合物含量高于未沙埋的。如轻度和中度半埋,沙埋部位匍匐茎中总碳水化合物含量较未沙埋的高8%和167%; 轻度和中度全埋处理下沙埋部位匍匐茎中总碳水化合物含量较未沙埋的高51%和102%。沙埋处理使匍匐茎各部位叶片中碳水化合物含量均高于茎的。
2.3 沙埋对匍匐茎各部位根茎叶中可溶性糖含量影响
本研究对匍匐茎中非碳水化合物(可溶性糖、淀粉)和结构碳水化合物(纤维素)含量用百分含量表示,即匍匐茎上同一部位,可溶性糖、淀粉和纤维素含量分别与该部位总碳水化合物含量(可溶性糖+淀粉+纤维素)的百分比,以揭示沙埋对匍匐茎非结构和结构碳水化合物间转化的影响。 结果表明,对照匍匐茎各段茎叶中可溶性糖含量大约相近,差异不显著,茎中可溶性糖含量略高于叶片(表2)。与对照相比,不同程度半埋和全埋均使整个匍匐茎茎叶中可溶性糖含量增加,尤其是中度半埋和全埋提高幅度最大(表2)。由于不同程度半埋和全埋沙埋处理下匍匐茎上不定根的形成, 而使整个匍匐茎可溶性糖含量增加,并与对照差异显著(P<0.05)。同一匍匐茎上,沙埋部位茎叶中可溶性糖含量高于没有沙埋部位的。如轻度和中度半埋沙埋处理,沙埋部位根茎叶可溶性糖比没有沙埋的高33%和54%;轻度和中度全埋沙埋处理中,沙埋部位的较没有沙埋的高50%和51%。沙埋引起沙下匍匐茎上产生不定根可能是导致沙埋部位可溶性糖含量增加的直接原因。单就匍匐茎不同器官而言,沙埋使叶片可溶性糖增加幅度大于茎部,但重度全埋降低可溶性糖含量。
表1 沙埋20d单叶蔓荆匍匐茎各段茎叶根总碳水化合物含量变化 (μg/g干重)
Table 1 Changes of total carbohydrate contents in the leaves and shoot and roots of Vitex trifolia var. simplicifoli under different levels of sand burial for 20days
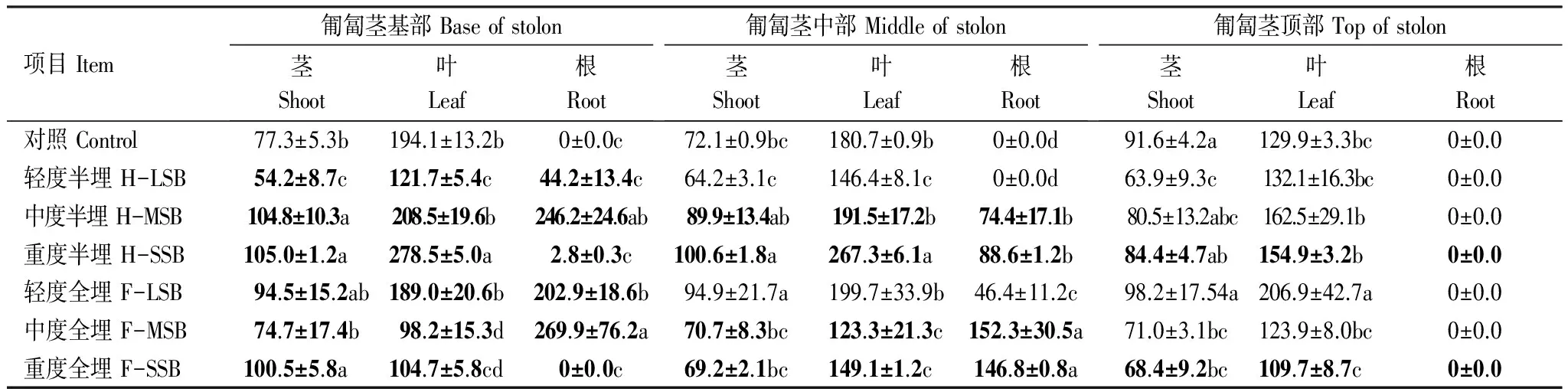
项目Item匍匐茎基部Baseofstolon茎Shoot叶Leaf根Root匍匐茎中部Middleofstolon茎Shoot叶Leaf根Root匍匐茎顶部Topofstolon茎Shoot叶Leaf根Root对照Control77.3±5.3b194.1±13.2b0±0.0c72.1±0.9bc180.7±0.9b0±0.0d91.6±4.2a129.9±3.3bc0±0.0轻度半埋H-LSB54.2±8.7c121.7±5.4c44.2±13.4c64.2±3.1c146.4±8.1c0±0.0d63.9±9.3c132.1±16.3bc0±0.0中度半埋H-MSB104.8±10.3a208.5±19.6b246.2±24.6ab89.9±13.4ab191.5±17.2b74.4±17.1b80.5±13.2abc162.5±29.1b0±0.0重度半埋H-SSB105.0±1.2a278.5±5.0a2.8±0.3c100.6±1.8a267.3±6.1a88.6±1.2b84.4±4.7ab154.9±3.2b0±0.0轻度全埋F-LSB94.5±15.2ab189.0±20.6b202.9±18.6b94.9±21.7a199.7±33.9b46.4±11.2c98.2±17.54a206.9±42.7a0±0.0中度全埋F-MSB74.7±17.4b98.2±15.3d269.9±76.2a70.7±8.3bc123.3±21.3c152.3±30.5a71.0±3.1bc123.9±8.0bc0±0.0重度全埋F-SSB100.5±5.8a104.7±5.8cd0±0.0c69.2±2.1bc149.1±1.2c146.8±0.8a68.4±9.2bc109.7±8.7c0±0.0
黑体示沙埋处理部位; H-LSB:Half of light sand burial;F-LSB:Full of light sand burial;H-MSB:Half of moderate sand burial;F-MSB:Full of moderate sand burial;H-SSB:Half of severe sand burial;F-SSB:Full of severe sand burial
表2 沙埋20d匍匐茎各段根茎叶可溶性糖与其各段总碳水化合物含量比的变化 (%)
Table 2 Changes of the ratio of soluble sugar and total carbohydrate contents in the leaves and shoot and roots of each stolon segments of Vitex trifolia var. simplicifoli under different levels of sand-burial for 20days
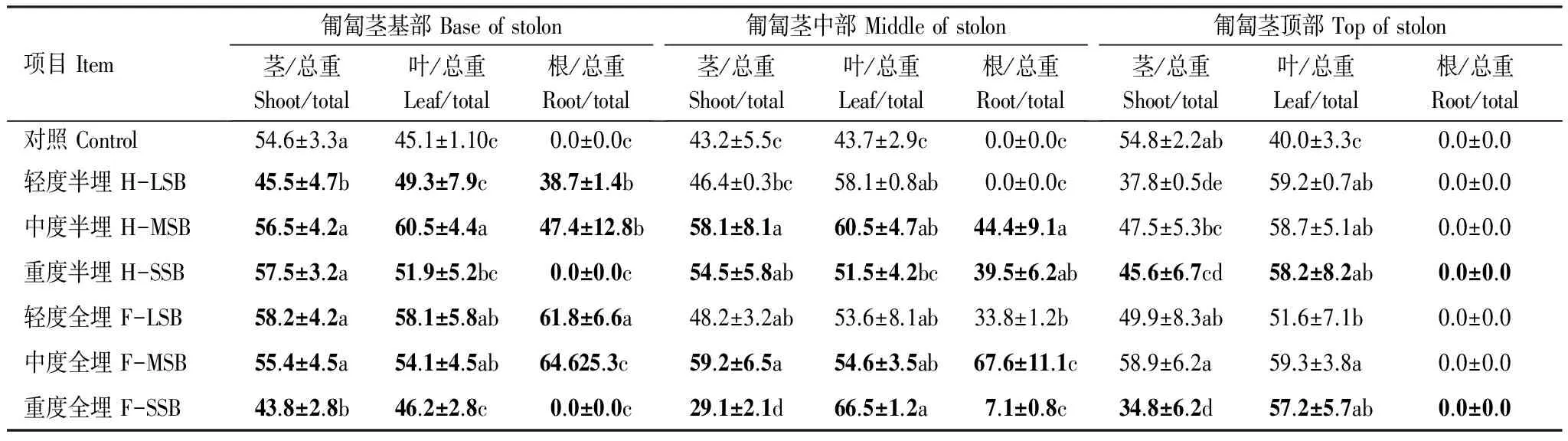
项目Item匍匐茎基部Baseofstolon茎/总重Shoot/total叶/总重Leaf/total根/总重Root/total匍匐茎中部Middleofstolon茎/总重Shoot/total叶/总重Leaf/total根/总重Root/total匍匐茎顶部Topofstolon茎/总重Shoot/total叶/总重Leaf/total根/总重Root/total对照Control54.6±3.3a45.1±1.10c0.0±0.0c43.2±5.5c43.7±2.9c0.0±0.0c54.8±2.2ab40.0±3.3c0.0±0.0轻度半埋H-LSB45.5±4.7b49.3±7.9c38.7±1.4b46.4±0.3bc58.1±0.8ab0.0±0.0c37.8±0.5de59.2±0.7ab0.0±0.0中度半埋H-MSB56.5±4.2a60.5±4.4a47.4±12.8b58.1±8.1a60.5±4.7ab44.4±9.1a47.5±5.3bc58.7±5.1ab0.0±0.0重度半埋H-SSB57.5±3.2a51.9±5.2bc0.0±0.0c54.5±5.8ab51.5±4.2bc39.5±6.2ab45.6±6.7cd58.2±8.2ab0.0±0.0轻度全埋F-LSB58.2±4.2a58.1±5.8ab61.8±6.6a48.2±3.2ab53.6±8.1ab33.8±1.2b49.9±8.3ab51.6±7.1b0.0±0.0中度全埋F-MSB55.4±4.5a54.1±4.5ab64.625.3c59.2±6.5a54.6±3.5ab67.6±11.1c58.9±6.2a59.3±3.8a0.0±0.0重度全埋F-SSB43.8±2.8b46.2±2.8c0.0±0.0c29.1±2.1d66.5±1.2a7.1±0.8c34.8±6.2d57.2±5.7ab0.0±0.0
2.4 沙埋对匍匐茎各部位根茎叶淀粉含量的影响
对照匍匐茎不同部位茎中淀粉含量除了中部较高外,基部和顶部差异不明显,不同部位叶片中淀粉含量差异也不明显(表3)。但不同程度半埋20d后,匍匐茎茎叶中淀粉含量增加并高于对照,其增加幅度随匍匐茎沙埋程度增大而降低。如轻度、中度、重度半埋下,匍匐茎茎叶总淀粉较对照分别增加287%、49%和3%。整个匍匐茎(根茎叶)在轻度、中度、重度半埋中总淀粉分别较对照增加356%、110%和39%。并且,同一匍匐茎上沙埋部位茎叶和没沙埋部位茎叶,以及同部位匍匐茎上茎叶淀粉含量差异均不显著。
与匍匐茎半埋不同的是,轻度全埋使匍匐茎茎叶淀粉含量较对照下降,中度全埋下略有增加(8%),重度全埋明显增高(75%)。整个匍匐茎淀粉含量由于不定根生成使中度全埋(45%)和重度全埋(113%)增加更为显著。同一匍匐茎上沙埋部位和没沙埋部位茎叶淀粉含量差异不明显。
2.5 沙埋对匍匐茎各部位根茎叶纤维素含量的影响
对照匍匐茎从基部到顶部茎叶纤维素含量呈增加趋势,但差异不明显。同时匍匐茎上同一部位茎和叶中纤维素含量没有差异。但不同程度半埋和全埋20d后,匍匐茎茎叶纤维素含量均较对照低,其下降幅度随匍匐茎沙埋程度增大而减小(表4)。与对照相比,匍匐茎茎叶总纤维素含量在轻度、中度、重度半埋下,分别降低74%、37%和20%;在轻度、中度、重度全埋下,分别降低15%、30%和20%,均与对照差异显著(P<0.05)。全埋下由于不定根生成使整个匍匐茎总纤维素含量略有增高。同一匍匐茎上,没沙埋部位茎叶纤维素含量略高于沙埋部位的,但差异不显著。但不同程度半埋和全埋使茎中纤维素含量高于叶片,尤其是轻度半埋匍匐茎上茎中纤维素较叶片的高156%,其余相差较小(24%)。
表3 沙埋20d匍匐茎各段茎叶根淀粉含量与其各段总碳水化合物含量比的变化 (%)
Table 3 Changes of the ratio of starch and total carbohydrate contents in the leaves and shoot and roots of each stolon segments of Vitex trifolia var. simplicifoli under different levels of sand-burial for 20days
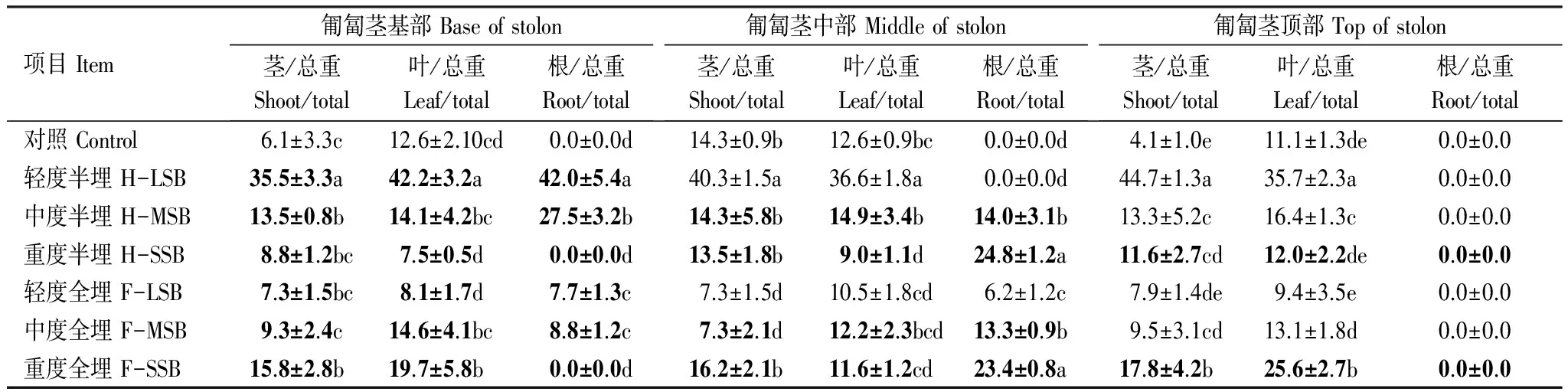
项目Item匍匐茎基部Baseofstolon茎/总重Shoot/total叶/总重Leaf/total根/总重Root/total匍匐茎中部Middleofstolon茎/总重Shoot/total叶/总重Leaf/total根/总重Root/total匍匐茎顶部Topofstolon茎/总重Shoot/total叶/总重Leaf/total根/总重Root/total对照Control6.1±3.3c12.6±2.10cd0.0±0.0d14.3±0.9b12.6±0.9bc0.0±0.0d4.1±1.0e11.1±1.3de0.0±0.0轻度半埋H-LSB35.5±3.3a42.2±3.2a42.0±5.4a40.3±1.5a36.6±1.8a0.0±0.0d44.7±1.3a35.7±2.3a0.0±0.0中度半埋H-MSB13.5±0.8b14.1±4.2bc27.5±3.2b14.3±5.8b14.9±3.4b14.0±3.1b13.3±5.2c16.4±1.3c0.0±0.0重度半埋H-SSB8.8±1.2bc7.5±0.5d0.0±0.0d13.5±1.8b9.0±1.1d24.8±1.2a11.6±2.7cd12.0±2.2de0.0±0.0轻度全埋F-LSB7.3±1.5bc8.1±1.7d7.7±1.3c7.3±1.5d10.5±1.8cd6.2±1.2c7.9±1.4de9.4±3.5e0.0±0.0中度全埋F-MSB9.3±2.4c14.6±4.1bc8.8±1.2c7.3±2.1d12.2±2.3bcd13.3±0.9b9.5±3.1cd13.1±1.8d0.0±0.0重度全埋F-SSB15.8±2.8b19.7±5.8b0.0±0.0d16.2±2.1b11.6±1.2cd23.4±0.8a17.8±4.2b25.6±2.7b0.0±0.0
表4 沙埋20d单叶蔓荆匍匐茎各部位根茎叶纤维素含量与其各段总碳水化合物含量比的变化 (%)
Table 4 Changes of the ratio of cellulose and total carbohydrate contents in the leaves and shoot and roots of each stolon segments of Vitex trifolia var. simplicifoli under different levels of sand-burial for 20days
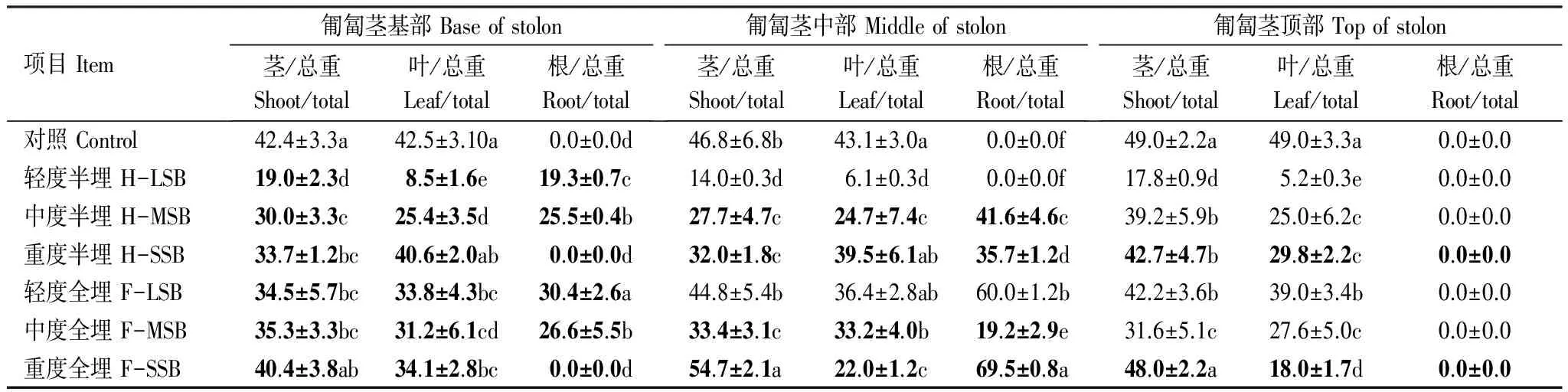
项目Item匍匐茎基部Baseofstolon茎/总重Shoot/total叶/总重Leaf/total根/总重Root/total匍匐茎中部Middleofstolon茎/总重Shoot/total叶/总重Leaf/total根/总重Root/total匍匐茎顶部Topofstolon茎/总重Shoot/total叶/总重Leaf/total根/总重Root/total对照Control42.4±3.3a42.5±3.10a0.0±0.0d46.8±6.8b43.1±3.0a0.0±0.0f49.0±2.2a49.0±3.3a0.0±0.0轻度半埋H-LSB19.0±2.3d8.5±1.6e19.3±0.7c14.0±0.3d6.1±0.3d0.0±0.0f17.8±0.9d5.2±0.3e0.0±0.0中度半埋H-MSB30.0±3.3c25.4±3.5d25.5±0.4b27.7±4.7c24.7±7.4c41.6±4.6c39.2±5.9b25.0±6.2c0.0±0.0重度半埋H-SSB33.7±1.2bc40.6±2.0ab0.0±0.0d32.0±1.8c39.5±6.1ab35.7±1.2d42.7±4.7b29.8±2.2c0.0±0.0轻度全埋F-LSB34.5±5.7bc33.8±4.3bc30.4±2.6a44.8±5.4b36.4±2.8ab60.0±1.2b42.2±3.6b39.0±3.4b0.0±0.0中度全埋F-MSB35.3±3.3bc31.2±6.1cd26.6±5.5b33.4±3.1c33.2±4.0b19.2±2.9e31.6±5.1c27.6±5.0c0.0±0.0重度全埋F-SSB40.4±3.8ab34.1±2.8bc0.0±0.0d54.7±2.1a22.0±1.2c69.5±0.8a48.0±2.2a18.0±1.7d0.0±0.0
3 讨论与结论
研究结果表明,(1)沙埋前等长度标记的匍匐茎各段经20d生长后,无论是对照还是沙埋处理的匍匐茎,其基部和中部长度增加不明显,顶部长度增加显著。尤其是匍匐茎顶部未遭沙埋的轻度和中度半埋和全埋沙埋处理均加速顶部匍匐茎生长使长度较对照长(图1)。(2)海岸单叶蔓荆匍匐茎经轻度、中度半埋和全埋20d后,匍匐茎长度均显著大于对照(图1),碳水化合物总量(表1)增加,其中可溶性糖含量(表2)及淀粉含量增高 (表3),而纤维素含量下降 (表4)。(3)沙埋还使沙埋部位茎叶可溶性糖含量高于没有沙埋的,茎叶纤维素含量低于没有沙埋。尤其是匍匐茎顶部(如轻度半埋),茎中可溶性糖较低、淀粉增加最多,纤维素最低。结果表明,沙埋不仅导致匍匐茎内物质分配发生改变[7],而且打破了匍匐茎内正常的碳水化合物代谢平衡。沙埋后匍匐茎快速生长与非结构性碳水化合物积累和结构性碳水化合物含量降低相关。那么,沙埋诱发匍匐茎内碳水化合物转移和转化、促使匍匐茎顶端快速生长的作用机理是什么呢?
一些研究发现,生物界物种普遍存在着表型可塑性(phenotypic plasticity),即同一个基因型对不同环境应答可产生不同的表型特性[24]。如,植物可随着光照强度的不同,其茎节长度、单叶叶面积等发生表型差异[25]; 植物在遭受动物采食刺激后体内会产生一些次生代谢物阻滞动物采食[26];广幅种桃叶蓼(Polygonumpersicaria)在土壤水涝胁迫时能通过快速重新调整根系统使之向表土层分布以保持较高的生长速率[27]。 研究认为在干扰等异质生境下产生的表型可塑性是物种生存扩散的有力性状[28],是生物适应变化着的环境提高耐受性的重要方式[29-30]。因此,沙埋胁迫下,单叶蔓荆匍匐茎内碳水化合物转移和转化、及顶端的快速生长是其固有表型可塑性特征表现,是其对沙埋的适应性反应。那么,沙埋促进匍匐茎顶端快速生长的机理是什么呢?
Karpinski[ 31 ]将叶兰芥(Arabidopsis)一部分叶片置强光下,另一部分叶片遮光。 他发现遮光的叶片同样获得了光保护能力。 Yono[32]测试了处于不同强光下Chenopodiumalbum新叶发育形态上的变化。研究发现,当生长点遮光,成熟叶置强光下,结果顶端产生的新叶能适应强光照。研究指出,成熟叶所处环境决定了叶片发育分化,对光反应的信息可以从成熟叶传递给幼叶,同时植物展示了一种能力,即当一个植物的两个部分处于不同环境时,这两部分具有相互交流的能力,使植物具有系统获得适应的能力。因此,在沙埋处理中,沙埋部位均为成熟叶片,感受沙埋重力胁迫的成熟叶可能将胁迫信号传递给没有沙埋的匍匐茎顶端生长点,导致整个匍匐茎均获得胁迫信息,引起整个匍匐茎适应性反应和表型可塑性的展示。
沙埋后匍匐茎产生的适应性反应,首先是加速匍匐茎顶部快速延伸生长以摆脱进一步的沙埋。正常情况下,植物会将光合作用生产的碳水化合物一部分用于维护植株生命代谢(非结构碳水化合物),一部分用于植物的形态建成(结构碳水化合物),而使碳水化合物代谢处于平衡状态。但在沙埋情况下,叶片光合作用受阻、用于维持植株生命代谢和生长的非结构碳水化合物不足导致匍匐茎顶部碳水化合物代谢失衡。为了维护碳水化合物代谢平衡和匍匐茎顶部有足够的能量和营养用于顶部的快速生长,则在匍匐茎顶部发生了碳水化合物转化,即结构性碳水化合物(纤维素)开始分解为非结构性碳水化合物,导致顶部纤维素含量急剧下降和可溶性糖和淀粉含量增加。Turner等[19]研究发现,植物在刈割,叶片受损时,根部储存的碳水化合物就会向上转移使茎基部可溶性碳水化合物增高而促进再生。Libes等[20]研究也发现,海草在地上大部分生物量被摄食后, 海草地下茎中非结构性碳水化合物就向地上转移补偿地上芽、促进叶片生长和植株的恢复。研究认为,胁迫条件下植物非结构碳水化合物的转移在补偿叶片生长和光合组织再生中起重要作用[11]。因此沙埋胁迫下,匍匐茎顶端通过快速调整碳水化合物代谢和物质转换,加速纤维素分解提高可溶性糖含量以促进其快速生长,这可能是其摆脱进一步沙埋和维持生长的调节对策。其次,加速匍匐茎沙埋部位不定根的生成。单叶蔓荆匍匐茎具有着地部分生须根的特点。沙埋使被沙埋匍匐茎置于黑暗、潮湿、缺氧环境。一方面不同程度半埋和全埋处理使部分或全部叶片被沙埋而无法行光合作用,造成可溶性碳水化合物输入降低,而着地匍匐茎不定根生长对可溶性碳水化合物需求增大,引起匍匐茎茎内碳水化合物代谢失衡,导致茎叶碳水化合物转化,大量的纤维素分解提高淀粉和可溶性糖含量,用于匍匐茎不定根的形成。而新形成的不定根不仅是植物对环境变化的适应产物,而且它可以通过扩大根部吸收水分和土壤营养的面积、缩短与顶部输水距离、弥补了沙埋造成的水分丢失而在维护沙埋后匍匐茎内的水分平衡、矿物营养平衡、和碳水化合物平衡中起重要作用。因此,沙埋后匍匐茎顶部纤维素的降解是其顶端快速生长的能量来源,在促进顶端快速生长、摆脱进一步沙埋、维护碳水化合物平衡和植株的持续生存有重要作用。而中部和基部匍匐茎中纤维素的降解不仅为受损的匍匐茎继续生存提供了能量,也是匍匐茎上不定根形成的营养物质供体,在维护整个匍匐茎水分平衡、碳水化合物平衡有重要调控作用。但是重度半埋和全埋使整个匍匐茎置于沙下,不仅匍匐茎顶端由于被沙生长受抑,而且匍匐茎不定根形成也受阻。 这可能是由于沙下缺氧使纤维素分解受阻,导致沙下匍匐茎中纤维素含量较轻度和中度半埋和全埋高。同时淀粉含量相对较低,有限的可溶性碳水化合物在维护植物呼吸消耗后,可能剩余的不足从而抑制了不定根生长。因此,不同程度沙埋后单叶蔓荆匍匐茎内纤维素的快速分解、匍匐茎顶端快速生长、不定根的产生是其生理和表型可塑性的表现。
研究表明,单叶蔓荆具有表型可塑性特性,而这种特性在沙埋后单叶蔓荆维护匍匐茎快速生长、不定根形成、碳水化合物代谢平衡、水分平衡以及提高其抗沙埋能力上起具有作用。由于表型可塑性是受基因型决定还受环境因素的影响[24]。因此,单叶蔓荆耐沙埋能力是由其遗传特性所决定,而沙埋胁迫是其表型可塑性产生的诱因。研究还发现,在不伤及匍匐茎顶端情况下,轻度和中度半埋均使匍匐茎产生表型可塑性反应,导致纤维素分解最快、淀粉积累量最多、可溶性糖最多、匍匐茎生长快。这表明轻度沙埋胁迫即可诱发单叶蔓荆产生表型可塑性反应、促使匍匐茎快速生长、加速种群扩大。可见,在海岸沙地进行适度沙埋干扰,通过加速匍匐茎碳水化合物转化和匍匐茎延伸生长、促进不定根形成就可扩展单叶蔓荆种群,这在海岸沙地单叶蔓荆种群管理上值得借鉴。
综上所述,沙埋是一种胁迫,它损伤叶片、扰乱碳水化合物代谢平衡。 但它又是胁迫信号通过匍匐茎沙埋部位传到未沙埋的顶部诱导整个植物产生适应性反应,并激活表型可塑性特性。未遭沙埋的匍匐茎顶端区域通过加速碳水化合物转化、分解储存的纤维素、提高淀粉和可溶性糖含量,为顶端生长提供能量和营养,并加速匍匐茎快速生长以防止进一步被沙埋。同时沙埋部位枝叶通过分解其纤维素产生更多的可溶性糖和淀粉为匍匐茎不定根生长提供能量,同时新不定根的形成可扩大吸水和吸收养分的面积、提高向顶端水分运输的效率。因此,沙埋后单叶蔓荆纤维素的快速分解在维护匍匐茎碳水化合物代谢平衡、水分平衡以及提高单叶蔓荆抗沙埋能力具有重要作用。
[1] 唐村, 王慧梅. 耐盐、耐旱、固沙地被——单叶蔓荆. 园林, 2008, (5):65- 65.
[2] 乔勇进,张敦论,郗金标,王开芳,丰宗新. 沿海沙质海岸单叶蔓荆群落特点及土壤改良的分析. 防护林科技, 2001, (4):6- 8.
[3] 宋天英. 单叶蔓荆对滨海沙地土壤养分和木麻黄生长的影响. 福建林业科技. 2002, 29(2):44- 45 53- 53.
[4] 王仲礼,孔冬瑞,王磊. 单叶蔓荆小孢子发生和雄配子体的发育. 植物研究, 2007, 27(6):664- 668.
[5] 宗文,韩晓弟,高原,杨洋. 单叶蔓荆植物生物学研究. 安徽农业科学, 2008,36(35):15439- 15440.
[6] 周瑞莲,王进,杨淑琴,杨树德. 海滨沙滩单叶蔓荆对沙埋的生理响应特征. 生态学报, 2013, 33(6):1973- 1981.
[7] 周瑞莲,杨树德,左进城,王艳芳,李其芳,胡德昌. 海滨沙地单叶蔓荆匍匐茎对沙埋适应对策. 生态学报,2015, 35(4):1- 13
[8] 李秋艳,赵文智. 五种荒漠植物幼苗出土及生长对沙埋深度的响应. 生态学报, 2006, 26(6):1803- 1808.
[9] Harris D, Davy A J. Carbon and nutrient allocation inElymusfarctusseedlings after burial with sand. Annals of Botany, 1988, 61(2):147- 157.
[10] Shi L, Zhang Z J, Zhang C Y, Zhang J Z. Effects of sand burial on survival, growth, gas exchange and biomass allocation ofUlmuspumilaseedlings in the Hunshandak Sandland, China. Annals of Botany, 2004, 94(4):553- 560.
[11] 江志坚, 黄小平,张景平. 环境胁迫对海草非结构性碳水化合物储存和转移的影响. 生态学报,2012,32(19):6242- 6250.
[12] Loewe A, Elinig W, Shi L B, Dizengremel P, Hampp R. Mycorrhiza formation and elevated CO2both increase the capacity for sucrose synthesis in source leaves of spruce and aspen. New Phytologist, 2000, 145 (3):565- 574.
[13] Alcoverro T, Zimmerman R C, Kohrs D G, Alberte R S. Resource allocation and sucrose mobilization in light-limited eelgrassZosteramarina. Marine Ecology Progress Series, 1999,187:121- 131.
[14] 周瑞莲,张普金. 春季高寒草地牧草根中营养物质含量和保护酶活性的变化及其生态适应性研究. 生态学报, 1996,16(4):402- 407.
[15] 周瑞莲,赵梅,王进,张萍,朱露英,赵彦宏. 冬季高温对白三叶越冬和适应春季“倒春寒”的影响. 生态学报,2012, 32(14):4462- 4471.
[16] 刘建芳, 周瑞莲, 赵梅, 赵彦宏, 王艳芳. 氮肥、钙肥和盐处理在冬小麦融冻胁迫适应中的生理调控作用. 生态学报, 2011, 31(23):7161- 7169.
[17] 肖强,郑海雷,陈瑶,黄伟滨,朱珠. 盐度对互花米草生长及脯氨酸、可溶性糖和蛋白质含量的影响. 生态学杂志,2005, 24(4):373- 376.
[18] Lattanzi F A, Schnyder H, Thornton B. Defoliation effects on carbon and nitrogen substrate import and tissue-bound efflux in leaf growth zones of grasses. Plant, Cell and Environment, 2004,27(3):347- 356.
[19] Turner L R, Donaghy D J, Lane P A, Rawnsley R P. Patterns of leaf and root regrowth, and allocation of water-soluble carbohydrate reserves following defoliation of plants of prairie grass (Bromus willdenowii Kunth.). Grass and Forage Science, 2007,62(4):497- 506.
[20] Libes M, Boudouresque C F. Uptake and long-distance transport of carbon in the marine phanerogramPosidoniaoceanica. Marine Ecology Progress Series, 1987,38:177- 186.
[21] Clabby G, Osborne B A. Irradiance and nitrate-dependent variation in growth and biomass allocation ofMycelismuralis. an analysis of its significance for a functional categorization of ‘sun’ and ‘shade’ plants. New Phytologist, 1997,135(3):539- 547.
[22] Brun F G, Olivé I, Malta E J, Vergara J J, Hernández I, Pérez-Lloréns J L. Increased vulnerability ofZosteranoltiito stress caused by low light and elevated ammonium levels under phosphate deficiency. Marine Ecology Progres Series, 2008,365:67- 75.
[23] 赵世杰. 植物生理学实验指导. 北京:中国农业科技出版社, 2002.
[24] 孙利忠,刘彤. 植物表型可塑性概述. 生物学教学,2009,34(3):2- 5.
[25] Niinemets U, Valladares F, Ceulemans R. Leaf-level phenotypic variability and plasticity of invasiveRhododendronponticumand non-invasivellexaquifoliumco-occurring at two contrasting European sites. Plant, Cell & Environment, 2003, 26(6):941- 956.
[26] Bazzaz F A. Plants in Changing Environments:Linking Physiological, Population, and Community Ecology. Cambridge, England:Cambridge University Press, 1996.
[27] Bell D L, Sultan S E. Dynamic phenotypic plasticity for root growth inPolygonum. a comparative study. American Journal of Botany, 1999, 86(6):807- 819.
[28] 陆霞梅,周长芳,安树青,方超,赵晖,杨茜,颜超. 植物的表型可塑性、异速生长及其入侵能力. 生态学杂志, 2007,26(9):1438- 1444.
[29] Sultan S E. Phenotypic plasticity and plant adaptation. Acta Botanica Neerlandica, 1995, 44(4):363- 383.
[30] 耿宇鹏,张文驹,李博,陈家宽. 表型可塑性与外来植物的入侵能力. 生物多样性, 2004, 12(4):447- 455.
[31] Karpinski S, Reynolds H, Karpinska B, Wingsle G, Creissen G, Mullineaux P. Systemic signaling and acclimation in response to excess excitation energy in Arabidopsis. Science, 1999, 284 (5414):654- 657.
[32] Yono S, Terashima I. Separate localization of light signal perception for sun or shade type chloroplast and palisade tissue differentiation in Chenopodium album. Plant & Cell Physiology, 2001, 42(12):1303- 1310.
Relationship between carbohydrate conversion and resistance to sand burial in the stolon ofVitextrifoliavar.simplicifoliagrown on the Coast in Yantai, China
ZHOU Ruilian1,*, YANG Shuqin1, JIA Youyu2, HUANG Qingrong1, XIE Weihai1, LIU Xiaofeng1
1CollegeofLifeScience,LudongUniversity,Yantai264025,China2InnerMongoliaAcademyofAgricultureandAnimalHusbandrySciencesandInstituteofResourcesEnvironmentandDetectionTechnology,InnerMongolia,Hohhot010030,China
Vitextifoliavar.Simplicafoliagrown on the sandy coast of Yantai, China, was chosen as the material for this study. In these experiments, basis on stolon length, the four levels of sand burial treatments were set up:no-sand burial, light sand burial (1/3 lengths of the stolon), moderate sand burial (2/3 lengths of the stolon), and severe sand burial (3/3 lengths of the stolon). In each sand burial treatment, the stolon was buried at two different depths, to half the shoot height and the full plant height. After 20days of sand-burial, various parameters were measured, including the length of the stolon and adventitious roots, shoot height, and soluble sugar, starch, and cellulose content, to determine how carbohydrate conversion in the stolon ofV.tifollacontributed to plant resistance to sand burial. The results showed that compared to the control without sand-burial, the stolon was much longer following light and moderate treatments (i.e., half or full height of shoot), and had new adventitious roots, higher soluble sugar and starch content and lower cellulose content In particular, under the light half sand burial treatment, the top of theV.tifollastolon grew fast, and had the highest starch content, lowest cellulose content, and low soluble sugar content. However, under severe half sand burial and severe full sand burial treatments, the stolons grew very slowly, had higher cellulose content and lower starch content. These results indicate that sand burial represents a type of stress to these plants, which damaged the leaves and disturbed the normal balance of carbohydrate metabolism in the stolons, but also signaled the plant to activate their adaptive response. During the adaptive response, the conversion of carbohydrates was accelerated at the top of the stolon, so that cellulose content declined, while starch and soluble sugar content increased. This response may provide more nutrients and energy for the top of the stolon to grow quickly and protrude above the sand. Alternatively, cellulose in the stolon subjected to sand burial may be degraded to provide energy and nutrients to the damaged stolon to grow and survive, in addition to enhancing the growth of adventitious roots. Our results indicate thatV.trifoliaovercomes burial through the quick growth of the top of stolon and new adventitious roots, with carbohydrate conversion providing the energy resource and nutrition for growth. Thus, carbohydrate conversion is correlated with the capacity of theV.trifoliastolon to resist sand burial. Moreover, the capacity ofV.trifoliato adapt to sand burial shows that this species exhibits phenotypic plasticity, which is important for regulating the carbohydrate balance and sustaining the stolon under sand-burial.
sand burial;Vitextrifoliavar.simplicifolia; carbohydrate; resistance to sand-burial
烟台市科技局(2013ZH351); 国家自然科学基金项目资助(30972422)
2014- 05- 17; < class="emphasis_bold">网络出版日期:
日期:2015- 05- 19
10.5846/stxb201405171010
*通讯作者Corresponding author.E-mail:zhourl726@163.com
周瑞莲,杨淑琴,贾有余,黄清荣,解卫海,刘晓凤.海岸单叶蔓荆沙埋胁迫下碳水化合物变化与其耐沙埋的关系.生态学报,2015,35(23):7729- 7737.
Zhou R L, Yang S Q, Jia Y Y, Huang Q R, Xie W H, Liu X F.Relationship between carbohydrate conversion and resistance to sand burial in the stolon ofVitextrifoliavar.simplicifoliagrown on the Coast in Yantai, China.Acta Ecologica Sinica,2015,35(23):7729- 7737.

