活血益气方及其拆方对大鼠心肌梗死边缘区Spred1及血管新生的影响
郑瑞玲 陈萌 娄利霞 吴爱明 赵一舟 赵久丽 成文堃 吕晞滢 张冬梅
·论著·
活血益气方及其拆方对大鼠心肌梗死边缘区Spred1及血管新生的影响
郑瑞玲 陈萌 娄利霞 吴爱明 赵一舟 赵久丽 成文堃 吕晞滢 张冬梅
目的 观察活血益气方及其拆方对心肌梗死后大鼠梗死边缘区心肌组织血管新生负性调控因子Spred1及血管新生的影响,探讨活血益气方促血管新生的可能作用机制及配伍规律。方法 健康雄性SD大鼠30只,随机分为假手术组6只与手术组24只,手术组行左冠状动脉前降支结扎术制备急性心肌梗死模型,随机分为模型组、活血益气方组、益气方组、活血方组。假手术组只穿线不结扎。连续给予相应药物4周后,处死大鼠,取梗死边缘区心肌组织进行指标检测。采用免疫组织化学法观察微血管密度(microvasculardensity,MVD)、微血管平均直径(mean microvascular diameter,MMVD);采用实时荧光定量PCR法检测Spred1 mRNA的表达;采用Western Blot法检测Spred1蛋白的表达。结果 (1)模型组MVD高于假手术组,MMVD小于假手术组(P<0.01);活血益气方组、益气方组、活血方组MVD高于模型组(P<0.01或P<0.05),其中以活血益气方组最为明显,MMVD大于模型组,仅活血益气方组与之比较具有统计学差异(P<0.01);益气方组、活血方组MMVD小于活血益气方组,分别与之比较,均具有统计学差异(P<0.01)。(2)模型组梗死边缘区心肌组织Spred1 mRNA表达高于假手术组(P<0.05);活血益气方组、益气方组、活血方组Spred1 mRNA表达高于模型组,差异具有统计学意义(P<0.01或P<0.05);益气方组、活血方组Spred1 mRNA表达均高于活血益气方组,仅活血方组与之比较具有统计学差异(P<0.01)。(3)模型组梗死边缘区心肌组织Spred1表达高于假手术组,两者比较未见统计学差异(P>0.05);活血益气方组、益气方组、活血方组Spred1表达均低于模型组,比较差异具有统计学意义(P<0.05);益气方组Spred1表达低于活血益气方组,活血方组Spred1表达高于活血益气方组,分别与之比较,均未见统计学差异(P>0.05)。结论 活血益气方及其拆方具有不同程度促进心肌梗死模型大鼠梗死边缘区血管新生的作用,以活血益气方作用最为显著,益气方、活血方在其中起协同作用,其作用机制可能与下调Spred1、上调其mRNA的表达有关。在Spred1 mRNA上调的情况下,Spred1表达降低,提示Spred1 mRNA可能存在转录后调节因子,其具体作用机制尚需进一步研究。
活血益气方; Spred1; 心肌梗死; 血管新生
冠心病是严重影响人类健康的疾病,随着社会老龄化、生活方式的改变,其发病率和死亡率呈逐年增高趋势[1]。目前由于经皮冠状动脉介入治疗、冠状动脉搭桥术等治疗对弥漫性病变患者、晚期心肌梗死患者存在局限性,因此,治疗性血管新生已成为治疗冠心病研究的新方向[2-4]。前期研究表明,活血益气方具有促进血管内皮生长因子(vascular endothelial growth factor,VEGF)蛋白表达和缺血心肌血管新生,进而减轻心肌缺血、预防和逆转心室重构的作用[5-7]。然而血管新生是诸多因子参与的一系列相互衔接、相互影响的过程,Spred1作为重要的血管生成负性调控因子之一,能抑制VEGF介导的Ras-MAPK信号通路从而负性调控血管新生[8-10]。因此,本研究拟在前期研究的基础上,采用左冠状动脉前降支结扎术制备大鼠急性心肌梗死模型,观察活血益气方及其拆方对梗死边缘区Spred1及其mRNA表达及血管新生的影响,进一步分析探讨活血益气方促血管新生的作用机制及配伍规律,为临床上中医药促进冠心病缺血心肌血管新生治疗提供理论依据。
1 材料与方法
1.1 动物
成年健康雄性SD大鼠30只,6周龄,SPF级,体质量(200±20)g,由中国医学科学院医学实验动物研究所提供,许可证号:11401300011899。实验期间饲养于北京中医药大学东直门医院中医内科学教育部重点实验室SPF级实验动物房。
1.2 仪器
ALC-V8动物呼吸机(上海奥尔科特生物科技有限公司);心电图机(CardiMax Fx-7202)、千分之一电子天平(上海精密科学仪器有限公司JA1003N型);超薄切片机LEIA RM2135(Feica公司);高倍显微镜BX60(OLYMPUS公司);图像采集系统SPOT FLEX(美国Diagnostic Instrument 公司);TGL-16G 4℃离心机(上海沪粤明科学仪器有限公司);基因扩增仪GeneAmp PCR system 9700(美国AB公司,Applied Biosystems);安捷伦实时荧光定量PCR仪Mx3000P(美国安捷伦科技公司);紫外分光光度计(Pharmacia Biotech 公司);RT-6000酶标分析仪(深圳Rayto公司);电泳槽、电转槽、稳压稳流定时电泳仪DYY-8C(北京六一仪器厂)。
1.3 药物和试剂
活血益气方由黄芪60 g、党参60 g、丹参10 g、川芎10 g、赤芍10 g、红花10 g组成;益气方由黄芪60 g、党参60 g组成;活血方由丹参10 g、川芎10 g、赤芍10 g、红花10 g组成。所有药物均采用北京康仁堂药业有限公司的免煎颗粒剂,购自北京中医药大学东直门医院。
兔源多克隆抗体CD31(BA2966,生产批号:ZP1797BP97)购自武汉博士德生物工程有限公司;兔源多克隆抗体α-SMA(ab32575,生产批号:GR212262-B)、β-actin(ab6276,生产批号:GR166100-3)、Spred1抗体(ab77079,生产批号:GR163732-1)均购自英国abcam公司;兔二步法免疫组化检测试剂盒(PV9001,生产批号:K157702D)、DAB显色试剂盒(ZLI-9017,生产批号:K156820A)购自北京中杉金桥生物技术有限公司;miRNeasy mini kit试剂盒(217004,生产批号:148025403)、反转录试剂盒(218161,生产批号:148027867)均购自德国凯杰(QIAGEN)公司;SYBER Green(041913914001,生产批号:10197100)购自Roche公司;BCA法定量试剂盒(P1511)、蛋白抽提试剂盒-I(P1250)、ECL超敏发光液(P1010)、HRP标记的羊抗兔二抗(C2226)、羊抗鼠二抗(C2130)均购自北京普利莱基因技术有限公司;Spred1引物及GAPDH引物由北京诺赛基因组研究中心有限公司合成。
1.4 模型制备
采用大鼠左冠状动脉前降支结扎法制备大鼠急性心肌梗死模型[11]。大鼠用7%水合氯醛0.5 mL/100 g腹腔麻醉后,背位固定,经喉行气管插管术,连接呼吸机,80次/分,潮气量0.7~0.8 mL行人工呼吸。沿第三、四肋间隙打开胸腔,以开胸器扩大手术视野,撕开心包,在动脉圆锥与左心耳之间下约2 mm处用5/0线结扎左冠状动脉前降支,当心电图I导联显示ST段显著抬高后,重置心脏于胸腔,并立即分层缝合胸壁。术后连续三天注射青霉素预防感染,常规饲养。假手术组的手术过程同上,只穿线不结扎。
1.5 分组与给药
造模成功后,将大鼠随机分为模型组、活血益气方组、益气方组、活血方组,每组6只。活血益气方组(3.2 g/mL)、益气方组(2.4 g/mL)、活血方组(0.8 g/mL)分别给予相应的药物,0.5 mL/100 g灌胃。模型组和假手术组给予等量生理盐水灌胃,每天一次,于造模后24小时开始,连续4周后,处死大鼠,取大鼠心脏梗死边缘区心肌组织,进行指标检测。
1.6 指标检测
1.6.1 梗死边缘区心肌组织微血管密度(microvascular density, MVD) 每组随机选取5只大鼠进行检测。计数心肌组织用4%多聚甲醛固定,常规石蜡包埋切片后,采用免疫组化PV二步法进行CD31和α-SMA染色。切片常规脱蜡、水化后,使用枸橼酸钠缓冲液低火15分钟进行抗原修复,3%H2O2灭活内源性过氧化物酶,滴加一抗(CD31,1∶100;α-SMA,1∶400),4℃冰箱内过夜,滴加二抗,DAB显色,常规脱水、透明封片。阴性对照以PBS代替一抗。梗死边缘区心肌组织微血管密度的计算采用改进的Weidner[12]方法,先低倍镜下定位梗死区,然后在高倍镜下(200倍、400倍)镜下观察染成棕黄色的组织,凡出现棕黄色的细胞、细胞丛及小于50 μm的环形阳性区域作为一个血管计数,选择5个400倍镜下最高血管密度区进行微血管计数,然后计算平均值作为一个样本的MVD。
1.6.2 梗死边缘区心肌组织微血管平均直径(mean microvascular diameter,MMVD) 每组随机选取5只大鼠进行检测。检测对α-SMA染色切片,先低倍镜下定位梗死区,然后在高倍镜下(200倍、400倍)镜下观察染成棕黄色的组织,凡出现棕黄色的单个周细胞、周细胞丛及小于50 μm的环形阳性区域作为一个血管,每个样本随机选择2个400倍视野下图像,利用Image-Pro Plus 6.0软件,测量血管短轴长度,计算其平均值作为微血管的平均直径。
1.6.3 实时荧光定量PCR法 检测Spred1 mRNA的表达取梗塞边缘区组织,miRNeasy mini kit试剂盒提取包括microRNA在内的总RNA,测定吸光度A260/A280,计算RNA浓度及纯度。取1μg总RNA,根据miScriptII RT Kit说明书:5×miScript HiFilex Buffer 4 μL、10×miScript Nucleics Mix 2 μL、miScript Reverse Transcriptase Mix 2μL、RNase-free water,配置20 μL反应体系,在37℃ 60分钟、95℃ 5分钟条件下进行反转录,得到cDNA链。以cDNA为模板进行PCR反应,按FastStart universal SYBR Green Master (ROX)说明书操作:2×QuantiTect SYBR Green PCR Master Mix 12.5 μL、10 μmol/L上下游引物各1 μL、cDNA1 μL、RNase-free water 9.5 μL,配置25 μL的反应体系,放入PCR仪,95℃10分钟激活FastStart DNA Taq聚合酶后,95℃15秒,60℃1分钟,40个循环。以GAPDH作为内参照。每个样品设立2个复孔,取均值,所得CT值按照2-△△ct的方法,进行均一化处理后,再进行统计学分析。Spred1、GAPDH的引物序列见表1。

表1 Spred1及GAPDH引物序列及扩增产物长度
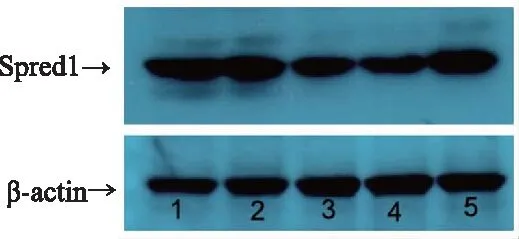
1.6.4 Western blot法 每组随机选了5只大鼠进行检测。检测Spred1蛋白的表达按蛋白抽提试剂盒说明书提取总蛋白,BCA法定量蛋白质。取50 μg蛋白,采用5%的浓缩胶和10%的分离胶的十二烷基磺酸钠-聚丙烯酰胺凝胶电泳进行分离,然后冰水混合物中恒流250 mA、2小时转至硝酸纤维素膜膜上;室温下用5%脱脂奶粉摇动封闭1小时后,加入1∶5000稀释的兔抗Spred1多克隆抗体,4℃摇动过夜。室温下TBST3×10分钟洗膜,加入1∶5000稀释的辣根过氧化物酶标记的羊抗兔IgG二抗,室温摇床孵育1小时,TBST3×10分钟洗去未结合的二抗,然后在暗室滴加化学发光剂ECL进行发光显影。以β-actin为内参照,取出膜TBST3×10分钟洗膜后,以小鼠抗β-actin单克隆抗体(1∶10000),辣根过氧化物酶标记的羊抗小鼠IgG二抗(1∶5000),重新孵育抗体,操作步骤同Spred1。用Photoshop 7.0去色后,用Image J软件分析条带的灰度值,以Spred1/β-actin的比值,比较不同组别心肌梗死边缘区Spred1表达水平。
1.7 统计学处理
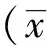
2 结果
2.1 对梗死边缘区心肌组织MVD的影响
以α-SMA检测梗死边缘区心肌组织MVD,模型组MVD高于假手术组,两者比较具有统计学差异(P<0.01)。活血益气方组、益气方组、活血方组MVD高于模型组,分别与之比较,仅活血益气方组、活血方组具有统计学差异(P<0.01、P<0.05),益气方组与之比较未见统计学差异(P>0.05);益气方组、活血方组MVD均低于活血益气方组,分别与之比较,差异均具有统计学意义(P<0.01、P<0.05)。见图1、表2。
注:A.假手术组;B.模型组;C.活血益气方组;D.益气方组;E.活血方组

组别nα⁃SMAMVD(个)CD31MVD(个)假手术组55.92±0.547.84±0.38模型组512.20±0.55a12.80±0.32a益气方组512.76±0.57e15.52±1.68c活血方组513.32±1.28bd16.52±0.83c活血益气方组514.44±0.91c16.80±1.33c
注: 与假手术组比较,aP<0.01;与模型组比较,bP<0.05,cP<0.01;与活血益气方组比较,dP<0.05,eP<0.01。
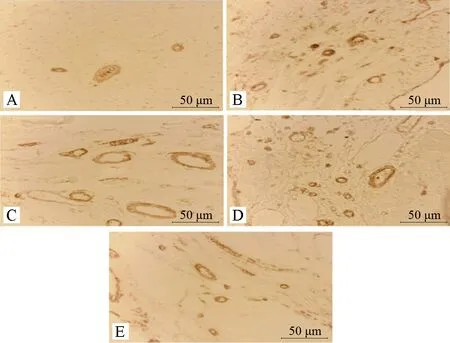
以CD31检测梗死边缘区心肌组织微血管密度,模型组MVD高于假手术组,两者比较具有统计学差异(P<0.01);活血益气方组、益气方组、活血方组MVD高于模型组,与之比较,均具有统计学差异(P<0.01);益气方组、活血方组MVD均低于活血益气方组,与之比较,未见统计学差异(P>0.05)。见图1、表2。
注:A.假手术组;B.模型组;C.活血益气方组;D.益气方组;E.活血方组
2.2 对梗死边缘区心肌组织MMVD的影响
模型组梗死边缘区心肌组织MMVD显著小于假手术组,差异具有统计学意义(P<0.01)。活血益气方组、益气方组、活血方组MMVD不同程度大于模型组,活血益气方组与之比较,差异具有统计学意义(P<0.01),而益气方组及活血方组与之比较,差异无统计学意义(P>0.05)。益气方组、活血方组MMVD小于活血益气方组,分别与之比较差异具有统计学意义(P<0.01)。见表3。

表3 各组大鼠心肌梗死边缘区微血管平均直径(MMVD)的比较
注:与假手术组比较,aP<0.01;与模型组比较,bP<0.01;与活血益气方组比较,cP<0.01。
2.3 对梗死边缘区心肌组织Spred1 mRNA表达的影响
模型组Spred1 mRNA的表达高于假手术组,差异具有统计学意义(P<0.05);活血益气方及其拆方各组Spred1 mRNA的表达高于模型组,与之比较差异均有统计学意义(P<0.01、P<0.05)。益气方组、活血方组Spred1 mRNA的表达均高于活血益气方组,益气方组与之比较差异无统计学意义(P>0.05);活血方组与之比较,差异具有统计学意义(P<0.01)。见表4。

表4 各组大鼠心肌梗死边缘区Spred1 mRNA表达水平的比较±s)
注: 与假手术组比较,aP<0.05;与模型组比较,bP<0.05,cP<0.01;与活血益气方组比较,dP<0.01。
2.4 对梗死边缘区心肌组织Spred1蛋白表达的影响
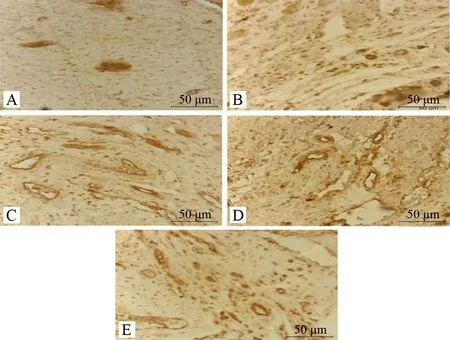
模型组梗死边缘区心肌组织Spred1表达高于假手术组,两者比较未见统计学差异(P>0.05);活血益气方组、益气方组、活血方组Spred1低于模型组,分别与之比较,均具有统计学差异(P<0.01、P<0.05)。益气方组Spred1表达低于活血益气方组,活血方组Spred1表达高于活血益气方组,差异比较均无统计学意义(P>0.05)。见图3、表5。
注:A.假手术组;B.模型组;C.活血益气方组;D.益气方组;E.活血方组

组别nSpred1假手术组51.00±0.00模型组51.08±0.16益气组50.71±0.21b活血组50.84±0.14a活血益气方组50.78±0.22a
注: 与模型组比较,aP<0.05,bP<0.01。
3 讨论
治疗性血管新生[13-14],又称“药物促进心脏自身搭桥”,可以有效建立侧枝循环,改善患者的缺血、缺氧状态,减少心肌梗死、预防或逆转心室重构,在改善患者心功能及预后等方面,发挥着重要作用,为临床治疗缺血性疾病提供了新的思路。
在血管新生的研究中,MVD是普遍采用的比较直观和有效反映新生血管数目和侧枝循环建立情况的指标,常以内皮细胞特异性标志物CD31来反映组织中微血管密度[15-16]。研究发现,心肌梗死等许多疾病在病理状态下新生血管存在结构及功能上的异常,常表现为血管形态不规则、结构紊乱、内皮细胞外缺乏周细胞及血管平滑肌细胞覆盖等异常的新生血管,并不能有效地建立侧枝循环,改善患者的缺血缺氧状态[17-19]。因此,有研究者提出,仅仅依靠血管计数并不能准确反映血管新生情况,应该从血管直径、血管成熟情况等多个方面来观察血管新生情况[20]。α-SMA仅存在于血管平滑肌细胞及周细胞的微丝束中,可作为这两种细胞的特异性标记物[21-23],利用α-SMA对周细胞及平滑肌细胞进行标记是目前最常用的判断血管成熟的方法[24-25]。因此,本研究借鉴判断微血管成熟的方法α-SMA染色,并结合CD31染色,对心肌梗死边缘区血管新生情况进行观察。研究结果表明,模型组较假手术组微血管明显增高,但微血管平均直径显著小于假手术组,提示在心肌梗死大鼠中,缺血缺氧条件可以引起梗死边缘区心肌组织病理性的血管新生;活血益气方组及其拆方对梗死边缘区心肌组织CD31标记微血管密度及α-SMA标记微血管密度均不同程度增高,且管腔直径较模型组不同程度增大,其中以活血益气方组效果最好,提示活血益气方及其拆方能够促进心梗大鼠梗死边缘区心肌组织血管新生,其中益气方和活血方在此方面具有协同作用。
Spred1是一种sprouty相关的酪氨酸激酶结合蛋白,可以特异性地抑制MAPK信号通路[26]。越来越多的研究表明,Ras-MAPK信号通路在血管建立及缺血后血管新生中具有重要作用[27],血管生长因子如VEGF、成纤维细胞生长因子通过激活Ras-MAPK信号通路,促进细胞的迁移、增殖及黏附性,并最终促进血管新生及血管的完整性。而Ras-MAPK信号通路的治疗性激活面临诸多问题,如Ras-MAPK的激活因子、VEGF存在半衰期短,基因治疗存在安全可控的问题。因此,有研究者尝试通过调控Ras-MAPK信号通路的重要负性调控因子Spred1,来促进血管新生[28-29]。Wang S等[28]研究发现在Spred1过表达的情况下,内皮细胞迁移能力降低,而通过siRNA抑制Spred1的表达,可提高内皮细胞的迁移能力,促进血管新生;Jakob P等[29]通过上调和下调内皮祖细胞miR-126、siRNA抑制Spred1表达等一系列实验表明,抑制Spred1可促进内皮祖细胞的增殖、迁移及细胞集落形成能力。
本实验研究结果显示,模型组Spred1及其mRNA表达均较假手术组增加,提示缺血缺氧引起的病理性血管新生情况下,血管新生的抑制因子表达增加;活血益气方及其拆方可上调Spred1 mRNA的表达,降低Spred1蛋白的表达,促进血管新生,推测其可能的作用机制与影响Spred1 mRNA的转录后调节因子有关,但具体机制尚待进一步研究。
[1] 乔树宾.冠心病诊疗进展[M].北京:人民卫生出版社,2013:53-56.
[2] 史载祥,黄春林,史大卓.现代中医心血管病学[M].北京:人民卫生出版社.2006:1-2.
[3] Giulio G, Stefanini M.D, David R, et al. Drug-eluting coronary-artery stents [J]. New England Journal of Medicine, 2013, 368(3): 254-265.
[4] Sellke FW, Simons M. Angiogenesis in cardiovascular disease: Current status and therapeutic potential [J].Drugs, 1999, 58(3):391-396.
[5] 李敏,王硕仁,赵明镜,等. 活血、益气方药对心梗后心衰大鼠血流动力学影响的实验研究[J]. 中国中医基础医学杂志,2001,7 (6):22-24.
[6] 王振涛,王硕仁,赵明镜,等. 活血和益气方药对心肌梗死后左心衰大鼠左心室重构影响的比较研究[J]. 中国中西医结合杂志,2002,22 (5): 376-378.
[7] 张冬梅,吴爱明,娄利霞,等. 活血益气方对心梗后大鼠缺血心肌血管新生及VEGF表达的影响[J]. 辽宁中医杂志,2010,37(8): 1602-1604.
[8] Wakioka T,Sasaki A,Kato R,et al.Spred is a Sprouty-related suppressor of Ras signalling[J].Nature,2001,412(6847):647-651.
[9] Chong H, Vikis HG, Guan KL. Mechanisms of regulating theRaf kinase family [J]. Cellular signalling, 2003, 15(5): 463-469.
[10] Nicoli S, Standley C, Walker P, et al. MicroRNA-mediated integration of haemodynamics and Vegf signalling during angiogenesis[J]. Nature, 2010, 464(7292): 1196-1200.
[11] 刘振,刘玲玲,杨廷桐.两种大鼠心肌梗死模型的比较研究[J].动物医学进展,2010,31(4):19-25.
[12] Weidner N,Semple JP,Welch WR,et al. Tumor angiogenesis and metastasis——correlation in invasive breast carcinoma[J].The New England journal of medicine,1991,324(1):1-8.
[13] Ware JA,Simons M. Angiogenesis in ischemic heart disease [J]. Nature Med,1997,3(2): 158-164.[14] Isner JM,Rosenfield K,Losordo DW,et al. Percutaneous intravascular US as adjunct to catheter-based interventions: preliminary experience in patients with peripheral vascular disease [J]. Radiology,1990,175(1): 61-70.
[15] Majchrzak K,Kaspera W,Szyma J,et al. Markers of angiogenesis (CD31, CD34, rCBV) and their prognostic value in low-grade gliomas [J]. Neurologiai Neurochirurgia Polska,2013,47(4): 325-331.
[16] Sharma B,Singh N,Gupta N,et al. Diagnostic modalities of precancerous and cancerous cervical lesions with special emphasis on CD31 angiogenesis factor as a marker [J]. Pathology research international,2013: 243168.
[17] Hamzah J,Jugold M,Kiessling F,et al. Vascular normalization in Rgs5-deficientTumors promote immune destruction [J]. Nature,2008,453(7193): 410-414.
[18] De La Cruz JP,Gonzalez-Correa JA,Guerrero A,et al. Pharmacological approach to Diabetic retinopathy. [J]. Diabetes Metab Res Rev,2004,20(2): 91-113.
[19] Patrick S Ward,Craig B Thompson. Metabolic Reprogramming: A Cancer Hallmark Even War burg Did Not Anticipate[J].Cancer cell,2012,20(3):297-308.
[20] Hlatky L,Hahnfeldt P,Folkman J. Clinical application of antiangiogenic therapy: microvessel density, what it does and doesn't tell us[J]. Journal of the National Cancer Institute,2002,94(12): 883-893.
[21] Banopadhyay R,Ort e C, Lawrenson JG, et al. Contractile proteins in pericytes at the blood-brain and blood-retinal barriers [J]. J Neurocytol, 2001, 30 (1): 35-44.
[22] Nakano M, Atobe Y, Goris RC, et al. Ultrastructure of the capillary pericytes and the Expression of smooth muscle alpha-actin and desmin in the snake infrared sensory organs[J] .The Anatomical Record, 2000, 260 (3): 299-307.
[23] 王医术,李玉林,王心蕊,等.用α-SMA结合部位标记新生血管周细胞[J].吉林大学学报,2003,29(5):594-598.
[24] 于德新,张宗利,马祥兴,等. 血管生成及其成熟度在肝细胞癌边缘与中心的差异研究[J]. 中国现代普通外科进展,2009,12(2):113-117.
[25] 滕建英,郭瑞,谢菁,等.血管内皮生长因子DNA质粒对真皮支架修复猪Ⅲ度烧伤创面中血管化的影响[J].中华医学杂志,2011,91(36):2568-2872.
[26] 张静,王华,王立生. Spred的结构及生物学特性[J]. 军事医学科学院院刊,2009,33(1):74-77.
[27] Jiang ZY,He Z,King BL,et al. Characterization of multiple signaling pathways of insulin in the regulation of vascular endothelial growth factor expression in vascular cells and angiogenesis[J].The Journal of biological chemistry,2003,278(34):31964-31971.
[28] Wang S,Aurora AB,Johnson BA,et al. The endothelial-specific microRNA miR-126 governs vascular integrity and angiogenesis[J].Developmental Cell,2008,15(2): 261-271.
[29] Jakob P,Doerries C,Briand S,et al. Loss of angiomiR-126 and 130a in angiogenic early outgrowth cells from patients with chronic heart failure: role for impaired in vivo neovascularization and cardiac repair capacity[J]. Circulation,2012,126(25):2962-2975.
(本文编辑: 韩虹娟)
Effects ofHuoxueYiqiprescription and its disassemble prescriptions on Spred1 and angiogenesis in rats with acute myocardial infarction
ZHENGRui-ling,CHENMeng,LOULi-xia,etal.
DongzhimenHospitalAttachedtoBeijingUniversityofChineseMedicine,Beijing100700,China
ZHANGDong-mei,E-mail:chaweto@126.com
Objective To observe the impact ofHuoxueYiqiprescription on the negative regulation factor Spred1 and angiogenesis of myocardial tissue in the marginal zone of myocardial infarction rats, and to explore the mechanism and compatibility regularity of the compound decoction ofHuoxueYiqiprescription promoting therapeutic neovascularization. Methods Model rats of acute myocardial infarction (AMI) were established by ligation of left anterior descending coronary artery, and randomly divided into 4 groups. Therapeutic groups were treated withHuoxueYiqiprescription (HXYQ),Yiqiprescription (YQ),Huoxueprescription (HX) and model group. Rats of sham group were treated with saline and operated without ligation. Animals were sacrificed and the myocardial infarction border areas were taken as indicators after 4 weeks of treatment. Microvascular density (MVD) and the mean microvessel diameter (MMVD) were assessed by immunohistochemistry. The expression of Spred1 mRNA and VEGF mRNA was detected by quantitative real-time PCR (qRT-PCR), and Western Blot was used to observe the expression of Spred1. Results (1) The MVD in model group was higher than that in sham group (P<0.01). Compared with model group, HXYQ, HX and YQ group can improve MVD (P<0.01 orP<0.05), and the effect of HXYQ is the most significant. The MMVD in model group was higher than sham group (P<0.01). Compared with model group, HXYQ,HX and YQ group could improve MMVD, but only HXYQ group had significant difference (P<0.01). The MMVD in HXYQ group was higher than that in the other two therapeutic groups (P<0.01). (2) The mRNA level of Spred1 in model group was higher than that in sham group (P<0.05). Compared with model group, HXYQ, HX and YQ group could significantly improve the mRNA level of Spred1 (P<0.05). The mRNA level of Spred1 in HXYQ group was lower than that in HX group or YQ group. However it was only significantly lower than in HX group (P<0.01). (3)The expression of Spred1 in model group was higher than sham group, but there was no significant difference (P>0.05). Compared with model group, HXYQ, HX and YQ group could significantly reduce the expression of Spred1 (P<0.05). The expression of Spred1 in HXYQ group was higher than that in YQ group and lower than in HX group, but there was no significant difference (P>0.05). Conclusion To varying degrees, HXYQ and its decomposed recipes can promote angiogenesis in myocardial infarction border areas in rats after AMI. The effect of HXYQ is the most significant. It’s two decomposed recipes work synergistically. The mechanisms may be related with their effects on down-regulating Spred1 and up-regulating the mRNA level of Spred1. In addition, we found that the mRNA level of Spred1 increased while the expression of Spred1 decreased. It is suggesting that Spred1 mRNA may be regulated at the post-transcriptional level by other factor, therefore further researches regarding the specific mechanism may be needed.
HuoxueYiqiprescription; Spred1; Myocardial infarction; Angiogenesis
国家自然科学基金面上项目(81273694)
100700 北京中医药大学东直门医院中医内科学教育部和北京市重点实验室[娄利霞、吴爱明、赵一舟、赵久丽、成文堃(硕士研究生)、吕晞滢、张冬梅];北京中医药大学基础医学院(陈萌);郑州市中牟县中医院内一科(郑瑞玲)
郑瑞玲(1986- ),女,硕士,住院医师。研究方向:中西医结合心血管疾病的应用基础研究。E-mail:752682356@qq.com
张冬梅(1975- ),女,博士,副研究员。研究方向:中西医结合心血管疾病的应用基础研究。E-mail:chaweto@126.com
R285.5
A
10.3969/j.issn.1674-1749.2016.12.001
2016-05-08)

