十个八倍体小偃麦的细胞学鉴定和染色体构成分析
亓晓蕾鲍印广李兴锋钱兆国王瑞霞吴 科王洪刚,*
1山东农业大学农学院 / 国家小麦改良分中心/作物生物学国家重点实验室, 山东泰安 271018;2泰安市农业科学研究院, 山东泰安271000
十个八倍体小偃麦的细胞学鉴定和染色体构成分析
亓晓蕾1,2,**鲍印广1,**李兴锋1钱兆国2王瑞霞2吴 科2王洪刚1,*
1山东农业大学农学院 / 国家小麦改良分中心/作物生物学国家重点实验室, 山东泰安 271018;2泰安市农业科学研究院, 山东泰安271000
培育新的八倍体小偃麦, 对于利用偃麦草遗传物质进行小麦的遗传改良具有重要意义。本研究利用细胞学和基因组原位杂交技术, 对从中间偃麦草与小麦品种烟农15杂交后代选育出的10个八倍体小偃麦山农TE256、山农TE259、山农TE261、山农TE262、山农TE263、山农TE265、山农TE266、山农TE267-1、山农TE270和山农TE274进行了细胞学鉴定和染色体构成分析。结果表明, 10个八倍体小偃麦绝大多数单株根尖细胞的染色体数目为2n = 56, 个别单株含有54或55条染色体; 大多数2n = 56单株的花粉母细胞在减数分裂中期I的染色体构型为2n = 28II, 少数花粉母细胞存在单价体、三价体或四价体, 后期 I染色体可均等分向两极, 仅有极少数细胞出现染色单体提前分离等现象; 10个八倍体小偃麦均含有普通小麦的全套染色体和中间偃麦草的1个混合染色体基组, 其中间偃麦草染色体是由来自中间偃麦草 3个不同染色体基组的染色体构成的混合染色体基组, 其染色体构成分别为2St+8JS+ 2J+2J-St、2St+8JS+4J、2St+8JS+2J+2J-St、2St+8JS+2J+2J-St、2St+8JS+2J+2J-St、6St+4JS+2J+2J-St、4St+6JS+2J+2J-St、2St+8JS+4J、2St+8JS+4J和4St+6JS+4J, 与目前已报道的八倍体小偃麦均有所不同。研究结果可为这些新型八倍体小偃麦的研究和有效利用提供参考依据。
中间偃麦草; 八倍体小偃麦; GISH; 染色体构成
中间偃麦草(Thinopyrum intermedium, 2n = 6x = 42, JJJSJSStSt)是小麦亚族中的多年生野生种, 对小麦的叶锈、条锈、秆锈、白粉病等免疫, 对黑穗病、叶枯病和根腐病、黄矮病、条纹花叶病等高抗, 并且抗寒冷、耐盐碱和干旱, 是国内外小麦遗传改良中应用较多的野生亲本材料[1]。将中间偃麦草染色体组导入普通小麦遗传背景育成的八倍体小偃麦,不仅保持了中间偃麦草抗病、耐寒、耐旱和大穗等优良特点, 而且与普通小麦杂交易于成功, 在小麦品种遗传改良研究中具有重要利用价值。
国内外学者利用中间偃麦草与小麦杂交育成了多种八倍体小偃麦, 并对其染色体构成进行了分析。1953年我国学者孙善澄[2]利用它与小麦杂交, 培育出“中 1”至“中 5”等八倍体小偃麦。1966年Cauderon[3]利用中间偃麦草与普通小麦 Vilromin杂交育成了八倍体小偃麦 TAF46。山东农业大学利用中间偃麦草进行小麦遗传改良研究, 并育成了山农TE253等13个八倍体小偃麦[4-7]。这些小偃麦已成为创造异附加系、异代换系和易位系, 向小麦转移中间偃麦草有益基因的重要桥梁亲本。王洪刚等[4]利用自育的6个八倍体小偃麦与中1、中2、中3、中4和中5杂交, 通过对杂种F1的染色体构型分析并结合种子醇溶蛋白电泳分析结果推测, 两类八倍体小偃麦或其中之一所携带的偃麦草染色体组可能是一种混合染色体组。张学勇等[8]利用细胞遗传学方法, 对 5个八倍体小偃麦中附加的中间偃麦草染色体组分析认为, 中 1和中 2可能含有中间偃麦草的St染色体组, 而中3、中4和中5则含有中间偃麦草的E (Ee或Eb)染色体组。近年来, 随着基因组原位杂交[9-12](genome in situ hybridization, GISH)和多色荧光原位杂交 (multicolour genome in situ hybridization, mcGISH)[13-14]等技术的发展, 为识别小麦和中间偃麦草染色体提供了新的技术手段。Chen等[9]以拟鹅观草(Pseudoroegneria Á. Löve, 2n = 2x = 14, StSt)基因组(2n = 14, StSt) DNA为探针, 普通小麦总DNA为封阻对中间偃麦草进行GISH分析, 将其染色体分为3类, 第1类整条染色体显示杂交信号, 为St基组染色体; 第 2类染色体两端显示杂交信号,为J基组染色体; 第3类在着丝粒周围(偶尔端部也有)显示杂交信号, 其余部分相对较弱, 为 JS基组染色体。鲍印广等[6-7]利用GISH技术分析并明确了山农TE253等5个八倍体小偃麦的染色体构成。
本研究利用细胞学和基因组原位杂交技术, 分析了10个八倍体小偃麦的根尖细胞染色体数目、花粉母细胞减数分裂中期 I染色体构型及其中间偃麦草染色体构成。
1 材料与方法
1.1 试验材料
10个八倍体小偃麦包括山农 TE256、山农TE259、山农TE261、山农TE262、山农TE263、山农TE265、山农TE266、山农TE267-1、山农TE270和山农 TE274, 均是由山东农业大学利用普通小麦品种烟农15与中间偃麦草杂交育成, 中间偃麦草(PI547333)引自原中国科学院西北植物研究所, 拟鹅冠草(Z2774)引自中国农业科学院作物科学研究所, 烟农15由国家小麦改良中心山东(泰安)分中心保存。
1.2 根尖细胞染色体观察
种子室温下浸泡露白后, 在4℃冰箱中冷冻24 h,然后在25℃条件下培养, 根长1.5~2.0 cm时剪取根尖在冰水中处理24 h, 以卡诺氏固定液(V无水乙醇∶V冰醋酸= 3∶1)固定24 h以上。将固定好的根尖放入1 mol L-1盐酸, 于60℃水浴中解离8~10 min, 以改良卡宝品红染色, 压片, 镜检, 照相。
1.3 花粉母细胞减数分裂染色体构型分析
选取处于减数分裂中期 I的花药, 以卡诺氏固定液固定24 h以上, 转入70%乙醇保存。将固定好的花药放入1 mol L-1盐酸, 于60℃水浴中解离8~10 min, 以改良卡宝品红染色, 压片, 镜检, 照相。
1.4 基因组原位杂交
交参照 Han等[13]的方法, 略有改动。所用探针为拟鹅冠草或中间偃麦草基因组 DNA, 封阻 DNA为烟农15基因组DNA。利用DAPI (4’,6-diamidino-2-phenylindole)将小麦染色体复染成蓝色。在OLYMPUS BX-60型荧光显微镜下观察, 以DS-Ri1CCD相机(Nikon, 日本)采集图像。
2 结果与分析
2.1 八倍体小偃麦根尖细胞染色体数目
随机选取各八倍体小偃麦的10个单株观察其根尖细胞染色体数目。绝大多数单株的根尖细胞染色体数目为2n = 56 (表1)。其中, 山农TE256、山农TE261、山农 TE262、山农 TE265和山农 TE267-1的10个单株染色体数目均为2n = 56; 山农TE259、山农TE263、山农TE266、山农TE270和山农TE274的10个单株中有9株的染色体数目为2n = 56, 占90%, 个别单株的染色体数目为2n = 54或2n = 55。上述10个八倍体小偃麦可能附加了1组中间偃麦草染色体。

表1 10个八倍体小偃麦的根尖细胞染色体数目Table 1 Number of plants with different chromosome numbers in root tip cells of ten octoploid Trititrigia
2.2 八倍体小偃麦花粉母细胞的染色体构型
分别选取5株染色体数目为2n = 56的八倍体小偃麦单株, 对其花粉母细胞减数分裂中期 I (PMC MI)的染色体构型分析发现, 除山农 TE265和山农TE267-1为2n = 28II外, 在其余八倍体小偃麦中均观察到其他染色体构型。例如, 在观察的60个山农TE256花粉母细胞中, 57个细胞中的染色体联会成28个二价体(图1-A), 占95%; 1个细胞中观察到2个单价体(图1-B), 2个细胞中观察到1个四价体(图1-C); 山农TE256在PMC MI期的平均染色体构型为2n = 0.033I + 27.917II + 0.033IV, 相对紊乱系数为0.002; 花粉母细胞减数分裂后期I (PMC AI)染色体可均等分向细胞两极(图1-D)。与山农TE256相似,在山农 TE259、山农 TE261、山农 TE262、山农TE263、山农TE266、山农TE270和山农TE274的绝大多数花粉母细胞减数分裂中期I均能观察到28个二价体, 在少数细胞中可观察到单价体、三价体、和四价体等现象(表2)。除山农TE262相对紊乱系数为0.032外, 山农TE259、山农TE261、山农TE262、山农TE263、山农TE266、山农TE270和山农TE274的相对紊乱系数均低于 0.01。山农 TE259、山农TE261、山农TE262、山农TE263、山农TE266、山农TE270和山农TE274的PMC MI平均染色体构型分别为2n = 0.156I + 27.723II + 0.022III + 0.022IV、2n = 0.250I + 27.875II、2n = 0.120I + 27.290II + 0.080IV、2n = 0.090I + 27.865II + 0.045IV、2n = 0.133I + 27.933II、2n = 0.125I + 27.937II和2n = 0.152I + 27.891II + 0.022III (表2)。在PMC AI期, 上述材料 95%以上的细胞染色体可均等分向两极, 仅有极少数细胞出现染色单体提前分离等现象。
2.3 八倍体小偃麦的花粉母细胞GISH鉴定
以中间偃麦草DNA作探针、普通小麦品种烟农15的基因组DNA作封阻对10个八倍体小偃麦的花粉母细胞进行GISH鉴定显示, 10个八倍体小偃麦花粉母细胞中均有 7个二价体呈现杂交信号, 其余染色体被封阻 DNA封闭, 且被 DAPI复染为蓝色(图2)。说明10个八倍体小偃麦中均附加了中间偃麦草的14条染色体, 附加的中间偃麦草染色体均能形成二价体, 具有较高的细胞学稳定性。

图1 八倍体小偃麦山农TE256的染色体构型Fig. 1 Chromosome configurations of octoploid Trititrigia Shannong TE256A: PMC MI, 2n = 28II; B: PMC MI, 2n = 2I + 27II; C: PMC MI, 2n = 26II + 1IV; D: PMC AI, 28 vs. 28.

表2 10个八倍体小偃麦PMC MI的染色体构型Table 2 Chromosome configurations of ten octoploid Trititrigia at PMC MI
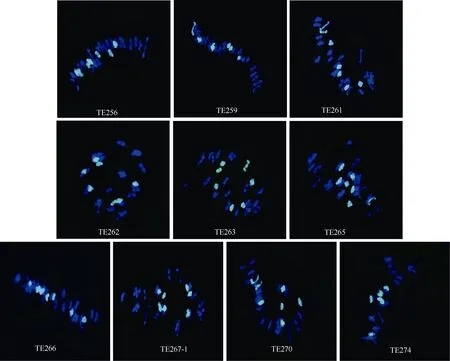
图2 10个八倍体小偃麦花粉母细胞的基因组原位杂交鉴定Fig. 2 GISH patterns of ten octoploid Trititrigia at PMC MI10个八倍体小偃麦花粉母细胞( 2n = 28II )的基因组原位杂交结果均显示, 7个二价体呈现绿色杂交信号, 来自中间偃麦草, 其余21个二价体被DAPI复染为蓝色, 来自普通小麦烟农15。TE256为山农TE256的简写, 余同。GISH patterns of ten octoploid Trititrigia at PMC MI (2n = 28II), showing seven bivalents from Th. intermedium (green) and 21 bivalents from common wheat Yannong 15 (blue). TE256 is the abbreviation of Shannong TE256, and so forth.
2.4 八倍体小偃麦根尖细胞基因组原位杂交鉴定
为了进一步确定10个八倍体小偃麦中中间偃麦草染色体的染色体基组归属, 以拟鹅冠草DNA作探针, 烟农15的基因组DNA作封阻, 对其根尖细胞染色体进行了GISH分析。结果发现, 10个八倍体小偃麦根尖细胞中均有14条染色体呈现杂交信号, 为中间偃麦草染色体; 而其余染色体被封阻DNA封闭呈现蓝色, 为小麦染色体。进一步证明10个八倍体小偃麦均含有14条中间偃麦草染色体(图3)。例如, 在山农TE256中, 1对染色体的绿色信号均匀遍布整条染色体, 为St染色体; 4对染色体在着丝粒区域呈现亮绿色信号, 两臂末端偶尔出现绿色信号, 为 JS染色体; 1对染色体仅在两臂末端呈现绿色杂交信号,为J染色体; 1对染色体较为特殊, 整条长臂呈绿色,且中间有亮绿信号点, 而短臂仅在末端有杂交信号,为J-St易位染色体(图4)。因此, TE256除含有普通小麦的全部染色体外, 还含有14条中间偃麦草染色体,其中2条为St染色体、8条为JS染色体、2条为J染色体、2条为J-St易位染色体。
山农TE259、山农TE261、山农TE262、山农TE263、山农TE265、山农TE266、山农TE267-1、山农TE270和山农TE274除含有普通小麦的全部染色体外, 亦含有14条中间偃麦草染色体, 其染色体构成分别为2St+8JS+4J、2St+8JS+2J+2J-St、2St+8JS+ 2J+2J-St、2St+8JS+2J+2J-St、6St+4JS+2J+2J-St、4St+ 6JS+2J+2J-St、2St+8JS+4J、2St+8JS+4J和4St+6JS+4J (图4)。

图3 10个八倍体小偃麦根尖细胞基因组原位杂交鉴定Fig. 3 GISH patterns of ten octploid Trititrigia at RTCs10个八倍体小偃麦根尖细胞(2n = 56) 的基因组原位杂交结果显示, 14条染色体呈现绿色杂交信号, 来自中间偃麦草; 其余42条染色体被复染为蓝色, 来自普通小麦烟农15。TE256为山农TE256的简写, 余同。GISH patterns of ten octoploid Trititrigia at RTCs (2n = 56), showing 14 chromosomes from Th. intermedium (green), and 42 chromosomes from common wheat Yannong 15 (blue). TE256 is the abbreviation of Shannong TE256, and so forth.

图4 10个八倍体小偃麦中的中间偃麦草染色体构成Fig. 4 Th. intermedium chromosomes of ten octoploid Trititrigia TE256为山农TE256的简写, 余同。TE256 is the abbreviation of Shannong TE256, and so forth.
3 讨论
八倍体小偃麦含有小麦的全部染色体和偃麦草的14条染色体, 兼具偃麦草和普通小麦亲本的性状特点, 且更容易与小麦杂交, 杂种后代稳定相对较快, 是向小麦转移偃麦草有益基因的重要桥梁。培育新的八倍体小偃麦可丰富小偃麦的类型, 对于利用偃麦草遗传物质进行小麦的遗传改良具有重要意义。本研究证明10个八倍体小偃麦的染色体数目基本为2n = 56, PMC MI期的染色体构型基本为2n = 28II, 具有较高的细胞学稳定性; 10个八倍体小偃麦中的中间偃麦草染色体构成, 与目前已报道的八倍体小偃麦[5-7,10-12,15-17]均有所不同, 为新的八倍体小偃麦类型。本研究结果可为供试八倍体小偃麦的研究及有效利用提供参考依据。
对10个八倍体小偃麦中的中间偃麦草染色体基组分析发现, 它们均为混合染色体基组, 其染色体由中间偃麦草JS、J和St三个染色体基组中的不同染色体构成, 且来自JS、J染色体基组的染色体较多。这与Bao等[6-7]的研究结果一致。综合目前八倍体小偃麦染色体基组的染色体构成研究结果, 除Zhang等[15]报道了小偃麦78829含有完整的14条St染色体以外, 其余八倍体小偃麦[5-7,10-12,16-17]中的偃麦草染色体基组都是混合染色体基组。生物的染色体基组是功能和遗传的基本单位, 其包含的各条染色体是一个协调的整体。八倍体小偃麦中的中间偃麦草混合染色体基组的染色体来自 3个不同的染色体基组, 且小偃麦生长发育正常, 说明其混合染色体基组内各染色体间具有良好的遗传互补和协调性,作为功能单位所包含的遗传信息是完整的。由于中间偃麦草含有 3种不同的染色体基组, 其染色体基数为 7, 它们在小偃麦形成过程中产生混合染色体基组的种类可能是多样的, 从而可产生丰富的小偃麦新类型。但在小偃麦形成过程中, 其中间偃麦草的混合染色体基组的成因如何, 它的形成具有什么特点等问题, 尚需深入研究解析, 这将有助于对小偃麦形成机理的深入理解, 对于小偃麦新物种的创制及其有效利用也具有指导意义。
本研究在6个八倍体小偃麦中都发现J-St易位染色体, 推测是由中间偃麦草不同染色体基组间发生易位重组所致, 但是这种重组是发生在中间偃麦草的进化过程中, 还是在八倍体小偃麦的形成过程中也需要进一步研究。
4 结论
供试的10个八倍体小偃麦为新的八倍体小偃麦类型, 染色体数目为2n = 56, PMC MI期的染色体构型多为2n = 28II, 具有较高的细胞学稳定性。它们含有的中间偃麦草染色体基组均来自中间偃麦草3个不同染色体基组的染色体构成的混合染色体基组,且在6个八倍体小偃麦中发现J-St易位染色体。
[1] 王洪刚, 刘树兵, 亓增军, 孔凡晶, 高居荣. 中间偃麦草在小麦遗传改良中的应用研究. 山东农业科学, 2000, 31: 333–336
Wang H G, Liu S B, Qi Z Y, Kong F J, Gao J R. Application studies of Elytrigia intermedium in hereditary of wheat. Shandong Agric Sci, 2000, 31: 333–336 (in Chinese with English abstract)
[2] 孙善澄. 小偃麦类型与物种形成的探讨. 作物学报, 1980, 6: 1–10
Sun S C. Research on Triticum agropyron form and species formation. Acta Agron Sin, 1980, 6: 1–10 (in Chinese with English abstract)
[3] Cauderon Y. Étude cytogénétique del’évolution du matériel issu decroisement entre Triticum aestivum et Agropyron intermedium. Ann de l’Amél Plantes, 1966, 16: 43–70
[4] 王洪刚, 刘树兵, 李兴锋, 高居荣, 封德顺, 陈冬花. 六个八倍体小偃麦的选育和鉴定. 麦类作物学报, 2006, 26(4): 6–10
Wang H G, Liu S B, Li X F, Gao J R, Feng D S, Chen D H. Breeding and identification of six octoploid Trititrigia. J Triticeae Crops, 2006, 26(4): 6–10 (in Chinese with English abstract)
[5] Liu S B, Wang H G, Zhang X Y, Li X F, Li D Y, Duan X Y, Zhou Y L. Molecular cytogenetic identification of a wheat–Thinopyrum intermedium (Host) Barkworth & DR Dewey partial amphiploid resistant to powdery mildew. J Integr Plant Biol, 2005, 47: 726–733
[6] Bao Y G, Li X F, Liu S B, Cui F, Wang H G. Molecular cytogenetic characterization of a new wheat-Thinopyrum intermedium partial amphiploid resistant to powdery mildew and stripe rust. Cytogenet Genome Res, 2009, 126: 390–395
[7] Bao Y G, Wu X, Zhang C, Li X F, He F, Qi X L, Wang H G. Genomic compositions and reactions to powdery mildew and stripe rust of four novel wheat Thinopyrum intermedium partial amphiploids. J Genet Genomics, 2014, 42: 663–666
[8] 张学勇, 董玉琛. 小麦与彭梯卡堰麦草杂种及其衍生后代的细胞遗传学研究: II. 来自小麦和彭梯卡(长穗)偃麦草及中间偃麦草杂种后代11个八倍体小偃麦的比较研究. 遗传学报, 1994, 21: 287–296
Zhang X Y, Dong Y C. Cytogenetic research on hybrids of Triticum with Thinopyrum ponticum and their derivatives: II. Comparative research of 11 partial amphiploids derived from hybrid offspring of T. aestivum with both Th. ponticum and Th. intermedium. Acta Genet Sin, 1994, 21: 287–296 (in Chinese with English abstract)
[9] Chen Q, Conner R L, Laroche A, Thomas J B. Genome analysis of Thinopyrum intermedium and Th. ponticum using genomic in situ hybridization. Genome, 1998, 41: 580–586
[10] Chen Q, Conner R L, Ahmad F, Laroche A, Fedak G, Thomas J B. Molecular characterization of the genome composition of partial amphiploids derived from Triticum aestivum × Thinopyrum ponticum and T. aestivum × Th. intermedium as sources of resistance to Wheat streak mosaic virus and its vector, Aceria tosichella. Theor Appl Genet, 1998, 97: 1–8
[11] Chen Q, Conner R L, Laroche A, Ji W Q, Armstrong K C, Fedak G. Genomic in situ hybridization analysis of Thinopyrum chromatin in a wheat–Th. intermedium partial amphiploid and six derived chromosome addition lines. Genome, 1999, 42: 1217–1223
[12] Chen Q, Conner R L, Li H, Sun S C, Ahmad F, Laroche A, Graf R J. Molecular cytogenetic discrimination and reaction to Wheat streak mosaic virus and the wheat curl mite in Zhong series of wheat–Thinopyrum intermedium partial amphiploids. Genome, 2003, 46: 135–145
[13] Han F P, Liu B, Fedak G, Liu Z H. Genomic constitution and variation in five partial amphiploids of wheat–Thinopyrum intermedium as revealed by GISH, multicolor GISH and seed storage protein analysis. Theor Appl Genet, 2004, 109: 1070–1076
[14] Kruppa K, Molnár-Láng M. Simultaneous visualization of different genomes (J, JStand St) in a Thinopyrum intermedium × Thinopyrum ponticum synthetic hybrid (Poaceae) and in its parental species by multicolour genomic in situ hybridization (mcGISH). Comp Cytogenet, 2016, 10: 283–293
[15] Zhang X Y, Koul A, Petroski R, Ouellet T, Fedak G. Molecular verification and characterization of BYDV-resistant germplasm derived from hybrids of wheat with Thinopyrum ponticum and Th. intermedium. Theor Appl Genet, 1996, 93: 1033–1039
[16] Fedak G, Chen Q, Conner R L, Laroche A, Petroski R, Armstrong K W. Characterization of wheat–Thinopyrum partial amphiploids by meiotic analysis and genomic in situ hybridization. Genome, 2000, 43: 712–719
[17] Yang Z J, Li G R, Chang Z J, Zhou J P, Ren Z L. Characterization of a partial amphiploid between Triticum aestivum cv. Chinese Spring and Thinopyrum intermedium ssp. trichophorum. Euphytica, 2006, 149: 11–17
Cytological Identification and Chromosome Constitution Analyses of Ten Octoploid Trititrigia Accessions
QI Xiao-Lei1,2,**, BAO Yin-Guang1,**, LI Xing-Feng1, QIAN Zhao-Guo2, WANG Rui-Xia2, WU Ke2, and WANG Hong-Gang1,*
1College of Agronomy, Shandong Agricultural University / Tai’an Subcentre of National Wheat Improvement Centre / State Key Laboratory of Crop Biology, Tai’an 271018, China;2Tai’an Academy of Agricultural Sciences, Tai’an 271000, China
Developing new octoploid Trititrigia is of great significance for using Thinopyrum intermedium to the genetic improvement of common wheat. Ten octoploid Trititrigia accessions, i.e., Shannong TE256, Shannong TE259, Shannong TE261, Shannong TE262, Shannong TE263, Shannong TE265, Shannong TE266, Shannong TE267-1, Shannong TE270, and Shannong TE274, were developed from the progenies of the cross between Thinopyrum intermedium and common wheat variety ‘Yannong 15’. In this study, cytological methods and genomic in situ hybridization (GISH) were employed to determine cytological stability and chromosome constitutions of the 10 octoploid Trititrigia accessions. Mitotic observation indicated that most plants of octoploid Trititrigia had 56 chromosomes and a few had 54 or 55 chromosomes. Chromosomes in most pollen mother cells of plants with 2n = 56 formed 28 bivalents, showing a high degree of cytogenetic stability, simultaneously, univalents, trivalents and tetravalents appeared occasionally at meiotic metaphase I. At meiosis anaphase I (PMC AI), most chromosomes segregated equally to the two poles except for several univalent chromosomes moving ahead in very few cells. Fourteen Th. intermedium chromosomeswere observed to be added to the whole set of common wheat chromosomes in each octoploid Trititrigia, and the alien chromosome constitutions of the 10 octoploid Trititrigia accessions were 2St+8JS+2J+2J-St, 2St+8JS+4J, 2St+8JS+2J+2J-St, 2St+8JS+2J+2J-St, 2St+8JS+2J+2J-St, 6St+4JS+2J+2J-St, 4St+6JS+2J+2J-St, 2St+8JS+4J, 2St+8JS+4J, and 4St+6JS+4J. These alien chromosome constitutions were different from those reported in octoploid Trititrigia, suggesting that the 10 octoploid Trititrigia accessions are novel materials and might be valuable in wheat breeding programs.
Th. intermedium; Octoploid Trititrigia; GISH; Chromosome constitution
(
): 2016-12-05; Accepted(接受日期): 2017-03-02; Published online(网络出版日期): 2017-03-17.
10.3724/SP.J.1006.2017.00967
本研究由国家重点研发计划项目(2016YFD0102004)和山东省现代农业产业技术体系项目(SDAIT-04-021-12)资助。
This study was supported by the Key Project of the National Research and Development Program (2016YFD0102004) and the Modern Agricultural Technology System of Shandong Province (SDAIT-04-021-12).
*通讯作者(Corresponding author): 王洪刚, E-mail: hgwang@sdau.edu.cn, Tel: 0538-8242141
**同等贡献(Contributed equally to this work).
联系方式: E-mail: qixiaoleielica226@163.com
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20170317.1937.002.html

