骨骼肌萎缩机制的研究进展
丁恺志,汪楚楚,唐崇茂,艾力希尔江·艾合买提,姚丽华
(江西科技师范大学生命科学学院,江西 南昌 330013)
1 前言
骨骼肌是人体最丰富的组织及最大的蛋白质储存库[1],它在运动产生、姿势维持、机体保护和产热中起着重要作用。然而,在日常生活中,机体会因为各种原因导致骨骼肌萎缩。骨骼肌发生萎缩时,肌肉合成代谢和肌肉再生能力下降,并且分解代谢过程增加,导致肌纤维横截面积的萎缩、肌肉质量的下降和肌肉功能的损失[2]。骨骼肌萎缩会对人体功能的正常运转造成不利影响,甚至可能导致死亡[3]。因此,保持肌肉的健康对于维持机体正常新陈代谢和功能运转至关重要。
生命体肌肉质量是通过蛋白质周转来维持的[4]。在骨骼肌中,肌肉蛋白合成的抑制和降解的激活等稳态失衡是导致其萎缩的重要因素[5]。因此,研究萎缩的机制和探究切实可行的治疗靶点对预防和治疗骨骼肌萎缩十分重要。本文通过对骨骼肌萎缩的发生机制及其药物治疗研究进展的综述,有望为未来其有效预防和治疗提供可靠的理论依据和治疗策略。
2 骨骼肌萎缩的分类
骨骼肌萎缩的特征是肌肉纤维类型的改变、肌纤维直径的减少和总蛋白的净损失。肌纤维直径的减少是其最显著的组织病理学特征。根据引发原因的不同,其可分为原发性和继发性萎缩。原发性骨骼肌萎缩是由肌营养不良症、线粒体肌病和代谢性肌病等遗传性肌肉疾病直接引起的[6],通常与炎症、进行性肌萎缩、肌肉纤维代谢障碍、肌肉痉挛或僵硬等有关;继发性骨骼肌萎缩是由后天原因引起,与衰老疾病如骨质疏松症、癌症恶病质、慢性阻塞性肺疾病、肥胖、慢性肾脏疾病、心力衰竭等密切相关;日常生活中,烧伤、创伤、禁食或营养不良等情况[7]也容易导致骨骼肌萎缩。无论何种原因导致的骨骼肌萎缩都会由于肌纤维蛋白质的丢失和细胞的凋亡,引发肌力的下降和刺激阈值的增高,从而对患者的生活质量造成严重影响,这已经成为一个世界性的公共卫生问题。
3 骨骼肌萎缩的机制
骨骼肌萎缩的发生机制是非常复杂的(图1)。近期研究表明泛素—蛋白酶体系统(Ubiquitin-proteasome system,UPS)、自噬—溶酶体途径(Autophagy-lysosome pathway,ALP)等蛋白质降解系统的相互配合导致了骨骼肌萎缩的发生[8]。自然状态下,骨骼肌损伤后会进行自我修复以达到肌肉再生,其中肌肉生长因子在肌肉的生长和发育中起着重要作用。因此,肌肉生长因子与骨骼肌萎缩的相关性和对其可能的改善作用还需进一步的研究。此外,炎症在骨骼肌萎缩的发生也至关重要。多种炎症相关疾病都伴随着骨骼肌萎缩,并严重影响了原发疾病的治疗和预后[9]。虽然适当的炎症会刺激肌肉再生,但白介素-6(IL-6)、IL-8 和肿瘤坏死因子-α(TNF-α)等促炎细胞因子水平的高度表达会给骨骼肌带来不利的影响[10]。
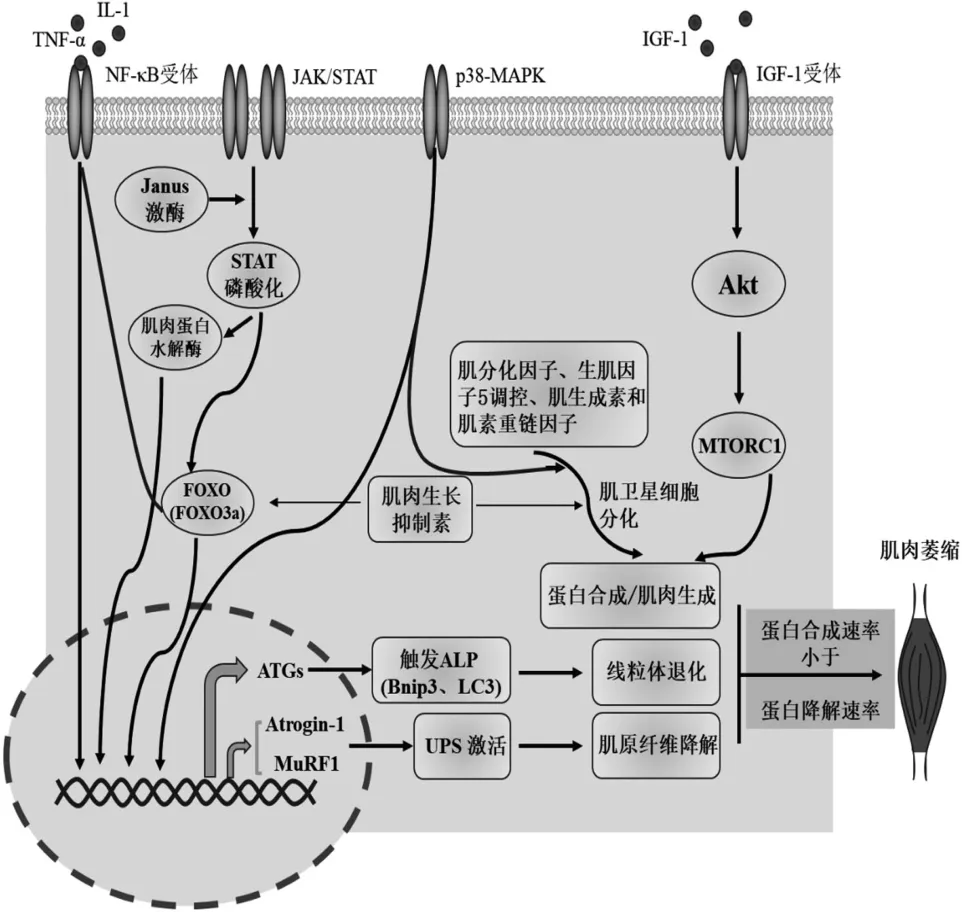
图1 骨骼肌萎缩的分子机制
3.1 泛素—蛋白酶体系统
UPS 包括蛋白酶体选择性降解泛素标记底物的过程,并且在控制肌肉蛋白质降解或利用其产生能量方面具有重要作用。泛素化可以调节细丝蛋白的降解和肌原纤维的分解,并导致肌肉质量和力量的丧失[11]。蛋白质降解是由三组酶参与的,即泛素E1(活化酶)、泛素E2(结合酶)和泛素E3(连接酶)。泛素化是细胞内重要的蛋白质降解的生理过程。E1 酶先开始激活泛素,后泛素转移到E2 酶并与E3 酶结合,以此识别泛素化的底物蛋白,最终转移到26S蛋白酶体复合体中被降解[8]。在萎缩过程中,肌肉萎缩盒F 基因(Atrogin-1)和肌肉特异性环指蛋白1(MuRF1)作为两种肌肉特异的E3 泛素连接酶会被高度表达,并且转录因子FOXO3 也可以调控它们的高度表达。这说明Atrogin-1 和MuRF1 是骨骼肌萎缩关键决定因素。另外,骨骼肌质量的过度损失也会伴随着Atrogin-1 的高度表达,因此抑制其表达,可以恢复肌纤维的生长能力[12]。Bodine SC 等人研究表明,缺乏Atrogin-1 和MuRF1 基因的小鼠对失神经引起的肌肉萎缩具有抗性。此外,敲除Atrogin-1基因可以防止禁食期间造成的肌肉损失,而敲除MuRF1 基因的小鼠对地塞米松诱导的肌肉萎缩具有抵抗力[14]。因此,这两个E3 泛素连接酶已成为预防和治疗骨骼肌萎缩的有效靶点。
3.2 自噬—溶酶体途径
ALP 是细胞质内容物和细胞器运送到溶酶体进行降解的途径。自噬是维持体内平衡和应对细胞应激的重要途径。在骨骼肌中,它起着维持肌肉纤维蛋白平衡的作用。然而,自噬的失衡将导致细胞的异常降解,从而引发骨骼肌萎缩等疾病。FOXO3是一种转录调控基因,控制着自噬机制。自噬基因Bnip3 通过触发自噬小体的发育,引发FOXO3 诱导的自噬;自噬基因LC3 在自噬诱导下通过与磷脂酰乙醇胺结合,进一步促进胞浆LC3-II 的形成;随后,LC3-II 被附着到自噬体膜上,以此来启动自噬小体的形成和增长,并最终引发蛋白质降解[15]。综上所述,Atrogin-1、MuRF1、LC3 和Bnip3 都 可以 被FOXO3调节,这表明FOXO3 是UPS 和ALP 这两种蛋白质降解系统的共同调节剂[16]。
3.3 炎症通路
炎症是骨骼肌萎缩发生和发展的重要因素[17]。机体内长期的炎症刺激会改变骨骼肌细胞的微环境,破坏其蛋白质合成和降解之间的平衡。这一过程是由机体释放炎症因子并激活NF-κB、JAK/STAT和p38 MAPK 等多种炎症相关信号通路来完成的。除此之外,炎症因子还可以导致消化系统、神经系统和其他系统的代谢紊乱,间接调节骨骼肌质量。
NF-κB 通路是一种经典的促炎信号通路,它可以促进炎症因子的表达。NF-κB 的激活是调节骨骼肌萎缩的关键因素。炎症发生时,促炎因子(TNF-α,IL-1)与NF-κB 受体结合,导致NF-κB 靶基因转录。NF-κB 靶基因作用于UPS,导致蛋白质分解并引发骨骼肌萎缩[18]。另外,促炎因子TNF-α 也可以抑制蛋白质的合成并加速蛋白质的降解[5]。Li C 等人[19]研究发现,组蛋白脱乙酰酶2 可能通过抑制NF-κB 信号通路和促炎细胞因子的产生而下调MuRF1 等萎缩相关蛋白水平,最终缓解骨骼肌萎缩。
JAK/STAT 信号转导通路在炎症反应的调控中起着重要作用。促炎细胞因子可以激活JAK/STAT信号。形成的蛋白质复合体通过Janus 激酶(JAK1/JAK2)触发细胞内STAT 的磷酸化[20]。磷酸化的STATS 可以激活肌肉蛋白水解酶,增加肌肉中UPS(Atrogin-1、MuRF1)和半胱氨酸天冬氨酸蛋白酶-3的表达,进而抑制了肌肉的生成[21]。这一系列过程将导致肌肉质量下降,最终引发骨骼肌萎缩。另外,STATS 可通过与FOXO 和NF-κB 相互作用来调节肌萎缩基因转录水平,进而影响肌肉质量[22]。综上所述,JAK/STAT 通路的激活在骨骼肌萎缩中至关重要。针对其的抗肌萎缩药物的开发可能在临床实践中具有重要价值。
p38-MAPK 通路作为经典的信号通路,参与了细胞衰老、细胞凋亡、细胞周期停滞、炎症和肿瘤的发生。在骨骼肌中,p38-MAPK 的激活可以促进肌肉的再生、干细胞的增殖和分化等而修补损伤肌肉。然而,p38-MAPK 的过度表达会导致肌肉组织的病理变化和骨骼肌萎缩。Yuasa K 等人[23]研究发现,p38-MAPK 异构体p38-αMAPK 可能是肌肉萎缩的正调节因子,而抑制p38-αMAPK 过度表达介导的细胞内信号传导可以缓解骨骼肌萎缩。此外,通过抑制p38-MAPK/NF-κB 通路可以改善氧化应激和抑制自噬,并降低小鼠的炎症反应[24]。因此,p38-MAPK通路的激活在骨骼肌萎缩中起着重要作用。针对该通路的药物开发对预防和治疗骨骼肌萎缩也可能具有潜在的临床价值。
此外,骨骼肌萎缩也与氧化应激、线粒体功能障碍等因素密切相关,这是因为它们也会导致骨骼肌蛋白质代谢失衡[25]。在肌肉纤维中,氧化还原信号通路中活性氧的增加以及线粒体数量的大幅减少,将导致骨骼肌蛋白质的降解大于蛋白质的合成,进而引发骨骼肌萎缩[26]。
4 骨骼肌萎缩的治疗
在正常生命体中,一方面,肌肉生长因子可促进蛋白质的合成和肌肉卫星细胞的增殖分化,另一方面肌肉生长抑制素可通过激活UPS 等蛋白降解系统来诱导蛋白质分解和抑制卫星细胞募集,从而最终达到肌肉稳态平衡状态。
肌肉生长主要是依赖IGF-1/Akt 通路。在骨骼肌中,IGF-1 可与其受体结合导致Akt 磷酸化。Akt 磷酸化在蛋白合成激活中发挥着核心作用,并且在细胞质中通过抑制FOXO 的转录来抑制UPS 和ALP的激活。另外,Akt 可以调控重要的蛋白质合成途径MTORC1 及其下游途径,有助于促进肌肉生长[27]。肌卫星细胞是骨骼肌前体细胞,能通过增殖和分化并融合成多核肌管,最终形成肌纤维。这一过程中,肌分化因子在肌肉再生中起着重要作用。它在肌分化因子及生肌因子5 调控下开始启动分化,而肌生成素和肌素重链因子参与了中后期分化过程,最终形成新的肌纤维,从而修复了受损的肌肉组织,达到了肌肉再生的目的[28]。然而,在骨骼肌萎缩过程中,肌卫星细胞的激活、增殖和分化等功能会发生不利变化,导致肌肉再生被抑制。Inaba S 等人研究发现,在恶病质小鼠中,肌卫星细胞的增殖和分化能力降低,肌纤维甚至不能维持形态而导致萎缩[29]。另外,肌生长抑制素作为转化生长因子β(TGF-β)超家族的一员,是骨骼肌质量的负调节因子,与蛋白质降解和肌卫星细胞增殖分化功能的抑制密切相关[30]。肌肉生长抑制素由肌肉细胞产生,可激活成熟肌肉细胞中的UPS,控制其自我更新过程,并抑制肌卫星细胞的增殖和分化。在患慢性肾脏疾病的小鼠模型中,注射抗肌生长抑制素肽体可通过PI3K/Akt/FOXO3O途径阻断蛋白质的降解,并改善肌卫星细胞的功能[31]。因此,探究肌肉再生平衡机制对了解骨骼肌萎缩相关的肌肉功能障碍中是至关重要的。肌肉再生平衡的调控以及潜在治疗机制的开发为未来骨骼肌萎缩的治疗带来了巨大的希望。
目前,针对骨骼肌萎缩已有了体育锻炼、营养补充、药物治疗等多种治疗方法。其中,体育锻炼被认为是有效的治疗方法,它可以促进血液流动、增加供氧、减少ROS 的产生、减轻骨骼肌的炎症反应[32]。另外,运动会诱导代谢适应,从而改善葡萄糖代谢、增强线粒体功能以及增加肌肉质量[33]。然而,运动的作用也是一把双刃剑。例如,长期力竭运动会引起自噬相关蛋白ATG7、Becn1 和FOXO3 的高表达,以及泛素蛋白标记物Atrogin-1 和MuRF1 的高表达,从而导致运动耐受能力的降低以及肾功能的损伤[34]。因此,不同程度运动后肌萎缩因子的激活以及运动调节肌萎缩相关机制的进一步研究对缓解骨骼肌萎缩和促进机体健康具有重要意义。
然而,活动受限患者,如长期卧床和神经损伤的患者,往往因为无法达到运动要求而只能采取其它治疗途径。营养治疗可能是减缓骨骼肌萎缩的良好治疗方案。比如,含亮氨酸或B 族维生素的饮食可以减少肌肉蛋白的降解并提高肌肉性能[35]。目前关于营养支持对骨骼肌萎缩患者影响的研究非常有限,仍需要大规模和长期的临床试验来检验。
药物应用于骨骼肌萎缩治疗的基础研究也受到广泛关注。例如,类固醇生物碱Conessine 可以通过抑制萎缩相关泛素连接酶Atrogin-1 和MuRF1 的表达来缓解骨骼肌萎缩,而这一途径可能是通过抑制NF-κB 通路和FOXO3 转录来完成的[36]。大蒜硫化物Ajoene 也具有缓解骨骼肌萎缩的作用。体内实验发现其可通过减少肌肉运动因子的分泌和抑制JAK/STAT3 途径,促使肌肉特异性E3 连接酶低表达,来缓解骨骼肌萎缩[37]。天然植物黄芪和牡丹提取液也可降低小鼠炎症因子的表达,并在体外实验发现其可降低骨骼肌萎缩因子MuRF1 的表达以及抑制NF-κB 和p38-MAPK 通路,从而达到抑制炎症作用,最终缓解了肿瘤恶病质导致的骨骼肌萎缩[38]。总之,现有药物主要是通过抑制炎症反应、促进肌肉蛋白质合成和抑制蛋白质水解等来缓解骨骼肌萎缩。这些发现进一步证实了炎症在骨骼肌萎缩中的重要作用,也为炎症通路作为潜在靶点用于开发预防和治疗的新药提供了科学依据。
此外,目前其他治疗方法还包括基因疗法、干细胞和外泌体疗法、细胞因子疗法等[39],均是通过促进肌肉蛋白合成和抑制肌肉蛋白降解等机制来缓解骨骼肌萎缩。
然而,目前临床应用的治疗药物尚存在较大的副作用,而非药物治疗方法存在疗效有限或成本过高等问题。因此,研究人员有必要继续加深对其机制的了解,以寻找新的靶点和药物。
5 结论与展望
骨骼肌是人体中最丰富的的组织,在机体内扮演着重要的角色。骨骼肌萎缩的主要表现为肌肉质量的明显减少,这将导致患者生活质量的下降。另外,炎症相关疾病常伴随着骨骼肌萎缩等并发症,因而会增加发病率和死亡率。本文综述了骨骼肌萎缩的类型、机制和治疗策略等,以期为开发新的预防和治疗方案提供帮助。

