基于纳米尖端结构的活单细胞胞内传递方法研究进展
于素素 武园园* 汪夏燕 郭广生*,2
1(北京工业大学化学系,环境安全与生物效应卓越中心,北京 100124)
2(中央民族大学生命与环境科学学院,北京 100081)
细胞是生物体结构与功能的基本组成单位,基于单细胞的研究是生命研究的基础[1-2]。单细胞分析是跨学科的前沿研究领域[3],已成为现代生物学和医学研究的重要方法[4-5],可获得细胞在复杂生物环境中的准确信息,反映细胞在生命体中的作用,并进行细胞的深度信息解读,从而揭示细胞的本质,对研究细胞信号传导、理解生命过程以及阐明疾病发生机理具有重要意义[6-7]。活单细胞分析能够实时跟踪细胞内物质的发展变化过程,反映生物体生理及病理的连续变化趋势,在单细胞分析中具有重要地位[8-9]。
将药物、核酸和蛋白质等外源物质传递入细胞,即胞内传递,能够进行细胞分析、了解细胞功能和监测细胞命运[10]。胞内传递现已成为基因编辑[11]、药物递送[12]及细胞疗法[13]等的关键步骤,近年来已经发展了多种胞内传递方法,主要包括生物、化学和物理三类方法[14]。生物方法利用病毒载体等运送生化复合物进入细胞;化学方法主要是利用脂质载体,诱导细胞利用内吞作用进行物质传递;物理方法是利用由电场、磁场或光产生的高强度能量或力,在细胞膜上产生孔隙而进行物质传递。这些方法已经广泛用于疾病治疗、药理学分析及发育生物学等研究领域[15]。但是,这些方法多以群体细胞作为研究基础[14,16],丢失了一些稀有信息,掩盖了个体细胞的差异性;并且只能实现单向传递,即将外界物质传递入细胞;传递效率有限,对细胞活性有一定影响,无法实现精准胞内传递[17]。
为了在不同时间跟踪并监测传递入单细胞内的物质的变化过程,从而准确了解单细胞的实时动态信息,为疾病的治疗提供精准信息,进行活单细胞胞内传递的研究具有重要意义[18]。基于纳米尖端结构的活单细胞胞内传递方法是一种高传递效率、低破坏性的物理类机械胞内传递方法,在活单细胞胞内传递的研究中脱颖而出[17-19]。该方法中使用的纳米尖端结构的长度通常在微米级别,尖端尺寸从几纳米至几百纳米不等,主要包括纳米线、纳米管和纳米尖端移液针等[17-18];该结构可跨越细胞膜在细胞内外建立通道,用于少量物质的传递;其对细胞损伤小,基本不会影响细胞的活性。在物质传递过程中,这些纳米结构的尖端可进入目标细胞,不存在细胞遗漏,细胞利用率高;利用该结构可将外源物质注射入活单细胞内,也可将活单细胞内物质取出,实现双向传递[20-21],用于跟踪检测;纳米尖端移动灵活,可结合高分辨显微镜对活单细胞内细胞器进行定位,能够用于单细胞定位胞内传递[22]。同时,纳米尖端的中空结构能够直接用于各种细胞胞内传递不同物质,受细胞类型影响小,传递物质范围广(包括各种小分子及大分子)。另外,基于纳米尖端结构的活单细胞胞内传递方法利用扩散、泵压及电压等驱动力将物质传递到细胞内或将细胞内物质取出,可实现单细胞定量胞内传递[23]。
本文重点归纳并总结了实心纳米尖端和空心纳米尖端两类结构,详细介绍了两类纳米尖端结构的材质、尺寸和制备方法,探讨了基于纳米尖端结构的活单细胞胞内传递方法的驱动力、原理、优缺点及应用,最后,对该方法未来的发展前景进行了展望。
1 基于实心纳米尖端的活单细胞胞内传递方法
基于纳米尖端结构的活单细胞胞内传递方法通常是将具有微米级别长度的纳米级尖端刺入目标细胞,纳米尖端结构能够穿越细胞膜,在膜内外建立通道,最后利用扩散/吸附、泵压或电压等将物质传递到细胞内或将细胞内物质取出,实现活单细胞的胞内传递[24-25]。纳米尖端有阵列结构和独立结构两种:阵列纳尖端用于胞内传递的装置,通常是在基底上制备一定数量的垂直纳米尖端,尖端向上,尖端不可随意移动,从下向上刺入培养的细胞中,进行胞内传递;独立纳尖端用于胞内传递的装置,是将一根纳米尖端固定于悬臂上,尖端向下,尖端可随意移动,从上向下刺入培养的细胞中,进行胞内传递。
本文依据纳米尖端结构将其分为实心纳米尖端和空心纳米尖端两类。根据纳米尖端结构形状的不同,实心纳米尖端主要包括纳米线和纳米针。基于实心纳米尖端的活单细胞胞内传递方法是对纳米尖端表面进行修饰,将外源物质结合在尖端上,通过扩散解析或电刺激的方式传递入细胞内,或将细胞内物质通过萃取的方式取出[24-27]。
1.1 基于纳米线的活单细胞胞内传递方法
纳米线主要分为独立纳米线和垂直阵列纳米线两种结构,其中,垂直阵列纳米线的胞内传递通量高,最为常用。纳米线具有较高的纵横比(大于10),尖端尺寸通常小于200 nm,为最易制造的实心纳米尖端结构之一,多利用离子刻蚀或化学气相沉积等方法,对硅、镍、金和氧化锌等材料进行微纳加工,得到不同尺寸的纳米线[26,28]。根据目标细胞和传递分子类型,通过调控垂直阵列纳米线的平均间距、长度、直径和锐度等物理参数,控制纳米线的机械性能,提高胞内传递的效率[26]。
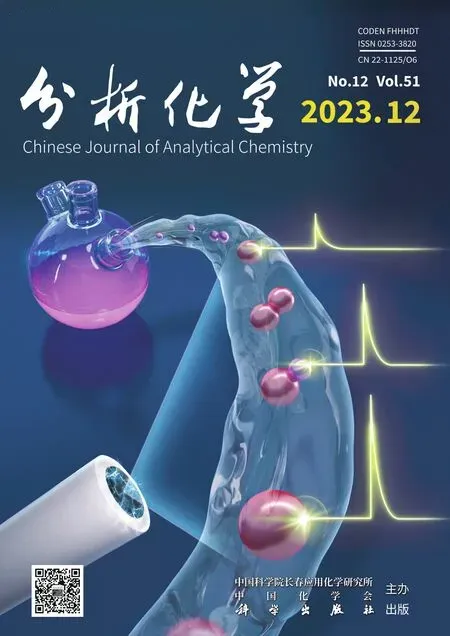
Yan 等[29]报道了一种生物相容性的纳米线光学探针用于高时空分辨的胞内传递和胞内检测的方法(图1A)。将氧化锡(SnO2)纳米线(直径尺寸为100~250 nm)与光纤的锥形尖端(锥角为3º~5º、尖端直径为300~500 nm)连接,该纳米线光学探针具有高度的灵活性和稳定性,可在细胞成像过程中承受反复的弯曲和变形。该方法可将可见光引导到活哺乳动物细胞的细胞器中,检测来自亚细胞区域的光信号;通过光激活机制,该纳米线光学探针可将负载的外源物质传递入具有时空特异性的细胞中,并且在此过程中没有显著的毒性。除了氧化锡材质纳米线,Kim 研究组[30]提出了一种基于金(Au)纳米线的纳米注射器,用于将外源基因传递到活单细胞的细胞核中(图1B)。金纳米线的直径为100~150 nm,通过气相传输法合成,具有极佳的机械性能,可最大限度地减少细胞损伤。该纳米注射器的高导电性可精确定时及有效释放附着在金纳米线表面的DNA 分子。采用电刺激触发的方法,实现快速、定量和定时的DNA 传递,不会造成明显的细胞损伤,可将DNA 直接送入细胞核,并能成功表达。随后,Kim 研究组[31]利用该电响应金纳米线(E-R Au NWI)注射器对猪精原干细胞(pSSCs)进行高效基因修饰,提高pSSCs 的转染效率,用于转基因猪的有效生产。与传统的基于非病毒载体的基因传递方法相比,基于电响应金纳米线的方法将猪精原干细胞的转染效率提高了至少6.7 倍,最高可达46.7 倍。
图1 基于纳米线的活单细胞胞内传递方法:(A)氧化锡纳米线用于高时空分辨的胞内传递[29];(B)金纳米线用于活单细胞的核内传递[30];(C)聚吡咯-硅纳米线阵列用于胞内传递[34]Fig.1 Intracellular delivery methods of living single cells based on nanowires: (A) SnO2 nanowire used for intracellular delivery and intracellular detection with high spatiotemporal resolution[29];(B)Gold nanowire used for intranuclear delivery of living single cells[30];(C) Polypyrrole (PPy)-Si nanowire array used for intracellular delivery[34]
独立纳米线的单细胞胞内传递通量较低,为了高通量地将各种生物活性分子传递入不同类型的细胞,研究人员利用阵列纳米线进行活单细胞胞内传递。制备阵列纳米线的材质很多,其中硅(Si)最为常用,Shalek 等[32]使用表面修饰的垂直硅纳米线阵列将生物分子定位、高效地传递到哺乳动物细胞中。垂直硅纳米线阵列通过化学气相沉积及离子刻蚀制备,纳米线的尖端尺寸为100~200 nm,高度约为1 μm。该胞内传递方法依靠硅纳米线穿透细胞膜,随后将表面结合的分子直接释放到细胞质中,从而能够高效传递生物分子。这种传递方法能够改造传统方法难以转染的原始细胞,还可诱导小分子神经元祖细胞生长,并将蛋白引入特定的细胞器。然后,Lu 等[33]提出了一种基于活性氧(ROS)响应性硅纳米线阵列的基因转染平台,以提高多个细胞系的基因转染效率。硅纳米线阵列通过化学刻蚀法制备,纳米线的尖端尺寸约为100 nm,高度约为10 μm。金纳米颗粒修饰的硅纳米线阵列(SN-Au)表面接枝聚[(2-丙烯酰)乙基(对硼酸苄基)二乙基溴化铵](B-PDEAEA),通过静电相互作用结合表面的质粒DNA(pDNA),在纳米线穿透细胞时直接传递到细胞中。SN-Au 在光处理下产生ROS,B-PDEAEA 接枝在金纳米颗粒上的表面电荷变化,实现pDNA 在细胞质中有效释放,用于转染。短时间光照后,该平台对多种细胞类型的转染效率显著提高(HeLa 细胞3.2 倍,L929 细胞7.6 倍,BMSC 细胞2.3 倍,mESC 细胞6.2 倍)。Loh 等[34]开发了一种导电聚吡咯-硅(PPy-Si)纳米线阵列装置,利用纳米尺寸尖端和电学性质结合的方法,进行有效胞内传递(图1C)。利用离子刻蚀及化学气相沉积技术制备纳米线阵列,纳米线的尖端尺寸小于200 nm,高度为10 μm,间隔5 μm。荧光物质掺杂在纳米线尖端矩阵的电沉积聚吡咯中,在施加还原电位时被释放出来,实现定量胞内传递。除了使用硅材质制备纳米线阵列外,还可以采用镍、氧化锌和砷化铟等材质[35-37],采用这些材质制备的纳米线阵列均可用于活单细胞胞内传递。
1.2 基于纳米针的活单细胞胞内传递方法
纳米线可有效地减小尖端尺寸,提高胞内传递效率,但是机械稳定性下降;纳米柱具有更有利的纵横比(小于10),机械稳定性更优,可在机械稳定性和胞内传递有效性之间取得平衡[26]。纳米柱主要为阵列结构,尖端尺寸为200~500 nm,多利用离子刻蚀、化学刻蚀和火焰刻蚀等方法,对硅、二氧化硅、高聚物和碳等材质进行加工制备[26,38-40]。但是,由于纳米柱尖端尺寸较大,用于胞内传递的报道较少,阵列纳米柱主要用于细胞核形变、细胞增殖和活细胞成像等生物学研究[38-40]。纳米针则结合了纳米线和纳米柱两者的优势,具有锋利的尖端和宽的基底以及良好的机械稳定性[26]。纳米针主要分为独立纳米针和阵列纳米针两种结构,阵列纳米针应用较多,其尖端尺寸通常小于100 nm,多利用离子刻蚀、化学刻蚀和光刻蚀等方法,对硅材质进行加工,制备不同尺寸的纳米针[26,41]。
独立纳米针进行胞内传递多依赖于原子力显微镜(Atomic force microscope,AFM),将AFM 的探针进行改进,制备出尖锐的锥形纳米针,将表面修饰的纳米针刺入活单细胞,进行胞内传递。Ryu 等[42]通过聚焦离子束蚀刻的方法制备了一个超锋利的锥形硅纳米针,连接在AFM 悬臂上,插入活细胞中,并使用AFM 的力-距离曲线反映插入过程的机械响应。纳米针的尖端尺寸为200 nm,长度为10~15 μm。修饰后的纳米针可用于原位检测单细胞内的分子,研究结果表明,gp5 修饰的纳米针提高了插入效率,有助于对低插入效率的细胞种类进行分子检测和分析。Penedo 等[43]以AFM 的硅针尖为材料,采用聚焦离子束铣削工艺制备了不同直径和形状的硅纳米针,纳米针形状有扁平和尖锐两种,尖端尺寸为100、200 和400 nm。作者测试了不同直径和形状的纳米针对细胞膜的穿透能力,证明了薄而尖锐的纳米探针可减少穿透细胞膜所需的穿透力(FP)和压痕长度(IL),从而最大限度地减少细胞损伤,增加胞内传递后细胞的存活率。除了将外源物质传递入细胞内,纳米针还可通过固相微萃取的方法将活单细胞内的物质取出。Wang 研究组[44-45]采用固相微萃取(SPME)技术集成纳米生物传感器跟踪和量化单个活细胞细胞质中多巴胺浓度的波动(图2A)。设计了一种聚吡咯改性的碳纤维双功能纳米探针,提取细胞质中的多巴胺,然后进行电化学检测。通过火焰刻蚀法制备碳纳米针,再用聚吡咯对其进行修饰,得到纳米尖端≤100 nm的双功能纳米探针,对样品中的10 pmol/L 多巴胺具有良好的检测性能。在保持靶细胞存活的情况下,采用该方法实现了连续检测细胞质中的多巴胺,为研究多巴胺神经毒性及神经退行性疾病相关药物作用机制提供了参考。

图2 基于纳米针的活单细胞胞内传递方法:(A)碳纳米针提取单细胞中的多巴胺[45];(B)硅纳米针阵列用于单细胞基因编辑[46];(C)硅纳米针阵列调节单细胞的基因表达[48]Fig.2 Intracellular delivery methods of living single cells based on nanoneedles: (A) Carbon nanoneedle used for extracting dopamine from single cell[45];(B) Silicon nanoneedle arrays used for single-cell gene editing[46];(C) Silicon nanoneedle arrays used for modulating gene expression in single cell[48]
独立纳米针也存在胞内传递通量低和效率低的问题,因此阵列纳米针在活单细胞胞内传递中更为常用。Li 等[46]提出了一种振动辅助纳米针/微流体复合系统,利用大面积纳米针在振动下快速刺穿微通道中移动的悬浮细胞,实现连续的高通量胞内传递(图2B)。采用自组装模板方法制备阵列硅纳米针,该方法将离子刻蚀、化学刻蚀和气相沉积相结合,纳米针的尖端尺寸小于50 nm、底部尺寸约为300 nm、高度约为700 nm。基于大面积自组装技术和微通道的纳米针阵列可最大限度地提高胞内传递效率,对于难以转染的免疫细胞,递送效率可达98%,而细胞活力仍保持约80%;并且胞内传递通量可保持在mL/min 水平。此外,通过该平台制备了CD96 敲除的NK-92 细胞,基因编辑的NK-92 细胞具有更高的免疫力。Stevens 研究组[47]利用离子刻蚀及化学刻蚀的方法制备了多孔硅纳米针阵列,纳米针尖端尺寸约为100 nm。将电子和扫描离子电导显微镜与分子生物学技术相结合,探究了纳米针的生物分子传递机制,表明纳米针的使用有助于将核酸传递进入人类干细胞。随后,Stevens 研究组[48]利用离子蚀刻法可控制备纵横比高且不可降解的硅纳米针阵列,实现了纳米针尖端直径在20~700 nm 范围内的精确调节。使用该阵列对人间充质干细胞(hMSCs)进行长期培养(图2C),并利用纳米针尖直径的变化控制hMSCs的形态、核大小和F-肌动蛋白排列,调节核层基因、Yes 相关蛋白(YAP)靶基因和粘附基因的表达。Stevens 研究组[49]还采用表面修饰的硅纳米针阵列进行细胞转染,表明纳米针可提高转染效率,使用该系统进行表面介导转染是高效和安全的,并且所需的核酸量比标准培养转染低1 个数量级。
纳米线具有极小的尖端尺寸,可最大限度地减小对单细胞造成的机械破坏,保持细胞的活性。但是,纳米线的纵横比高,使其刚性降低,容易在纳米线-衬底和纳米线-细胞界面处断裂。纳米针因具有尖端小、刚性高等优点,适宜作为实心纳米尖端,在活单细胞胞内传递中发挥重要作用。但是,采用纳米针进行胞内传递时,与纳米线和纳米柱等实心纳米尖端相似,需要将外源物质修饰到纳米针上,因此传递的物质种类有限,这限制了实心纳米尖端的使用范围。
2 基于空心纳米尖端的活单细胞胞内传递方法
根据纳米尖端结构形状的不同,空心纳米尖端主要包括纳米管、纳米尖端移液针及中空AFM 悬臂纳米锥结构。空心纳米尖端与实心纳米尖端相比,胞内传递的物质范围广,主要利用液压和电等驱动力将外源物质(大分子和小分子)通过尖端内部的中空腔室传递入活单细胞内,或将活单细胞内的物质通过尖端的中空腔室取出[17-18]。
2.1 基于纳米管的活单细胞胞内传递方法
纳米管为空心圆柱体,尖端尺寸通常小于200 nm,多以阵列纳米管结构进行胞内传递。通常采用原子层沉积与离子刻蚀相结合的方法,对氧化铝、二氧化硅和二氧化钛等材质进行加工制备阵列纳米管。通过在纳米管膜上施加低功率、低电压的电场,阵列纳米管可将多种生物分子注入活单细胞中或将活单细胞内的物质取出,但不干扰细胞功能或存活能力,实现细胞内外物质的高效传输[50-51]。
Schmiderer 等[55]利用中空氧化铝纳米管将RNA 传递入人类造血干细胞和祖细胞(HSPCs)。采用原子层沉积与电感耦合等离子体-反应离子刻蚀相结合的方法制备氧化铝纳米管,纳米管尖端直径约为150 nm,在电场作用下实现了6~2000 kDa 的mRNA、短干扰RNA(siRNAs)、DNA 寡核苷酸和右旋糖酐的高效传递。胞内传递后的细胞功能齐全,并且细胞的基因表达不受干扰。纳米管介导的转染是一种温和的基因传递方法,适合敏感的原代干细胞的非扰动治疗。Zhang 等[53]使用自旋镀膜及等离子体刻蚀的方法制备出尺寸可控、间距可控的二氧化硅(SiO2)和二氧化钛(TiO2)纳米管。将二氧化硅和二氧化钛纳米管与微流控系统结合,构建纳米电穿孔系统,实现了细胞膜不渗透分子在HeLa 细胞和MCF-7 细胞内的高效传递(图3A)。纳米管不仅可用于将外源物质传递入活单细胞内,还可用于将活单细胞内的物质取出,实现连续跟踪检测。Cao 等[54]报道了一种时间分辨、纵向提取和定量测量多种细胞类型的蛋白质和mRNA 的方法。采用原子层沉积与离子刻蚀相结合的方法制备尖端直径为150 nm 的氧化铝纳米管,在指定的取样区域内从同一细胞中反复取样细胞质内容物超过5 d,取样后的细胞存活率>95%,该取样过程是无损的,可对细胞进行长期分析。从人诱导多能干细胞(hiPSC-CMs)的心肌细胞中分析了48 个mRNA 序列,其中41 个被准确量化。该平台适用于细胞系和原代细胞,通过长期跟踪同一细胞或细胞群,提供了了解动态细胞行为的途径。He 等[55]开发了一个多功能分支纳米管(BNS)电穿孔平台,可有效捕获循环肿瘤细胞(CTCs),并能够实时、原位地对细胞内的活动进行调控和监测(图3B)。在中空纳米管的外侧壁上具有许多纳米分支,可与特异性抗体结合,从而促进CTCs 的有效捕获。纳米电穿孔可通过BNS 在低电压下无损地穿孔细胞膜,使外源生物分子进入细胞质,也可通过纳米管吸取细胞质,而不影响细胞活力,能够在空间和时间控制下有效地将生物分子(如小分子染料和DNA 质粒)传递到癌细胞中,或将细胞内酶(如Caspase-3)进行重复提取用于实时监测。

图3 基于纳米管的活单细胞胞内传递方法:(A)二氧化硅和二氧化钛纳米管与微流控系统结合用于胞内传递[53];(B)多功能分支纳米管对单细胞进行调控和监测[55]Fig.3 Intracellular delivery methods of living single cells based on nanostraws: (A) SiO2 and TiO2 nanotubes combining with microfluidic system used for intracellular delivery[53];(B) Multifunctional branched nanotubes for regulating and monitoring single cells[55]
2.2 基于纳米尖端移液针的活单细胞胞内传递方法
纳米尖端移液针为中空锥状结构,由石英或硼硅酸盐玻璃毛细管制成,尖端尺寸从几纳米至几百纳米不等,多以独立纳米尖端移液针进行胞内传递[20]。制备纳米尖端移液针的方法主要有3 种:直接拉制法[56]、拉制与离子蚀刻相结合的方法[57]、拉制与化学刻蚀相结合的方法[22]。直接拉制法适合内外径比较大的毛细管制备纳米尖端移液针,拉制与刻蚀相结合的方法则适用于内外径比较小的毛细管制备纳米尖端移液针。纳米尖端移液针主要依靠气压泵、液压泵和电化学泵等驱动力进行胞内传递,可将外源物质传递入单细胞内,也可将单细胞内物质取出,不影响单细胞的活性[22,58-59]。
Wu 等[22]建立了基于流体辅助湿法刻蚀的实时“可视化”精准可控制备石英纳米尖端移液针的方法。根据绘制出的尖端内径开口尺寸与电流值的标准曲线,通过控制终止刻蚀时的电流值,能够制备内径开口小至10 nm 尖端的可控制备。以电渗泵为驱动力,实现了高空间分辨的活单细胞(直径<30 μm)核内蛋白注射,并在自建的活单细胞工作站上完成质粒核内传递,用于单细胞转染(图4A)。Li 等[59]提出了一种光响应水凝胶-纳米尖端移液针混合系统,采用直接拉制法制备尖端直径为100 nm 的石英纳米尖端移液针,可用于高空间/时间分辨率的单细胞操作。纳米尖端移液针在单细胞研究中克服了高电压(~1000 mV)或有机溶剂在操作过程中对靶细胞造成的干扰和损伤。光触发系统用于无电压、非侵入性的单细胞注射,保证了良好的细胞活力(存活率90%)。纳米尖端移液针具有灵活性,可将外源物质精准传递入活单细胞的不同区域。Lv 等[60]报道了一种基于玻璃纳米尖端移液针的单细胞注射和荧光标记方法(图4B)。采用直接拉制法制备尖端直径为100 nm 的纳米尖端移液针,对感兴趣单细胞的不同亚细胞区域进行注射和高分辨率荧光标记。通过控制纳米尖端移液针内的电渗流,对胞内传递实现精确控制,比较了非靶向染料和核靶向染料的不同递送模式,展示了基于纳米尖端移液针的方法在分析特定亚细胞区域方面的能力。纳米尖端移液针除了可实现活单细胞精准胞内注射,还可用于取出活单细胞中的物质。活体神经元中单个轴突和树突的分子图谱能够为更好地理解神经元功能提供重要信息。Xu 等[61]建立了一种电注射器辅助电喷雾质谱方法,实现了活神经元中单个细胞的轴突或树突内取样,用于质谱分析(图4C)。利用直接拉制法制备尖端直径为130 nm 的石英纳米尖端移液针,插入到轴突或树突中,通过电渗流吸取细胞质。该方法揭示了整个活神经元的分子分布,为深入研究神经元内部轴突/树突与机体之间的分子通讯提供了可行性。
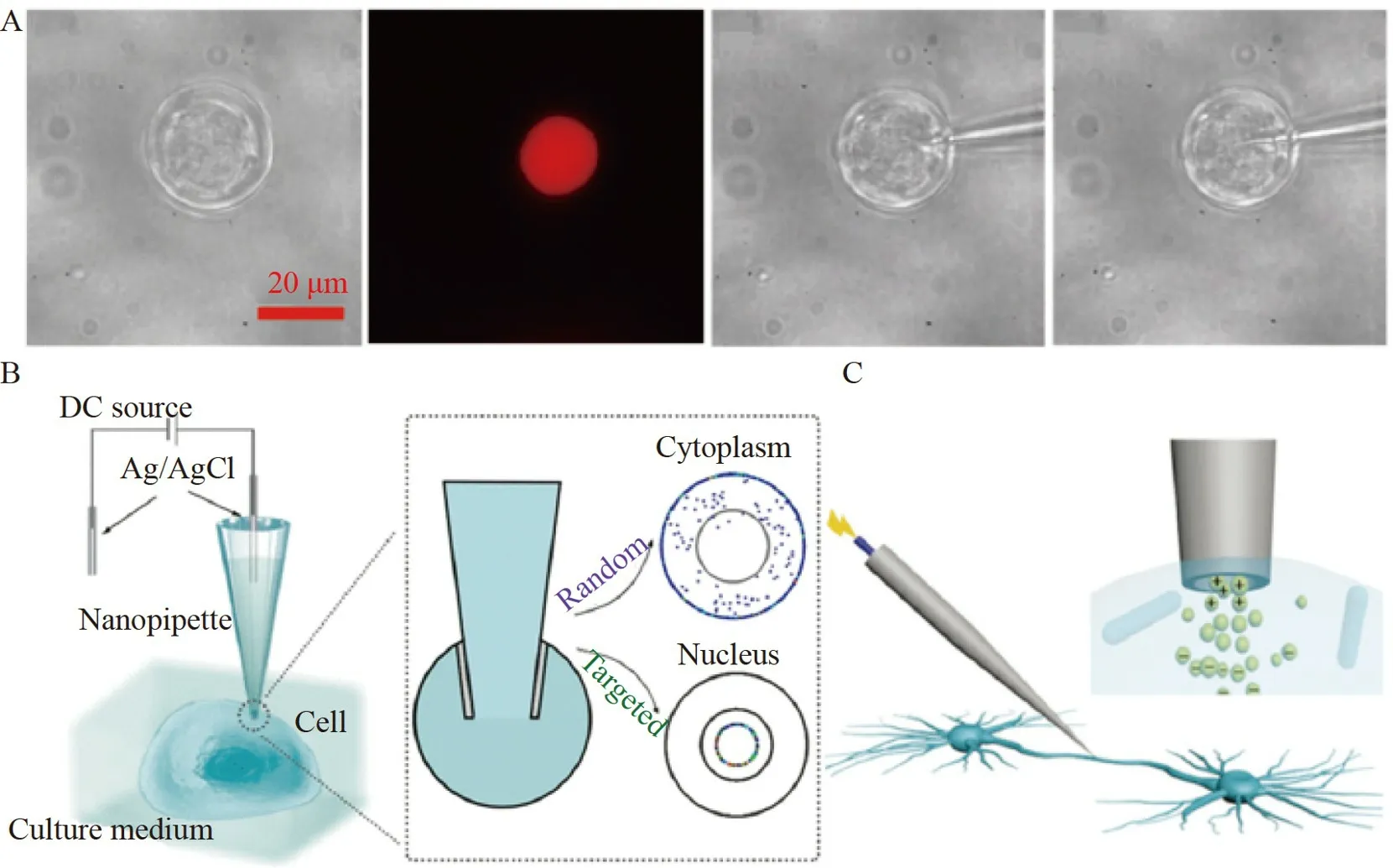
图4 基于纳米尖端移液针的活单细胞胞内传递方法:(A)石英纳米尖端移液针用于单细胞转染[22];(B)玻璃纳米尖端移液针对单细胞的不同亚细胞区域进行注射[60];(D)石英纳米尖端移液针从单个细胞的轴突或树突内取样[61]Fig.4 Intracellular delivery methods of living single cells based on nanopipettes:(A)Quartz nanopipette used for single-cell transfection[22];(B)The glass nanopipette injecting to different subcellular regions of a single cell[60];(D) Quartz nanopipette extracting from the axons or dendrites of a single cell[61]
2.3 基于中空AFM悬臂纳米锥的活单细胞胞内传递法
基于中空AFM 悬臂纳米锥的活单细胞胞内传递法,即流体力显微镜(FluidFM)胞内传递法是近年新发展的一种重要的单细胞胞内递送方法,将纳米级分辨率的AFM 与控制流体回路的微通道悬臂相结合,能够局部操纵液体,主要用于贴壁单细胞的胞内递送,同时保持细胞的活力[67]。
Zambelli 研究组[63]于2009 年首次提出了基于AFM 及中空悬臂纳米锥的FluidFM 技术,用于局部液体分配和对单个活细胞的刺激(图5A)。采用聚焦离子束刻蚀的方法可控制备氮化硅中空悬臂纳米锥,纳米锥尖端孔径从100 nm 至1 μm 不等,壁厚为100 nm。溶液通过悬臂中的纳米流体通道及尖端进行溶液分配,灵敏的AFM 力反馈能够可靠地区分是否与细胞膜接触或刺入细胞内;通过FluidFM,将染料注入到单个活细胞内。随后,该研究组利用FluidFM 技术将染料定量传递入活单细胞内,并将质粒定位注射进细胞核中,单细胞成功转染出绿色荧光蛋白[64]。FluidFM 技术不仅可将外源物质定量地传递入活细胞内,也可将活单细胞内的物质定量取出。Zambelli 研究组[23]于2016 年提出利用FluidFM 技术对单细胞进行时空分辨的定量样品移取(图5B)。从细胞质或细胞核移取可溶性分子并进行综合分析,包括酶活性和转录丰度的检测。该方法揭示了单细胞能够承受皮升级样品的移取,并为研究细胞动力学和细胞间相互作用提供了平台。近年,FluidFM 技术多用于生物领域及疾病的发现与治疗。Gabelein 等[65]利用FluidFM 技术以亚细胞空间分辨率从活单细胞中提取、注射和移植细胞器。当提取单个或一定数量的线粒体时,由于局部施加的流体力,线粒体的形态转变为串上的珍珠表型。在细胞间移植时,转移的线粒体融合到宿主细胞的线粒体网络中。经过线粒体的转移和细胞的繁殖,供体线粒体DNA(mtDNA)在受体细胞内复制。该研究为细胞器生理学和体内平衡的研究提供了新方法。

图5 基于中空原子力显微镜悬臂纳米锥的活单细胞胞胞内传递法:(A)FluidFM 将染料注入到活单细胞[63];(B)FluidFM 用于单细胞定量样品提取[23]Fig.5 Intracellular delivery methods of living single cells based on hollow atomic force microscopy cantilever nanoco:(A)FluidFM injecting dye into living single cell[63];(B)FluidFM used for quantitative sample extracting of single cell[23]
纳米管以阵列的形式用于活单细胞胞内传递,通量高,但纳米管阵列垂直固定,无法移动,灵活性较差,较难实现活单细胞定位胞内递送。与阵列纳米管相比,纳米尖端移液针和中空AFM 悬臂纳米锥的灵活性高,可实现活单细胞定位胞内递送,但是通量低。另外,中空AFM 悬臂纳米锥制备复杂,用于胞内递送所使用的仪器价格昂贵,一般实验室难以获取。
综上,基于纳米尖端结构的活单细胞胞内传递方法各有特点,其性能比较见表1。
3 结论与展望
胞内传递在疾病诊断方面发挥了重要作用,其中,活单细胞胞内传递为疾病治疗提供了更多精准的信息。基于纳米尖端结构的活单细胞胞内传递方法具有破坏性小、传递效率高以及细胞利用率高等优点,能够实现双向传递,已经成为活单细胞胞内传递的重要方法。纳米尖端结构主要包括实心纳米尖端和空心纳米尖端两类。实心纳米尖端主要有纳米线和纳米针两种,尖端尺寸通常小于200 nm,多以垂直阵列结构通过扩散解析或电刺激的方式进行活单细胞胞内传递。空心纳米尖端主要包括纳米管、纳米尖端移液针及中空AFM 悬臂纳米锥3 种,尖端尺寸通常小于200 nm,纳米管为垂直阵列结构,纳米尖端移液针及中空AFM 悬臂纳米锥为独立结构,利用液压和电等驱动力,进行活单细胞胞内传递。空心纳米尖端与实心纳米尖端相比,具有无需修饰、胞内传递物质范围广等优点,可传递蛋白质、核酸和药物等,因此近年来在活单细胞胞内传递研究中应用更多。目前,基于纳米尖端结构的活单细胞胞内传递方法仍然存在一些问题。以阵列纳米尖端进行胞内传递的方法虽然通量高,但是空间分辨率低、灵活性差。以独立纳米尖端进行胞内传递的方法的空间分辨率高、灵活性好,但是通量较低。利用微型化、集成化、可设计性强的微流控芯片进行活单细胞捕获及培养,使用多光路、高分辨显微镜对胞内传递过程进行成像,结合机械自动化及人工智能技术对胞内传递部位进行精准定位及快速传递,有望在保证空间分辨率的基础上,提高胞内传递通量,解决上述问题。基于纳米尖端结构的活单细胞胞内传递方法在应用于疾病治疗的干细胞和免疫细胞等稀有细胞的研究领域中具有广阔的应用前景。