皮层局部环路结构与功能研究综述
任泓安,孙 乐,王晓群,4,谭 韬
(1.昆明理工大学 非人灵长类生物医学国家重点实验室,云南 昆明 650500;2.中国科学院生物物理研究所 脑与认知国家重点实验室,北京 100101;3.首都医科大学 北京脑重大疾病研究院,北京 100069;4.北京师范大学 IDG/麦戈文脑科学研究院 认知神经科学与学习国家重点实验室,北京 100875)
0 引 言
大脑是一个高度复杂的系统.19世纪末,Ramon Cajal提出神经元是神经系统的基本单位.神经元种类多样,数量巨大,人脑中约有860亿个神经元[1]通过突触连接传递信息,也正是神经元高度复杂的连接及其特有的信息处理方式造就了非凡的大脑.认识神经元的连接对于解析脑功能至关重要.
目前神经元的连接主要从宏观、介观和微观三个尺度[2]来进行研究,不同空间尺度的测量对于全面了解连接组是各有优势,且相互补充.宏观连接组学(Macro-connectomics),分辨率在毫米级,主要基于磁共振成像技术来进行连接组的绘制,核磁的一大优势是以非侵入的方式进行成像,可以无创测量人的大脑不同区域之间的连接[3].磁共振的局限是时间和空间分辨率较低,无法清晰地描绘局部环路的连接.介观连接组学(Meso-connectomics),分辨率在微米级,主要利用病毒或者蛋白标记需要示踪的神经元,利用光学成像技术追踪神经元的投射.从介观水平既可以研究跨脑区的连接,又可以研究局部环路的连接.虽然利用病毒稀疏跨突触标记或者膜片钳技术可以记录到介观水平的神经元形态以及连接,但介观难以发现微观水平上存在的连接细节,如无法记录到突触后连接精细的亚水平结构.并且介观水平的分辨率受到光学成像的限制,对突触连接的判断存在一定程度的干扰.所以,微观连接组学(Micro-connectomics)应运而生,分辨率在纳米级,主要利用电镜技术来获取纳米分辨率下的神经元,在局部环路研究上具有非常大的优势.
大脑的连接不仅是脑区之间的信号传递,在脑认知研究中最关键的是皮层密集连接,以及如何对不同来源的信号进一步处理.不管是何种尺度的研究,想要进一步理解神经元的连接架构,都需要从结构和功能的角度来全面认识神经环路.现有的一些研究未将结构和功能很好地结合起来,例如从电镜角度研究神经元大多数都只包含了结构信息,而没有神经元连接的功能信息[4-5].现有的研究也缺乏对皮层细胞亚类之间的联系和突触连接功能属性的完整描述[6].本文将从小鼠和灵长类皮层的局部环路出发,从微观尺度结合结构和功能的研究来讨论皮层局部神经环路的连接.突触连接不是一个静态的连接,并且连接强度也是不断变化着的,同时受到突触前后各类神经元活动的精细调节.了解神经连接的底层框架以及如何实现特定计算,有助于启发类脑智能研究.
1 微观水平上局部环路的神经结构
早在1986年,White等[7]第一次利用电子显微镜绘制出线虫全部的神经以及数千个突触连接.在2019年,Cook等[8]在线虫中利用连续电子显微镜发现了比以往更多的突触连接,神经元投射位点,并间接测量出连接强度.但相对于更大体积的脑来说,目前的电镜技术重构出小鼠和灵长类全脑的连接组还是存在一定的困难.最近美国脑计划2.0[9]提出未来将绘制出哺乳动物全脑的微观水平神经连接,但目前的研究更多的是利用电镜重构出小鼠以及灵长类皮层的局部环路[10-11].在微观水平上,局部环路的结构可通过电镜对神经元类型进行较为基础的分类,对微观结构以及连接结构,连接偏好性有较为细致的研究,并间接推测连接强度.
1.1 基于微观结构对神经元类型的划分
在局部环路的研究中,神经元的类型区分是较为基础的一步,虽然根据电生理特征、形态学、蛋白表达以及转录组学信息可以对神经元进行较为细致的分类,但单纯在电镜水平还不能够对每一个神经元进行细致的划分.目前大多的电镜数据是在无特异性分子标记情况下,根据电镜下神经元形态及微观结构对神经元进行分类[12-13],例如锥体神经元,轴突始端指向白质,以及存在树突棘[14];抑制性神经元胞体较大,且含有大量线粒体,轴突起源于树突;而非神经细胞,细胞体积小且细胞核的形态也不同[15].在分类的基础上,统计不同物种之间神经元类型的占比,发现存在着较大差异.与啮齿动物相比,人脑皮层中存在更多的胶质细胞[16],更多比例的抑制性神经元,猕猴和人类皮层抑制神经元占比与小鼠相比扩大了约2.5倍[15],导致连接组合的复杂度进一步提升.
1.2 局部环路中的连接偏好性
有了兴奋和抑制神经元的划分,就可以进一步研究环路连接偏好性.在最近,人的皮层研究中首次发现,在轴突距离胞体不同路径长度下,存在突触连接偏好性[15].如锥体神经元远端轴突投射偏好于兴奋性神经元的树突棘,近端轴突投射偏好于抑制性神经元的树突轴.另外,灵长类动物皮层中还存在锥体神经元轴突往兴奋性神经元树突轴投射,而小鼠中却不存在这样的连接偏好[17].神经元类型的占比和突触连接偏好性综合起来考虑,可进一步整合局部环路连接架构.转录组数据[18-19]和电镜数据均提示人类皮层中抑制性神经元占比相对于小鼠多,电镜下双极细胞比小鼠多了一倍,并且双极细胞突触偏好性主要接受抑制性输入,进一步提示人类皮层接受更多的抑制到抑制的神经网络输入[15],这也是从小鼠皮层到人类皮层的一个关键变化.并且在不同发育时期的小鼠皮层中发现,连接方式、连接密度还有突触选择偏好性上还存在着较大差异[17].对不同时期神经元连接形成过程,偏好选择过程提供了新的见解.通过测量突触后密度(Postsynaptic Density,PSD)[13]面积来测量突触大小,与突触前囊泡的数量成正比[20],并且可间接推测突触强度[21-23].
电镜可以在结构上对神经元的形态和连接提供一个极高的分辨率,使得我们对接连结构,连接偏好,连接密度有更加准确的认识,而无法直观获得神经元连接强度、可塑性变化等相关信息.
2 电生理对突触连接功能的研究
电生理的优势,可以非常准确地记录到电信号.常用的电生理方法可分为胞外记录和胞内记录.胞外记录可以被用来检测单细胞电活动以及局部场电位.例如探索局部环路中一群神经元如何编码处理信息,可利用多电极阵列(Multi-Electrode Array,MEA)来同时记录多个神经元的电活动.多电极阵列记录到的是局部群体细胞的电活动,在单细胞水平上的连接还存在较大的局限.而胞内记录保证了对电信号更高的敏感度和信噪比,从而获得突触传递机制.
2.1 膜片钳技术记录神经环路连接
自从膜片钳技术应用以来,越来越多的人开始利用这一技术研究神经元突触的连接,从单个细胞的全细胞记录,到两个细胞同时的全细胞记录[24-25],到现在更多的8个细胞的同时记录[26].从记录神经元的形态和电生理特性,到突触电生理特性,到发现神经环路特定模式.虽然膜片钳已经有几十年的历史,但仍然是目前研究神经功能强有力的工具.另外光遗传技术和膜片钳技术的结合[27],也可以用来研究局部环路的连接.对于局部环路微电路的功能研究,多通道膜片钳(Multiple whole-cell patch-clamp recording)与其他方法相比仍然是金标准[28-29].因为其亚毫秒和亚皮安的分辨率,可记录神经元的形态和电生理特征,使得研究局部环路中连接概率、连接强度、可塑性和神经网络成为可能[30-32].
电生理相对于电镜来说,有其独特的优势.可以结合遗传标记或者转录组学,对神经元亚类类型进行进一步划分,并且把亚类的介观或者超分辨形态与电生理相结合,得到每种神经元对应的电生理特征与属性.根据蛋白表达、形态和电生理特征,已经鉴定出十多种γ-氨基丁酸能(GABA)抑制性神经元亚型[33-38].并且经过大样本量的膜片钳记录,可以对某种亚类的神经元的占比进行统计,例如:成年小鼠视皮层V1的Martinotti cell在L2/3层占其他抑制性神经元的11%,在L5层占32%[39-40].
2.2 多通道膜片钳揭示局部环路连接模式与功能
多通道膜片钳技术的优势在于不但可以获得细胞介观的形态和电生理特征,而且还能直接获取神经元之间的连接信息和突触连接可塑性动态变化的信息.所以,在局部环路的研究上,多通道膜片钳技术具有极大的技术优势,这是其他电生理技术无法直接替代的.
在介观形态和电生理的记录中,更多反应的是细胞自身结构和内在的电生理特性,神经元的结构特征决定了它投射的区域位置,以及下游可能连接某些脑区的特定细胞类型.不仅形态决定神经元的投射以及下游可能存在的连接,神经元的电生理和形态特征的进一步结合可以对神经元类型进行初步分类,判断神经元属于兴奋还是抑制类神经元,并在后期连接中进一步对神经元进行分类,从而有可能进一步考虑兴奋与兴奋的连接概率,兴奋到抑制的概率,抑制到兴奋的概率以及抑制到抑制的连接概率.另外,神经元的结构特征也有助于建立起何种形态的神经元倾向于形成哪些特殊类型的连接.例如L2/3的神经胶质样细胞(Neurogliaform Cell,NGC)更倾向于在胞体周围投射,形成卷曲样的球形结构,这种类型的神经元在连接记录中发现会存在较长的延迟时间[39].这些介观形态和电生理特征都是在多通道膜片钳中可以记录到.
除了可以研究神经元结构和内在电生理特性,多通道膜片钳强大的技术优势是对突触连接以及突触连接功能的进一步研究.虽然皮层中每种神经元都有特定的连接模式,在不同层以及不同类型的细胞中,发现存在一些简单的连接模式和连接规则,基于多通道膜片钳技术发现抑制性神经元可划分为三种连接模式[39]:1)非特异性连接.此类细胞与突触后各类细胞的连接概率接近,几乎没有连接偏好.2)抑制性连接偏好.这类神经元绝大部分投射抑制性神经元,几乎不投射兴奋性神经元.如: 双极细胞(Bipolar Cells,BPC)等,与电镜下双极细胞结果一致[15].3)最后一类主要往兴奋性神经元投射.研究发现,浅层的连接概率高于深层,并且随着蛋白特异性标记的神经元结合多通道膜片钳大规模的记录(见图1),也发现生长抑素(Somatostatin,Sst)和血管活性肠肽(Vasoactive intestinal peptide,Vip)表达的抑制性神经元会产生与自身的连接,并且与小清蛋白(Parvalbumin,Pvalb)神经元一起互相抑制[41],补充了以往突触连接的模式[42-43].另外,还发现不同物种皮层的不同层中存在着细胞类型差异和连接差异.在人类中,随着皮层深度的增加,细胞电生理特征的多样性也随之增加,而在小鼠中未观察到,并且L4层的连接性低于小鼠,这是人类L4层特有的属性[41].不仅如此,还在人皮层中观察到多突触连接.对于不同物种皮层微环路有了进一步的认识.
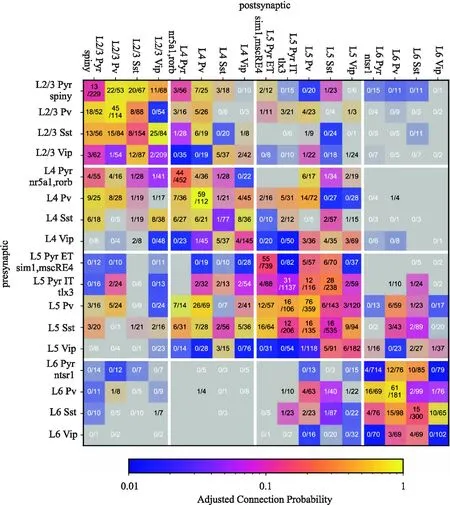
图1 多通道膜片钳揭示皮层连接概率[41]Fig.1 Multiple whole-cell patch-clamp recording reveals cortical connection probability[41]
皮层的突触连接不是一个静态的环路系统,大脑的运行是一个连续且不断变化的过程,皮层环路神经元反应强度会根据活动的变化随时改变,所以需要在静态环路的基础上考虑到突触连接的可塑性,比如皮层中常见的短时程可塑性(Short-Term Plasticity,STP)(见图2).并且在配对记录以及多通道膜片钳的基础上发现,兴奋性动力学由突触后神经元类型决定[44-45],抑制性动力学取决于突触前类型[46-47].人类皮层兴奋性神经元PSP(Postsynaptic Potentials,PSP)较大,且STP刺激后恢复的速度比小鼠快,也就意味着短时间内信息传递的内容可能会更多[41,48-49].
(a)Common motifs (b)Layer 2/3 (c)Layer 5 (d)Short-term plasticity图2 多通道膜片钳揭示皮层连接模式以及突触可塑性[39-41]Fig.2 Multiple whole-cell patch-clamp recording reveals cortical circuit motif and synaptic plasticity[39-41]
所以,多通道膜片钳技术是研究局部神经环路强有力的工具,但仍然受限于技术操作水平的影响.最近也在不断催生自动化多通道膜片钳技术[29].除此之外,由于目前多通道膜片钳技术基本都是在离体脑片中进行的,也会存在着神经元连接在制备脑片时被切断的情况.
3 结构与功能的结合对于神经环路的研究
在海马中发现,突触的长时程增强会诱导树突棘的生长,并记录到突触后电流的增强[50],这表明突触连接强度与超微结构之间存在一定关系,尤其是 PSD 面积和树突棘体积[51-52].后来在皮层中也发现类似现象[53].所以,连接组学的研究不仅仅停留在介观层面或者功能层面,开始进一步转为超微结构和功能同时来研究连接组学.
3.1 钙成像与电镜技术的结合
可用来研究神经环路如何处理信息.利用钙成像指示剂在细胞分辨水平上记录局部区域神经元电活动,可以与行为学结合,研究不同行为下的脑区电活动,从而观察到神经信号在不同类型细胞间的连接架构与组织方式[54-56]、刺激强度与连接密度关系[57]、突触大小分布和多突触连接[58]等.巨大的优势就是在于在动物活体状态下结合行为学进行脑区活动研究,但是局限也非常的明显.对于电信号的灵敏度低,钙离子荧光指示剂GCaMP6能够检测单个动作电位,但不能解析高频率动作电位的发放.钙成像技术用于神经功能的研究尚存在一定的局限性.
3.2 电生理与电镜技术的结合
可研究突触大小和连接强度之间的线性关系,囊泡释放模型等[59].从微观的角度重新考虑,突触在功能连接中所占有的生理权重.发现复杂形态PSD的突触拥有更强的突触峰值电流,并与PSD面积成正相关.通过量子分析提示皮层中可能存在多囊泡释放[59-61],给现有的释放模型[62]提出新的挑战.
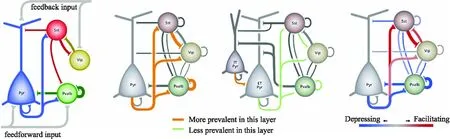
另外,特定类型神经元的下游连接亚细胞结构和突触连接有特定的偏好性[63](见图3),例如表达Pvalb的抑制性神经元更偏向于支配下游的下游兴奋性神经元的胞体[37,64]等.不仅可以测得突触连接精细的结构信息,还可以发现新的连接方式以及新的信号传递方式.发现抑制性神经元Chandelier cell的轴突末端与锥体神经元的轴突始端形成突触连接[65](见图3),并且在多通道膜片钳中发现皮层中Chandelier Cell主要支配调控Chandelier Cell以及锥体神经元这两类细胞[39].另外,也通过这两种技术的结合确定存在一种新的神经递质传递方式:体积传输(Volume transmission)[66],该结构在电镜下发现未形成传统的突触结构,但随着神经递质在组织间隙中释放,可扩散至周围的各类神经元,并且这些神经元在多通道膜片钳下均可被同时记录到抑制信号[39,67]. 膜片钳与电镜技术的结合,及其高分辨率和精细化的研究突触连接功能与结构,为洞察神经元连接方式与计算方式打开了一扇窗.

图3 GABA 能抑制性中间神经元的主要亚型及其突触多样性[63]Fig.3 GABAergic inhibitory interneurons and their synaptic diversity[63]
这些技术的结合,促进我们发现和理解皮层局部微环路的连接架构与功能之间的关系.揭示不同皮层以及不同细胞类型之间连接的功能偏差,更好地理解认知行为的环路连接.不仅如此,神经元之间的连接拥有比想象中更复杂的计算.并且,已经在目前已有的结构与功能的基础上,模拟出皮层的架构与运算规则,构建出了一系列皮层局部环路计算模型[68-70].每一种模型都存在着一定的限制,随着局部神经环路结构与功能进一步的深入研究,模型也将一步优化.
4 结语与展望
在皮层的局部环路研究中,我们可以发现不同细胞类型、不同皮层状态下,神经元之间的连接架构也是有差异的,并且受到各类细胞之间的精细调节以及协调,在不同场景下,突触连接的强度也不断变化着.皮层环路连接的高度复杂需要我们进一步去深入了解.在了解过程中也会发现一些局限,在微观水平上,毫米级的脑区,就会产生海量的数据需要处理与分析,耗费大量人力物力,是微观连接组学进展缓慢的重要原因.并且在多通道膜片钳技术上,技术水平对科研工作者也提出了极高的要求.高通量的电镜成像,以及自动化的数据处理,自动化的多通道膜片钳技术也有望解决上述局限.
不仅仅是从结构到功能,还需要从分子到细胞,不同空间尺度,不同组学的测量,这些对于认识细胞研究大脑的连接组学都非常重要.目前依靠解剖学数据、电生理学、基因表达谱的手段在连接组已经获得了丰硕的成果,可进一步结合转录组数据,对神经元亚类进行进一步细分,为绘制特定神经元类型的连接组提供基础.另外,局部环路的神经架构的研究同样启发着我们对类脑智能的思考,不断地刺激和推动类脑智能的发展.

