大鼠螺旋神经节干细胞体外优化培养方法的研究
朱一丹 吴翠萍 金越凡 殷善开 李春燕
上海交通大学医学院附属第六人民医院耳鼻咽喉头颈外科(上海 200233)
上海交通大学耳鼻咽喉研究所(上海 200233)
螺旋神经元(Spiral Ganglion Neuron,SGN)一旦损伤很难再生。利用SG 干细胞诱导分化为神经元有望为螺旋神经元的修复提供新的方向[1]。然而,SG 干细胞培养仍有一些亟待解决的关键问题。既往研究[2-6]主要采用悬浮培养方法进行SG 干细胞球的培养。但悬浮培养方法存在一定缺陷,如干细胞球内细胞不容易与培养基中营养物质接触,后期会出现细胞凋亡及自噬等损伤;其次,内部细胞无法进行形态上的直观观察。既往研究[7]发现,SG 干细胞与脑来源神经干细胞的形态和生物学特性极其相似。而脑来源的神经干细胞多采用单层贴壁法培养,其优点在于细胞单层贴壁,减少了早期接触抑制,并且与培养基接触完全,便于营养物质的交换,更加有利于形态观察和研究[8]。但SG干细胞的单层贴壁培养方式还鲜有研究报道。因此,本研究利用单层贴壁方式进行大鼠SG干细胞的培养,并首次与传统悬浮培养法进行比较,对比两种方法培养的SG干细胞形态、活性、纯度、增殖能力及分化潜能。
1 材料和方法
1.1 材料
1.1.1 实验动物
新生1 天(Postnatal Day1,P1)的SD(Sprague-Dawley)由上海杰思捷实验动物有限责任公司提供,生产许可证号:20180004055508。
1.1.2 实验试剂
改良Dulbecco 细胞培养液(Dulbecco’s odifiedm Eagle’s medium,DMEM/F12培养液;Invitrogen,美国),无血清培养液添加剂N2 和B27(Invitrogen,美国),表皮生长因子(epidermal growth factor,EGF;PeproTech,英国),碱性成纤维细胞生长因子(basic-fibroblast growth factor,bFGF;PeproTech,英国),胰岛素样生长因子-1(insulin-like growth factor-I,IGF1; PeproTech,英国),脱氧核糖核酸酶I(Deoxyribo、nucleaseI,DNaseI;Worthington,美国),大豆胰蛋白酶抑制剂(oybean trypsin inhibitor;Sigma,美国),青霉素-链霉素溶液(Biosharp,中国),0.25%胰蛋白酶(Invitrogen,美国),胎牛血清(Fetal Bovine Serum,FBS,Invitrogen,美国)Hanks’平衡盐溶液(Hanks’balanced salt solution,HBSS;Solarbio,中国),Dulbecco的磷酸盐缓冲盐水(phosphate buffered saline,DPBS;Solarbio,中国),聚L-赖氨酸(Poly-Llysine,PLL,Sangon biotech,中国),活/死细胞染色试剂盒(Live/Dead Cell Staining Kit; Sciencell,美国),CCK8 试剂盒(CCK-8 Cell Counting Kit; Vazyme,中国),Annexin V-FITC细胞凋亡检测试剂盒(Annexin V-FITC Apoptosis Detection Kit;Beyotime,中国)
1.1.3 免疫细胞化学染色抗体及试剂
鼠抗Nestin 单克隆抗体,克隆rat-401(sigma,MAB353);兔抗SOX2多克隆抗体(abcam,ab97959);鼠抗Ki67 单克隆抗体(abcam,ab279653);兔抗beta III Tubulin 单克隆抗体(abcam,ab52623);山羊抗小鼠IgG H&L (Alexa Fluor® 488) (abcam,ab150113);山羊抗兔IgG H&L (Alexa Fluor® 555)(Thermo Fisher Scientific,A-21429);Fluoroshield ™封固剂(含DAPI)(sigma,F6057)
1.2 实验方法
1.2.1 新生大鼠SG干细胞的分离及培养
新生1d SD 大鼠(P1)经水合氯醛腹腔麻醉、75%乙醇浸泡消毒后,迅速断头处死,取出双侧颞骨置于4℃预冷的HBSS 溶液中;耳蜗完全暴露;剥除未骨化的蜗壳,沿蜗轴分离螺旋韧带、血管纹及基底膜,再将螺旋神经节与蜗轴剥离,取螺旋神经节置于预冷的DPBS 溶液中。用Hanks’液清洗2次,使用0.125%胰蛋白酶37℃消化10min,每5min震荡1 次;用内含10mg/ml 的大豆胰蛋白酶抑制剂和1mg/ml 的DNaseI 的DMEM/F12 培养液重悬细胞终止消化,吸管轻柔吹打,40μm 细胞滤网过滤,获得均匀的单细胞悬液。一部分以2×105cell/ml 的密度接种于悬浮六孔板中进行悬浮培养;另一部分以相同的密度接种于预先经聚L-赖氨酸包被的培养板中进行单层贴壁培养。培养基为无血清培养基,成分为DMEM/F12(1;1)、N2(1:100)、B27(1:100)、EGF(20ng/ml)、bFGF(10ng/ml)、IGF-1(50ng/ml)、青-链霉素(1:100),每3d半量换液一次。
1.2.2 细胞形态学观察
倒置显微镜观察细胞的形态及生长情况。
1.2.3 活/死细胞荧光染色
离心收集悬浮培养的SG干细胞,加入1ml含有1μl活/死细胞染液的PBS(1:1000)。室温静置10分钟。荧光显微镜观察。将单层贴壁培养的细胞的培养基吸去。加入1ml含有1μl 活/死细胞染液的PBS(1:1000)。室温静置10分钟,荧光显微镜观察。
1.2.4 Annexin V/PI双细胞荧光染色
离心收集悬浮培养的SG 干细胞,采用Annexin V-FITC/PI 双标法检测细胞凋亡,具体操作方法参照试剂盒(Beyotime)说明书进行。
1.2.5 SG干细胞免疫细胞荧光染色
将悬浮球状和单层贴壁培养5d 的干细胞解离成单细胞,接种于经聚L-赖氨酸包被处理并置于24 孔板中的圆形玻片上,置于5% CO2培养箱37℃培养4h。4%的多聚甲醛固定20min,0.5% TritonX-100 37℃孵育10min,,5%山羊血清封闭30min。除去封闭液,分别加入一抗anti-Nestin 单克隆抗体(1:200)、anti-Sox2 多克隆抗体(1:200)、anti-Ki67单克隆抗体(1:100),4℃下孵育过夜;PBS 洗涤后加二抗Alex Fluor 488(1:500)、Alex Fluor 555(1:500),室温避光孵育1 h,洗涤后DAPI 染色封片,荧光显微镜下观察拍照。
1.2.6 SG干细胞分化及鉴定
为了分析分化潜能,将悬浮培养5 天的神经球接种在聚L-赖氨酸包被的盖玻片上,次日换用干细胞诱导分化培养基(DMEM/F12、10%胎牛血清、0.1%青霉素-链霉素)诱导其分化,隔天换液,继续培养3d,进行免疫荧光染色观察。在贴壁培养中,SG 干细胞接种培养5 天后更换诱导分化培养基以诱导SG 干细胞分化,隔天换液,继续培养3d,进行免疫荧光染色观察。
1.2.7 生长曲线的测定
SG 干细胞分别以悬浮和单层的培养方式接种于96 孔板中,采取CCK-8 法于1d、3d、5d、7d 分别测定两种培养方式所培养的细胞的生长曲线。
1.2.8 统计学处理
荧光显微镜在一个视野放大200 倍镜头下计数,用GraphPad Prism 8.0 进行统计分析,对所有数据均用±s表示,对差异显著性进行t检验,以P<0.05 为差异显著性指标。
2 结果
2.1 悬浮和单层贴壁培养的SG干细胞的形态学观察
经悬浮培养方式培养1-2 天后的细胞可见“细胞球”,随着培养天数的增加,细胞球体积逐渐增大;绝大部分细胞球为实心细胞球,呈桑葚状,细胞球内所含细胞数量不一,细胞球大小不一,周围可见单个细胞。培养6-7d 时,部分细胞球出现中心颜色加深、透光性变差的现象(图1A)。
以贴壁细胞培养方式培养的细胞,接种后6h,已有部分细胞贴壁并生长,细胞形态多呈椭圆形。随后贴壁细胞迅速增多,多呈梭状,并以簇状分布,周围可见单个细胞,有少部分细胞可见小突起。贴壁细胞单层排列,胞体透明,胞浆匀质,折光性良好(图1B)。
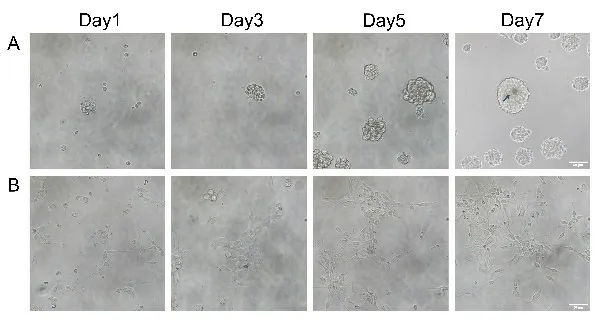
图1 不同培养方式下的SG 干细胞的光学显微镜形态照片。A:体外悬浮培养1、3、5、7 天;B:体外单层贴壁培养1、3、5、7天。7天时,悬浮培养(A)中较大细胞球出现暗色核心(蓝色箭头),可能为细胞死亡现象。Scale bar=50μm。Fig.1 Light micrographs of SG stem cells under different culture methods.A: In vitro suspension culture for 1,3,5,and 7 days; B: In vitro monolayer adherent suspension culture for 1,3,5,and 7 days.On day 7,larger spheroids in suspension culture (A) developed dark cores(blue arrow),likely due to cell death.Scale bar=50μm.
2.2 活/死细胞荧光染色
悬浮培养的神经球,经活/死细胞染色试剂盒荧光染色后可观测到,神经球整体发绿色荧光,表明神经球细胞多为活细胞(图2A)。单层贴壁培养的细胞经活/死细胞染色试剂盒荧光染色后细胞发绿色荧光,表明培养体系中的细胞多为活细胞(图2B)。以上结果表明悬浮和单层贴壁两种不同方式培养的SG干细胞均具备良好的生长状态。

图2 不同培养方式下的SG 干细胞的活/死细胞染色。(A)悬浮培养5天。(B)单层培养5天。绿色:活细胞,红色:死细胞。Scale bar=100μm。Fig.2 Live/dead cell staining of SG stem cells under different culture methods.(A)Suspension culture for 5 days.(B)Monolayer culture for 5 days.Green:live cells Red,death cells.Scale bar=100μm.
2.3 Annexin V/PI双细胞荧光染色
Annexin V/PI双染法是检测细胞凋亡和坏死的一个敏感且特异的方法,早期凋亡细胞即可表现为细胞膜被Annexin V 荧光染色(呈绿色荧光),晚期凋亡细胞膜染色(呈绿色荧光)的同时核DNA 被PI 染色(呈红色荧光),坏死细胞核DNA 被PI 染色(呈红色荧光)。结果显示以两种不同的培养方式培养的细胞群中,凋亡以及死亡的细胞均很少(图3),绝大部分细胞的均为活细胞。

图3 不同培养方式下的SG 干细胞的Annexin V/PI 双染色测定。(A)悬浮培养5 天。(B)单层培养5 天。图中绿色荧光为Annexin V-FITC 染色阳性细胞(Annexin V-FITC+),红色为PI 染色阳性细胞(PI+)。Annexin V-FITC+:凋亡细胞。Annexin V-FITC+/PI+:坏死和晚期凋亡细胞。Annexin VFITC-/PI-:正常细胞。Scale bar=100μm。Fig.3 Annexin V/PI double-staining assay of SG stem cells under different culture methods.(A)Suspension culture for 5 days.(B)Monolayer culture for 5 days.The green fluorescence in the figure is Annexin V-FITC staining-positive cells(Annexin V-FITC+),and the red is PI staining-positive cells(PI + ).Annexin V-FITC + : apoptotic cells.Annexin VFITC+/PI+: necrotic and late apoptotic cells.Annexin VFITC-/PI-:normal cells.Scale bar=100μm
2.4 不同培养方式SG干细胞纯度分析
通过免疫荧光染色,可以进一步分析和比较悬浮培养及单层贴壁培养的细胞的SG 干细胞纯度。Nestin 是一种中间丝蛋白,Sox2 为转录因子家族中的一员,均在神经前体细胞中有大量表达,为神经干细胞的特异性标志蛋白。对经Nestin、Sox2 鉴定为双阳性细胞进行细胞纯度计算,结果显示以悬浮方式培养的细胞群体中SG 干细胞的纯度为(78.43±7.86)%,以单层贴壁方式培养的细胞群体中SG干细胞的纯度为(74.42±10.57)%,SG干细胞纯度差异无统计学意义(t=0.557;P=0.595,n=4)(图3)。提示两种培养方式均可培养出大量保持干细胞生物学特性、具有自我更新能力的SG干细胞。
2.5 不同培养方式SG干细胞增殖活性分析
Ki67是一种细胞增殖状态的标志蛋白,主要表达于细胞增殖的的各个时期,但在静息的细胞中不表达。我们用Ki67 和Sox2 对细胞进行双重荧光标记,其中Ki67和Sox2双标阳性的细胞为具有增殖特性和自我更新能力的SG 干细胞,这也进一步表明了SG 干细胞的增殖活性。免疫荧光测定结果显示,悬浮培养中约有细胞群体中Ki67、Sox2 双阳性的细胞占(9.99±1.03)%,以单层贴壁方式培养的细胞群体中Ki67、Sox2 双阳性阳性的细胞占(15.64±0.55)%,Ki67、Sox2 双阳性的干细胞所占比例差异有统计学意义(t=11.84;P<0.0001,n=7)(图4)。结果表明以这两种不同的培养方式培养SGN细胞均可在相应的培养体系中增殖,但贴壁方式培养的细胞中Sox2、Ki67双阳性的干细胞所占的比例较悬浮培养高,提示贴壁培养的干细胞的增殖活性较悬浮培养的干细胞强。
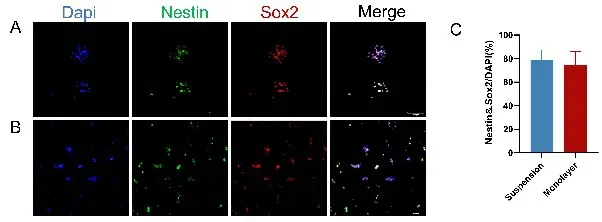
图4 不同培养方式下的SG 干细胞纯度对比。悬浮培养(A)和单层培养(B)第5天时,使用Nestin(绿色)和Sox2(红色)特异性抗体对SG干细胞进行免疫荧光标记。C:Nestin/Sox2双阳性细胞的定量化计算(n=4)。Scale bar=100μm。Fig.4 Purity comparison of SG stem cells under different culture methods.Suspension cultured (A) and Monolayer cultured (B) SG stem cells were subjected to immunofluorescence labeling using antibodies specific for Nestin(green)and Sox2 (red) at day5.Quantification of anti-Nestin and anti-Sox2 double-positive double-positive cells(n=4)(C).Scale bar=200μm.
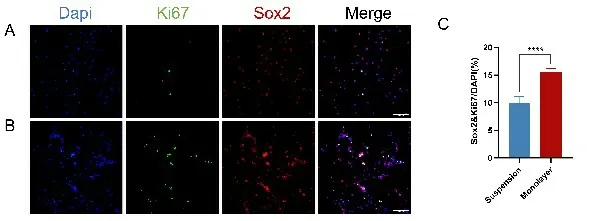
图5 不同培养方式下的SG 干细胞增殖活性对比。悬浮培养(A)和单层培养(B)第5 天时,使用Sox2(红色)和Ki67(绿色)特异性抗体对SG 干细胞进行免疫荧光标记。C:Ki67/Sox2 双阳性细胞的定量化计算。进行t 检验以计算显着性差异(n=7,****P<0.0001)。Scale bar=100μm。Fig.5 Comparison of the proliferation activity of SG stem cells under different culture methods.Suspension cultured (A)and Monolayer cultured (B) SG stem cells were subjected to immunofluorescence labeling using antibodies specific for Sox2 (red) and Ki67 (green) at day5.Quantification of anti-Ki67 and anti-Sox2 double-positive double-positive cells (C).The t-tests were performed to calculate significance (n=7,****P<0.0001).Scale bar=100 μm.
2.6 不同培养方式SG干细胞的诱导分化能力鉴定
将两种培养方式获取的SG 干细胞经FBS 诱导分化后,均可观察到类似SGN 形态的神经元样细胞,大多数神经元样细胞呈现类似双极神经元形态,细胞胞体呈梭形,双极伸出较长突起,长的达胞体的数倍,细胞状态良好。神经元特异性管蛋白Ⅲ型(Neuronic-specific tubulin Ⅲ,Tuj1)是SGN 的特异性标志物之一。为了在形态学上鉴定SGN,应用Tuj1标记SGN进行免疫细胞荧光染色,结果显示两种培养方式经诱导后均可观察到全细胞着色呈红色荧光的SGN样细胞,椭圆形胞体和神经突起十分清晰,表明具有神经元的特征。根据免疫荧光结果定量分析了SG干细胞向神经元方向的分化效率,即Tuj1阳性细胞占DAPI细胞的百分比。悬浮培养获取的SG 干细胞向神经元方向的分化效率(3.94±1.18)%,贴壁培养获取的SG 干细胞向神经元方向的分化效率为(4.70±0.94)%,其差异无统计学差异(t=1.008;P=0.352,n=4)(图6)。提示两种培养方式来源的SG 干细胞经过诱导分化后均可以形成螺旋神经元样细胞,且其分化效率无统计学差异。
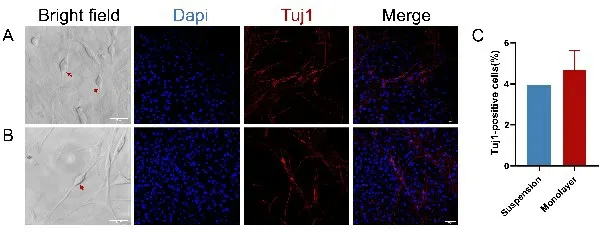
图6 不同培养方式获取的SG 干细胞的分化鉴定。悬浮培养(A)和单层培养(B)获取的SG 干细胞应用FBS 诱导分化3d后,使用Tuj1(红色)特异性抗体对分化的神经元细胞进行免疫荧光标记。明场图像中的红色箭头表示具有双极形态的神经元样细胞,两个神经突起生长在神经元胞体的两极。C:Tuj1阳性细胞的定量化计算(n=4)。Scale bar=20μm。Fig.6 Differentiation identification of SG stem cells obtained by different culture methods.After SG stem cells obtained from suspension culture (A) and monolayer culture (B) were induced to differentiate by FBS for 3 days,the differentiated neuronal cells were subjected to immunofluorescence labeling using antibodies specific for Tuj1 (red).The red arrows in the bright field image indicate neuron-like cells with bipolar morphology,with two neurites growing at the two poles of the neuron cell body.C:Quantitative calculation of anti-Tuj1 positive cells(n=4).Scale bar=20μm.
2.7 生长曲线的测定
SG 干细胞在悬浮和单层的培养方式下均呈增殖趋势。自第3 天后,单层贴壁培养的细胞数量每天都略高于悬浮培养的细胞数量(图7),第3 天时悬浮培养细胞活性高于贴壁培养,其差异有统计学意义(t=7.97;P<0.01,n=3),提示单层贴壁培养的细胞的增殖能力较悬浮培养的细胞强。两种方式培养的干细胞增殖均在第5 天时达到巅峰,随后细胞活性下降。悬浮培养细胞活性下降的速率较单层贴壁培养的细胞快,且悬浮培养细胞活性小于单层贴壁培养的细胞(培养第7 天),其差异有统计学意义(t=11.13;P<0.001,n=3)。
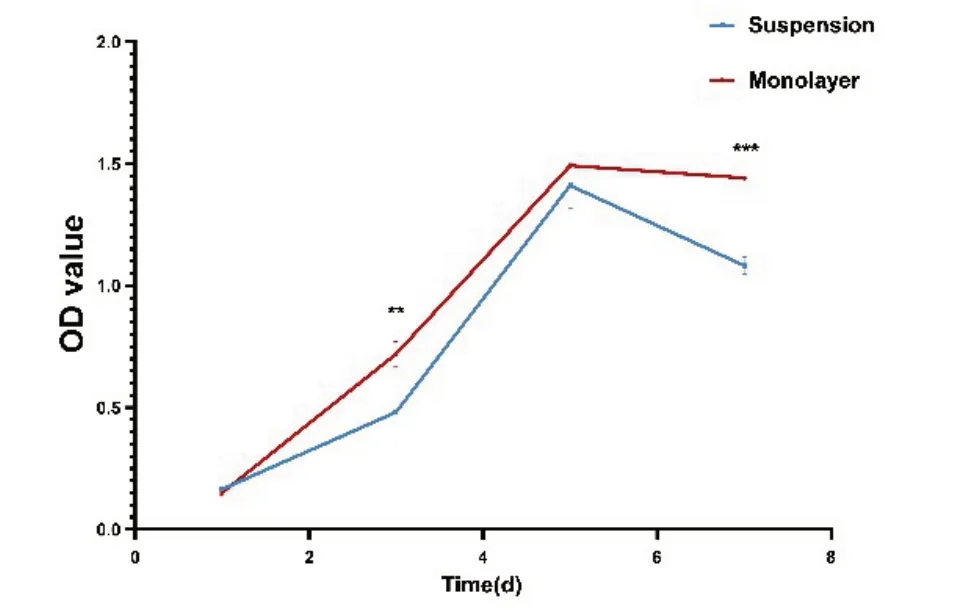
图7 不同培养方式下的SG 干细胞生长曲线。进行t 检验以计算显着性差异(**P<0.01,***P<0.001,n=3)。Fig.7 Growth curves of SG stem cells under different culture methods.The t-tests were performed to calculate significance(**P<0.01,***P<0.001,n=3).
3 讨论
SGN 再生是耳科学研究的热点。利用干细胞诱导分化为SGN 是解决这一科学难题的重要研究方向[9-13]。2007年Oshima[14,15]分离了来自新生哺乳动物螺旋神经节部位的干细胞。目前已有研究证实[16-18],SG 干细胞具有自我更新能力,可分化为类似于神经元和神经胶质的细胞。与其他来源的干细胞如间充质干细胞相比,SG 干细胞理论上分化为螺旋神经元的效率会更高,更容易分化为功能性的SGN 细胞。因此,利用SG 干细胞诱导分化为神经元能为SGN损伤后的修复提供高效手段。然而,SG 干细胞数量少,获取困难,因此,进行稳定高效的体外培养使其获得稳定增殖能力尤为重要。
既往研究多使用传统悬浮培养法来培养小鼠的SG干细胞,SD大鼠的SG干细胞单层贴壁培养方式还鲜有研究报道。本研究尝试用单层贴壁方式进行SD 大鼠SG 干细胞的培养,并首次与悬浮培养法进行了对比。研究结果证实单层贴壁方式培养同样可获得大量具有干细胞特异性的SG 干细胞,且获得的SG 干细胞纯度与传统悬浮培养方式相比无统计学差异。本研究悬浮方式获取的SG 干细胞纯度与既往文献悬浮方式培养的小鼠SG 干细胞纯度[4]相似。
活、死荧光染色和Annexin V/PI 双染检测结果显示两种培养方式培获得的SG 干细胞的生长状态均良好,其中凋亡细胞和死细胞很少。诱导分化实验结果证实,两种培养方式培获得的SG 干细胞均可诱导分化为SGN样神经元细胞。
免疫荧光与生长曲线实验证实,单层贴壁培养法获得的SG 干细胞增殖活性较悬浮培养的干细胞强。这种差异的存在可能归结于以下两个原因。一.相比悬浮培养方式,SG 干细胞的单层贴壁可以显著增加细胞与培养液的接触面积,从而更有利于其充分获取细胞因子刺激和营养成分滋养,因此增殖更快。二.贴壁培养更有利于SG 干细胞的快速稳定增殖可能与贴壁培养方式中使用聚L-赖氨酸(Poly-L-lysine,PLL)作为粘附基质有关。PLL是一种细胞外基质蛋白,可通过其上的正电荷与细胞膜的负电荷相互结合以促进细胞粘附与存活,在细胞培养中广泛被用于包被物促进细胞贴壁,也是细胞增殖的合适基质。既往研究表明,PLL 可能同干细胞表面一些与细胞外基质相互作用的受体分子如整合素家族成员相结合,从而影响干细胞存活、迁移、增殖、分化等行为。例如Park 等[19]报道称PLL 可以促进人类造血干细胞的离体扩增。也有报道[20]称PLL 可以促进神经干细胞功能。近年来也有研究表明[21],PLL 能够为间充质干细胞的细胞培养提供良好的微环境,显著促进间充质干细胞的增殖,并引起干性标记物基因表达的一致上调。此外,PLL 还可以增强细胞对培养基质的吸附,从而可能进一步提升干细胞的活力。
此外,悬浮方式培养的细胞进行免疫荧光等操作时,需要对细胞进行消化破球,不可避免地会损失一部分细胞,这可能是免疫荧光实验中悬浮培养细胞密度低于贴壁培养细胞密度的原因。而SG 干细胞的贴壁培养可以有利避免消化破球时的细胞损伤,有益于对SG 干细胞进行稳定准确的定量研究,从而提供更精准科学的数据。
综上所述,本研究创新性探索了SG 干细胞的单层贴壁培养方式,通过与传统悬浮培养方式进行对比发现单层贴壁培养的SG 干细胞的增殖活性较悬浮培养的干细胞更强,更有利于细胞的形态观察及定量。本研究提供了SG 干细胞培养的优越方式,不仅为进一步开展SG 干细胞的研究奠定了实验基础,也为该领域SG 干细胞的优化培养提供了方法学上的参考。

