彩色马铃薯StANS1a基因的克隆及表达分析
聂利珍,张志成,谢 锐,常 悦,张琼琳,韩平安,羿 静
(1.内蒙古自治区农牧业科学院,内蒙古 呼和浩特 010031; 2.内蒙古自治区植物蛋白质组学重点实验室,内蒙古 呼和浩特 010031;3.乌兰察布市农林科学研究所,内蒙古 集宁 012000)
花色苷是一种常见的水溶性植物色素,其结构为花青素与糖类以糖苷键结合,存在于植物各器官的细胞液中,赋予其红、紫或蓝等五彩缤纷的颜色。花色苷是植物次生代谢过程中产生的黄酮类物质,在花色苷合成途径中,花色苷合成酶(Anthocyanidin synthase,ANS)位于花色苷生物合成途径下游,催化无色花色苷转化成有色的花色苷,在植物着色过程中起重要作用[1]。Menssen等[2]在1990年首先从玉米突变体中利用转座子标签法分离得到ZmANS基因,之后陆续在紫苏(Perillafrutescens)[3]、可可(Theobromacacao)[4]、草莓(Fragaria×ananassa)[5]等植物中分离出来ANS基因。进一步的研究表明,将郁金香(Tulipagesneriana)、丹参(Salviamiltiorrhiza)、茶叶(Camelliasinensis)、东方百合(Orientallily)、紫萼玉簪(Hostaventricosa)等植物的ANS基因进行超量表达,都能促进转基因植株的花色苷积累[6-10]。
马铃薯(Solanumtuberosum)是全球第四大重要粮食作物,其营养丰富,除了具有基本的食用价值,还具有特殊的保健功效。马铃薯薯肉主要为白色和黄色,还具有紫、红、黑等颜色的薯肉,这种具有彩色薯肉的马铃薯叫彩色马铃薯[11]。它除了含有马铃薯的营养成分之外,还含有丰富的花色苷[12]。近年来,马铃薯中参与花色苷生物合成的相关基因研究也取得了一定的进展[13]。研究人员在马铃薯中过表达了3GT基因,结果显示,转基因马铃薯块茎中的花色苷含量和块茎颜色显著提高[14]。已有的研究表明,StANS基因在彩色马铃薯中的转录表达明显高于黄色马铃薯,在马铃薯中过表达StANS基因可以提高转基因马铃薯块茎中花色苷的积累[15]。
尽管在许多植物中已克隆了ANS基因并进行相关的研究,但彩色马铃薯中该基因的研究还鲜见报道。本研究根据彩色马铃薯薯肉的特性,克隆其ANS基因的cDNA序列,通过生物信息学分析其同源性及进化特性,并将其过表达到拟南芥中进行功能验证,揭示ANS基因在转基因拟南芥中的表达与花色苷积累的关系,以期为了解彩色马铃薯花色苷合成途径中关键基因的功能奠定试验基础,同时也为彩色马铃薯的分子育种提供技术指导。
1 材料和方法
1.1 试验材料
彩色马铃薯品种红美块茎作为基因克隆的试验材料;野生型拟南芥Columbia 生态型(Col-0)种子作为转基因受体材料。
1.2 设计基因的特异引物
根据GenBank数据库中报道马铃薯StANS基因(NM_001287930)的cDNA序列,通过Primer 5设计基因的特异引物如下:
ANS-F:5′-TGGTGAGTGAAGTGGTTCCAA-3′;ANS-R :5′-ACAGGAACATGTTTGAGGACT-3′。ANS-ORF-F:5′-CACGGGGGACGAGCTCGGTACCATGGTGAGTGAAGTGGTTCCAATTC-3′;ANS-ORF-R:5′-ACCATGGTGTCGACTCTAGATTTAGATTCTTTAGCAGGAACATCCTTGA-3′。
1.3 彩色马铃薯块茎总RNA提取及逆转录
选用块茎的薯皮和薯肉作为试验材料,提取其总RNA,具体详细的提取方法见参考文献[11]和[16]的试验方法。吸取1 μL 总RNA样品作为反转录模板,按照反转录试剂盒(宝生物)的操作步骤进行反转录合成cDNA,获得块茎的cDNA样品,以此cDNA进行PCR扩增。
1.4 彩色马铃薯花色苷合成酶基因PCR扩增
以反转录合成的cDNA为模板,利用ANS-F/R作为特异引物进行PCR扩增,扩增程序为:95 ℃ 5 min;95 ℃ 10 s,56 ℃ 10 s,72 ℃ 1 min,40个循环;72 ℃ 10 min。电泳检测结果,利用纯化回收试剂盒回收PCR产物。
1.5 ANS基因的连接及测序
将纯化回收的PCR产物与克隆载体(T载体)进行连接,然后将连接产物转化大肠杆菌Trans1-T1。过夜培养后挑取单菌落进行菌落PCR验证,验证正确后选取阳性菌液测序。
用上述质粒作为模板,ANS-ORF-F/R作为引物进行PCR扩增,扩增程序同上,纯化回收PCR产物,连接T载体,转化农杆菌,获得T-ANS质粒。
1.6 ANS基因的生物信息学分析
利用BlastN对ANS基因序列进行比对分析;根据GenBank数据库中获得的马铃薯StANS(NM_001287930)和其他植物基因序列,利用DNAMAN 10软件对克隆基因进行氨基酸序列及多序列相似性比对;利用ExPASy Prot Param tool软件在线预测克隆基因的理化特性;根据MEGA 7.0.26软件对多种物种来源的ANS序列构建系统进化树[11]。
1.7 植物表达载体的构建
用KpnⅠ和XbaⅠ双酶切植物表达载体pCAM35S-GFP和T-ANS载体,分别回收大片段和目的片段;然后利用T4DNA连接酶(NEB,美国)连接,连接产物通过冻融法转化大肠杆菌感受态细胞,37 ℃过夜培养后,挑取单菌落进行菌落PCR鉴定,鉴定正确即完成了植物表达载体的构建。采用冻融法将StANS1a基因导入农杆菌GV3101,通过菌落PCR鉴定阳性菌落,验证正确后挑选阳性菌落摇菌,菌液-20 ℃保存备用,用于侵染拟南芥。
1.8 转基因拟南芥的获得
在EP管中装入拟南芥种子,用70%的乙醇消毒2~3 min,再用10%次氯酸钠消毒10 min,用无菌水洗4~5次,点种在1/2 MS培养基上,4 ℃黑暗条件下春化3 d,然后置于16 h光照/8 h黑暗光周期、40~60 μmol/(m2·s)、18 ℃、湿度为70%条件下培养。10 d后,选择生长健壮的幼苗移栽到培养土中。当幼苗生长14 d左右抽薹时进行转化,转化前将已经开放的花和种子剪除干净。将冷冻保存的农杆菌菌液活化培养后,重悬于渗透缓冲液中,调节菌液浓度OD600=0.4~0.6,将拟南芥花器浸入农杆菌悬浮液30 s,继续生长约30 d收获种子。通过含有潮霉素的培养基筛选转基因植株和纯合植株。
1.9 花色苷含量测定
根据Laby等[17]的方法进行花色苷含量的测定。每个样品都选用14 d左右的转基因和非转基因拟南芥植株3棵,称质量后加入99∶1甲醇∶HCl(V/V)提取液,混合均匀,4 ℃提取16 h,其间每隔5~6 h颠倒混匀1次。处理结束后,4 ℃条件下,12 000 r/min 离心10 min,吸取上清液至新的离心管。花色苷采用分光光度计进行检测,每个样品分别读取530,657 nm下的吸光值进行测量,每个样品3 次生物学重复。使用以下公式确定相对花色苷水平:花色苷的相对单位/新鲜组织的质量=(OD530-(0.25×OD657))×提取体积(mL)×1/组织样品的质量(g)。
1.10 RT-PCR检测
分别提取转基因拟南芥和非转基因拟南芥植株的总RNA,按照反转录试剂盒(宝生物)操作步骤进行反转录合成cDNA作为模板,进行转基因植株的RT-PCR检测。PCR扩增的引物分别为:扩增StANS1a基因的特异引物为StANS1a-RT-F-5′-ATGGTGAGTGAAGTGGTTCCA-3′和StANS1a-RT-R-5′-AAGTCTTCCATGCCTCCAAC-3′,扩增片段跨StANS1a基因内含子,扩增cDNA片段长度为659 bp。拟南芥内参基因引物为Atactin-F-5′-CGGAAAACAAGGTGAGCCGA-3′和Atactin-R-5′-GATTTGAGTCATCTTCTCACG-3′,扩增cDNA片段长度为555 bp。
2 结果与分析
2.1 彩色马铃薯ANS基因的RT-PCR 扩增
以反转录获得的彩色马铃薯cDNA为模板,利用ANS-F/R作为引物,扩增获得长度约1 500 bp 的特异性条带(图1-A)。PCR产物回收纯化后连接转化大肠杆菌,对挑取的单克隆进行菌液PCR验证,其结果见图1-B。将PCR 验证为阳性的菌液送公司测序,结果显示,所得cDNA片段长度为1 406 bp(图2-A),通过比对分析其包含一个1 368 bp完整的开放阅读框,编码 455个氨基酸残基 (图2-B)。
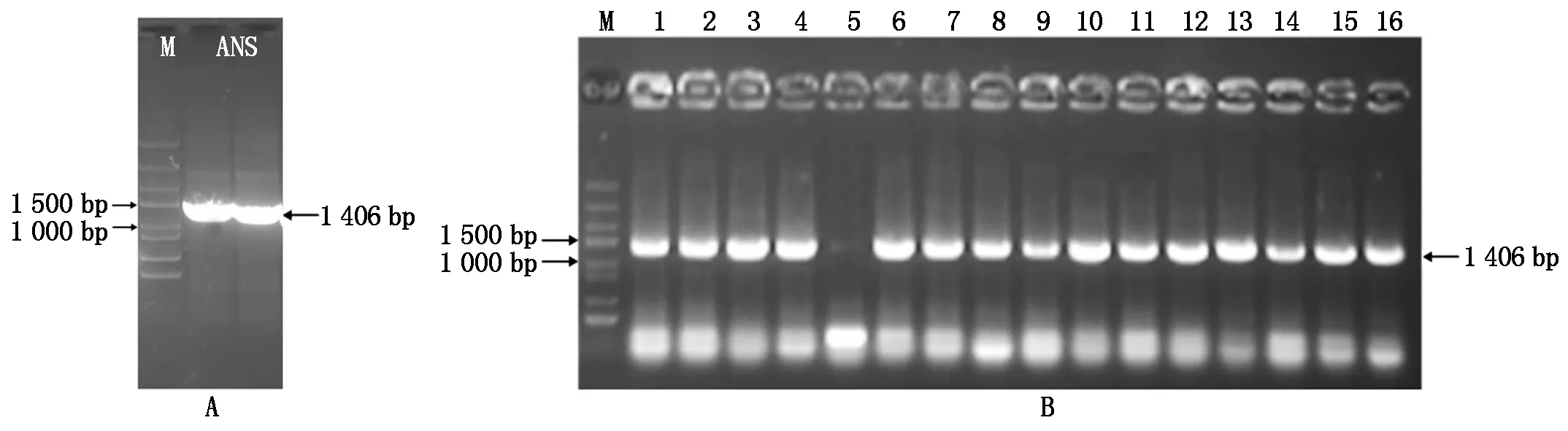
M.DNA Marker DL3000; A.StANS1a基因克隆; B.PCR验证阳性菌落; 1—16.随机菌落。

A.StANS1a基因cDNA序列;B.StANS1a氨基酸序列;4~228.多肽链N端。
Blast比对后发现,该序列与马铃薯StANS(NM_001287930)基因序列相似度达到84.60%(图3-A),而开放阅读框相似度为97.59%,氨基酸相似度为95.82%(图3-B),通过对其氨基酸序列编码蛋白质结构域比对,发现碱基改变未引起蛋白质结构域改变,并且具有保守的结构域DIOX_N和2OG_FeⅡ_Oxy,分别位于氨基酸序列的第52~166位和第215~312位(图2-B)。表明克隆得到的序列为马铃薯StANS基因序列,命名为StANS1a(GenBank:ON512347)。
2.2 StANS1a理化性质分析
利用ExPASy ProtParam tool 软件分析StANS1a氨基酸的理化性质,结果显示,StANS1a 蛋白质是由455 个氨基酸残基组成的,分子式为C2292H3633N607O696S13,原子总数为7 241个,分子质量约为51.25 ku,其中带正、负电荷的氨基酸残基分别有63,81 个,理论等电点(pI)是5.32,不稳定系数44.45,平均亲水系数-0.496,表明StANS1a蛋白属于亲水性的不稳定蛋白质(图4)。
2.3 StANS1a蛋白质的相似性比对分析
根据 NCBI数据库中其他植物ANS的氨基酸序列,利用DNAMAN 10软件分析以下几种植物的ANS氨基酸序列的相似性,如马铃薯StANS (Solanumtuberosum,NM_001287930)、番茄SlANS(Solanumlycopersicum,NP_001361323.1)、茄子SmANS(Solanummelongena,ACJ02088.1)、辣椒CaANS(Capsicumannuum,PHT92526.1)、烟草NtANS(Nicotianatabacum,AWL24853.1)、拟南芥AtANS(Arabidopsisthaliana,NP_001031700.1)、苹果MdCHS(Malusdomestica,RXI03704.1)、大豆GmANS3(Glycinemax,NP_001240884.1)、黑果枸杞(Lyciumruthenicum,QFR04941.1)、澳洲棉(Gossypiumaustrale,KAA3469013.1)、葡萄(Vitisvinifera,ABV82967.1)、胡桃(Juglansregia,XP_018847204.1)、可可(Theobromacacao,XP_007040068.2)、榴莲(Duriozibethinus,XP_022736758.1)、阿月浑子(Pistaciavera,XP_031284664.1)、覆盆子(Rubusidaeus,AXY97021.1)。由图5可知,StANS1a基因在氨基酸水平与StANS和番茄SlANS相似性达到98%,而与茄子SmANS、辣椒CaANS、烟草NtANS、拟南芥AtANS、苹果MdANS和大豆GmANS3等氨基酸序列的相似性也都超过了80%,它们在氨基酸水平具有很高的相似性,揭示了在植物中ANS基因的氨基酸序列具有极强的保守性,也可能说明了不同植物ANS蛋白质功能具有较高的相似性。
图5 StANS1a与其他植物ANS氨基酸序列相似性的比对分析
2.4 构建StANS1a蛋白质的系统进化树
根据NCBI数据库比对分析,选用与StANS1a氨基酸序列同源性较高的其他植物ANS的氨基酸序列,分别为马铃薯(NM_001287930)、番茄(NP_001361323.1)、茄子(ACJ02088.1)、辣椒(PHT92526.1)、烟草(AWL24853.1)、黑果枸杞(QFR04941.1)、澳洲棉(KAA3469013.1)、葡萄(ABV82967.1)、胡桃(XP_018847204.1)、可可(XP_007040068.2)、榴莲(XP_022736758.1)、苹果(RXI03704.1)、阿月浑子(XP_031284664.1)、覆盆子(AXY97021.1)和拟南芥(NP_001031700.1)。利用MEGA 7软件构建系统进化树,由图6可知,在初级聚类中,首先聚合成2大分支,其中StANS1a与同为茄科的马铃薯、番茄、茄子聚在同一个分支,其亲缘关系较近;其他的聚为另一个分支,亲缘关系较远,进化树的构建也反映了一些物种亲缘关系的远近。
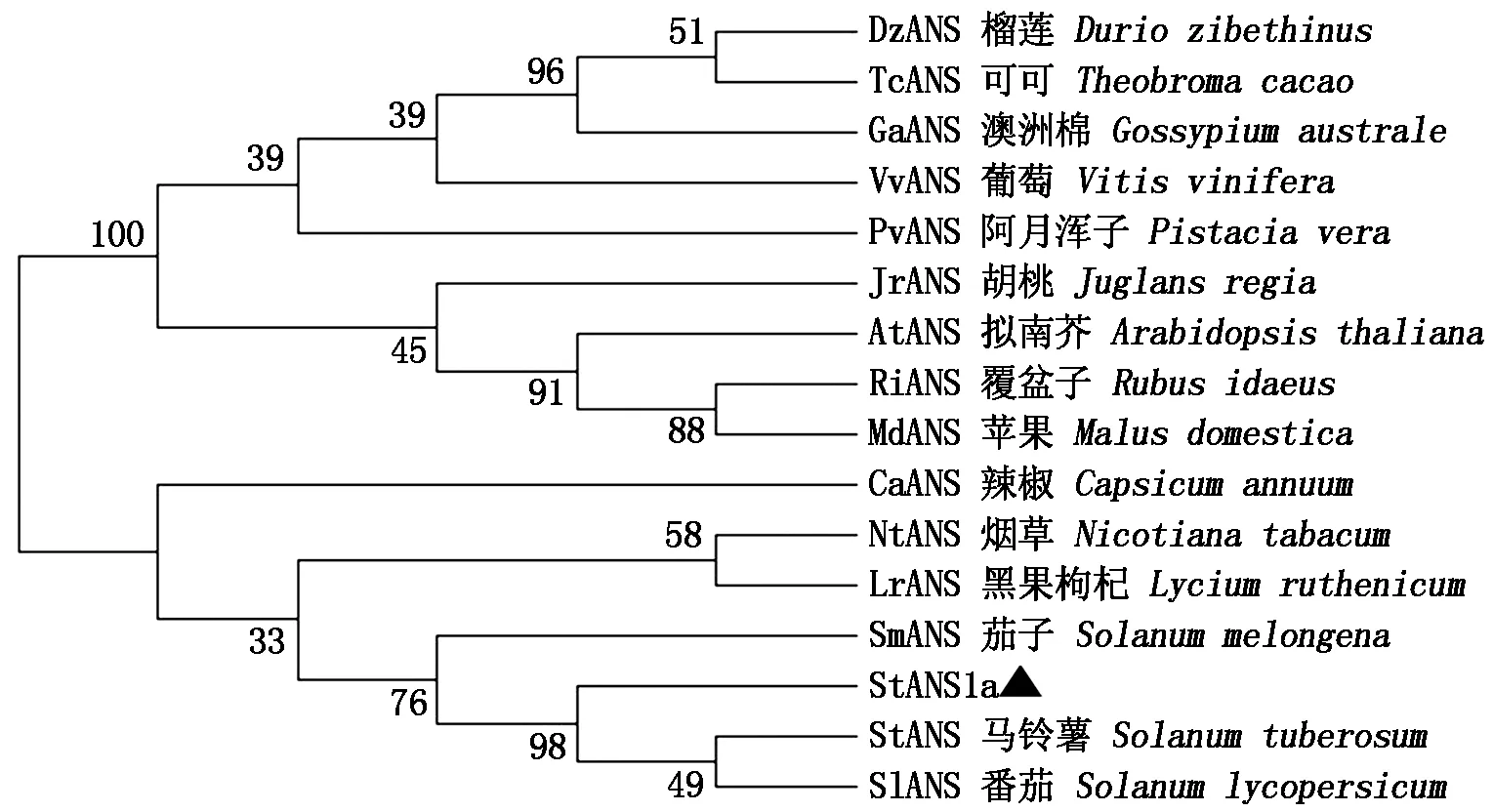
各节点处数字表示bootstrap 值(重复1 000 次)。
2.5 植物表达载体的构建
用KpnⅠ和XbaⅠ双酶切植物表达载体pCAM35S-GFP(图7-A)和克隆载体T-StANS1a,分别回收大片段和小片段,将所得大片段与酶切所得的StANS1a基因的cDNA小片段用同源重组连接酶重组连接,转化至Trans1-T1感受态细胞,挑取阳性菌落进行菌落PCR验证,载体测序验证,构建好的植物表达载体见图7-B,最后将构建好的植物表达载体转入农杆菌中,菌落PCR验证阳性菌落(图7-C),证实彩色马铃薯StANS1a基因已转入农杆菌中。
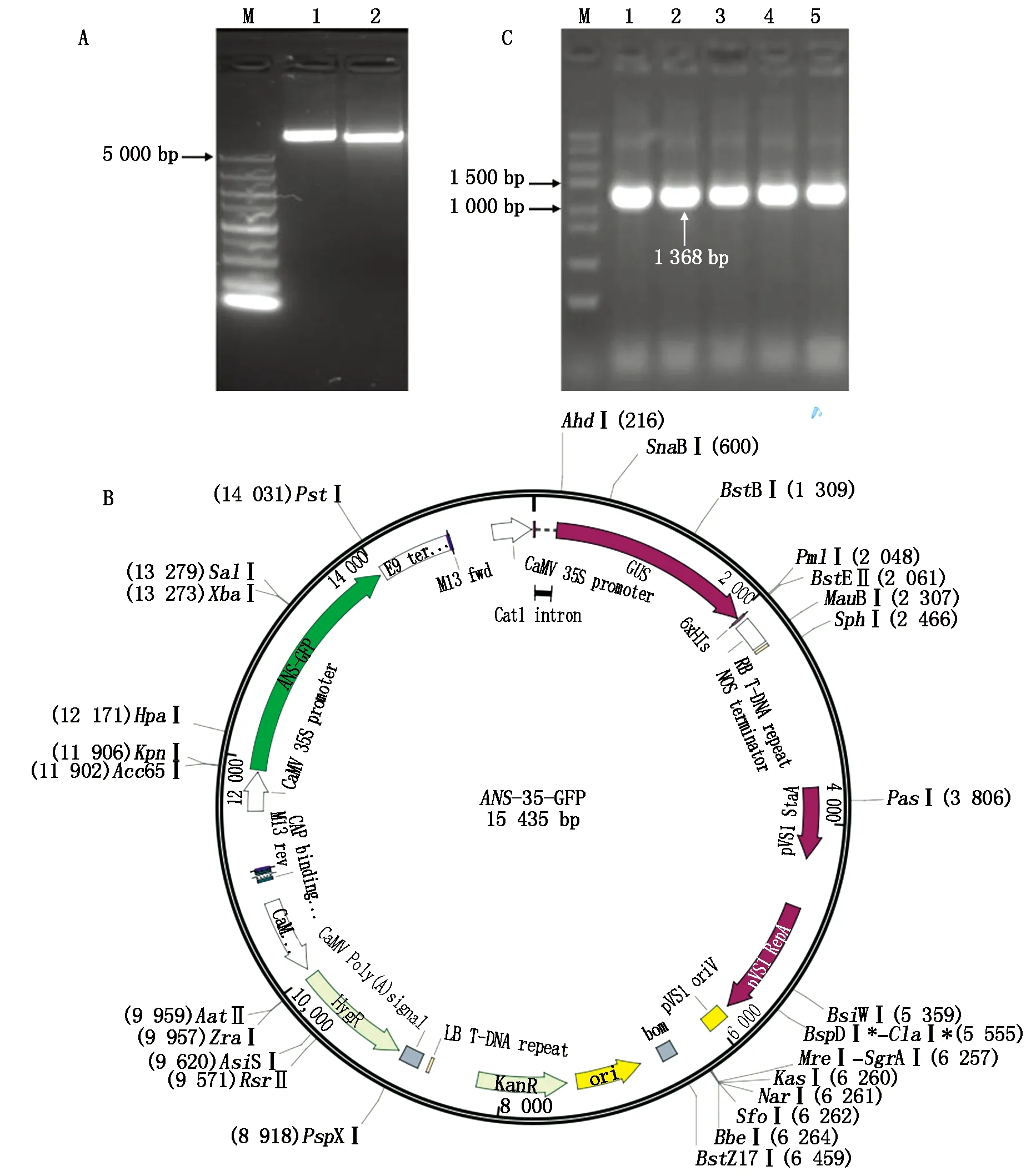
A.酶切pCAM35S-GFP和T-StANS1a载体;B.构建的植物表达载体图谱;C.菌落PCR验证StANS1a;1—5.随机单菌落。
2.6 StANS1a基因转化拟南芥
将含有StANS1a基因的植物表达载体通过农杆菌介导法转入拟南芥中,将收获的种子种植于含有潮霉素的培养基中,利用转基因种子带有抗性基因,在含有潮霉素的培养基中仍然能正常生长,而非转基因种子不能生长而死亡,来筛选转基因植株。通过筛选获得了转基因拟南芥T3纯合种子。
2.7 转基因植株中StANS1a的相对定量分析
为了验证转基因拟南芥植株中StANS1a基因的转录水平,随机挑选7个转基因植株,利用StANS1a的特异引物StANS1a-RT-F/R,以拟南芥的Atactin基因作为内参基因,通过RT-PCR检测StANS1a在转基因拟南芥中的表达。由图8可知,7株转基因植株中都有StANS1a基因的表达,只是表达量稍有不同。
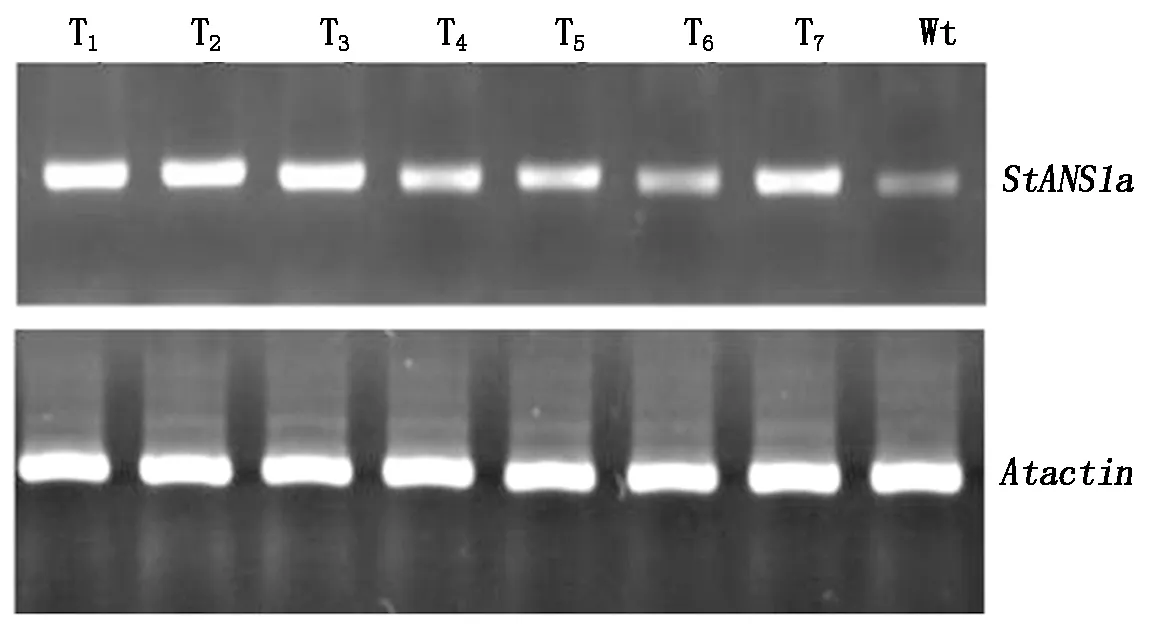
图8 转基因株系RT-PCR分析
2.8 转基因拟南芥中花色苷含量的测定
为了验证StANS1a基因参与花色苷的积累,本研究测定了不同转基因拟南芥株系中花色苷的含量,由图9可知,部分转基因株系内花色苷含量与非转基因拟南芥相比有显著差异(P<0.05),最高T2比非转基因拟南芥高54.61%;其次为T3,比非转基因拟南芥高51.63%;T4比非转基因拟南芥高40.24%;T7比非转基因拟南芥高36.39%;T1比非转基因拟南芥高28.76%;最低为T5,比非转基因拟南芥略高2.17%。

不同的字母代表转基因拟南芥与Wt 的差异达显著水平(P<0.05)。
3 结论与讨论
花色苷是植物黄酮类化合物中最大的一类,在许多植物中主要呈现红色和蓝色[18]。花色苷在合成过程中需要多种酶的参与,如ANS、DFR、F3′5′H和3GT等[14,19-20]。其中ANS 是花色苷生物合成途径末端的关键酶,对植物的成色起着关键作用,是其生物合成途径中重要的结构基因[21]。本研究从彩色马铃薯块茎中克隆到1个包含1 368 bp的完整开放阅读框,编码 455个氨基酸残基的花色苷合成酶基因的cDNA序列。分析比对后发现,该序列部分碱基发生改变,但与StANS序列相比蛋白质结构域未发生变化,具有ANS保守的结构域DIOX_N和2OG_FeⅡ_Oxy,这些 ANS 的保守结构域与其他植物是一致的[22]。进化分析表明,StANS1a与同为茄科的马铃薯、番茄和茄子处在同一分支,亲缘关系最近,与苹果和拟南芥等亲缘关系较远,这与植物学传统分类一致。本研究构建了StANS1a过表达载体转化拟南芥,转基因株系中StANS1a基因的转录水平较非转基因植株有了明显提高,这与杨成龙等[9]将东方百合ANS转入拟南芥,转基因株系ANS基因的表达量显著上升的结果是一致的。转基因植株花色苷含量比非转基因植株中高2.17%~54.61%,这些结果证实StANS1a基因具有花色苷合成酶的功能,且促进了转基因拟南芥中花色苷含量的积累,这与ANS基因在草莓和苹果中的结果是一致的[5,23]。
对转基因植株进行表型观察,转基因拟南芥在幼苗期未出现明显的表型变化,推测可能有两方面的原因,一是转基因株系中StANS1a在苗期表达量低,形成的花色苷含量也低,不足以在表型上体现出来;二是在拟南芥颜色形成的过程中,StANS1a基因可能并不是拟南芥成色的主效基因,只是催化无色花色苷变成有色花色苷,具体的原因还有待于进一步的深入研究。本研究也证实了过表达单一的StANS1a基因并不能引起拟南芥幼苗植株颜色的变化,只能改变拟南芥幼苗体内花色苷的积累量,说明ANS基因在植物花色苷形成过程中起了关键作用。综上所述,彩色马铃薯StANS1a基因在花色苷代谢途径中起着重要作用,为后续利用该基因对马铃薯的分子改良提供了基因资源。

