氯虫苯甲酰胺亚致死剂量对蜂巢小甲虫生长发育和繁殖的影响
韩文素,李 健,高景林*,李 翔,钟义海,王释婕,赵 珊
(1. 中国热带农业科学院环境与植物保护研究所,海口 571101;2. 华中农业大学动物科学技术学院,武汉 430070;3. 中国热带农业科学院蜂业技术研究中心,海口 571101)
蜂巢小甲虫AethinatumidaMurray属鞘翅目Coleoptera露尾甲科Nitidulidae,是一种完全变态寄生在蜂群内的杂食性害虫,是侵害蜜蜂的六大重要病原体之一(World Organisation For Animal Health, 2019),也是侵染我国蜜蜂的重要检疫性害虫(中华人民共和国进境动物检疫疫病名录,2020)。该虫原分布于非洲南部撒哈拉沙漠以南地区,在当地危害性极小(Neumannetal., 2004)。1998年首次在美国的佛罗里达洲发现该虫危害蜂群,并造成了300多万美元的经济损失(Ellisetal., 2002)。到2003年,该虫遍及美国的30多个洲,引起了大量的蜂群飞逃和死亡(Hood, 2004; Kangaetal., 2021)。当前,蜂巢小甲虫已扩散到除南极洲之外的所有大陆(Neumannetal., 2016),在我国的广东(赵红霞等,2018)、海南(钟义海等,2019)和广西(蜜蜂产业行业内通报)相继发现该虫危害蜂场并呈严重的扩散蔓延态势。
蜂巢小甲虫成虫入侵蜂群后,在巢框缝隙内聚集、交配和产卵;其成虫和幼虫均可取食蜂蜜、花粉、蜜蜂幼虫、蛹(Ellisetal., 2002; Neumannetal., 2004);幼虫在觅食过程中在蜂巢内到处挖洞,破坏巢房,同时传播病原菌(如Paenibacilluslarvae)(Schäferetal., 2010),病毒(如蜜蜂残翅病毒Deformedwingvirus、克什米尔病毒Kashmirbeevirus)(Eyeretal., 2009;Nanettietal., 2021)和蜜蜂寄生虫(Lotmariapassim、Crithidiabombi)(de Landaetal., 2020)使蜜蜂幼虫感病;还可携带酵母菌Kodamaeaohmeri使蜂蜜发酵,并散发出腐臭气味,从而失去商品价值(Cornelissenetal., 2019)。蜂巢小甲虫成虫可存活数月,扩散飞行能力非常强,一头雌虫一生可产卵2000多粒(Papachetal., 2020),可在不同的蜂群间互相扩散,世代重叠。
尽管蜂巢小甲虫造成了巨大的经济损失,但当前还没有有效的绿色防控措施。化学杀虫剂依然是当前防治蜂巢小甲虫的主要手段(Kangaetal., 2012; Kangaetal., 2021)。国外长期使用蝇毒磷(Coumaphos),氟氰胺菊酯(Fluvalinate)防治蜂巢小甲虫。据报道,蜂巢小甲虫对蝇毒磷已产生了43.7倍的抗药性,对氟胺氰菊酯产生了5.4倍的抗药性(Kangaetal., 2021)。蜂箱内用药比较困难,一是高毒农药会造成蜜蜂农药中毒,二是蜂蜜中农药残留也是令人担忧的食品安全问题。笔者对海南蜂场进行蜜蜂病虫害的普查过程中发现蜂农采用氯虫苯甲酰胺进行蜂巢小甲虫的防治,具有良好的控制效果。
氯虫苯甲酰胺(Chlorantraniliprole)是新型邻氨基苯甲酰胺类杀虫剂,作用于鱼尼丁受体(Ryanodine receptor),具有高效、低毒、对其它类型杀虫剂无交互抗性等特点,主要用于农业害虫防治(杨桂秋等,2012)。但随着氯虫苯甲酰胺的推广使用,一些重要农业害虫如甜菜夜蛾Spodopteraexigua、小菜蛾Plutellaxylostella、二化螟Chilosuppressalis等均对氯虫苯甲酰胺产生了较高水平的抗性(支昊宇等,2021)。昆虫抗药性的产生与农药产生的亚致死作用相关。如田间昆虫长期处于杀虫剂的低剂量选择压下,抗药性或耐药性强的个体存活或繁殖的机会较大,就有利于抗药性能力的积累和发展(韩文素等,2011)。伴随着蜂巢小甲虫的爆发,蜂农施用氯虫苯甲酰胺的剂量因防止蜜蜂中毒不会太高,但频率会相应增加。这样蜂巢小甲虫长期处于氯虫苯甲酰胺低剂量的选择压下,必然对氯虫苯甲酰胺的敏感性逐渐降低。本研究测定了氯虫苯甲酰胺亚致死剂量对蜂巢小甲虫生长发育和繁殖的影响,旨在指导蜂农科学用药,以减少过度使用杀虫剂带来的蜂产品污染,同时为有效防治蜂巢小甲虫提供理论基础。
1 材料与方法
1.1 试虫来源及饲养
供试蜂巢小甲虫采自海南省琼中县吊罗山区域内蜂场,带回实验室隔离养虫室内饲养。饲养方法参照Neumannetal.(2013)的方法,蜂巢小甲虫成虫和幼虫均用蜂粮(含蜂蜜、花粉、蛋白质)饲喂。饲养条件为:温度27±1℃,相对湿度60%±10%,未成熟幼虫黑暗无光照约2周;老熟即将化蛹的幼虫,自然光照14 h,持续1周,以便老熟幼虫离开食物入土化蛹,随后无光持续约20 d;羽化后的成虫,自然光照14 h,成虫产卵孵化为幼虫后,再黑暗饲养,周而复始。
1.2 供试药剂
氯虫苯甲酰胺96%原药,由海南博士威农用化学有限公司提供。
1.3 实验方法
1.3.1氯虫苯甲酰胺对蜂巢小甲虫幼虫亚致死剂量的测定
采用饲料混毒法进行幼虫的毒力测定(IRAC,2011)。使用95%丙酮将氯虫苯甲酰胺原药配置成最大溶解度为3.446 g/L的母液,备用。试验前,用丙酮将母液稀释成2.5、5、10、20、40和80 μg/mL的系列试验浓度。每浓度取0.5 mL药液与0.5 mL的蒸馏水混合,空白对照采用0.5 mL丙酮与0.5 mL的蒸馏水,然后将混匀的药液放入1 g蜂粮拌匀,配置成最终浓度为0、1.25、2.5、5、10、20、40 μg/g的混毒蜂粮。将配置好的蜂粮放入直径6 cm且垫有一层滤纸的培养皿内,接入大小一致刚刚进入3龄的幼虫。每个浓度重复3次,每个重复供试10头幼虫,将各处理放入温度27±1℃,相对湿度60%±10%,无光照的暗室内,48 h后统计死亡率。记录结果时,用毛刷轻轻推动不动的幼虫,等待一段时间,若幼虫仍没有反应则视为死亡。数据用SPSS 17.0软件处理,计算LC50,LC10、LC25和毒力回归方程的斜率(b)。
1.3.2氯虫苯甲酰胺对蜂巢小甲虫的亚致死效应
使用丙酮配置氯虫苯甲酰胺浓度为LC10和LC25的药液,对照为不含杀虫剂的丙酮溶液,分别放入1 g蜂粮内混匀,置于培养皿内,再接入刚刚蜕皮的3龄幼虫,放置于暗室内。每个浓度10次重复,每重复处理10头幼虫。48 h后将存活幼虫放入无毒的2 mL离心管中,采用无毒蜂粮单头饲养。对离心管进行编号,每日观察幼虫的生长发育情况,直至其变成老熟幼虫。由于蜂巢小甲虫在土里化蛹的特性,将快要化蛹的幼虫放入装满沙土(高温灭菌,湿度为10%)的50 mL离心管中供其化蛹。称量入土前幼虫的质量和初出土成虫的质量,判断出土成虫的雌雄,计算雌雄比。取单只雌虫和单只雄虫放入含无毒蜂粮和黑色塑料膜的50 mL离心管中配对,置于养虫室内饲养。每日观察蜂巢小甲虫的产卵情况,两个月以后(从雌雄配对开始算起)停止记录。收集各个处理组雌虫产卵期前10 日内产的卵(包括卵块和单卵),将其分为平等的三份作为3个重复,每个重复不少于70 粒卵,将卵放在消过毒的培养皿中放入光照培养箱,待卵孵化后测其孵化率。记录孵化数时,将没有孵化的卵算作死亡。
1.4 数据统计与分析
采用单因素方差分析(ANOVA)研究氯虫苯甲酰胺亚致死剂量对蜂巢小甲虫各个阶段的存活率、性别比例、漫游期幼虫重和初羽化成虫重以及子代卵孵化率的影响。每处理间的差异显著性采用Tukey’s HSD法(P< 0.05)。存活率、孵化率在方差分析前进行反正弦平方根转换,以满足方差齐性。采用Morris-Watt提出的公式计算种群趋势指数(I):I=S1·S2·S3……Sn·P♀·Fm(Watt, 1961; Morris, 1963)。式中,S1,S2,S3……Sn为生命表中各发育阶段的平均存活率,P♀为雌虫占成虫总数的百分率,Fm指实际平均产卵量,Fm=F·PF,F为雌虫最大产卵量,PF为卵的实际产出率。I=1,表明下代种群数量与上一代持平;I>1时,表明下代种群数量增加;I<1时,表明下代种群数量减少。数据统计分析采用SPSS 17.0软件,作图采用SigmaPlot 12.0软件,数据均以平均值±标准误表示。
2 结果与分析
2.1 氯虫苯甲酰胺对蜂巢小甲虫的亚致死剂量
根据室内生物测定的结果,氯虫苯甲酰胺对蜂巢小甲虫幼虫48 h的LC50、LC25和LC10分别为5.193、2.865和1.678 μg/g(表1),选取LC25和LC10两个浓度做亚致死效应研究。

表1 氯虫苯甲酰胺对蜂巢小甲虫3龄幼虫的致死中量和亚致死剂量
2.2 氯虫苯甲酰胺亚致死剂量对蜂巢小甲虫幼虫存活率和蛹羽化率的影响
氯虫苯甲酰胺亚致死剂量处理蜂巢小甲虫 3龄初幼虫后,LC25处理组蜂巢小甲虫的存活率为76.00%±4.52%,显著低于对照组;LC10处理组蜂巢小甲虫的存活率与对照组相比无显著性差异。LC25和LC10处理组蜂巢小甲虫蛹的羽化率与对照组相比均无显著性差异(表2)。
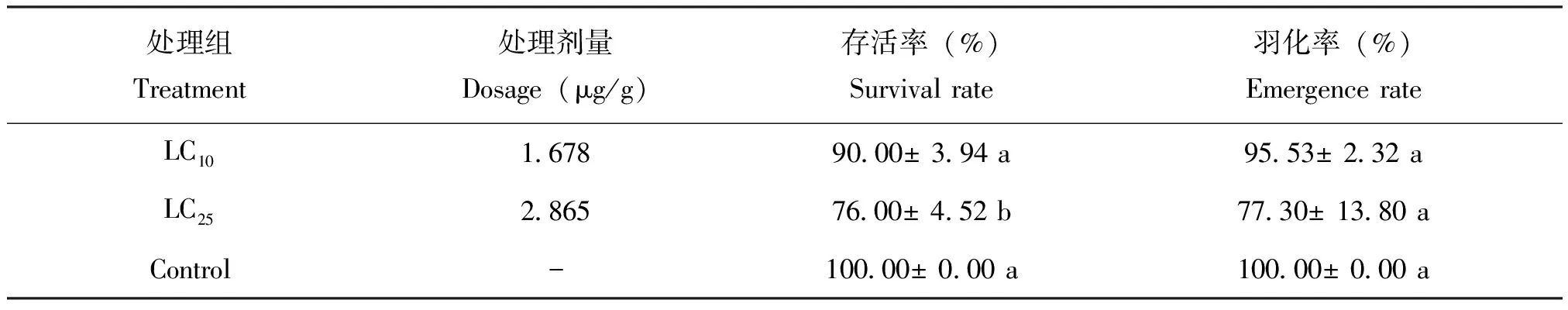
表2 氯虫苯甲酰胺亚致死剂量对蜂巢小甲虫幼虫存活率和羽化率的影响
2.3 氯虫苯甲酰胺亚致死剂量对蜂巢小甲虫幼虫和蛹发育历期的影响
蜂巢小甲虫3龄初幼虫经氯虫苯甲酰胺亚致死剂量处理后,对幼虫和蛹的生长发育影响结果见表3。对照组幼虫的发育历期为8.00±0.00 d,LC10和LC25处理组蜂巢小甲虫幼虫的发育历期明显延长,为8.27±0.06 d和8.36±0.08 d,分别延长了3.38%和4.50%,但两处理组间无显著性差异。LC10处理组雌蛹的预蛹+蛹期为26.82±0.20 d,雄蛹的预蛹+蛹期为27.00±0.23 d,LC25处理组雌蛹的预蛹+蛹期为29.59±1.31 d,雄蛹的预蛹+蛹期为28.78±1.14 d,相对于对照组的24.27±0.10 d和25.65±0.13 d,均显著延长,且分别延长了10.51%、21.92%和5.26%、12.20%,两处理组间存在显著性差异。LC10和LC25处理组漫游期幼虫体重、初羽化雌虫重和初羽化雄虫重分别为124.67±1.71 mg、82.75±1.35 mg、93.03±2.41 mg和127.59±2.21 mg、88.10±1.44 mg、93.93±2.35 mg,相对于对照组的147.45±1.55 mg、105.47±1.28 mg、112.44±1.28 mg均显著降低,

表3 氯虫苯甲酰胺亚致死剂量对蜂巢小甲虫幼虫和蛹发育历期的影响
且分别减轻了15.45%、21.54%、17.26%和13.47%、16.47%、16.46%。LC10和LC25处理组的雌性比例分别为57.23%±3.96%和54.49%±4.34%,与对照组的59.29%±4.23%相比,无显著性差异。
2.4 氯虫苯甲酰胺亚致死剂量对蜂巢小甲虫繁殖的影响
蜂巢小甲虫雌雄配对后在第6天出现了第一个产卵高峰期,随后大致在第20天、40天和 55天出现其余重叠的产卵峰(图1)。各组的每日产卵量趋势近乎相同,但有所差别。对照组和LC10处理组的每日单雌产卵量的峰值高度重叠,数目较多。而LC25处理组的每日单雌产卵量峰值相对较少,在第6天时峰值高于对照组和LC10处理组,其余时间均低于其它两组。各组产卵量虽不稳定,但从图中可看出LC25最高峰与最低峰相差最大,受到杀虫剂影响较大。

图1 亚致死剂量氯虫苯甲酰胺对蜂巢小甲虫每日单雌产卵量的影响Fig.1 Effects of chlorantraniliprole at different dosages on the number of eggs laid by per female per day of Aethina tumida
LC10和LC25处理组蜂巢小甲虫雌虫的产卵前期分别为7.96 d和7.47 d,显著低于对照组的20.32 d(表4)。雌雄配对后,对照组、LC10和LC25处理组60 d内的平均产卵量分别为142.63±27.58粒、151.38±44.19粒和100.79±22.20粒。与对照组相比,LC10和LC25处理组的蜂巢小甲虫产卵量分别增加了6.31%和减少了29.33%,但各组间并无显著性差异。值得注意的是,LC25处理组在5~7 d平均产卵量显著高于对照组,在18~19 d显著低于LC10处理组,在40~41 d显著低于对照组。各组卵的孵化率相比,对照组、LC10处理组和LC25处理组的孵化率分别为71.98%、81.04%和74.11%,无显著性差异。
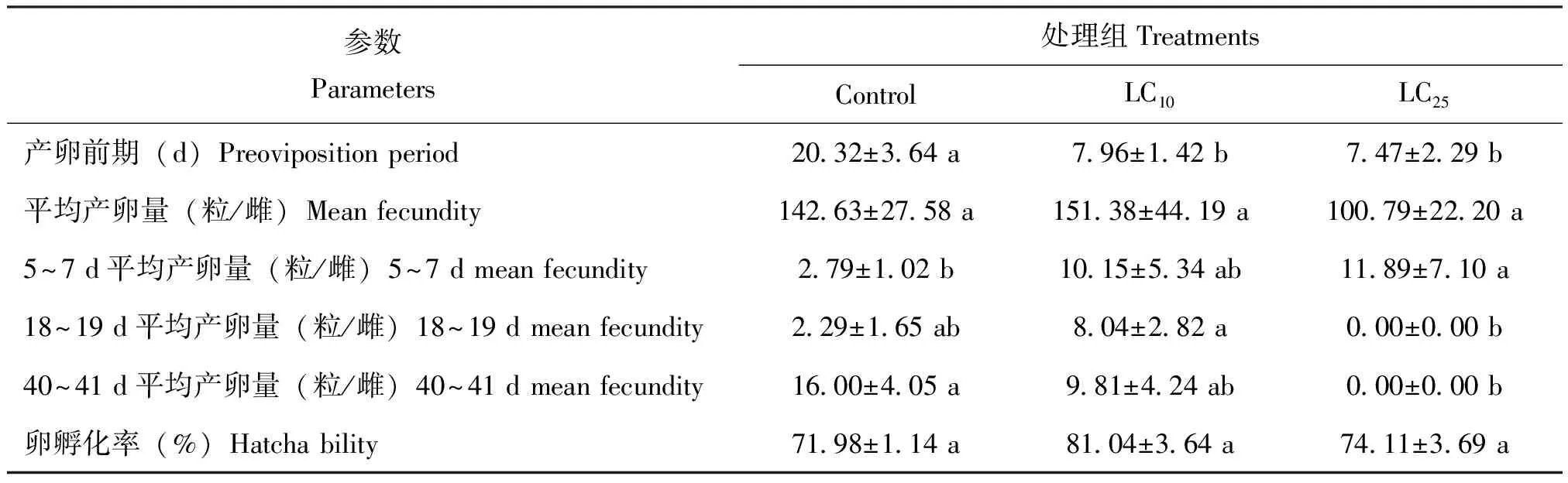
表4 氯虫苯甲酰胺亚致死剂量对蜂巢小甲虫繁殖力和卵孵化率的影响
2.5 暴露于氯虫苯甲酰胺亚致死剂量下的蜂巢小甲虫实验种群生命表
实验种群生命表的分析结果显示(表5),与对照组相比,氯虫苯甲酰胺亚致死剂量对蜂巢小甲虫的种群增长具有一定的抑制作用。LC10和LC25处理组的种群趋势指数与对照组相比分别降低了22.49%和67.27%,这与氯虫苯甲酰胺亚致死剂量降低蜂巢小甲虫各期的存活率和成虫的繁殖力有关。但本研究中LC10和LC25处理组实验种群的种群趋势指数远远大于1,表明暴露于氯虫苯甲酰胺亚致死剂量下的蜂巢小甲虫种群均处于增长态势,且氯虫苯甲酰胺暴露的剂量越低,蜂巢小甲虫的种群趋势指数越接近于对照。
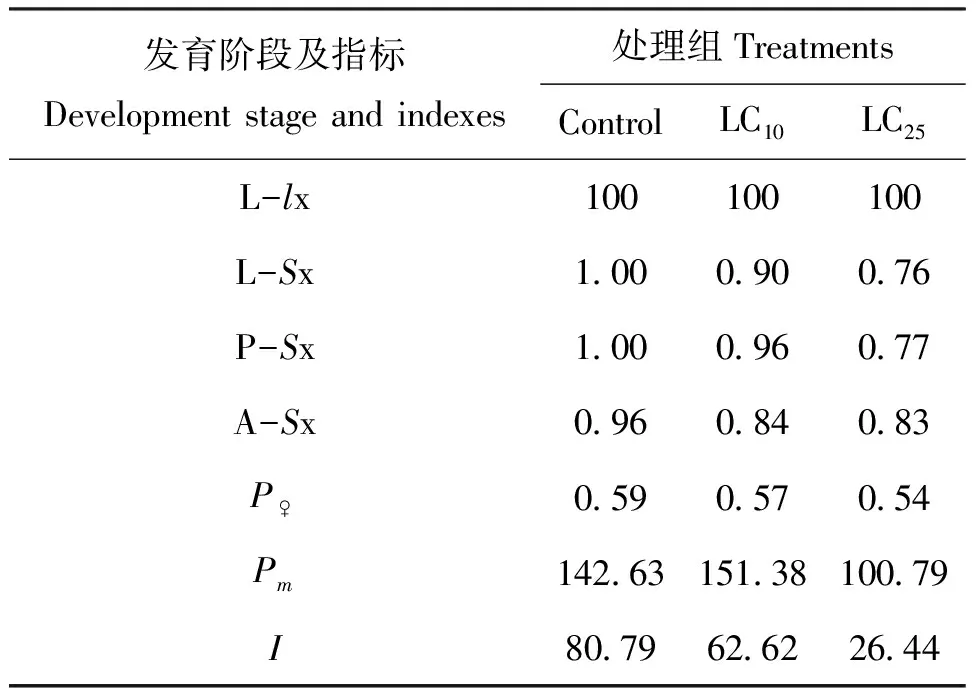
表5 暴露于氯虫苯甲酰胺亚致死剂量下的蜂巢小甲虫实验种群生命表
3 结论与讨论
近年来,蜂巢小甲虫呈严重的全球蔓延态势(Cornelissenetal., 2019),国外对蜂巢小甲虫的防治研究较多,物理、化学、生物的方法均有报道,但使用最为普遍的仍是化学杀虫剂。当前,美国佛罗里达州的蜂巢小甲虫种群已对有机磷类和拟除虫菊酯类杀虫剂产生了抗药性,因此急需筛选其它类型杀虫剂治理蜂巢小甲虫(Kangaetal., 2021)。我国蜂农在防治蜂巢小甲虫时,多使用防治蜜蜂害虫巢虫的常用药剂氯虫苯甲酰胺(秦裕本,2018)。本研究结果表明,氯虫苯甲酰胺对蜂巢小甲虫3龄初幼虫的LC50为5.193 μg/g,说明氯虫苯甲酰胺对非靶标害虫蜂巢小甲虫具有一定的生物活性。随着氯虫苯甲酰胺在农业上的广泛施用,已造成一些重要农业害虫产生了抗药性。此外,蜂巢小甲虫基因组测序表明,其涉及解毒杀虫剂和适应不同食源的几个基因家族的拷贝数增加(Evansetal., 2018),说明蜂巢小甲虫对氯虫苯甲酰胺抗性发展的风险较高。
亚致死效应是指由不能直接杀死害虫的低剂量杀虫剂所引起的一种应激性反应。杀虫剂的亚致死剂量可以影响害虫的生长发育、生态行为、生理生化及抗药性发展等多方面,并对不同害虫的生长发育和繁殖作用存在一定的差异。这种由杀虫剂引起的亚致死效应可以持续影响下一代甚至多代(Galvanetal., 2006; Hanetal., 2012)。本研究使用氯虫苯甲酰胺亚致死剂量LC10(1.678 μg/g)和LC25(2.865 μg/g)处理蜂巢小甲虫3龄幼虫后,与对照组相比,LC10和LC25处理组幼虫和蛹的发育时间显著延长,其中蛹的发育还存在明显的剂量效应。此研究结果与氯虫苯甲酰胺亚致死剂量延长梨小食心虫Grapholitamolesta(庾琴等,2018)、桃小食心虫Carposinasasakii(刘宴弟等,2021)、甜菜夜蛾Spodopteraexigua(Laietal., 2011)、白背飞虱Sogatellafurcifera(杨洪等,2012)的发育历期结果相似。LC10和LC25处理组入土前幼虫重和羽化后成虫重明显低于对照组,这可能是氯虫苯甲酰胺抑制了蜂巢小甲虫幼虫的取食,或者取食后获得营养一部分用于应付杀虫剂的解毒代谢,从而改变了其营养状况。
蜂巢小甲虫成虫可存活数月,一生可交配多次(de Guzmanetal., 2015),本研究发现成虫在60 d内可出现多个产卵高峰期。LC10和LC25处理组蜂巢小甲虫的产卵前期显著低于对照组,LC25处理组蜂巢小甲虫在60 d内的每雌产卵总和有所下降,但却无显著性差异。值得注意的是,进一步分析每日单雌产卵量,发现5~7 d时,LC25处理组显著高于对照组,说明氯虫苯甲酰胺亚致死剂量对蜂巢小甲虫首次产卵时具有一定的刺激繁殖作用。此研究结果不同于氯虫苯甲酰胺亚致死剂量显著降低小菜蛾(Hanetal., 2012)、白背飞虱(杨洪等,2012)、棉铃虫Helicoverpaarmigera(Zhangetal., 2013)、桃小食心虫(刘宴弟等,2021)等雌虫的产卵量。据Fujiwara研究报道,药剂的亚致死剂量对害虫的整个发育阶段的影响是不一样的,可能对某一发育阶段造成一定的刺激作用,而对另一发育阶段起到抑制作用(Fujiwaraetal., 2002)。
综上所述,氯虫苯甲酰胺亚致死剂量延长蜂巢小甲虫的发育历期,尤其是体现在预蛹和蛹期上,这可能与昆虫的自我补偿有关。在繁殖方面,LC25处理组蜂巢小甲虫的60 d产卵总量与对照相比呈下降趋势,但需要注意的是,在第一个产卵高峰时,显著高于对照组,出现这种情况的原因有待深入研究。氯虫苯甲酰胺亚致死剂量缩短蜂巢小甲虫的产卵前期,刺激蜂巢小甲虫初次产卵量增加的现象,可能会造成蜂巢小甲虫生活史缩短,繁殖代数增加,世代重叠。若蜂巢小甲虫连续暴露在氯虫苯甲酰胺的亚致死剂量下,无疑会诱导蜂巢小甲虫抗药性增强,种群大暴发,从而扩散到无疫区。虽然本研究表明氯虫苯甲酰胺亚致死剂量对蜂巢小甲虫处理代的种群增长具有一定的抑制作用,但其种群趋势指数仍远远大于1,表明蜂巢小甲虫种群仍处于增长趋势。因此,需要进一步监测蜂巢小甲虫对氯虫苯甲酰胺的抗性发展,以及研究抗性产生的机制,以期为氯虫苯甲酰胺防治蜂巢小甲虫的合理应用提供理论基础。此外,应该研发氯虫苯甲酰胺蜂箱内外施用的新方法,最大限度的减少对蜜蜂的毒性影响。

