二氢杨梅素联合小剂量VP16抗肺癌研究
郭娜娜,孙大永,马明轩,张翔宇,左彦珍(.承德医学院,河北 承德 067000;.承德市中心医院放化疗中心,河北 承德 067000)
肺癌是全世界发病率和死亡率最高的恶性肿瘤[1],五年生存率不足21.0%[2],其中非小细胞肺癌(nonsmall cell lung cancer,NSCLC)患者占85%[3]。近年来,由于吸烟、空气污染等一系列因素的影响,肺癌的发病率还在不断上升,每年肺癌新增病例占癌症病例的18.74%[4],其中首诊晚期肺癌的为84%[5],由于手术治疗的效果欠理想,放化疗成为中晚期NSCLC的首选治疗手段,联合化疗是增强治疗效果常用的治疗方案,但存在毒副作用大、患者不耐受的缺陷,故制定减毒高效的联合化疗方案迫在眉睫。
二氢杨梅素(dihydromyricetin,DMY)又称蛇葡萄素、白蔹素、福建茶素等,是一种二氢黄酮醇类化合物,大量存在于葡萄科蛇葡萄属植物中,在藤茶中的量可以达到30%[6],民间常将其用于治疗感冒、咳嗽。既往研究[7-9]表明DMY具有抗肿瘤、抗氧化、保护心血管、调节血糖、抗炎、保护神经系统、保护肝脏等药理作用。现有研究[10-14]已证实:DMY 能够通过改变细胞周期蛋白诱导细胞周期停滞在G2/M 期,抑制肝癌细胞增殖;通过SP-1 和NF-κB调节尿激酶纤溶酶原激活剂抑制人骨肉瘤细胞转移;通过促进肿瘤细胞的凋亡,抑制肿瘤细胞的迁移和侵袭,增加肿瘤细胞对化疗药物的敏感性,从而降低化疗毒副作用;DMY可下调survivin蛋白的表达,使已经对紫杉醇和阿霉素产生耐药的卵巢癌细胞增敏,使卵巢癌细胞凋亡增加;DMY能有效调节磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)通路、NF-κB、p53 和内质网应激(ER应激)驱动的信号进而用于肺癌等癌症的治疗。以上研究结论提示DMY有望成为低毒高效的化疗增敏剂,为抗癌联合治疗提供新思路。
本研究采用小剂量DMY 和小剂量VP16,初步探究DMY能否作为一种化疗增敏剂在体外发挥增敏VP16 抗肺癌的作用及其机制,寻找低毒高效的联合化疗方案,减少化疗药物用量的同时降低其毒副作用,提高治疗效果进而改善患者生存质量。
1 仪器与试药
人非小细胞肺癌A549 细胞株(天津肿瘤医院研究所)、RPMI1640 培养液(Gibco)、胎牛血清(Gibco)、0.25%胰酶溶液(含EDTA)(Sigma)、PBS缓冲液(HyClone);细胞培养箱(Thermo)、低速离心机(Thermo)、corning 培养皿(corning)、培养板(corning)、DMY(纯度> 99%,北京恒元启天化工技术研究院)、VP16、Tunel凋亡试剂盒(Roche)、倒置荧光显微镜、β-actin鼠抗人单克隆抗体(1 : 1000稀释;华安生物)、Parp 兔抗人多克隆抗体(1 : 1000 稀释;CST)、Caspase-3 兔抗人多克隆抗体(1 : 1000 稀释;CST)、Cleaved Caspase-3兔抗人多克隆抗体(1 : 1000稀释;CST)、Bax 鼠抗人单克隆抗体(1 : 1000 稀释;Abcam)、山羊抗鼠二抗和山羊抗兔二抗(1 : 4000稀释;Abcam)、RIPA裂解液(上海贝博)。
2 方法与结果
2.1 实验方法
2.1.1 细胞培养取人非小细胞肺癌A549细胞加入含10%胎牛血清的1640完全培养基培养于培养皿中,置于恒温37 ℃、5% CO2、饱和湿度的培养箱中培养。每1~2天更换一次培养基,PBS清洗,使用0.25%胰酶(含EDTA)消化传代,取对数生长期状态良好的细胞进行实验。
2.1.2 检测DMY对VP16治疗A549细胞生长的影响作用MTT实验确定单药给药浓度及时间(选取IC20浓度作为增敏单药浓度),取对数生长期的A549 细胞用0.25%含EDTA胰酶消化制备细胞悬浮液,按照1×106·皿-1接种细胞,放入培养箱培养24 h,当细胞融合率达35%左右时,更换为含不同处理因素的培养基:对照组(完全培养基)、DMY 组(含DMY 80 μg·mL-1完全培养基)、VP16组(含VP16 0.06 μg·mL-1完全培养基)、联合组(含DMY 80 μg·mL-1+ VP16 0.06 μg·mL-1完全培养基),根据细胞生长曲线,放入培养箱中继续培养48 h后,倒置显微镜下观察并记录细胞生长情况。
2.1.3 Tunel实验检测各组细胞凋亡情况取对数生长期细胞同上法对细胞进行分组干预,培养48 h后取出细胞,弃培养基,PBS 清洗后加入4%多聚甲醛固定细胞1 h(室温15~25 ℃),PBS漂洗两次;加入细胞通透液(0.1% Triton)于冰上反应2 min,PBS漂洗2次;加入Tunel反应液,37 ℃避光湿盒反应1 h,PBS漂洗,DAPI染色处理,在荧光显微镜下观察,封片拍照,随机选取5个视野,使用软件Image J计数并统计结果。
2.1.4 Western blot检测各组相关凋亡蛋白表达采用上述方法对细胞进行分组干预,培养48 h 后取出细胞。先用PBS 清洗两次,加入RIPA 裂解液(上海贝博)置于冰上,待充分裂解后用刮子将细胞轻轻刮下(要确保每个位置都刮到),收取裂解液,低温高速离心机12 000 r·min-14 ℃离心20 min,将离心后的上清液(注意不能取到细胞团和絮状物)分装转移至1.5 mL离心管(蛋白始终放置于冰上,防止降解)。按照BCA 蛋白定量试剂盒说明进行定量,按比例加入Loding进行蛋白变性。制备12%凝胶,按照30 μg 总蛋白量上样电泳,将蛋白转移至PVDF 膜上,放入含5%奶粉的盒子里置于摇床上封闭2 h,然后倒掉奶粉,并分别加入稀释好的一抗,4 ℃过夜孵育(期间确保抗体充分接触不能干膜),第2 天取出PVDF 膜,放入含TBST 液的盒子里,置于摇床上洗5 min,反复3 次,清洗完后按照一抗种属分别加入二抗,常温孵育1~2 h,然后取出PVDF 膜,TBST 清洗5 min,反复3 次,最后进行ECL 成像,Quntity One 4.6.2 软件定量分析条带灰度值,实验重复多次后统计分析结果。
2.1.5 药物协同作用评估及统计分析参照金氏公式:Q = Ea+b/(Ea+ Eb-Ea× Eb),评价分析药物联合作用是否为协同作用,Ea+b代表合并用药抑制率,Ea代表单用A 药的抑制率,Eb代表单用B 药的抑制率。公式中分子代表实测合并效应,分母代表期望合并效应,Q 是实测效应和期望效应的比值。Q<0.85为拮抗,0.85≤Q≤1.15为单纯相加,Q > 1.15为协同作用。所有实验至少重复三次,单因素方差分析和t检验评估统计意义,以P<0.05表示差异有统计学意义。
2.2 实验结果
2.2.1 DMY增敏VP16对A549细胞的生长抑制作用各组细胞干扰作用48 h 后,倒置显微镜下观察可见,对照组细胞贴壁紧实,细胞形态匀称,呈长梭形,边界清楚,表面光滑,折光性强,细胞融合密度约90%;VP16组细胞形态变大,融合密度约80%~90%;DMY组细胞形态变化不明显,融合密度约70%~80%;联合用药组细胞形态固缩且不规则,折光性差,明显可见大量死亡细胞及碎片,融合率不足30%。与对照组相比,联合组细胞显著减少,见图1。
2.2.2 Tunel 实验检测各组细胞凋亡情况结果显示,对照组表达绿色荧光的细胞约占(1.05±0.04)%,DMY 组表达绿色荧光的细胞约占(7.15±0.31)%,VP16 组表达绿色荧光的细胞约占(3.76±0.23)%,联合组表达绿色荧光的细胞约占(81.87±0.85)%。联合组表达绿色荧光的细胞百分比显著高于对照组和单独用药组(P<0.01),细胞凋亡情况见图2。
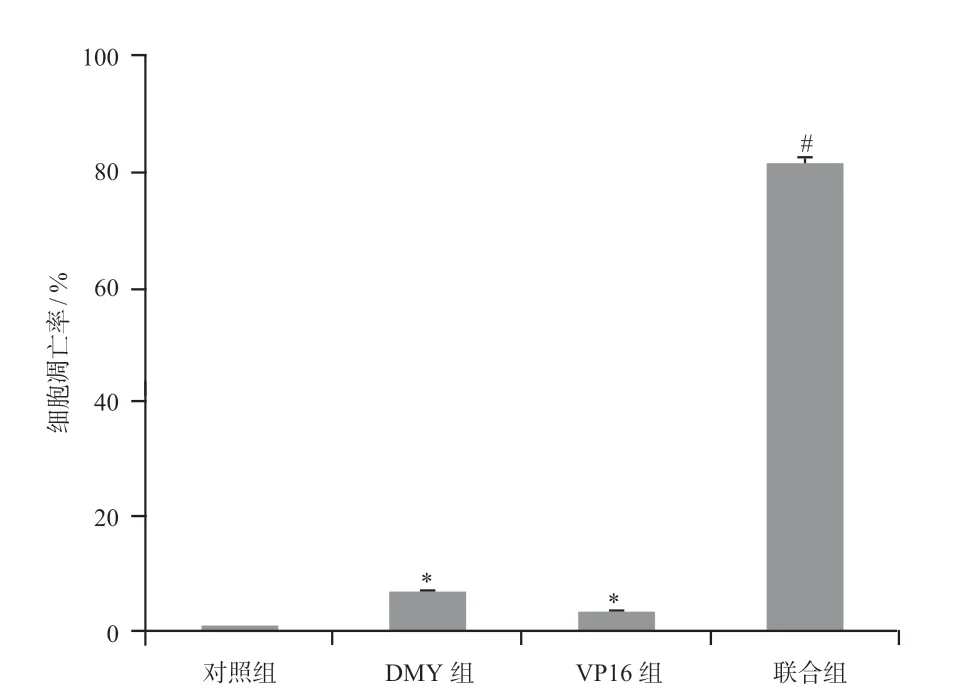
图2 Tunel实验检测各组细胞凋亡情况Fig 2 Apoptosis of each group by Tunel assay
2.2.3 Western Blot检测各组细胞相关凋亡蛋白的表达水平细胞培养48 h后Western blot结果显示,对照组、DMY组、VP16组和联合组β-actin条带相对均一,证明总蛋白量一致。VP16 组、DMY 组、联合组与对照组相比,PARP、Caspase-3 蛋白表达水平均有所降低(P<0.05);Cleaved PARP、Cleaved Caspase-3的蛋白表达水平VP16组和联合组升高(P<0.05),DMY组无显著差异。联合组与VP16组、DMY组、对照组相比均可见显著差异(P<0.01)。Bax蛋白表达水平VP16组、DMY组与对照组相比变化不大,而联合组蛋白表达水平明显高于对照组、VP16组和DMY组(P<0.01),见图3。
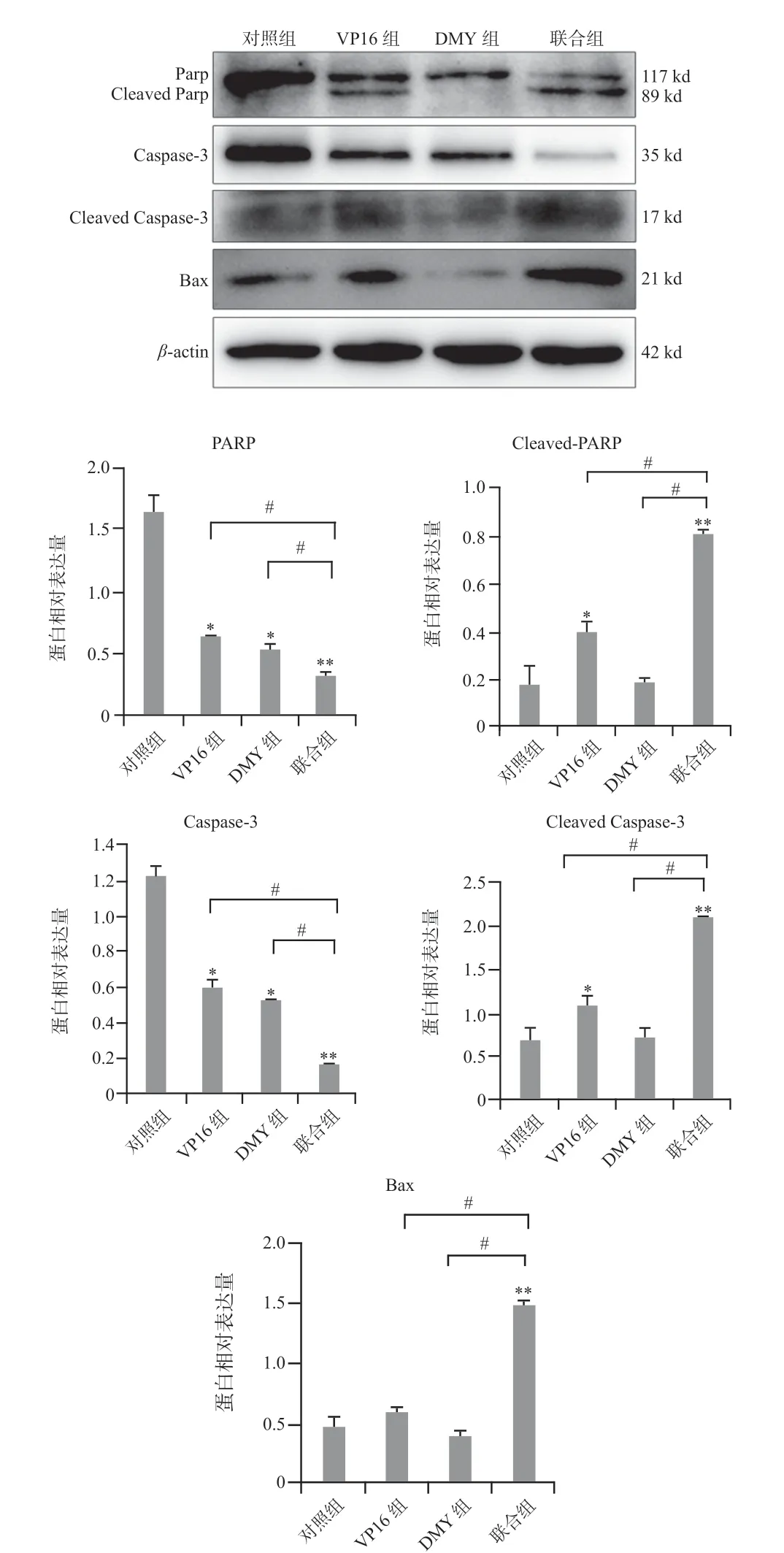
图3 Western blot检测各组PARP、Bcl-2、Bax蛋白表达Fig 3 Expression of PARP,Bcl-2 and Bax protein in each group by western blot assay
3 讨论
3.1 肺癌细胞选择依据
按照病理类型,肺癌分为小细胞肺癌和NSCLC,其中NSCLC占肺癌总数的85%左右[15]。由于早期临床表现不明显,大部分患者确诊时已发展为局部晚期或晚期,化疗是治疗中晚期NSCLC 的主要治疗手段[5],数据显示Ⅲ期肺癌化疗愈后率不足30%。探索新的化疗方案,为患者减轻毒副作用同时提高治愈率成为当下急需解决的医学问题。
3.2 药物选择依据
目前针对大多数晚期NSCLC患者的治疗方案仍为铂类化疗[16],VP16 是一种细胞周期特异性的抗肿瘤药物,它使细胞停止于有丝分裂中期,在临床化疗中呈现较严重的骨髓抑制。DMY是一种二氢黄酮醇类化合物,研究显示存在抗肿瘤作用,并且低毒高效的同时还有保护肝脏、降低血脂等作用[11,17-18]。本研究初步探究了DMY联合小剂量VP16对A549细胞的作用及机制,以明确联合DMY 治疗方案是否可以通过减少化疗药物的用量达到减毒高效增敏的治疗效果。文献及预实验显示小剂量VP16毒性作用明显降低但对肿瘤细胞的作用也明显减弱,甚至丧失,因此实验选取单药剂量时,采用了毒副作用低的小剂量药物浓度(IC20),结果显示小剂量DMY和小剂量VP16单药对肺癌细胞的抑制增殖和诱导凋亡作用均不显著,但联合用药作用显著,协同作用评估结果Q >1.15,提示两药联合应用存在协同作用。
3.3 联合作用机制
细胞凋亡是在特定时间中发生的由基因控制的细胞自主有序的死亡过程,任何细胞都可以发生凋亡,所以诱导肿瘤细胞凋亡是治疗肿瘤的重要方法之一。本研究从诱导细胞凋亡角度探讨了DMY 协同VP16抗肿瘤作用的机制。结果显示联合组细胞凋亡显著,DMY 与VP16 联合应用存在协同诱导凋亡作用。线粒体凋亡是重要的凋亡途径,是线粒体介导的内部凋亡通路,内外部刺激均可启动此通路,通路启动后,应激和DNA 损伤等促进Bax 等凋亡因子通过调控线粒体膜电位,促进细胞色素C 释放入胞液中,触发一系列凋亡活动,Caspase-3 位于细胞凋亡级联反应的下游,是凋亡级联反应的执行因子,细胞色素C 释放后经过一系列作用会将Caspase-3 激活成Cleaved Caspase-3,使细胞修复和细胞周期相关的酶失活,从而诱导细胞凋亡[18-20];PARP 是一类蛋白质翻译后修饰酶,以高浓度存在于真核细胞中,对于正常或DNA 轻度受损的细胞,PARP 帮助修复DNA维持基因组稳定,但这一过程是大量消耗ATP 的过程,当DNA损伤过强时,PARP大量被激活成Cleaved PARP,ATP 耗竭,细胞最终死亡[21],同时Cleaved Caspase-3 可使PARP 分裂而失去活性,从而抑制DNA修复,使细胞凋亡[22]。因此本研究选取Cleaved PARP、Cleaved Caspase-3、Bax、PARP、Caspase-3 作为检测指标,进而检测联合用药作用机制,Western blot 结果显示联合组与其他组相比,Cleaved PARP、Cleaved Caspase-3、Bax蛋白表达量显著增加,PARP、Caspase-3 蛋白表达下降,提示DMY 增强VP16 抗肺癌A549细胞的作用与诱导线粒体途径凋亡有关。
综上,本研究显示小剂量VP16 及DMY 对A549细胞的抑制增殖和诱导凋亡作用均不显著,但两药联合应用可产生协同作用,抑制增殖和诱导凋亡作用显著增加,进一步的研究显示其机制与上调Bax蛋白表达,增强Caspase-3和PARP蛋白活化诱发的一系列线粒体凋亡密切相关。但是DMY 是否可与VP16 一起协同抑制A549 细胞的迁移侵袭及其在体内的作用尚未探究,后续笔者将进一步研究,为开发我国减毒增效抗癌植物新药以及肺癌联合化疗新方案提供参考。

