氯化胆碱/二醇基低共熔溶剂的理化性质及其结构表征
朱振宝, 李 翯
(陕西科技大学 食品科学与工程学院, 陕西 西安 710021)
0 引言
近年来,离子液体作为新型溶剂具有很大应用潜力,成为了热门的研究领域.研究表明,离子液体同时具有粘度高、降解性差、有一定毒性和腐蚀性、对物质溶解有限以及生产成本高等缺点,目前寻找和开发新的类离子液体体系已成为研究和开发的重点.Abbott等[1,2]首次提出低共熔溶剂(Deep Eutectic Solvents,DESs)作为新的类离子液体得到了广泛关注.研究发现,DESs通常是由氢键受体(Hydrogenbond Acceptor,HBA)与氢键供体(Hydrogenbond Donor,HBD)以一定化学计量比通过氢键形成的共熔混合物.与离子液体相比[3],DESs具有无需纯化、成本低、不产生副产物、低毒、绿色环保等优势[4,5],目前新型DESs合成、制备和应用已成为重要的研究方向.
由于HBA和HBD 来源不同,因此DESs的种类繁多、组成多样且应用领域广泛.如氯化胆碱(Choline Chloride,ChCl)与对苯二酚形成的DESs可用于生物质预处理领域[6].ChCl与氯化锌合成的DESs作为催化剂用于生产生物柴油[7].此外,DESs还可用于化学合成、电沉积、萃取分离[8,9]等诸多领域.结构决定性质,性质决定应用,DESs体系的应用与其组成、结构和理化性质密切相关.因此,研究不同HBA和HBD形成的DESs 体系理化性质,表征其组成和结构,不仅能够揭示其科学机理,同时可以为相关应用提供技术指导.
目前,ChCl作为氢键受体,二元醇作为氢键供体合成和制备的DESs已广泛地应用于诸多领域.如利用ChCl/乙二醇DESs可以从废弃的阳极泥中回收贵金属[10],还能从黑松子中提取酚酸类物质[11].通常乙二醇、丙二醇等多元醇是重要的大宗化工原料,以醇基作为HBD,其不仅原料来源丰富、而且价格低廉.为了拓宽DESs在蛋白质等生物质提取领域的应用,揭示醇基HBD的类型以及HBD摩尔比对ChCl/醇基DESs理化性质的影响,本文分别以乙二醇、1,3-丙二醇、1,4-丁二醇作为HBD,以ChCl作为HBA,研究ChCl/醇基DESs合成和制备的条件.同时通过现代波谱学技术,利用傅里叶变换红外光谱(Fourier Transform Infrared Spectroscopy,FTIR)和核磁共振氢谱(H Nuclear Magnetic Resonance Spectroscopy,1H NMR)对DESs的结构进行表征.最后研究不同温度、摩尔比以及烷基链长对DESs理化性质的影响.研究结果不仅能够增加和完善新的DESs合成、制备体系,同时可以为其在食品工业领域中的应用提供理论基础,具有重要的科学意义和应用价值.
1 材料与方法
1.1 材料与试剂
氯化胆碱(纯度≥98%)、乙醇、乙二醇、1,3-丙二醇(纯度≥98%)、1,4-丁二醇(纯度≥98%),上海源叶生物科技有限公司;溴化钾、二甲基亚砜(DMSO-d6),天津市天力化学试剂有限公司;尼罗红染料,美国sigma公司.以上试剂均为分析纯.
1.2 仪器与设备
VECTOR-22傅里叶红外变换光谱、AVANCE NEO600M核磁共振波谱仪,德国布鲁克公司;DV-3+PRO数字式粘度计,闽测仪器设备有限公司;DDS-307A电导率仪,上海雷磁仪器有限公司;DA-130N便携式密度计,日本京都电子公司;UV1800紫外-可见-分光光度计,上海菁华仪器有限公司;DSA30界面流变仪,德国KRUSS公司;PHB-4pH计,上海雷磁仪器有限公司有限公司;DF-101S集热式恒温加热磁力搅拌器,上海力晨邦西仪器科技有限公司.
1.3 实验方法
1.3.1 低共熔溶剂的制备
参考文献[12]的方法,做少许修改.将ChCl和二元醇混合,集热式恒温磁力搅拌器80 ℃,500 r/min搅拌45 min.然后冷却,若形成均匀透明液体,则表明成功合成DESs.制备的溶剂室温保存.
1.3.2 傅里叶变换红外光谱表征低共熔溶剂
参考文献[13]的方法,将干燥24 h后的溴化钾用研钵研磨,装入磨具、压片.将DESs滴到溴化钾薄片上,摇匀后用吹风机吹干,上机测定.
Omnic 8.2.0软件进行图谱分析,Origin 2021软件绘图.
1.3.3 核磁共振氢谱表征低共熔溶剂
参考文献[14]的方法,用二甲基亚砜溶解DESs,装入5 mm核磁管中,放入核磁共振波谱仪进行测定.
MestReNove软件, ChemDraw软件解析谱图.
1.3.4 低共熔溶剂理化性质的测定
粘度:参考文献[15],数字式粘度计测定粘度.
电导率:校准电导率仪,用蒸馏水洗净电极后,测定电导率.
密度:室温下,便携式密度计测定DESs密度.
极性测定:参考文献[13],10 mg尼罗红染料用乙醇溶液溶解,并定容至10 mL容量瓶中.取1 mL母液稀释至100 mL,得0.01 mg/mL尼罗红乙醇溶液.取0.3 mL尼罗红乙醇溶液与2.4 mL DESs混合,摇匀,分光光度计200~800 nm下扫描,得到最大吸收波长,按公式(1)计算:
(1)

界面流变仪测定表面张力;pH计测定pH.
采用Origin 2021软件绘图.
2 结果与讨论
2.1 低共熔溶剂体系的合成与制备
ChCl和乙二醇、1,3-丙二醇、1,4-丁二醇分别以不同摩尔比(1∶1、1∶2、1∶3、1∶4)合成和制备低共熔溶剂的结果如表1所示.由表1可知,当ChCl/乙二醇的摩尔比为1∶2、1∶3、1∶4,ChCl/1,3-丙二醇、ChCl/1,4-丁二醇的摩尔比为1∶3、1∶4时均可以合成和制备DESs,而其它摩尔比的ChCl和醇之间则不能形成DESs.实验表明高浓度的ChCl不能与多元醇相互作用合成和制备DESs,结果与文献报道一致[16].因此选择ChCl/乙二醇摩尔比(1∶2、1∶3、1∶4)、ChCl/1,3-丙二醇和ChCl/1,4-丁二醇摩尔比(1∶3、1∶4)体系进行后续实验研究.

表1 ChCl与不同醇合成和制备低共熔溶剂体系
2.2 傅里叶红外光谱表征低共熔溶剂体系
FTIR常用于不同基团之间的相互作用研究、结构分析和鉴定,本文利用FTIR分别对ChCl、多元醇以及ChCl/醇基合成和制备DESs的结构进行表征,结果如图1~3所示.

图1 ChCl、乙二醇、ChCl/乙二醇低共熔溶剂体系傅里叶红外光谱图
由图1可看出,ChCl/醇基DESs体系较纯物质ChCl的吸收带变宽,这表明ChCl与醇之间已经形成了氢键,结果与曾朝喜[17]的研究结论一致.同时,从表2可知,与ChCl、乙二醇的羟基振动吸收峰在3 257 cm-1、3 382 cm-1相比,不同摩尔比(1∶2、1∶3、1∶4) ChCl/乙二醇DESs的羟基振动吸收峰分别为3 493 cm-1、3 497 cm-1、3 419 cm-1,其羟基吸收峰波数增大,发生了明显蓝移.其原因可能在于随着乙二醇的含量增加,削弱了DESs中ChCl的氢键作用,DESs的氢键作用先减小后增大,但始终低于纯物质的氢键作用.由图2可知,不同摩尔比(1∶3、1∶4) ChCl/1,4-丁二醇DESs中氢键作用强弱规律与ChCl/乙二醇体系相似.

图2 ChCl、1,4-丁二醇、ChCl/1,4-丁二醇低共熔溶剂体系傅里叶红外光谱图

表2 ChCl中部分集团振动吸收峰及峰归属
由图3可看出,ChCl/1,3-丙二醇DESs体系中氢键作用强弱与ChCl/乙二醇、ChCl/1,4-丁二醇相反.与1,3-丙二醇羟基吸收峰在3 386 cm-1相比,不同摩尔比(1∶3、1∶4) ChCl/1,3-丙二醇DESs的羟基吸收峰为3 379 cm-1、3 382 cm-1(如表3所示),ChCl/1,3-丙二醇DESs中的1,3-丙二醇羟基吸收峰波数减小,发生明显红移,结果表明ChCl的加入增强了ChCl/1,3-丙二醇DESs的氢键相互作用.ChCl与不同二醇之间DESs氢键相互作用存在的差异,其原因可能是醇中奇偶数碳原子间的不同所致.
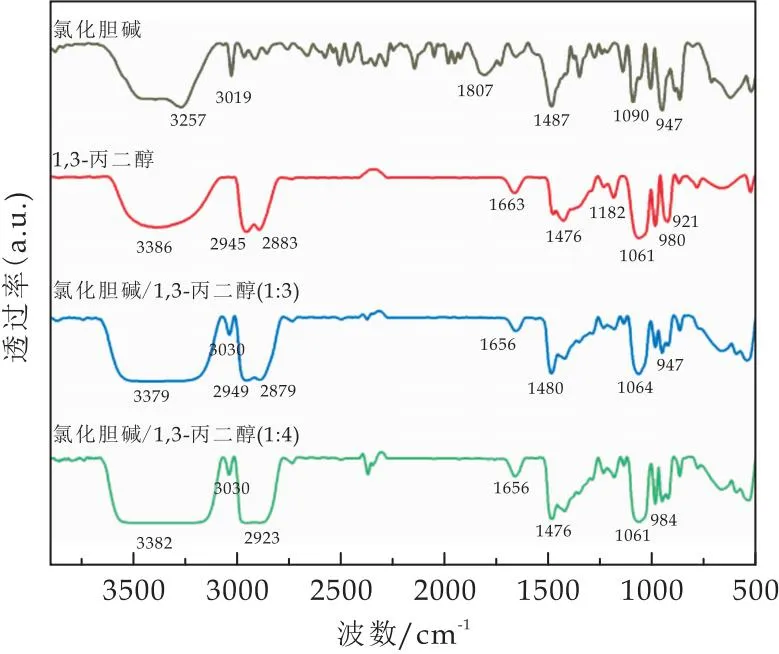
图3 ChCl、1,3-丙二醇、ChCl/1,3-丙二醇低共熔溶剂体系傅里叶红外光谱图
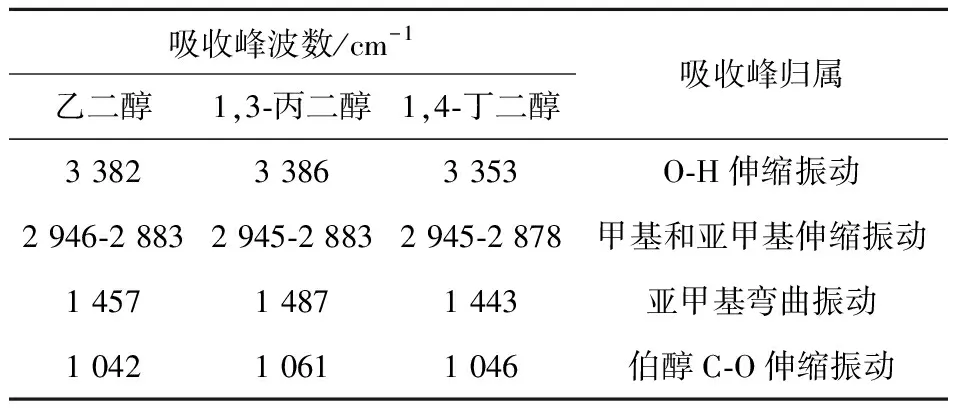
表3 乙二醇、1,3-丙二醇、1,4-丁二醇中
此外,从图1所示的结果还可看出,单独组分的特征峰和DESs之间并没有明显位移,说明二者之间形成的作用力除氢键外,可能还存在库仑力、范德华力等作用[18].
2.3 核磁共振氢谱表征低共熔溶剂体系
1H NMR常用于鉴定有机化合物的结构[19]、判断化学位移的变化[20]以及氢键作用的强弱,本文利用1H NMR来表征ChCl/醇基DESs中氢键的作用,其结果如图4~5及表4~6所示.

图4 ChCl/乙二醇低共熔溶剂核磁共振氢谱图
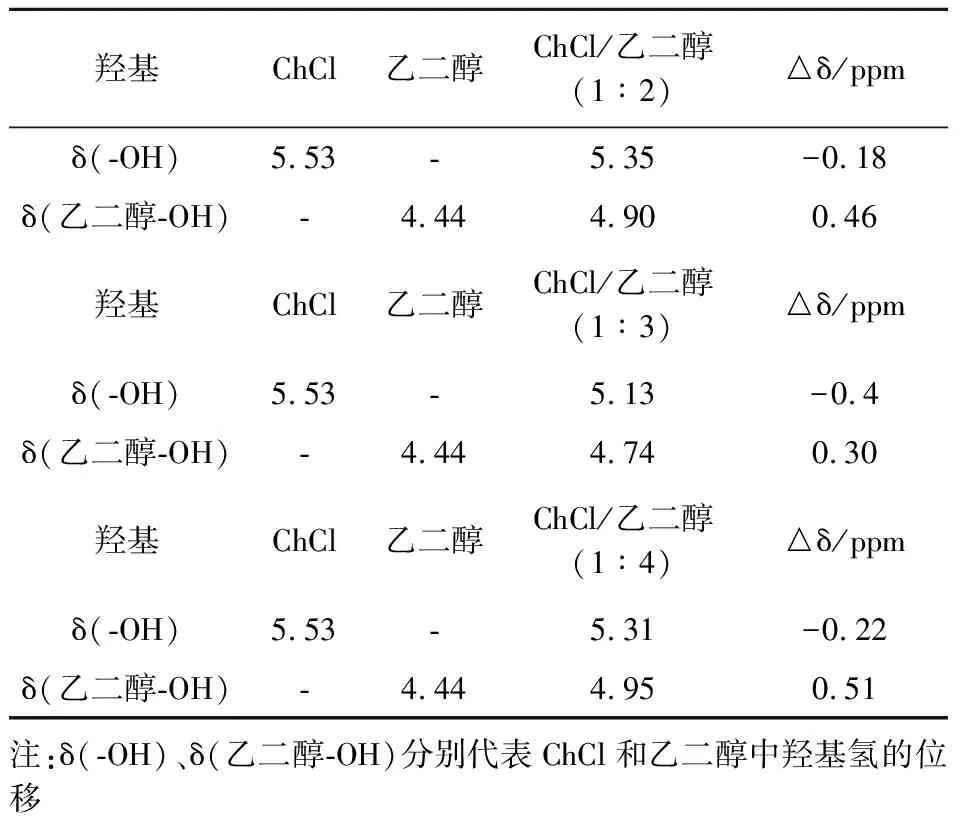
表4 ChCl、乙二醇和ChCl/乙二醇低共熔溶剂
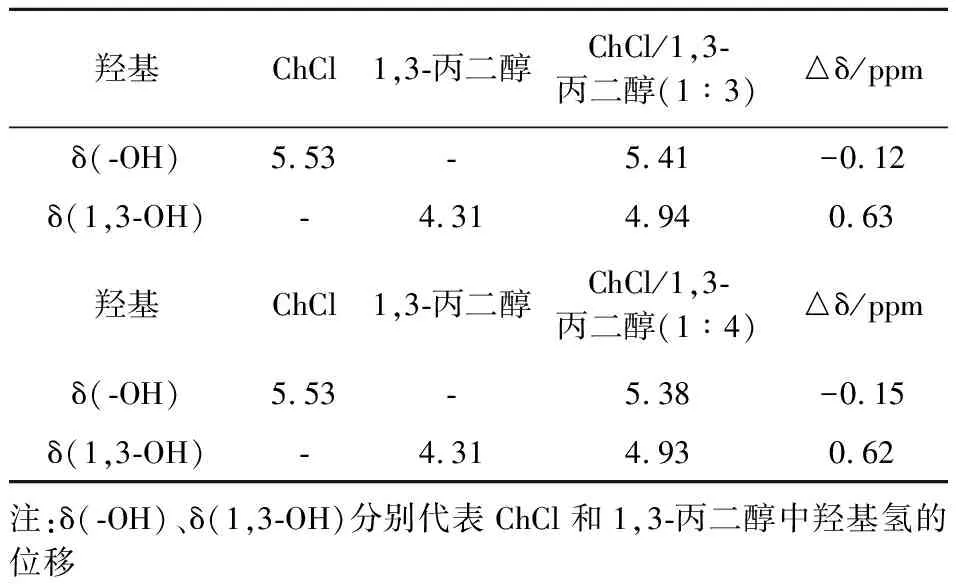
表5 ChCl、1,3-丙二醇和ChCl/1,3-丙二醇低共熔

表6 ChCl、1,4-丁二醇和ChCl/1,4-丁二醇低共熔
由表4可知,与羟基化学位移在5.53 ppm的ChCl相比,ChCl和乙二醇以不同摩尔比(1∶2、1∶3、1∶4)合成DESs后ChCl中的羟基对应化学位移变化分别为 -0.18 ppm、-0.4 ppm、-0.22 ppm,结果表明,随着ChCl含量降低,DESs中ChCl中氢键的作用先减弱后增强,而DESs中乙二醇中氢键作用先增强后减弱.其中,当ChCl与乙二醇的摩尔比为1∶3时,能够形成适宜的氢键.
同时可以看出,ChCl和乙二醇、1,3-丙二醇、1,4-丁二醇(1∶3)合成的DESs中ChCl的羟基对应化学位移变化分别为 -0.40 ppm、-0.12 ppm、-0.08 ppm(如表4~6所示).结合图4和图5可知,与ChCl的羟基相比,DESs中ChCl中氢键的作用均被减弱,而DESs中醇羟基的氢键作用增强,两者减弱或增强的趋势逐渐降低,并且ChCl和二元醇以摩尔比1∶4合成DESs的结果和趋势相同.1H NMR与FTIR结构表征结果一致,进一步说明了低共熔溶剂体系合成和制备成功.

图5 低共熔溶剂体系核磁共振氢谱图
2.4 低共熔溶剂理化性质
2.4.1 不同低共熔溶剂体系的粘度
研究发现,DESs体系粘度与HBD、HBA、摩尔比、温度、氢键网络[21]、离子尺寸、静电力或范德华力[22]等因素有关.通常来讲,因DESs的分子量较大,其体系粘度比常规溶剂更高.
由图6可发现,随着温度的升高,ChCl/醇基DESs体系的粘度显著降低.当温度为293.15 K时体系粘度为31~76 mPa·s,温度为343.14 K时体系粘度降低至11~21 mPa·s.其原因可能是温度升高,分子运动加剧[23],降低分子间作用力,阴离子-HBD、HBD-HBD和阴离子-阳离子之间的氢键数目急剧减少,从而影响溶剂层的流动性,使其更易流动,进而降低溶液的粘度.与此同时,DESs的粘度在低温时变化更为显著.
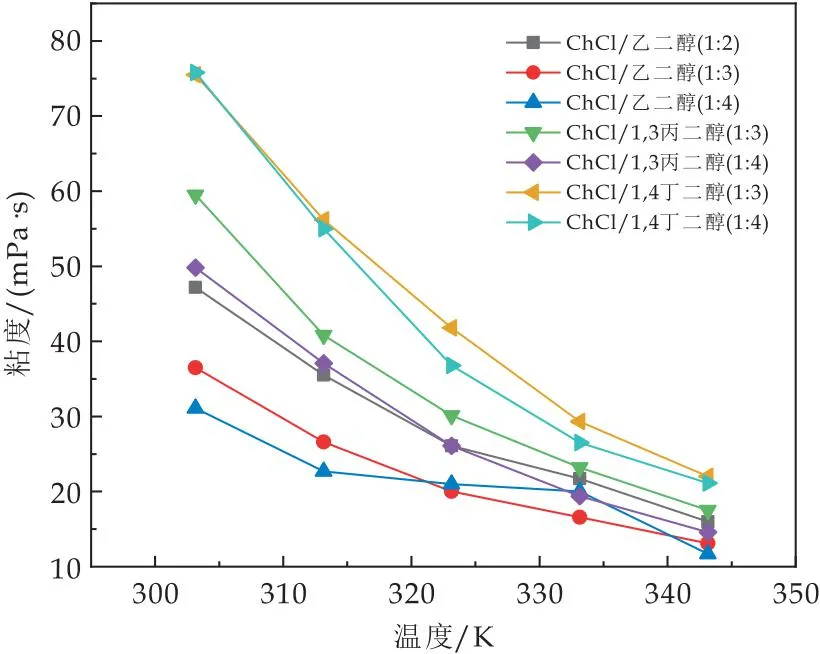
图6 不同温度下ChCl/醇基低共熔溶剂的粘度
结果发现,ChCl/醇基DESs体系中HBD摩尔比对DESs体系的粘度有一定影响.ChCl和乙二醇以不同摩尔比(1∶2、1∶3、1∶4)合成DESs的粘度分别为47.3 mPa·s、36.5 mPa·s、30.8 mPa·s,这表明随着HBD含量的增加,DESs体系粘度逐渐降低.
当温度为303.15 K时,摩尔比为1∶3的ChCl/乙二醇、ChCl/1,3-丙二醇、ChCl/1,4-丁二醇的粘度分别为47.3 mPa·s、59.8 mPa·s、75.5 mPa·s,结果表明DESs体系粘度随烷基链长度增加而升高,这与张欢欢[15]研究结果一致.
2.4.2 不同低共熔溶剂体系的电导率
由图7可知,随着温度升高DESs体系的电导率逐渐增大.其原因可能在于当温度升高时,离子自由体积增大[24],离子间作用力减弱,运动能力加强,从而导致电导率增大.与此同时,电导率和粘度成反比,粘度越小,粒子运动越快,体系电导率越大[25].

图7 不同温度下ChCl/醇基低共熔溶剂的电导率
同时可以看出,温度为313.15 K时,ChCl和乙二醇以不同摩尔比(1∶2、1∶3、1∶4)合成DESs体系的电导率分别为5.71 mS/cm、8.38 mS/cm、6.66 mS/cm.实验结果表明,随着乙二醇含量增加,DESs电导率先增大后减小.其原因可能是乙二醇浓度较低时其电导率相对较低,随着乙二醇浓度不断增大,HBA与HBD以氢键的方式结合,游离溶剂的量减少,从而引起电导率升高.当浓度增大到某一点时,ChCl和乙二醇互相配位,游离溶剂分子最少,电导率达到最大值.而后随着乙二醇浓度继续增大,电导率随着游离溶剂增多反而降低.
从图7中还发现,当ChCl和醇摩尔比为1∶3时合成DESs,体系的电导率随着醇基中烷基链增长而逐渐降低.
2.4.3 不同低共熔溶剂体系的密度
由图8可知,298.15 K时DESs的密度在1.031~1.111 g/mL,343.15 K为1.003~1.072 g/mL.结果表明,DESs体系的密度随温度的升高而减小.其原因可能是由于温度升高,分子间的氢键作用减弱,自由离子增多,体积膨胀,引起密度下降[15].但从总体来看,温度对DESs的密度影响较小.
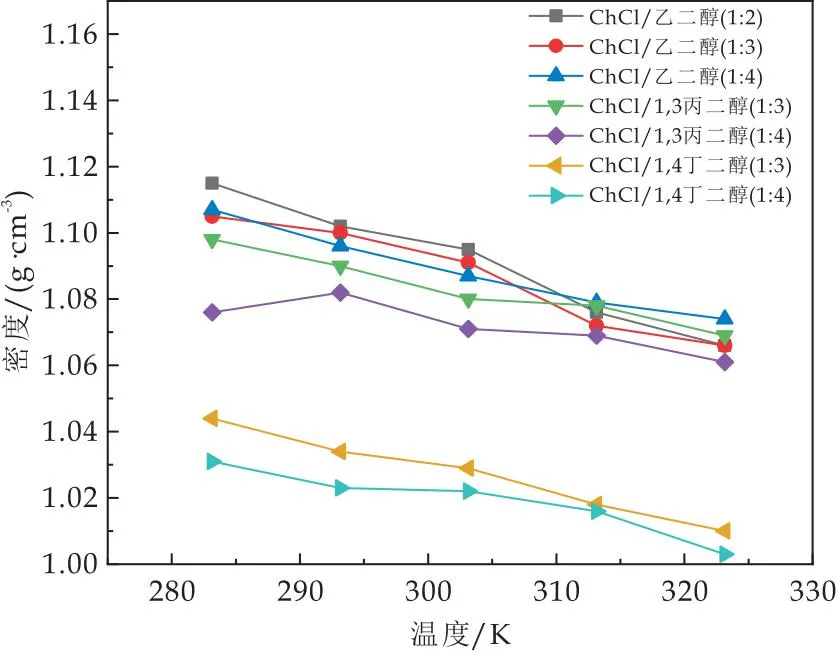
图8 不同温度下ChCl/醇基低共熔溶剂的密度
2.4.4 不同低共熔溶剂体系极性、表面张力和pH
极性是影响溶剂应用的最重要属性之一[26].DESs的极性通常受醇基的烷基链长度、OH位置以及数目等因素影响.由表7可知,ChCl和乙二醇、1,3-丙二醇和1,4-丁二醇(1∶3)合成的DESs体系极性分别为48.13 kcal/mol、105.50 kcal/mol、127.64 kcal/mol,结果表明DESs的极性随着烷基链长增加而增强.此外,由ChCl和乙二醇分别以不同摩尔比(1∶2、1∶3、1∶4)合成DESs的极性可看出,氯化胆碱/醇基的含量对极性的影响较小.该结果说明相对于摩尔比,醇基的烷基链长对极性的影响要更大一些.

表7 ChCl/醇基低共熔溶剂的极性、表面张力、pH
同时,从表7可看出,ChCl和乙二醇、1,3-丙二醇、1,4-丁二醇(1∶3)合成DESs表面张力分别为52.19 mN/m、51.50 mN/m和47.31 mN/m,结果表明随着烷基链长的增加,体系的表面张力在减小.此外,ChCl和乙二醇不同摩尔比(1∶2、1∶3、1∶4)合成DESs体系随着乙二醇含量的增加,其表面张力在逐渐降低,但变化幅度相对较小(如表7所示).这可能是由于乙二醇是一种相对弱的HBD,因此随着乙二醇浓度增大,表面张力变化较小[27].与极性变化趋势相类似,烷基链长对DESs表面张力的影响大于摩尔比.
DESs的pH是影响其提取应用的重要因素之一.由表7可知,ChCl和乙二醇以不同摩尔比(1∶2、1∶3、1∶4)合成DESs时,体系pH分别为4.49、8.32、6.28,呈现先升高后降低趋势.pH的变化与氢键的变化趋势一致,因此推测体系中氢键的变化可能是影响pH值的重要因素.此外,ChCl和乙二醇、1,3-丙二醇,1,4-丁二醇以摩尔比1∶3合成DESs的pH分别是8.32、5.93、4.96,结果表明随着烷基链长的增加,pH逐渐降低.
3 结论
通过对ChCl和不同的二醇合成和制备的DESs体系进行结构表征,测定其物理化学性质,结果发现,ChCl/醇基DESs的结构及其理化性质均受氢键供体种类影响,并且温度对体系的粘度、电导率影响显著,不同二醇类烷基链长对其极性影响较大,具体结论如下:
(1)ChCl和乙二醇分别以摩尔比(1∶2、1∶3、1∶4),与1,3-丙二醇、1,4-丁二醇以摩尔比(1∶3、1∶4)均能够制备和合成DESs体系.
(2)通过1H NMR,FTIR对DESs结构进行表征,结果发现醇基与ChCl之间存在氢键作用.并且,随着二元醇含量的增加,DESs中ChCl的氢键作用减弱、二元醇的氢键作用增强,但始终低于纯物质的氢键作用.其中,ChCl和乙二醇摩尔比(1∶3)氢键作用最佳,乙二醇和1,4-丁二醇DESs氢键作用的规律相似,1,3-丙二醇DESs氢键作用的规律不同.
(3)在303.15~343.15 K温度范围内,随温度升高,氯化胆碱/醇基DESs的粘度降低,电导率升高,密度变化不大.同一温度下,随着烷基链长度增加,氯化胆碱/醇基DESs的粘度、极性增强,电导率、表面张力和pH值均降低;而随着醇基含量的增加,DESs粘度显著降低,极性、表面张力变化较小,pH值则先升高后降低.

