松乳菇多糖提取工艺研究及降血糖活性评价*
罗丽平,李冰晶,杨 玲,杨彝华,贺红早
(贵州省生物研究所,贵州 贵阳 550009)
糖尿病是因遗传、饮食、环境等因素导致胰岛素功能衰减,从而对胰岛素敏感降低,影响相关代谢酶的活性而引起,其中α-淀粉酶、α-葡萄糖苷酶是影响人体血糖水平最主要的2 种酶[1]。α-淀粉酶可水解淀粉内部的α-1,4-糖苷键,并产生糊精、低聚糖和葡萄糖等物质,会造成血液中血糖浓度升高[2]。而α-葡萄糖苷酶能催化水解人体摄取的碳水化合物中的α-1,4-糖苷键,并释放葡萄糖,促进小肠对糖的吸收,导致血糖浓度升高[3]。因此,通过测定物质对α-淀粉酶、α-葡萄糖苷酶活性的抑制作用,可判断该物质的降血糖作用。
目前,许多天然产物均具有较好的降血糖功效且副作用小,具有开发成现有降血糖药物替代品的潜质[4]。比如,杨成峻等[5]发现花椒(Zanthoxylum bungeanum) 果皮中多酚类物质对α-葡萄糖苷酶活性的抑制作用显著,具有较好降血糖作用。常国立等[6]通过研究杨梅(Myrica rubra) 核多酚对α-葡萄糖苷酶的抑制作用,发现其具有较强的体外降血糖活性。王安娜等[7]研究了栘依(Docynia delavayi) 黄酮对α-淀粉酶、α-葡萄糖苷酶的抑制作用,发现其具有较好的体外降血糖活性。在以食用菌为试验对象的研究中,林杉等[8]报道了三地羊肚菌(Morchella eohespera) 胞外多糖对α-淀粉酶、α-葡萄糖苷酶的抑制作用,对羊肚菌胞外多糖的降血糖作用进行了探讨。另有研究发现,银耳(Tremella fuciformis)多糖可降低高胆固醇血症小鼠血清胆固醇含量,香菇(Lentinus edodes) 多糖可促进胆固醇代谢而降低其在血清中的含量[9]。冬虫夏草(Ophiocordyceps sinensis) 可促进细胞分泌胰岛素从而降低血糖[10]。
松乳菇(Lactarius Deliciosus) 属红菇科(Rus sulaceae) 乳菇属(Lactarius),肉质鲜美,营养丰富,食用价值高[11-13],并具有增强免疫力、抗肿瘤、抗氧化等作用[14]。项目组前期对松乳菇多糖粗提物进行了生物活性初探,结果发现松乳菇粗多糖提取物对α-淀粉酶、α-葡萄糖苷酶的活性抑制效果显著[15]。因此试验以松乳菇为研究对象,以提取物中的多糖含量为考察指标,探究不同提取方法和因素对松乳菇提取率的影响,为后续研究提供理论基础。
1 材料与设备
1.1 材料与试剂
野生新鲜松乳菇,采购于龙里野生菌市场。α-淀粉酶、α-葡萄糖苷酶、4-硝基酚-α-D-吡喃葡萄糖苷、葡萄糖,上海源叶生物科技有限公司;可溶性淀粉,成都金山化学试剂有限公司;二硝基水杨酸,国药集团化学试剂有限公司;PBS 缓冲液、Na2CO3,天津市致远化学试剂有限公司;无水乙醇,重庆川东化工(集团) 有限公司;试验用水均为二级水。
1.2 设备与仪器
DZF-6021 真空干燥箱,上海精宏实验设备有限公司;EYELA N-3000 循转蒸发仪,上海爱朗仪器有限公司;循环水式真空泵,郑州长城科工贸有限公司;DK-98-II 水浴锅,天津市泰斯特仪器有限公司;ISO9001 型电子天平,北京赛多丽斯仪器系统有限公司;SB25-12DTD 型超声波清洗机,宁波新芝生物科技股份有限公司;LGJ-18 型真空冷冻干燥机,北京松源华兴科技发展公司;UV755B 型紫外可见分光光度计,上海佑科仪器仪表有限公司。
2 试验方法
2.1 样品制备
新鲜松乳菇用水洗去表面尘土后,置于烘箱中50 ℃烘干,粉碎成粉末。
2.2 葡萄糖标准曲线制作
使用苯酚硫酸法测定提取物中的多糖含量。物质多糖在浓硫酸溶于水时产生的瞬间高温作用下水解产生单糖,并迅速脱水成糠醛衍生物。在强酸条件下与苯酚起显色反应,生成的橙黄色物质在波长490 nm 处有最大吸光值,吸光值与糖浓度呈线性关系[16]。配制质量浓度为0.5 mg·mL-1的葡萄糖标准品母液,分别取母液稀释至质量浓度为0.005、0.015、0.025、0.035、0.045 mg·mL-1。分别各取1 mL 溶液并加入6%苯酚1 mL,再缓慢加入5 mL 浓硫酸反应,冷却后于490 nm 下测定吸光值。以质量浓度为横坐标,吸光值为纵坐标,绘制葡萄糖标准曲线并得到回归方程。
2.3 提取方法对比试验
考察水提法、酶提法(纤维素酶、木瓜蛋白酶、胰蛋白酶)、醇提法(50%乙醇、75%乙醇) 对松乳菇多糖提取率的影响,筛选出较优的提取方法。
1) 水提法:称取适量的原料粉末于烧瓶中,按料液比为1∶8 加入蒸馏水,浸泡2 h,100 ℃回流提取2 次,每次2 h。合并提取液,减压浓缩后,用85%乙醇对浓缩液进行醇沉处理,4 ℃静置过夜,去上清,50 ℃减压浓缩后于真空干燥箱中50 ℃真空干燥得到粗多糖提取物。
2) 酶提法:称取适量的原料粉末于烧瓶中,按料液比为1∶8 加入蒸馏水,按原料100 g 使用30 mg的酶用量分别加入纤维素酶、木瓜蛋白酶、胰蛋白酶。60 ℃水浴提取2 次,每次2 h。之后100 ℃沸水浴10 min 使酶灭活。合并提取液,减压浓缩后,用85%乙醇对浓缩液进行醇沉处理,4 ℃静置过夜,去上清,50 ℃减压浓缩后于真空干燥箱中50 ℃真空干燥得到粗多糖提取物。
3) 醇提法:称取适量的原料粉末于烧瓶中,按料液比为1 ∶8 分别加入50%乙醇和75%乙醇。浸泡2 h,80 ℃回流提取2 次,每次2 h。合并提取液,减压浓缩后,用85%乙醇对浓缩液进行醇沉处理,4 ℃静置过夜,去上清,50 ℃减压浓缩后于真空干燥箱中50 ℃真空干燥得到粗多糖提取物。
2.4 单因素试验
基于提取方法比较试验结果,对最佳提取方法中的条件进行单因素试验。
2.5 正交试验
基于单因素试验选取的因素及结果,设计组合正交试验,对提取工艺进行优化,以确定各因素的影响程度,最终确定最佳工艺条件。
2.6 提取物对α-淀粉酶活性的抑制作用
使用二硝基水杨酸(DNS) 法测定α-淀粉酶活性[17]。作用原理:溶液中的α-淀粉酶将淀粉水解为还原糖,加入3,5-二硝基水杨酸后发生颜色反应,溶液由无色变为红棕色,此时可在540 nm 处测得最大吸光值,当加入酶抑制剂后,由于酶活性受到抑制,水解生成的还原糖减少,溶液的红棕色消退。根据数据变化分析提取物对α-淀粉酶的抑制作用[18]。
3 mL PBS 缓冲液(pH 6.8) 中加入0.5%可溶性淀粉溶液1 mL 和DNS 溶液5 mL,作为空白调零组。在2 mL PBS 缓冲液中加入1% α-淀粉酶溶液2 mL、0.5%淀粉1 mL 和DNS 溶液5 mL,作为对照组,测得吸光值A。取1 mL 待测样品溶液,加入PBS 缓冲液定容至3 mL,再加入1%的α-淀粉酶溶液1 mL,摇匀。放入37 ℃水浴预热10 min,加入0.5%淀粉溶液1 mL,在37 ℃恒温水浴锅中反应10 min 取出,加入DNS 溶液5 mL,沸水浴5 min 取出,冷却后于540 nm 下测得试验组吸光值A1。另取1 mL 与试验组质量浓度相同的被试样品溶液为本底对照组,加入PBS 缓冲液定容至4 mL,置于37 ℃水浴预热10 min,加入PBS 缓冲液1 mL,37 ℃水浴10 min,加入PBS 缓冲液5 mL,置于沸水中水浴5 min,冷却后于540 nm 下测得吸光值A0。每组试验3 个平行,最终值取3 次的平均值,抑制率(IA,%) 的计算公式为:
式中:A1为试验组吸光值;A0为本底对照组吸光值;A 为对照组吸光值。
2.7 提取物对α-葡萄糖苷酶活性的抑制作用
使用4 -硝基酚-α-D-吡喃葡萄糖苷(PNPG)比色法测定α-葡萄糖苷酶活性[19]。作用原理:溶液中的PNPG 被α-葡萄糖苷酶水解为葡萄糖和对硝基酚(PNP),在碱性条件下,溶液由无色变成黄色,PNP 在405 nm 处可测得最大吸光值,加入酶抑制剂后水解反应变弱导致PNP 的生成减少,溶液颜色变淡。根据数据变化分析提取物对α-淀粉酶的抑制作用[20]。
5 mL PBS 缓冲液(pH 6.8) 中加入0.1 mmol·L-1PNPG 2 mL 和0.1 mol·L-1Na2CO3溶液2 mL,作为空白调零组。4 mL PBS 缓冲液中加入20 mg·mL-1α-葡萄糖苷酶1 mL、PNPG 1 mL 和Na2CO3溶液1 mL 作为对照组,在400 nm 处测得吸光值A′。取1 mL 被试样品溶液,加入缓冲液定容至4 mL,后加入α-葡萄糖苷酶溶液1 mL,摇匀后置于37 ℃水浴锅中加热反应10 min,加入PNPG 2 mL,后继续于37 ℃水浴10 min,取出并加入Na2CO3溶液2 mL,摇匀后于400 nm 处测得试验组吸光值A′1。另取相同浓度被试样品溶液1 mL 加入PBS 缓冲液定容至5 mL,摇匀后于37 ℃水浴锅中加热10 min,随后加入PNPG 2 mL,继续在37 ℃水浴中加热10 min取出,加入Na2CO3溶液2 mL,于405 nm 下测得本底对照组吸光值A′0。每组试验3 个平行,最终值取3 次的平均值,抑制率(IG,%) 计算公式为:
式中:A′1为试验组吸光值;A′0为本底对照组吸光值;A′为对照组吸光值。
2.8 数据分析
采用Origin 21 和SPSS 17.0 软件对试验数据进行方差和显著性分析。
3 结果与分析
3.1 葡萄糖标准曲线
绘制的葡萄糖标准曲线见图1。
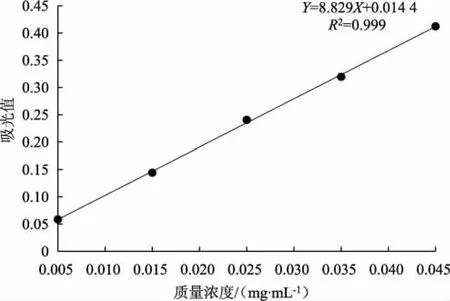
图1 葡萄糖标准曲线Fig.1 Glucose standard curve
如图1 所示,以质量浓度(X) 为横坐标,吸光值(Y) 为纵坐标,绘制标准曲线得到回归方程Y=8.829X+0.014 4,相关系数R2为0.999。
3.2 提取方法对比试验结果
使用水提法、酶提法(纤维素酶、木瓜蛋白酶、胰蛋白酶)、醇提法(50%乙醇、75%乙醇) 提取松乳菇多糖,不同提取方法对多糖提取率及酶活性抑制率的影响见图2。
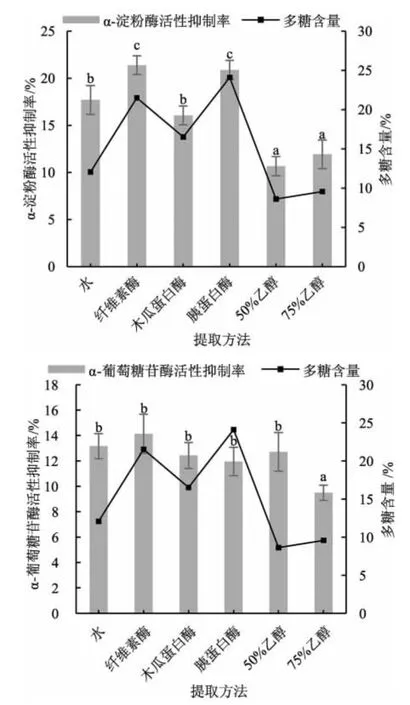
图2 不同提取方法对松乳菇提取物中多糖含量与酶活性的影响Fig.2 Effect of different extract methods on polysaccharide content in Lactarius deliciosus extracts and enzyme activity
由图2 可知,用纤维素酶酶解得到的提取物中的多糖含量均高于其他提取方法,提取得到的多糖提取物对α-淀粉酶和α-葡萄糖苷酶活性的抑制率也均高于其他组,为最佳提取方法。
3.3 单因素试验结果
针对纤维素酶酶用量、提取时间、提取温度3个因素进行单因素试验。酶用量:每100 克样品的酶用量为10、20、30、40、50 mg;提取时间:1、2、3、4 h;提取温度:40、60、80、100 ℃。纤维素酶不同酶用量对松乳菇多糖提取率及酶活性抑制率的影响见图3。
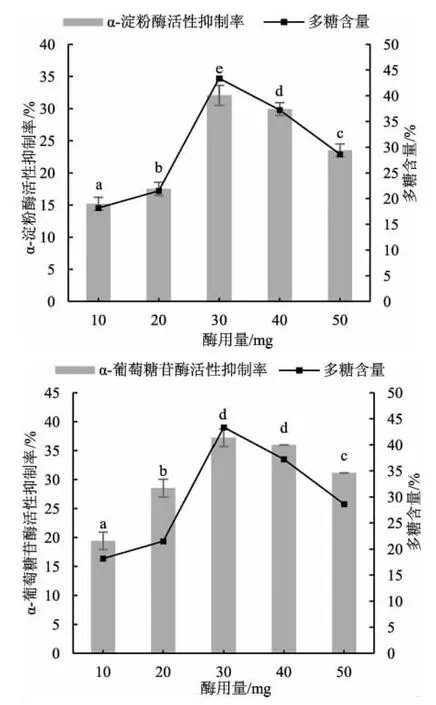
图3 纤维素酶不同酶用量对松乳菇提取物中多糖含量与酶活性的影响Fig.3 The effect of different enzyme dosages of cellulase on polysaccharide content in Lactarius deliciosus extracts and enzyme activity
由图3 可知,结果显示纤维素酶的酶用量为30 mg时,得到的提取物中多糖含量较高,且对α-淀粉酶和α-葡萄糖苷酶活性的抑制率也较强。
不同提取时间对松乳菇多糖提取率及酶活性抑制率的影响见图4。
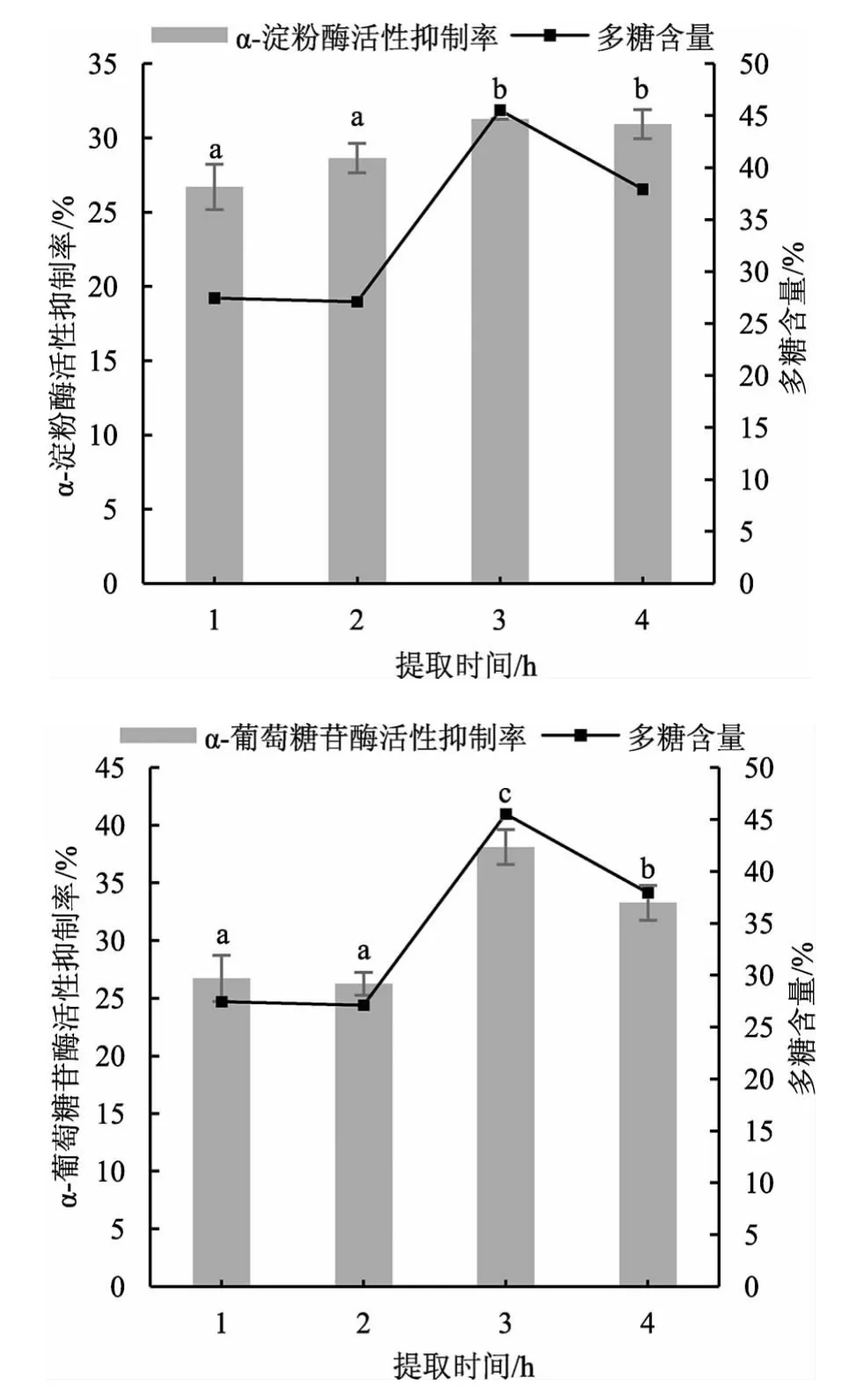
图4 不同提取时间对松乳菇提取物中多糖含量与酶活性的影响Fig.4 Effect of different extraction times on polysaccharide content in Lactarius deliciosus extracts and enzyme activity
由图4 可知,当提取时间为3 h 时,多糖含量较高,提取时间继续延长至4 h 时,多糖含量趋于稳定,时间继续延长多糖含量变化较小。
不同提取温度对松乳菇多糖提取率及酶活性抑制的影响见图5。
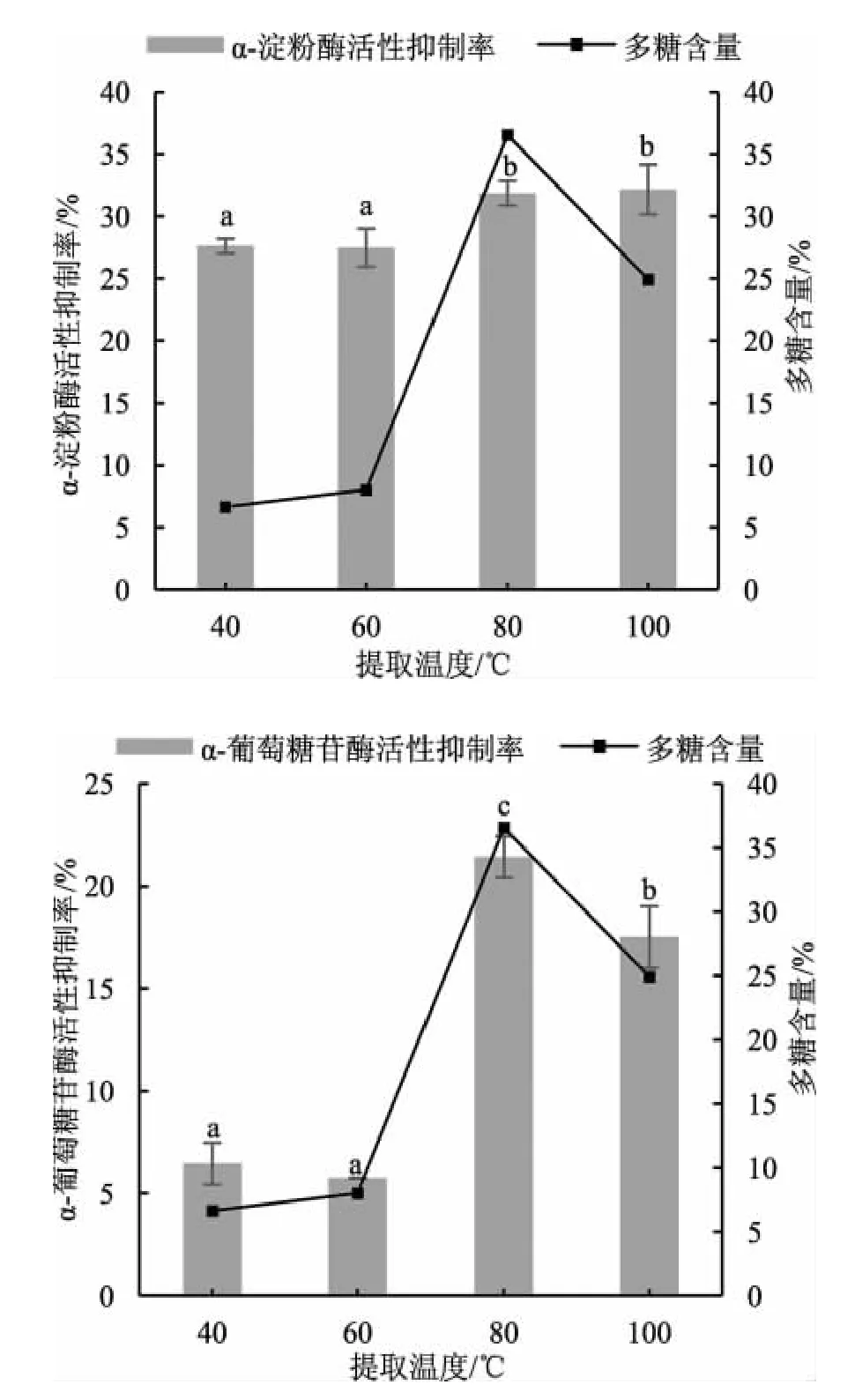
图5 不同提取温度对松乳菇提取物中多糖含量与酶活性的影响Fig.5 Effect of different extraction temperatures on polysaccharide content in Lactarius deliciosus extracts and enzyme activity
由图5 可知,当提取温度为80 ℃时多糖的含量较高,提取温度为100 ℃时,多糖含量开始下降,对α-淀粉酶和α-葡萄糖苷酶活性的抑制率强弱也随之变化,原因可能是高温影响物质结构所致。
3.4 正交试验结果
根据单因素试验结果开展纤维素酶酶提法正交试验,对酶用量(A)、提取时间(B)、提取温度(C)3 因素3 水平组合正交,L9(33) 正交表见表1。
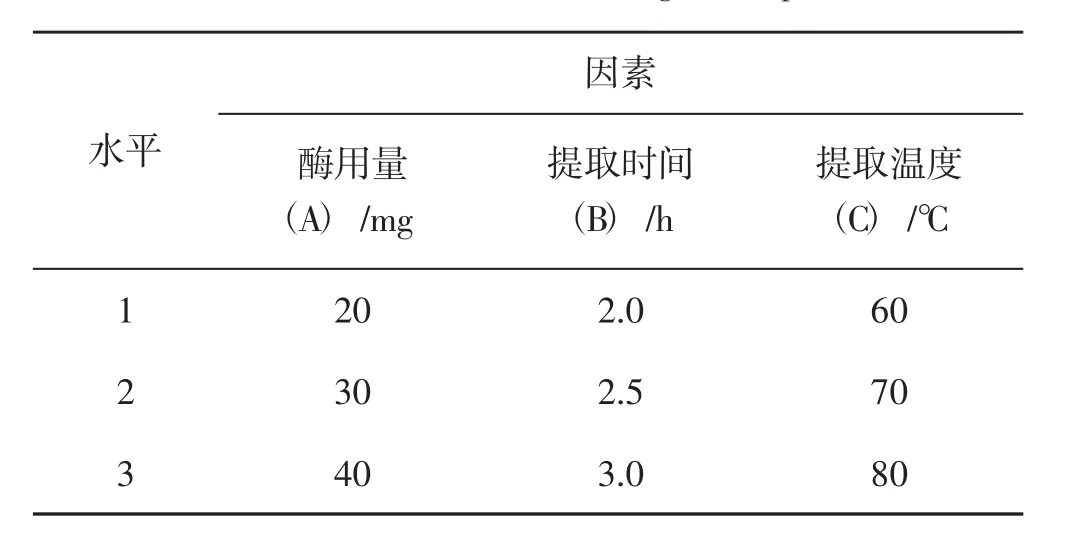
表1 正交试验的因素与水平Tab.1 Factors and levels of orthogonal experiment
根据表1 的设计方案进行试验,结果及方差分析见表2~表5。

表2 松乳菇提取物对α-淀粉酶活性的抑制作用Tab.2 Inhibitory effect of Lactarius deliciosus extracts on α-amylase activity
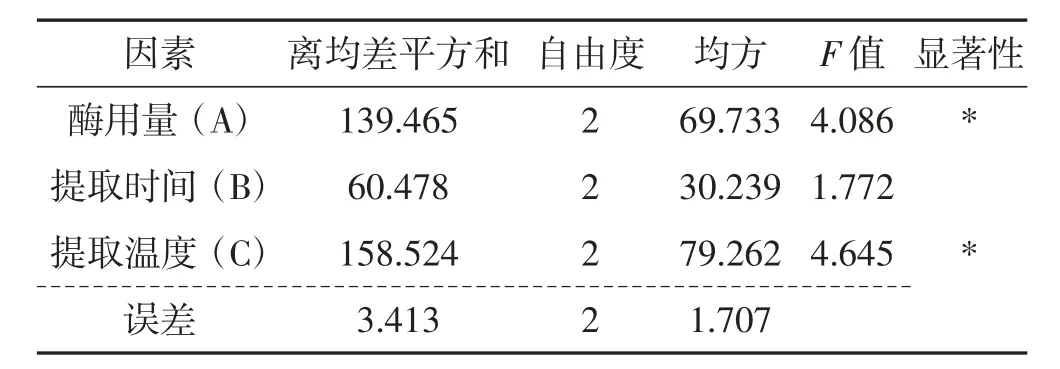
表3 松乳菇提取物对α-淀粉酶活性抑制作用的方差分析Tab.3 Variance analysis of the inhibitory effect of Lactarius deliciosus extracts on α-amylase activity
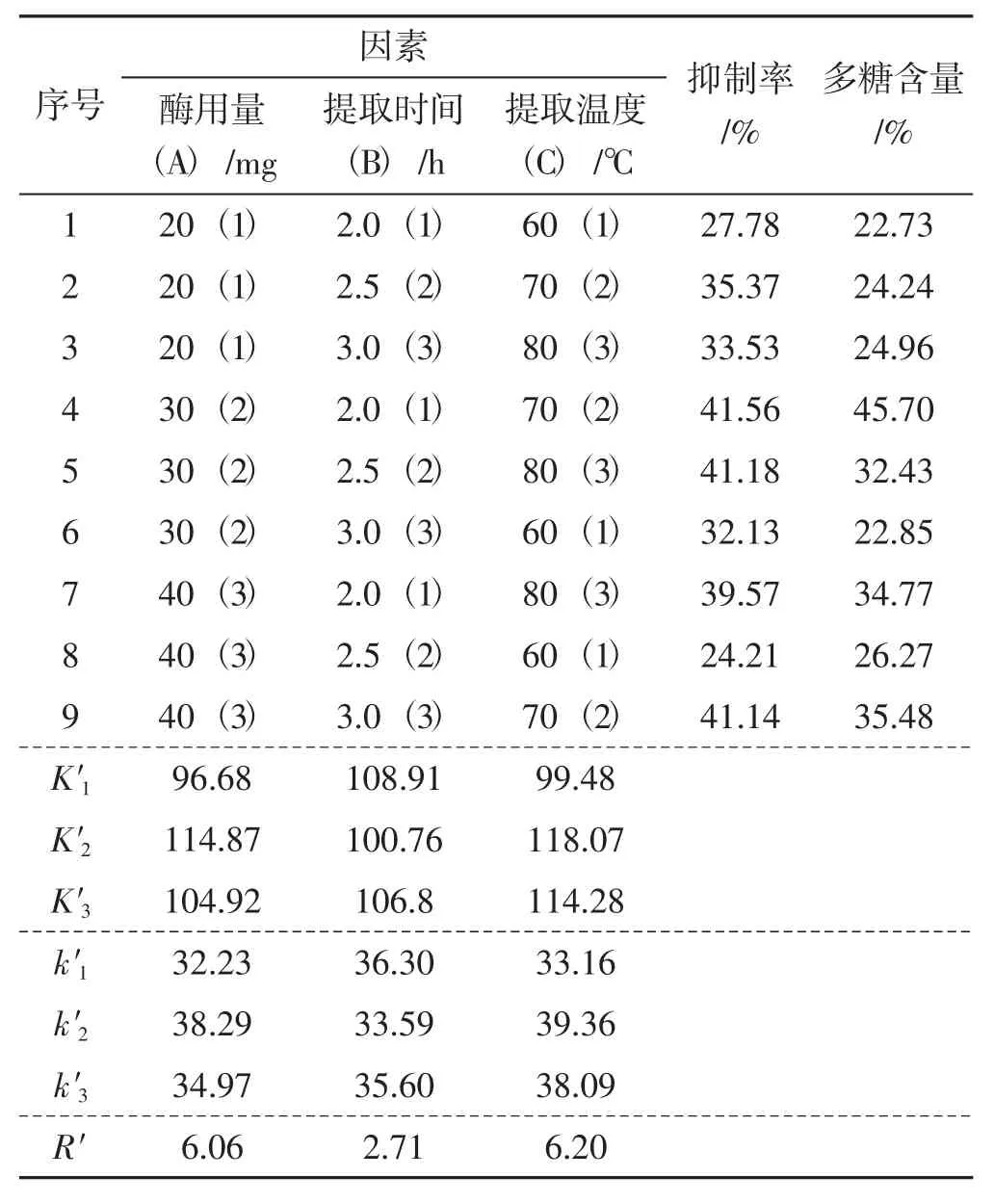
表4 松乳菇提取物对α-葡萄糖苷酶活性的抑制作用Tab.4 Inhibitory effect of Lactarius deliciosus extracts on α-glucosidase activity
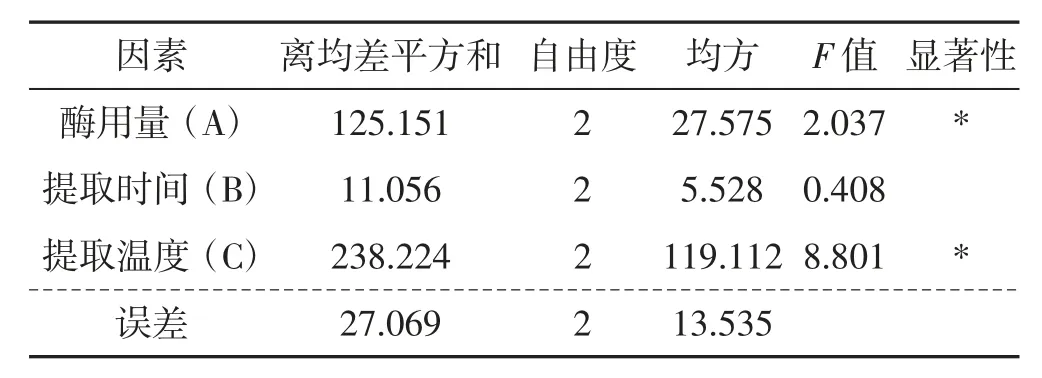
表5 松乳菇提取物对α-葡萄糖苷酶活性抑制作用的方差分析Tab.5 Variance analysis of the inhibitory effect of Lactarius deliciosus extracts on α-glucosidase activity
由表2~表5 结果分析可知,影响松乳菇多糖提取率的主次因素为C>A>B,提取温度(C) 的影响作用较大,而提取时间(B) 对其的影响较小。随着多糖含量的增加,对α-淀粉酶、α-葡萄糖苷酶活性的抑制作用也随之增强。综合分析最终得出松乳菇多糖的最佳提取工艺为A2B1C2,即纤维素酶酶用量为30 mg,提取时间为2.0 h,提取温度为70 ℃。
4 结论与讨论
本试验中选择不同提取方法对松乳菇多糖进行提取,通过单因素试验确定纤维素酶酶提法所得多糖含量最高,并通过正交试验优化提取工艺,最终确定了纤维素酶酶提法影响松乳菇多糖提取的主次因素为C>A>B,最佳提取工艺为A2B1C2,即纤维素酶酶用量为30 mg,提取时间为2.0 h,提取温度为70 ℃。
采用α-淀粉酶和α-葡萄糖苷酶的活性为指标,测定各多糖样品的体外降血糖活性。在最佳条件下提取得到的粗多糖含量可达45.70%,对α-淀粉酶活性抑制和α-葡萄糖苷酶活性抑抑制率可达41.80%和41.56%。试验结果表明,各样品均呈现出不同程度的降血糖活性,活性强弱与多糖含量基本呈现正相关。因此可初步得出松乳菇中的主要降血糖物质为松乳菇多糖。后续将进一步探明有效物质的作用机制,为松乳菇在食品、药品等领域的开发利用提供理论依据。

