雌激素及其受体对肠易激综合征影响的研究进展
王 莹 常 江 杨 玄 余 荻 徐声润
IBS 是一种以与排便相关的腹痛及腹部不适为主要特征的功能性肠病。根据IBS 罗马Ⅲ、罗马Ⅳ诊断标准,IBS 的全球患病率分别为9.2%和3.8%[1],在中国IBS 的患病率为1.4%~11.5%[2]。研究表明IBS 是由多种因素共同作用引起的脑-肠互动异常,其中中枢因素为中枢神经系统(CNS)对外周传入信号处理异常,外周因素包括内脏高敏感(VH)、肠道动力异常、肠黏膜通透性增高、免疫反应激活和肠道微生态紊乱等,这2 种因素相互作用且紧密联系[2]。
雌激素是一种甾体激素,包括雌二醇(E2)、雌酮和雌三醇,其中E2的生物活性最强。雌激素通过激活雌激素受体(ER)发挥生理作用,包括经典核受体ERα、ERβ 及G 蛋白偶联雌激素受体(GPER),这3 种受体在脑-肠轴不同部分的分布存在差异[3]。
研究表明,男性与女性的IBS 患病率之比为1∶1.16[4]。Weaver 等[5]的研究发现,与同年龄段健康女性相比,女性IBS 患者的血清E2水平显著升高,且其ERα 和GPER 的表达水平均显著升高,ERβ 的表达水平显著降低[6],这提示雌激素可能可以导致IBS 的发生。然而,女性IBS 患者的症状在血清E2水平较低的黄体晚期及月经期加重[7]。Lenhart 等[8]的研究也发现,绝经后女性IBS 患者的症状比未绝经者更严重。此外,另有研究表明,补充植物性雌激素大豆异黄酮可通过上调ER 表达而显著减轻女性IBS 患者的症状[9]。由此可见,雌激素及ER 在IBS 的发生和进展中可能起着多重作用。本文就雌激素及ER 对IBS 影响的研究进展作一综述,以期为IBS 患者的诊断和个体化治疗提供新的思路。
1 影响CNS
脑-肠轴是指CNS 与肠道间的信息交互网络,CNS 的结构改变及信号传递处理异常可以导致IBS患者肠道内分泌、免疫及微生态紊乱。
在结构方面,大脑岛叶处理内脏传入信息并下传至杏仁核、下丘脑和中脑导水管周围灰质,构成情绪唤醒网络,其中杏仁核对于痛觉敏化起着至关重要的作用,内侧前额叶及扣带回则参与了疼痛调节的相关反应[10]。研究表明,IBS 患者大脑中上述关于情绪唤醒及痛觉调节的区域发生了改变;相比于健康对照组,IBS 患者的前扣带回皮质较薄,双侧岛叶、双侧杏仁核、左扣带回的体积缩小,左侧中央后回体积增大,且背外侧前额叶皮层厚度与疼痛程度呈负相关,前岛叶厚度与疼痛持续时间呈正相关[11]。多项研究表明,IBS 患者的前额叶、扣带回、岛叶及杏仁核等相关大脑区域存在性别差异,且女性的情绪唤醒及痛觉感受区域更易被激活[10,12]。Hubbard 等[13]的研究发现,补充E2能显著提升结直肠受到伤害性刺激的大鼠的岛叶、前扣带回、杏仁核等脑功能分区的活跃度,从而增强大脑对内脏伤害感受的处理功能。
在信息处理方面,雌激素可能通过调控以下2 类物质影响IBS 的症状。其一,脑源性神经营养因子(BDNF),其主要在CNS 中表达,可以维持和促进神经元[尤其是5-羟色胺(5-HT)和多巴胺神经元]的生长发育和突触间连接。研究发现,E2可通过激活ERα 诱导大脑齿状回颗粒细胞释放BDNF,从而提升神经系统的活跃度并促进内脏超敏信号的接收[14]。此外,Scharfman 等[15]的研究还发现E2可上调海马体中BDNF 的表达,使女性焦虑相关疾病和创伤后应激综合症的发生率升高。其二,N-甲基-D-天冬氨酸受体(NMDAR),它是CNS 中一种可兴奋神经元并促进痛觉敏感信号传递的氨基酸受体,E2可上调NMDAR 亚单位1 的表达,而睾酮则可起到相反作用[16]。
由此可见,雌激素可强化CNS 对疼痛信号的感知,但也有不同的观点被提出。其一,雌激素可抑制部分神经胶质细胞过度活化而减轻疼痛反应。Lee 等[17]对脊髓损伤大鼠注射E2,可激活表达于L4~L5 背角神经元的ERβ,从而抑制小胶质细胞和星形胶质细胞的活化,并抑制小胶质细胞产生TNF-α、IL-1、IL-6 及前列腺素E2(PGE2)等炎症介质,从而减轻大鼠的神经病理性疼痛及痛觉过敏。其二,精神情绪障碍是IBS 发生、进展的重要影响因素。5-HT 主要由肠嗜铬细胞释放,是大脑产生愉悦情绪的重要介质,5-HT 再摄取抑制剂可通过升高大脑内5-HT 水平而起到抗抑郁的作用。研究表明,E2通过激活ERα 可下调5-HT 再摄取转运体的表达[18],而通过激活ERβ 可上调色氨酸羟化酶2 的表达,从而上调5-HT 的表达[19];对于更年期或分娩后的女性,其体内血清E2水平降低可导致5-HT 活性减弱并引发情绪障碍。因此,雌激素可以通过上调5-HT 表达而改善女性IBS 患者的心理状态和IBS 症状。综上所述,雌激素可通过影响CNS 参与疼痛信号处理,但其所产生的效应可能因其介导的受体和作用途径的不同而存在差异。
2 调节VH
VH 是IBS 的核心发病机制。女性通常具有较低的疼痛阈值和耐受度、较高的疼痛感受级别;纤维肌痛、偏头痛等慢性疼痛性疾病亦多见于女性,而这类疾病又常与IBS 并发。此外,研究表明女性IBS 患者在绝经后腹痛程度降低[20],这提示雌激素可能发挥着增强VH 的作用。作为IBS 神经内分泌调节中的重要神经递质,5-HT 不仅可以影响CNS,还可在外周促进胃肠蠕动和消化酶及消化液的分泌,提高胃肠道对于扩张刺激的敏感度,并起到增强VH 的作用,而雌激素则可上调5-HT 的表达,这提示雌激素可能可以间接增强VH。Lu 等[21]的研究也发现5-HT 对卵巢切除(OVX)小鼠VH的诱导作用不显著,然而给予OVX 小鼠E2、GPER激动剂后5-HT 则可增强VH,这提示5-HT 可能是通过与雌激素发挥协同作用以诱导VH 的。此外,辣椒素受体(TRPV1)广泛分布于感觉神经末梢和平滑肌细胞,其活化后不仅可激活疼痛信号通路[22],还可通过与5-HT 共表达以增强VH。多项研究表明,E2可提高TRPV1 的敏感度并促进其表达,从而加重IBS 疼痛症状[23-24]。
尽管IBS 患者的症状存在性别差异,且多项研究表明E2可增强VH,但该结论尚存争议。Zhang等[25]的研究结果显示,对雌激素处于较低水平的OVX 大鼠皮下植入雌激素药丸,使大鼠血清雌激素水平迅速升高,可逆转OVX 诱导的VH。另有研究表明,雌激素可通过激活GPER 或ERβ 以提高疼痛阈值,缓解VH[26-27]。
综上所述,雌激素通过激活ERα 可降低肠道疼痛阈值并增强疼痛信号传导,从而增强VH,而通过激活ERβ 及GPER 则可提高肠道疼痛阈值从而缓解VH,但雌激素所调节的其他疼痛反应相关物质及具体作用机制有待于进一步研究。
3 肠道动力异常
IBS 的另一个重要的症状是肠道动力异常。女性的肠道传输速度比男性慢,有研究表明,在E2水平较高的卵泡期,女性胃肠动力减弱,表现为胃舒张时间延长及移行性复合运动减弱等[28]。一氧化氮(NO)具有抑制结肠环形肌收缩的作用,一方面,激活ERα 可促进一氧化氮合酶(NOS)的表达以促进NO 合成[29];另一方面,GPER 可促进肠道氮能神经元释放NO,从而抑制肠道蠕动,这种效应可能是通过三磷酸肌醇与细胞表面G 蛋白耦联受体结合从而提高细胞内Ca2+水平而引起的[26]。Al-Shboul 等[30]的研究发现,ERα 及ERβ 被激活后均可触发环磷酸鸟苷酸途径而引起平滑肌松弛。此外,除可调节疼痛外,TRPV1 也可抑制结肠收缩,而E2同样可通过上调TRPV1 的表达以抑制结肠蠕动。因此,雌激素抑制肠道蠕动可能是女性IBS 患者的IBS 分型以便秘型为主的原因。
4 调节肠黏膜炎症反应及免疫
肠黏膜通透性增高可使肠道细菌、内毒素、炎症介质等更易进入机体内环境,导致肠道发生低度炎症反应,从而激活肠道免疫系统,并进一步损伤肠黏膜屏障。一项纳入了112 004 例溃疡性结肠炎(UC)患者的荟萃分析发现,45 岁前男、女性的UC 发病率差异无统计学意义,但由于女性45 岁后雌激素水平下降并进入围绝经期及绝经期,因此45 岁后男性UC 发病率显著高于同龄女性[31],这提示雌激素可能可以减轻机体的炎症反应。而另一方面,妊娠期女性的循环E2水平是非妊娠期女性的60 倍[32],Bränn 等[33]的研究发现妊娠期女性Th2 细胞活性增强、非特异性抗体水平升高、抑炎因子表达水平升高。ERα 和ERβ 在肠道炎症反应中发挥着相反的作用。有研究发现,敲除ERα基因的小鼠的结肠炎发病风险显著降低[34],这可能是因为雌激素可通过激活ERα 从而促进T 细胞活化和增殖,以增强自身免疫反应及炎症反应[35]。然而,激活ERβ 则可维持转化生长因子-β(TGF-β)依赖性T 细胞的免疫抑制功能[35],并参与维持肠黏膜屏障功能的完整性,从而在结肠黏膜免疫稳态中发挥关键作用。此外,Son 等[36]的研究发现,经偶氮甲烷/葡聚糖硫酸钠诱导的结直肠癌模型小鼠被敲除ERβ基因后,其体内促炎因子IL-6、IL-17、TNF-α 和干扰素-γ 水平均显著升高,可导致结肠炎进展。然而,雌激素对其他炎症因子的调节作用及机制尚待进一步探索。
5 调节肠道微生态
大量细菌定植于人类肠道,并通过神经、免疫和内分泌途径与脑-肠轴紧密联系。IBS 患者体内存在肠道微生态失衡,包括肠道菌群构成比例失调及其代谢产物改变。近年来的研究表明雌激素可调节肠道菌群。
IBS 患者的整体肠道菌群丰度降低,而一项纳入了1 135 名受试者的队列研究表明,相比于同龄男性,女性体内的肠道菌群种类更丰富,而使用口服避孕药或接受OVX 则可改变肠道菌群种类[37]。动物实验表明,OVX 大鼠的肠道菌群丰度显著降低[38]。短链脂肪酸(如乙酸、丙酸和丁酸等)由肠道细菌酵解产生,其可调节肠道菌群和肠道炎症反应及免疫。不同IBS 亚型患者的肠道短链脂肪酸种类和水平均存在差异,研究结果显示,相比于男性,女性粪便中的拟杆菌丰度更高,且产生的乙酸、丁酸更多[39]。
雌激素可影响厚壁菌门、拟杆菌门、变形菌门、阿克曼菌和双歧杆菌。研究发现IBS 患者肠道厚壁菌门比例增高,而拟杆菌门比例降低[40]。Shin 等[41]的研究分别根据男性睾酮水平和女性E2水平将57名受试者分为低、中、高水平3 组,结果显示与低E2水平组相比,高E2水平组的肠道拟杆菌门比例升高而厚壁菌门比例降低。OVX 可增高小鼠厚壁菌门和变形菌门的相对丰度,降低拟杆菌门的丰度[42]。变形菌门可抑制抑炎因子IL-10 及Toll 样受体的产生,同时可增强促炎因子IL-17、TGF-β 的促炎作用[43]。Menon 等[44]的研究发现,在ERβ 高表达组、ERβ 低表达组小鼠肠道内,变形菌门比例分别为14%和21%,口服补充E2可显著降低ERβ高表达组的肠道变形菌丰度,而ERβ 低表达组的变化则不显著,这提示E2可能可以通过激活ERβ以降低变形菌门的丰度,从而减轻肠道炎症反应。阿克曼菌可减少巨噬细胞浸润、改善肠道屏障功能、提高5-HT 水平[45]。多项研究表明,相比于男性,女性肠道中阿克曼菌数量显著增加[46-47]。此外,Kaliannan 等[48]的研究发现,经E2处理的雄性小鼠及OVX 小鼠肠道中阿克曼菌数量均显著增加。双歧杆菌除可用于便秘的辅助治疗外,还可抑制对牵张刺激敏感度较高的肠道神经元[49]。IBS 患者的肠道双歧杆菌丰度显著降低,而Zeibich 等[50]的研究则发现,外源性E2可增高肠道双歧杆菌的丰度,改变绝经女性的粪便菌群结构,这提示给予绝经期女性IBS 患者雌激素或可通过调节肠道微生态以改善其IBS 症状。
6 总结与展望
如图1 所示,雌激素可通过参与调节脑-肠互动各个环节从而影响IBS 的发生和进展。然而,由于ERα、ERβ 及GPER 这3 种雌激素受体的分布、表达、介导途径及效应不同,因此雌激素对IBS 的影响尚未形成定论。今后的研究应综合考虑IBS 患者的性别、年龄和症状,选择合适的雌激素或选择性雌激素受体激动剂,以制定个体化治疗方案。
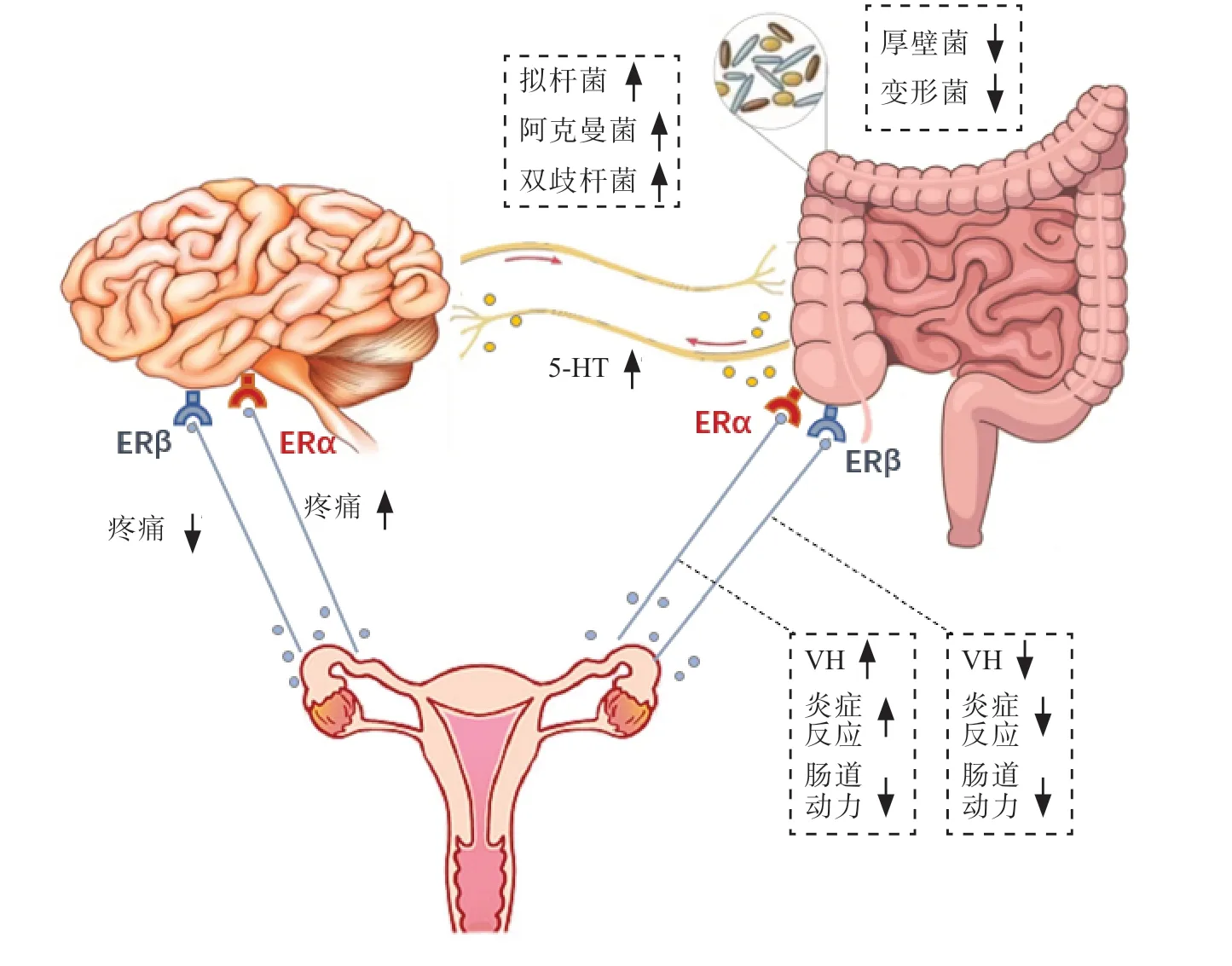
图1 雌激素及ER 参与调节IBS 患者的脑-肠互动

