油松抗性相关激素与代谢物对油松毛虫取食与剪叶刺激的响应
赵亚楠,孙天骅,王利峰,许 强,刘军侠,高宝嘉,周国娜
(河北农业大学林学院,河北 保定 071000)
植物受到胁迫后会启动茉莉酸(jasmonic acid,JA)、水杨酸(salicylic acid,SA)和乙烯途径参与抗性的形成[1-2],并且JA、茉莉酸甲酯(methyl jasmonate,MeJA)、SA与脱落酸(abscisic acid,ABA)等植物激素之间的相互作用在植物体中广泛存在[3-4]。抗性形成过程同样是植物体平衡生长和防御的过程,如,植物响应胁迫时会在叶绿体中产生大量的活性氧,ABA则可通过调节气孔的开闭控制光合作用,以此参与调控植物抗逆。在林木抗虫性形成过程中,抗性紧密相关激素JA、SA与生长发育相关激素之间的相互关系仍需进一步探究。代谢物是反映植物体变化的最直接指标,不同胁迫因子诱导不同代谢物发生变化[5]。樟子松(Pinussylvestrisvar.mongolia)中的酚类与萜烯类物质含量在松异舟蛾(Thaumetopoeapityocampa)刺激下发生变化[6];黏虫(Mythimnaseparate)取食刺激诱导甘蔗(Saccharumofficinarum)中参与碳水化合物、苯丙烷类、尼古丁合成代谢途径的物质表达上调[7]。植物激素是次生代谢物被诱导表达的信号分子[8],但激素与抗性物质相关关系的探究多通过在室内施加外源激素来进行,林木感受到刺激后内源激素的表达与抗性物质之间的相互作用及调控方式仍然比较模糊。
自然条件下的油松(P.tabuliformis)受到生物胁迫后,防御酶类、次生代谢物质、蛋白酶抑制剂的组成和含量发生明显变化,生物碱、酚类化合物、单宁等化学物质含量增加,某些防御蛋白质的含量同样发生变化[9-12]。但相关研究仅解决了单一的物质变化情况,缺乏对针叶树的抗虫性代谢通路的整体探究。随着油松染色体基因组测序工作的完成,油松中复杂的调控元件对基因表达的作用也为针叶树的抗虫机制研究提供了强有力的参考[13]。为了确定针叶树抗虫过程中代谢物的整体变化,以自然条件下的油松和油松毛虫(Dendrolimustabulaeformis)为研究对象,同时以剪叶处理作为机械损伤,对不同处理后油松针叶的内源植物激素JA、SA、生长素(IAA)和ABA的表达量进行测定,并且对未处理以及不同处理方式下油松针叶进行代谢组鉴定及验证,揭示针叶树响应昆虫胁迫过程中类黄酮途径变化的情况,为了解油松在生长与抗性相关激素的拮抗作用方面提供理论参考。
1 材料与方法
1.1 研究区概况
在河北省承德市平泉市黄土梁子林场(119°13′E,41°18′N),选取海拔(560 m)、坡度(16°)以及坡向(西南)相同,树势及管理水平相似且无油松毛虫虫害的油松纯林。该林场位于河北省东北部,与内蒙古、辽宁两省/自治区毗邻,属中温带大陆性干旱季风山地气候,年平均气温6.6 ℃,无霜期120~130 d,降水量540 mm左右。
1.2 试验设置
试验前,对5~7龄健壮油松毛虫进行饥饿处理10 h,虫源为河北省承德市平泉市七沟林场(118°21′E,40°55′N)。随机选择树龄为10 a左右、未被植食性昆虫取食的健壮油松共75棵,每组5棵树作为重复,分为15组,在自然条件下对其中7组分别进行10头油松毛虫取食刺激(feeding stimulation,FS)处理,7组分别进行剪叶(leaf clipping control,LCC)处理,1组作为对照不进行任何处理,即处理0 h(CK,记为0 h),每种处理的7组分别为处理后的0.5、1.0、1.5、2.0、4.0、6.0与8.0 h。剪叶处理用于模拟油松毛虫取食过程中的机械损伤及取食量,处理时自松针针尖反复剪叶多次模拟至10 头油松毛虫取食量。处理时选取每棵树的“东西南北” 4个方位枝长、离地高度一致的枝条进行,取松毛虫取食点和剪叶点以下3 cm针叶,每根枝条选取10根松针为1包,每组可从5棵树上共获得松针20包。对照组取完整松针10根为1包。均用锡箔纸保存,放入-80 ℃冻存。
1.3 代谢组测定
取油松针叶放置于冻干机(100F,宁波新芝生物科技有限公司)中真空冷冻干燥后利用研磨仪(MM 400,德国莱驰公司)研磨(30 Hz,1.5 min)至粉末状,称取100 mg的粉末,溶解于1.2 mL 70% (体积分数)甲醇提取液中,每30 min涡旋1次,每次持续30 s,共涡旋6次,样本置于4 ℃冰箱过夜。12 000 r/min离心10 min后,吸取上清液,用微孔(孔径0.22 μm)滤膜过滤样品,保存于进样瓶中,用于超高效液相色谱(Ultra Performance Liquid Chromatography,UPLC)(Nexera X2,日本岛津公司)和串联质谱(Tandem mass spectrometry,MS/MS)(4500 QTRAP,美国应用生物系统公司)分析,分别对取食刺激和剪叶刺激后0、2和8 h时(记为0 h、FS 2 h、FS 8 h、LCC 2 h与LCC 8 h)油松针叶中的初生代谢物和次生代谢物进行鉴定。代谢组委托武汉迈特维尔生物科技公司进行测定。
液相条件为:色谱柱,Agilent SB-C18 1.8 μm,2.1 mm×100 mm;流动相,A相为超纯水(含体积分数0.1% 的甲酸),B相为乙腈(含体积分数0.1% 的甲酸)。洗脱梯度,初始B相比例为5%(体积分数);9 min内B相比例线性增加到95%,维持1 min;10~11 min B相比例降至5%,平衡至14 min。流速0.35 mL/min;柱温40 ℃;进样量4 μL。
ESI源操作参数为:离子源,涡轮喷雾;源温度550 ℃;离子喷雾电压(IS)5 500 V(正离子模式)/-4 500 V(负离子模式);离子源气体I(GSI),气体Ⅱ(GSⅡ)和帘气(CUR)分别设置为3.447×105、4.137×105和1.724×105Pa,碰撞诱导电离参数设置为高。在三重串联四级杆(QQQ)和线性离子阱(LIT)模式下分别用10和100 μmol/L聚丙二醇溶液进行仪器调谐和质量校准。QQQ扫描使用质谱多反应监测(MRM)模式,并将碰撞气体(氮气)设置为中等。通过进一步去簇电压(DP)和碰撞电压(CE)优化,完成各个MRM离子对的DP和CE。根据每个时期内洗脱的代谢物,在每个时期监测1组特定的MRM离子对。
1.4 植物激素含量测定
称取0.6 g油松针叶,在液氮中充分研磨,加入5.4 mL pH为7.3的磷酸缓冲盐溶液(phosphate buffered saline,PBS), 4 ℃ 5 000 r/min离心30 min。JA、SA、IAA、ABA的测定使用植物激素酶联免疫分析试剂盒(上海酶联生物科技有限公司)。试剂盒采用双抗体夹心法测定植物样本中的植物激素水平。用1050酶标仪(赛默飞世尔科技公司)在波长450 nm下测定吸光值,在ELISA Calc中使用4参数Logistic模型拟合标准曲线,R2均大于0.9,表明模型拟合效果较好。
1.5 类黄酮含量测定
称取0.6 g油松针叶,在液氮中充分研磨,加入6 mL提取液,60 ℃ 300 W超声提取,每5 s间歇8 s,30 min后12 000 r/min常温离心10 min,使用植物类黄酮含量检测试剂盒(北京盒子生工科技有限公司)测定类黄酮含量。用1050酶标仪(赛默飞世尔科技公司)在波长510 nm处测定吸光值并根据标准曲线(R2> 0.99)计算植物中类黄酮含量。
1.6 数据处理
文中数据均为3次生物学重复的平均值±标准偏差。植物激素测定结果使用邓肯新复极差法检验,总黄酮测定结果使用LSD法检验,均符合P<0.05,双因素方差分析(Two-way ANOVA)、相关性分析(Spearman)均使用SPSS 21.0进行。
2 结果与分析
2.1 取食刺激与剪叶处理后油松代谢物的表达变化
使用超高效液相色谱串联质谱(UPLC-MS/MS)平台广泛靶向代谢技术鉴定取食刺激和剪叶刺激0、2和8 h的油松针叶中的初生代谢物和次生代谢物。试验共检测到999种代谢物,种类最多的前3种为黄酮类30.8%(质量分数,下同),酚酸类17.2%,脂质13.5%,其余物质的含量分别为氨基酸及其衍生物7.5%,有机酸7.0%,木脂素和香豆素5.7%,核苷酸及衍生物5.2%,萜类2.9%,鞣质1.4%,生物碱1.4%,其他物质7.3%。黄酮类物质中共监测到93种黄酮醇,90种黄酮,37种二氢黄酮,19种黄酮碳糖苷,17种黄烷醇类,15种查耳酮,15种异黄酮,13种二氢黄酮醇,7种花青素,2种双黄酮。对所有代谢物进行主成分分析(principle component analysis,PCA),如图1所示,其中第一主成分(PC1)解释了原始数据33.3%的特征。
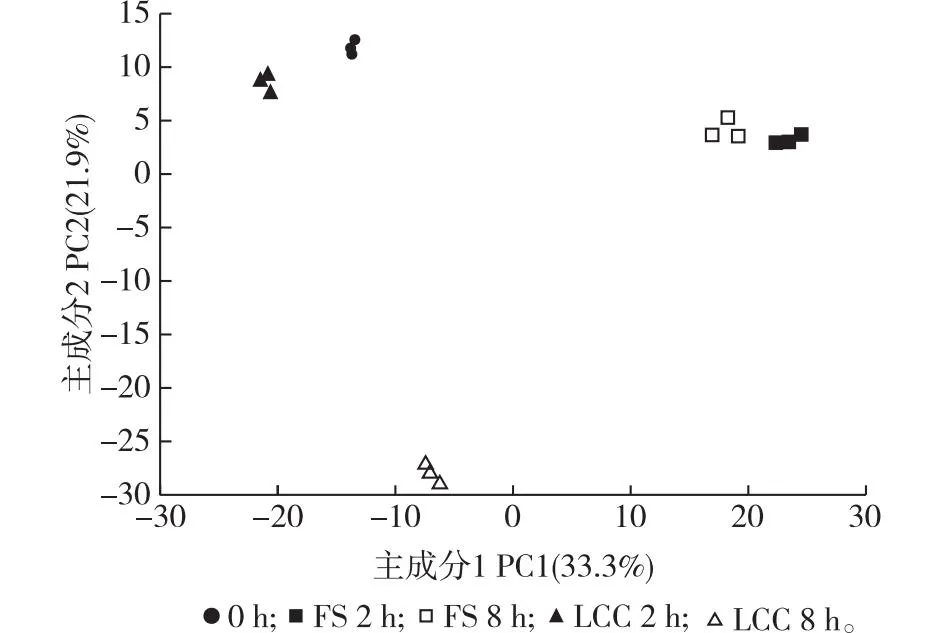
图1 各组样品的PCA得分图Fig. 1 PCA of metabolites in different groups
基于正交偏最小二乘法判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)模型的变量重要性投影(variable importance in projection,VIP)与差异倍数值(fold change,FC,式中记为FC)来进一步筛选出差异代谢物。选取log2|FC|≥1,VIP ≥ 1的物质为差异累积代谢物(different accumulated metabolites,DAMs)。经测定,0 h 和 LCC 2 h对比组中共检测到145个DAMs,0 h 和 LCC 8 h对比组中,共有229个DAMs。由图2分析可知,FS 2 h 的248个DAMs中有161个是由机械损伤引起的;FS 8 h的202个DAMs中有100个是由机械损伤引起的;取食刺激导致150个代谢物差异表达,其中28个DAMs的变化是由机械损伤外的其他物质或行为引起的。
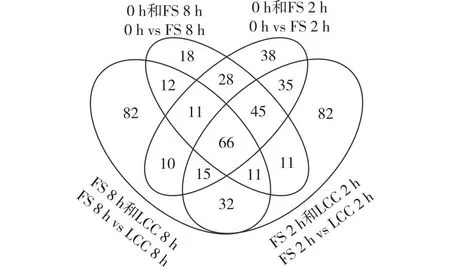
图2 各个分组中差异表达代谢物的数量Fig. 2 Number of different accumulated metabolites (DAMs) in different groups
2.2 油松差异代谢物的功能富集分析
将不同比较组中的所有DAMs匹配KEGG数据库,从而获得其通路信息,对注释结果进行富集,获得富集程度较高的通路。其中,FS 2 h 和 LCC 2 h对比组的差异代谢物主要注释和富集的前3条通路为类黄酮生物合成(12个),氨基酸合成代谢(8个),精氨酸和脯氨酸代谢(6个);FS 8 h和LCC 8 h对比组的差异代谢物主要注释和富集的前3条通路为类黄酮生物合成(14个),亚油酸生物合成(6个),黄酮和黄酮醇的生物合成(6个)。类黄酮生物合成为不同处理的两个对比组中富集到DAMs最多的途径。对不同对比组的类黄酮类物质的表达差异倍数进行分析,以确定昆虫取食与剪叶刺激中类黄酮类物质的变化情况。如表1所示,异樱花素[物质数字识别号码(chemical abstracts service number,简称CAS号):480-43-3]与山柰酚(CAS号:520-18-3)在FS 2 h和LCC 2 h对比组与0 h和FS 2 h对比组出现表达差异;橙皮素(CAS号:520-33-2)在FS 8 h和LCC 8 h对比组与0 h和FS 8 h对比组出现表达下调和表达上调;柚皮素(CAS号:480-41-1)与球松素(CAS号:480-37-5)仅在不同处理的对比组之间具有表达差异且均表现为在LCC处理中表达下调,表明油松毛虫取食刺激不会导致二者出现变化。同时,FS处理导致二氢杨梅素(CAS号:27200-12-0)、二氢槲皮素(CAS号:480-18-2)、圣草酚(CAS号:552-58-9)、根皮素(CAS号:60-82-2)、紫铆素(CAS号:492-14-8)、短叶松素(CAS号:548-82-3)、柚皮素查尔酮(CAS号:73692-50-9)表达上调,而橙皮素与香橙素(CAS号:480-20-6)的表达上调出现在0 h和8 h对比组。与FS处理相比,LCC处理2 h与8 h时分别导致异樱花素与黄颜木素(CAS号:20725-03-5)的表达上调。

表1 不同时间对比组类黄酮类物质表达差异情况
根据KEGG代谢通路还原表达具有差异的类黄酮类物质的代谢通路(图3)。苯丙氨酸途径的产物p-香豆酰辅酶A可以合成根皮素与紫铆素,进而生成根皮苷和黄颜木素。柚皮素作为整个反应的中间物质不仅生成圣草酚、二氢山柰酚(香橙素)与异樱花素,同时参与异黄酮的生物合成。圣草酚与二氢山柰酚经反应合成二氢槲皮素,与圣草酚的其他反应产物共同生成二氢杨梅素(蛇葡萄素)进入花青素的生物合成途径,二氢山柰酚的反应产物山柰酚进入黄酮和黄酮醇的生物合成。

实线表示反应没有中间步骤,虚线表示反应需要经过中间过程。Solid lines show the reaction with no intermediate steps and dashed lines show the reactions need the intermediate process. 图3 具有表达差异的类黄酮类物质代谢通路Fig. 3 Metabolic pathways of flavonoids with different accumulation
2.3 油松植物激素的含量变化及相关性分析
通过标准曲线计算样品中4种植物激素的浓度,如图4所示。随着时间的延长,FS处理使JA浓度先上升后下降再次上升。FS处理JA浓度最高点出现在1.5 h,为185.16 pmol/L,比LCC 1.5 h高59.8%。LCC处理的最高点出现在1 h,为157.43 pmol/L,比FS处理1 h高19.2%。除1 h与6 h外,其余时间点的JA浓度均表现为FS处理高于LCC处理。且除0和4 h外,其余时间点的两种处理均具有显著差异,表明与LCC处理相比,FS处理后短期(2 h)即可诱导JA的表达上调。

不同大写字母表示相同时间不同处理间的植物激素含量差异显著,不同小写字母表示相同处理不同时间的植物激素含量差异显著(P<0.05)。Different uppercase letters mean significant differences among different treat modes in the same time after different treatments at P <0.05. Different lowercase letters mean significant difference among different time after treatments under the same treat mode at P <0.05.图4 不同时间取食刺激处理与剪叶刺激处理的油松JA(A)、SA(B)、IAA(C)、ABA(D)的含量变化Fig. 4 Concentration of JA (A), SA(B), IAA(C) and ABA(D) at different time after treatment
FS处理导致SA浓度在1 h与4 h时出现断崖式下降,浓度分别为25.86与29.21 pmol/L,与0 h相比,分别降低70.0%与66.1%。LCC处理的SA浓度最低值仅出现在处理后4 h,最高点出现在处理后2 h,为115.22 pmol/L,FS处理导致SA浓度降低74.6%。2 h后LCC处理的SA浓度均高于FS处理,且随时间延长呈明显上升趋势,但两种处理之间除6 h外没有显著差异。
IAA质量浓度含量在FS处理1 h后表达显著上调达到峰值18.53 μg/L,显著高于LCC处理;LCC处理2 h的IAA质量浓度显著下调,且与FS处理之间具有显著差异;FS处理4 h与8 h时均导致IAA质量浓度高于LCC处理,表明FS处理在短期(2 h)内会引起IAA表达显著上调,而随着时间的延长LCC处理并不会引起IAA质量浓度出现显著差异。
FS处理会导致ABA质量浓度在1 h中持续升高至34.68 μg/L后降低,但处理6 h和8 h时再次出现表达上调,比0 h分别增加49.8%和23.6%。LCC处理的最高值为19.36 μg/L,出现在8 h,且仅在8 h时与0 h的表达量具有显著差异;最低值为9.40 μg/L,出现在1.5 h;虽然在处理4 h与6 h之间具有显著差异,但是在LCC处理4 h时ABA的质量浓度高于FS处理,而LCC处理6 h的质量浓度低于FS处理。
4种植物激素的双因素方差分析结果表明,处理方式、处理后不同时间及二者交互效应均对JA、SA、IAA与ABA产生极显著影响(P<0.001),不同处理主效应之间的事后检验结果显示, JA、IAA与ABA在FS处理与LCC处理、0 h与FS处理间差异显著(P<0.05),0 h与LCC处理间差异不显著;SA在0 h与FS处理间差异显著(P<0.05),在0 h与LCC处理、FS处理与LCC处理间差异不显著。表明单纯的机械损伤不会引起JA、IAA与ABA的表达显著差异。不同处理时间导致JA与SA之间、JA与IAA之间、IAA与ABA之间正相关关系显著(P<0.05),相关系数分别为0.39、0.30和0.61;SA与IAA和ABA呈负相关关系。
2.4 总类黄酮含量的变化分析
为了验证代谢组学的结果,对其中表达量差异最大的类黄酮质量浓度进行测定(图5)。随着时间推移,两种处理均会导致总类黄酮质量浓度的增加。FS与LCC处理8 h总类黄酮质量浓度分别为0.24与0.12 mg/mL,与0 h时质量浓度为0.08 mg/mL相比均差异显著,FS处理会导致表达具有显著差异;FS处理2 h和LCC处理2 h之间差异不显著,但FS处理8 h和LCC处理8 h之间差异显著;FS处理2 h和FS处理8 h的质量浓度之间具有显著差异,LCC处理则不会导致显著差异。以不同处理与处理后不同时间作为影响因子对总类黄酮质量浓度进行双因素方差分析,结果显示,处理方式的主效应极显著[F(1,10) =26.16,P<0.001];处理后不同时间主效应极显著[F(1, 10) = 39.43,P<0.001]。经综合,以LSD法对不同处理主效应之间进行事后检验,FS处理与未经处理的针叶中类黄酮的质量浓度具有显著差异,且FS处理与LCC处理8 h时差异性同样显著,但未处理的针叶与LCC处理之间没有显著性。
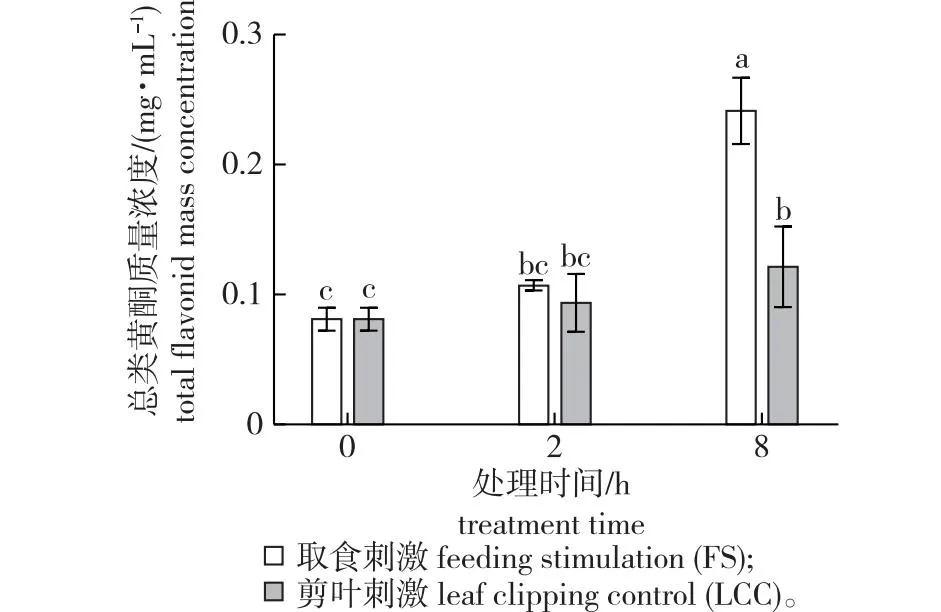
不同小写字母表示总类黄酮含量差异显著(P<0.05)。Different lowercase letters mean significant differences of total flavonoid at P <0.05.图5 不同处理下不同时间的油松总类黄酮含量Fig. 5 Concentration of total flavonoid at different time after treatment
3 讨 论
类黄酮类物质通过清除自由基抗氧化参与植物对胁迫的响应[14-17]。本研究中,松融取食刺激(FS)处理与剪叶刺激(LCC)处理的对比组中均有大量的差异累积代谢物富集在类黄酮途径。根据KEGG代谢通路,苯丙氨酸途径中C4H将肉桂酸裂解为4-香豆酸[18],进而生成p-香豆酰辅酶A后在查尔酮合酶的催化下生成柚皮素查尔酮[19],是本研究中大多数差异表达类黄酮类物质的合成前体,但不同处理8 h不存在表达差异。然而FS处理8 h查尔酮的下游物质柚皮素显著高于剪叶刺激,但柚皮素的下游物质在LCC处理2 h表达量上升。说明油松毛虫取食刺激时间的延长可能削弱了柚皮素流向异樱花素的反应,导致接下来柚皮素、圣草酚等在黄烷酮3-羟化酶(F3H)催化下形成二氢黄酮醇、二氢山柰酚、二氢槲皮素和二氢杨梅素的反应[19]。紫花苜蓿(Medicagosativa)中,石墨烯可以诱导异槲皮素和脯氨酸的上调表达参与植物对ROS的清除,保护其免受氧化损伤[20]。在处理8 h后,油松毛虫诱导了二氢山柰酚-二氢槲皮素-槲皮素的反应,且同时根据图3所示,山柰酚将参与黄酮和黄酮醇的生物合成。这些结果与黏虫取食过后的甘蔗、尺蠖(Ectropisobliqua)取食后的茶树(Camelliasinensis)中代谢物的变化保持一致[7, 21]。但除油松毛虫取食过程中机械损伤外的哪些因素诱导植物的防御启动仍然需要进一步探究。
植物受到胁迫的短期内生成大量茉莉酸(JA),茉莉酰异亮氨酸可以与COI1受体结合介导JAZs泛素化和降解,从而激活JA信号通路[22],调控类黄酮途径中花青素形成的大多数步骤[23]。本研究中JA表达变化表明油松毛虫取食刺激可能诱导了JA的表达并由其调控后续类黄酮途径参与氧化应激,且其在取食刺激短期内含量迅速升高后恢复可能是由于其过度积累导致植物防御过度而影响其生长发育[24]。水杨酸(SA)在两种处理之间、LCC处理与未处理组之间无显著差异,在FS处理1 h时出现的含量骤减可能是由于JA与SA之间的相互作用导致的[25-26]。在茶树抗虫性形成过程中JA与SA信号相互作用并调控其他植物激素的表达[27]。虽然二者的拮抗作用明显[27],但本研究中二者存在正相关关系,可能是在油松抗虫性的形成过程中JA与SA更多地表现出协同效应以调控其他植物激素的信号转导。研究表明,SA类似物可以抑制生长素(IAA)合成相关基因的表达,本研究中二者的负相关关系也可能是由于异分支酸途径中的酶的调控。ABA可以调节植物气孔开闭减少水分流失,参与植物非生物胁迫的响应[28-29],也可与JA共同作用调控植物对咀嚼式口器昆虫的防御反应[30],对杉木进行机械损伤也可以观察到内源IAA与ABA的升高[31],拟南芥中存在的可逆的氧化网络有助于ABA的信号调控[32],而黄酮类物质受JA调控参与植物的抗氧化过程。本研究中,油松在油松毛虫取食刺激后总类黄酮含量升高,且与同时间的ABA呈现显著正相关关系,而JA与ABA之间无显著相关关系,可能是在油松抗虫性形成过程中存在JA、类黄酮与ABA的相互作用共同参与氧化应激[33]。

