生长素调控水稻生长发育的研究进展
喻梓轩 刘新勇 张健 梁大成
(1 长江大学农学院,湖北 荆州 434025;2 中国水稻研究所/水稻生物育种全国重点实验室,杭州 310006;第一作者:yuzix2081520032@163.com)
生长素是植物中发现的第一个激素[1]。1880 年,Charles DARWIN 研究观察到,当单边光照到金丝雀草鞘尖时,它表现出正的向光曲率,当尖端被移除时,它没有产生弯曲。当尖端被锡箔盖覆盖时,它也没有显示出曲率。因此,他和他的儿子Francis DARWIN 在《植物运动的力量》中推测尖端含有一种植物生长物质,该物质被传递到下部,在那里它会导致曲率[2]。1910 年,BOYSEN-JENSE 证明胚芽鞘尖端产生的影响可以透过琼脂片传递给下面[3]。1914 年,PAAL 证明胚芽鞘弯曲生长是由于尖端产生的影响在胚芽鞘下部分布不均匀造成的[4]。1928 年,WENT 首次分离出在鞘尖端产生的与生长有关的物质,并把这种物质命名为生长素[5]。1931 年,KOGL 和HAAGEN-SMITH 从人类尿液中分离出三种化学物质,它们被命名为生长素a、生长素b 和异生长素[6]。1934 年,KOGL 发现异生长素是真正的植物生长素,其化学本质是吲哚3-乙酸或IAA[7-8]。1942年,HAAGEN-SMITH 等在植物材料中鉴定到生长素[9],1946 年,从未成熟的种子中将生长素分离出来[10]。生长素也因此被大众熟知和应用。
生长素是一类含有一个不饱和芳香族环状结构和一个乙酸侧链的内源激素。生长素有调节植物伸长、调控细胞形态建成和向性生长等功能。生长素在具有分生能力的组织中合成,例如幼嫩叶片和芽等,它是植物中分布最广的一种激素。生长素也是迄今发现的唯一一种极性运输的激素,它可以从植物的形态学上端(茎尖、根尖)运输到形态学下端(茎下部等)。生长素有多方面的生理效应,低浓度时可以促进生长,高浓度会抑制生长;在细胞和分子水平都能发挥作用。早在20 世纪60 年代,关于生长素的生理调控机制,KEY 等[11]提出基因活化假说,被大众接受。然而在20 世纪70 年代,RAYLE 和CLELAND[12],还有HAGER 等[13]众多科学家又提出了酸生长理论。经过实验证明,这两种假说都有一定证据但都不是很充分[12,14-15]。直到现在,这两种假说仍在延续,并未过时。基因活化假说证明,生长素不管是作为第一信使,还是作为间接激活其他基因的第二信使,最终导致蛋白质激酶或者其他无活性前体活化,进而诱发生理效应。2021 年,科学家为半世纪以来一直未解的“酸生长理论”提供直接理论证据,胞外生长素激活细胞膜表面类受体蛋白激酶TMK,通过特异磷酸化激活细胞膜表面的质子泵蛋白碳末端保守的苏氨酸位点,导致细胞壁酸化,促进细胞及组织伸长,植物发育适应环境[16-17]。
水稻(Oryza sativaL.)是禾本科稻属植物,人类重要的粮食作物之一。水稻生长发育离不开生长素。水稻作为单子叶植物的模式物种,由根、茎、叶、花、果实(稻谷、种子)等器官组成,较双子叶模式植物拟南芥,水稻的生长素运输途径和信号传导仍有很多未能得到系统研究。本文综述了20 年来生长素在水稻生长发育的调控研究,归纳整合了29 个水稻生长素相关基因在水稻的特征化功能(表1)。对生长素作用机理的了解有助于阐明生长素是怎样在植物基本生长发育过程中行使功能,为植物精准利用生长素提供理论依据,以及通过突变体表型变异了解更多关于植物开发的理论知识[18]。
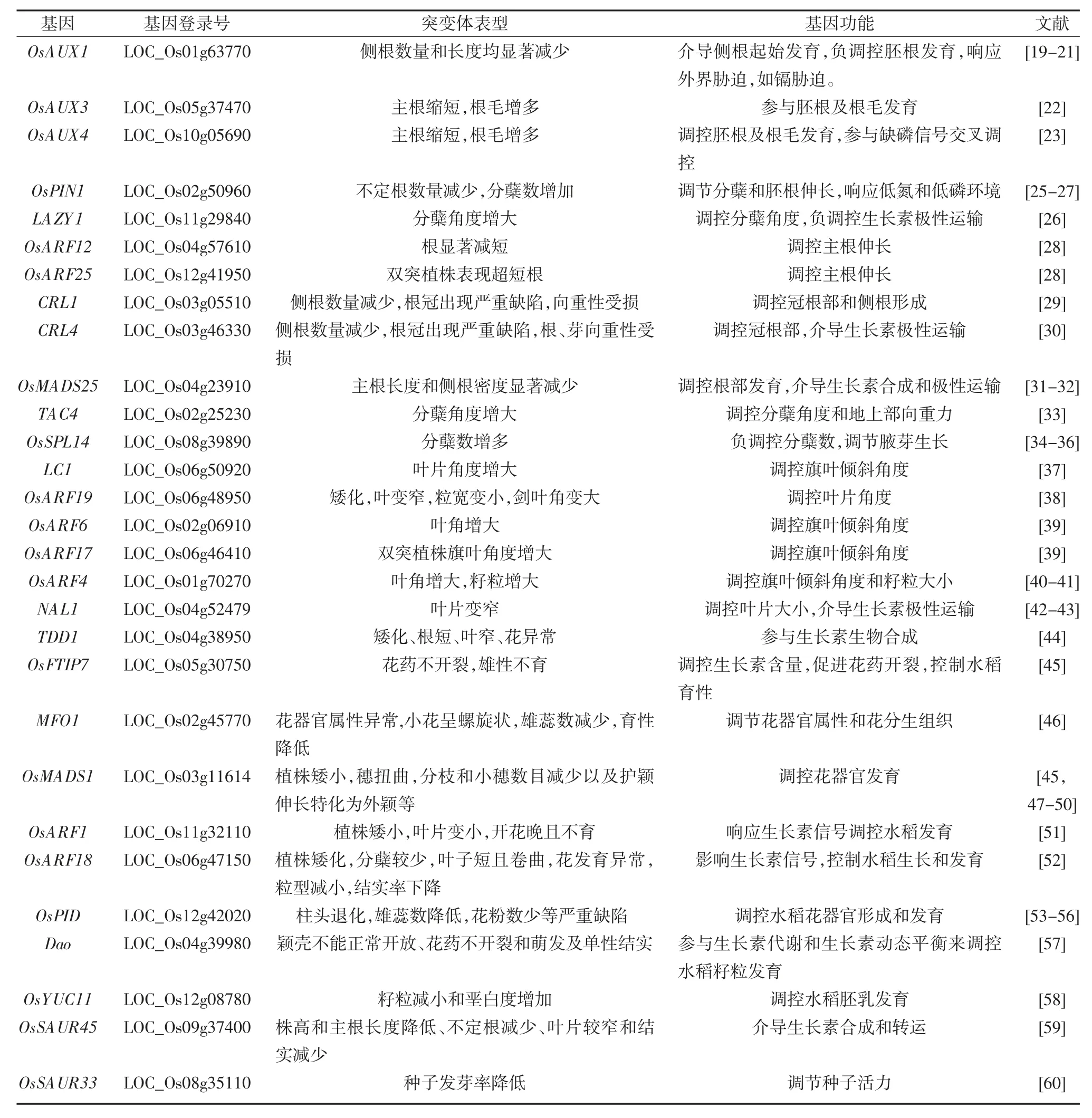
表1 部分已报道生长素调控水稻发育基因的功能特征(突变体表型图片见表后)
1 生长素调控根生长发育
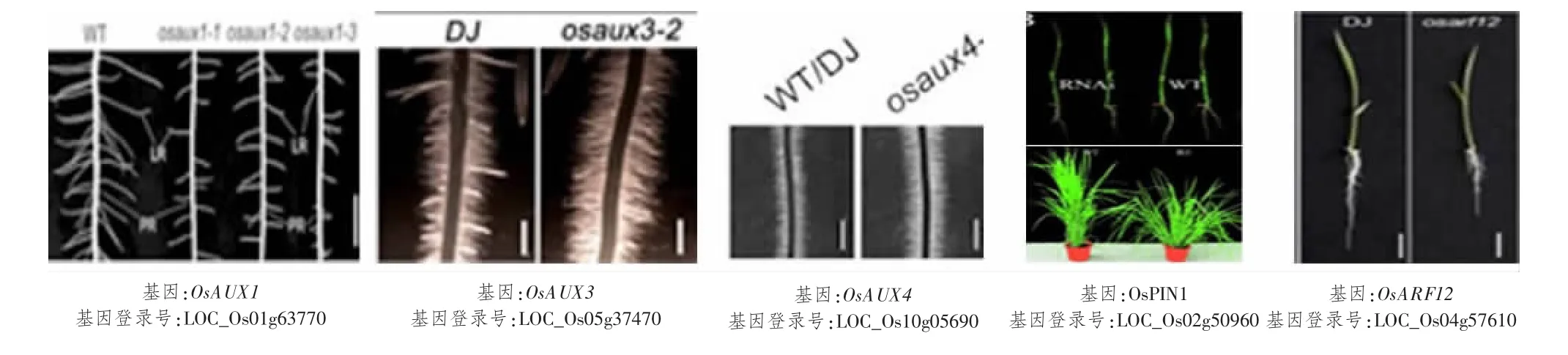
水稻根系是吸收水分和养分的重要器官,也是合成和分泌植物激素的重要地方。水稻根属须根系,由一条胚根和大量侧根及不定根组成。生长素在根尖分生组织(RAM)的建立和维护中起着重要作用[61]。生长素以极性方式沿着芽根轴从一个细胞运输到另一个细胞,这个过程就需要生长素输入和输出载体蛋白家族[62]。生长素极性运输及信号转导相关基因对水稻根系发育有重要的调控作用。近年的研究表明,在编码水稻生长素输入载体AUX/LAX 蛋白家族的5 个成员中,只有OsAUX1、OsAUX3和OsAUX43 个基因被研究报道。OsAUX1在韧皮部、中柱、侧根根冠、根尖表皮细胞、伸长区细胞均有表达。ZHAO 等[19]对OsAUX1位点进行3次不同T-DNA 插入,3 株水稻均缺失OsAUX1基因,且突变体较野生型侧根数量和长度均显著减少,研究表明,该基因调控生长素极性运输来介导侧根起始发育,及负调控胚根发育[20]和促进根毛伸长来响应外界一些胁迫[20-21]。OsAUX3[22]只在侧根原基、即靠近基部的表皮细胞中表达,OsAUX4[23]在根部强烈表达但仅局限于质膜上。这2 个基因参与水稻胚根及根毛发育,osaux3和osaux4突变体表型都显示胚根缩短,根毛增多。MIYASHITA 等[24]在水稻中鉴定出12 个编码生长素的输出载体PIN 蛋白家族。其中研究最多的OsPIN1基因被证明在生长素依赖性根系发育中起重要调节作用。OsPIN1过表达导致植株不定根增加;相反,突变体植株不定根数量减少,分蘖增加[25],另外SUN 等[27]发现,OsPIN1在根尖表达最多,而且通过调节根尖分生组织活性响应低氮和低磷环境,并参与水稻胚根伸长。
另一方面,生长素信号转导的重要转录因子ARF(auxin response factor)家族的OsARF12和OsARF25基因已被报道能够调控水稻胚根伸长,osarf12突变体及osarf12 osarf25双突变体植株分别出现短根和超短根表型[28]。INUKAI 等[29]研究表明CRL1基因是水稻中ARF 蛋白的直接靶基因。CRL1基因正调控侧根和根冠形成,crl1突变体植株在根冠形成中表现严重的缺陷,不敏感侧根数量减少,根向重性受损;同一泛素连接酶家族成员CRL4基因通过协调生长素输出载体PIN1蛋白的极性定位来介导生长素依赖性植物生长,其突变体表型与crl1突变体相似,并且在crl4突变体中,芽和根部的生长素运输受损[30]。OsMADS25可以通过另一大生长素信号转导Aux/IAA 家族来增强生长素的生物合成,以致于生长素在根系积累,刺激根系发育。Os-MADS25基因缺失后,突变体植株表现胚根长度和侧根密度显著减小,而过表达株系表型完全相反[31-32]。
2 生长素调控水稻茎伸长及分蘖
许多研究表明,茎伸长生长离不开生长素,缺少生长素会导致茎伸长生长受阻[63-64]。分蘖是植株生长发育中一种特殊的分枝方式,是决定植株结构发育的重要因素。生长素抑制水稻分蘖发生。
生长素输出蛋白PIN1 极性转运生长素,汇聚生长素形成高点,产生原基。叶原基、花原基都以一定的规则在茎尖分生组织周围产生,形成叶序和花序。水稻OsPIN1在维管束组织和根基中表达,OsPIN1基因表达下调的突变体中分蘖数显著增加,并且OsPIN1的反义表达实验也进一步证明了OsPIN1具有调控生长素极性运输(PAT)的功能,ospin1突变体不定根显著减少,分蘖数量增加[33,62]。LI 等[26]研究发现,OsPIN1表达水平下调后也会影响分蘖角度的改变,同时他们在水稻中克隆芽向性LAZY1基因,发现它负调控生长素极性运输。与野生型水稻相比,RNAi 转基因植株表现出更大的分蘖角度,LAZY1功能丧失后大大增强了PAT 功能,从而芽中内源性生长素的分布发生改变,导致向重性降低,水稻植株分蘖散开。经过人工驯化过程,在籼稻品种中遗传稳定的植物特异性核蛋白TAC4也被证明可以通过影响生长素含量和分布来调节分蘖角度和地上部向重力,TAC4基因在各种水稻器官中普遍表达,尤其在幼穗、叶片节间、叶鞘、节间和分蘖处高表达;敲除该基因后,突变体顶鞘和分蘖基部的内源生长素明显减少,但分蘖中下侧和上侧之间的内源生长素含量差异小于野生型IL55 植株[33]。
PILS 蛋白在结构上与PIN 蛋白相似,是植物中生长素输出载体的另一个主要家族。与将生长素转运出细胞质的PIN 蛋白不同,PILS 蛋白被证明位于内质网中并将生长素隔离在其中,从而调节核生长素信号传导[65-67]。OsSPL14基因是一种植物特异性转录编码因子,也称为理想株型基因(Ideal Plant Architectutre 1,IPA1),在水稻腋芽和穗中表达量很高,受OsmiR156和OsmiR529的调节[34-35]。LI 等[36]通过OsSPL14过表达和OsSPL14-RNAi植株研究发现,OsSPL14负调控水稻分蘖数目,还可以与下游2 种生长素外输蛋白基因Os-PIN1b和PILS6b的启动子结合,当OsPIN1b和PILS6b下调表达,生长素极性分布受到损害,影响水稻侧生分生组织中的生长素分布,从而调控水稻地上部的生长素转运,水稻腋芽生长加快。
3 生长素调控水稻叶片形态结构
生长素在水稻叶片夹角中起重要调控作用。叶片角度是决定植物结构和籽粒产量的重要农艺性状。叶片角度是叶片和叶鞘之间的弯曲程度或叶片与叶尖之间的倾斜度。
剑叶,又称旗叶,它是接近穗的最顶端叶片,具有最高的光合能力,在决定谷物产量方面起着重要作用。旗叶角度主要由连接茎秆和旗叶叶片节间形状和结构决定[68]。基部节间处伸长叶片中的细胞组织保持旗叶直立,因此叶片近轴和远轴端的细胞伸长以及细胞壁组成都会影响旗叶角度。水稻叶片节间中游离生长素水平降低导致旗叶角度增大[37-38,69-70]。ZHAO 等[37]通过筛选获得突变体植株lc1-D,LC1编码一个生长素氨基合成酶OsGH3-1,在水稻根、芽、花、叶和叶鞘等组织中均有表达,lc1-D突变体叶片节间近轴表面的细胞伸长受到刺激时,游离生长素含量降低,导致叶片角度增大。OsARF19正向调控另一种生长素氨基合成酶OsGH3-5,表达量受叶片节间中游离的生长素含量调节,进而调控水稻叶片角度。OsARF19过表达的植株表现矮化,叶片变窄,种子粒宽变小,并出现由于轴向细胞分裂增加而显示出更大的剑叶倾角[38]。HUANG 等[39]发现,生长素信号可以与次生细胞壁组成成分相结合,水稻生长素响应因子OsARF6和OsARF17在叶片节间组织中高表达。osarf6 osarf17双突变体显示叶片关节巩膜细胞(Scs)的次生细胞壁水平降低,导致在密集种植条件下植株旗叶角度变大,籽粒产量减少。OsARF4在水稻叶片节间中表达,通过控制叶片节间的局部生长素水平来调节叶片倾斜角度。osarf4突变体中吲哚-3-乙酸(IAA)含量和分布的减少导致叶片倾斜度更大,而Os-ARF4过表达水稻植株表现出相反的表型,且IAA 含量增加[40]。这表明有多个生长素响应因子在叶片角度性状中起调控作用。植物叶片的大小和形状也是一个很重要的农艺性状。NAL1位于细胞核中,可以编码很多未知特异性蛋白质,NAL1在调节极性生长素转运和细胞分裂中起作用。水稻nal1突变体中生长素的极性转运能力和PIN1 蛋白表达明显下降,进而改变了维管组织的分布模式并减小了叶宽,出现窄叶表型[42-43]。
4 生长素促进开花,调控水稻花器官发育,影响育性
水稻花序的基本单位是小穗。小穗最终由2 片退化颖片、穗轴和1 朵可育小花构成。而可育小花由1 个外稃、1 个内稃、2 个浆片、6 个雄蕊和1 个雌蕊构成[71]。开花授粉表征着植物有性生殖的进化,为植物适应复杂的外界环境提供新的可能。植物花发育过程极其复杂且精细,大致分为3 个连续的阶段:成花诱导、花原基形成和花器官发育。生长素合成、信号传递和极性运输相关突变体和基因功能解析证实生长素在调控水稻花器官发育中起着关键作用[72-75]。
生长素在植物中的生物合成主要有2 种途径:色氨酸(Trp)依赖性途径和Trp 非依赖性途径。Trp 生物合成途径是植物生长素生物合成的常用步骤之一。TDD1不仅自身参与Trp 生物合成,而且TDD1(OSAB1)是Trp 参与生物合成途径的限速酶。TDD1编码一个由288 个氨基酸组成的邻氨基苯甲酸合酶(anthranilate synthase,AS)β 亚基,在Trp 依赖性生长素生物合成的上游起作用,催化第1 步Trp 生物合成。tdd1突变体植株在Trp 生物合成中存在部分缺陷,胚胎致死,其上皮细胞的愈伤组织能够再生整个植株。矮化再生的tdd1植株表现出多效性表型:矮化、根短、叶窄、花异常。花在形态上的变化有,不能产生正确数量或正常结构的萼片、花瓣和雄蕊;雄蕊数量比其他器官的数量更容易减少,浆片与雄蕊、雄蕊与雌蕊均可形成融合状器官,育性极低。过表达Trp 依赖的生长素合成途径的关键酶OsYUCCA1 提高生长素的内源性水平,也仅在营养期挽救tdd1矮化表型[44]。研究说明依赖于TDD1合成的生长素含量在水稻胚胎发生及花器官发育过程中具有重要的调控作用。SONG 等[45]研究发现,生长素能调控花药开裂时间,水稻OsFTIP7基因在花粉有丝分裂之前的花药中高表达,并促进同源域转录因子Oryza sativa homeobox 1(OSH1)的核定位,该因子在花药后期发育过程中直接抑制主要的水稻花药生长素生物合成基因OsYUCCA4,从而限制花药发育后期的生长素含量,精准上调花药发育后期花药开裂和花粉成熟所需的茉莉酸生物合成含量。osftip7突变体植株由于细胞核中OSH1蛋白丰度降低、OsYUCCA4表达增加以及导致花药中生长素含量升高,从而使花药不分裂,导致植株雄性不育。
在拟南芥中发现了一种植物特异性转录因子LEAFY,该基因集结触发植株转变的外界环境和内部信号,介导了植株从营养生长到生殖生长阶段的过渡,在花器官形成发育过程中充当调控因子,激活下游行使功能,例如诱导成花[76-77]、形成新原基[78]。在水稻中,LEAFY部分通过影响生长素信号转导来调控花原基形成[79-80],但是其开花功能部分丧失,并被其他基因接管(例如AGL6基因同系物的含MADS-box 基因MOSAIC)。MADS结构域转录因子是一类DNA 结合蛋白,它介导ABCDE 类基因特异性组合来控制植物的花器官同一性和分生组织决定性,其中花器官MFO1基因调节花器官和花分生组织,mfo1突变体植株花分生组织功能丧失,发育出额外的雌蕊或小穗等;另外小花呈螺旋状,内稃小或者半开,雄蕊数减少,易出现颖片异位等结构,导致内部花器官发育异常,植株育性下降[46]。研究最早的水稻MADS-box 基因OsMADS1,在AGL9基因家族中形成独特分支,它最早在水稻小穗分生组织中表达,在花器官发育过程中,OsMADS1的表达也局限于外稃和前稃,在雌蕊表达较弱。OsMADS1不仅单独在水稻的花分生组织起始到器官分化和分生组织终止的发育过程中起着重要的调控作用,还能结合其他调节因子等调控小花发育网络。当OsMADS1功能丧失,如osmads1突变体水稻外部小花器官的外稃和前稃发育不良,不能包裹内部器官,外稃和皮层的典型表皮特征也丢失;此外,胚囊和雄蕊被转化为多外稃或多个颖壳,小花也出现多雌蕊结构[45,47-50]。
水稻中有25 个生长素响应因子,其中OsARF1主要表达于幼穗和愈伤组织。抑制OsARF1表达导致突变体植株出现矮化、开花延迟,甚至无花或不育等发育缺陷[51]。MicroRNA(miRNA)在植物中作为转录后基因表达的关键负调节因子,MiR160 通过抑制其靶生长素响应因子基因的表达,在拟南芥的生长发育中起关键作用[81-85]。在水稻中,HUANG 等[52]发现,OsARF18是OsmiR160 的靶基因,通过遗传手段得到的mOsARF18植株中OsARF18基因产生OsmiR160 抗性,出现矮化、分蘖较少、叶子短且卷曲、雄蕊异常衰老、粒型减小、淀粉积累减少等多效性缺陷表型。OsmiR160 解除对OsARF18的调控使得生长素合成、信号传导和极性运输的相关基因,以及植株体内OsmiR160 主要来源的OsMIR160a、OsMIR160b基因表达下调,表明OsmiR160靶向OsARF18的失调导致水稻异常生长发育,并且以正反馈环绕方式微调生长素信号途径。
OsPID是生长素极性运输基因。OsPID介导的生长素信号通路通过维持花分生组织在水稻柱头和胚珠形成的调控中起着关键作用。该基因过表达后植株雌蕊柱头数增加,雄蕊数降低;ospid突变体花发育严重缺陷,雌蕊柱头和花药不同程度退化,甚至无柱头表型,雌蕊的生长素活性也要低于野生型雌蕊,雄蕊数目增加,大多数小穗不能发育出正常的胚珠,植株结实率下降或不育[53-56]。WU 等[56]首次提出OsPID调控水稻花器官发育过程的分子机制:OsPID通过磷酸化OsPIN1a和OsPIN1b来调节生长素极性转运和生长素的极性分布,同时OsPID可以与LAX1、OsMADS16等转录因子相互作用调控水稻花器官发育。
5 生长素调节胚乳发育,调控水稻籽粒大小、产量和种子活力
近年来,有研究表明生长素对水稻籽粒发育也有调控作用。水稻中生长素氧化酶基因DIOXYGENASE OF AUXIN OXIDATION(DAO)编码一个未知的戊二酸和亚铁依赖性双加氧酶(2-oxoglutarate and Fe(II) [2-OG Fe(II)] dependent dioxygenase),可以将有活性的生长素(IAA)氧化成无活性的OxIAA,进而参与生长素代谢和生长素动态平衡。dao 突变体中花药和子房游离生长素含量上升,引起生长素响应基因OsARF6和15 个OsAux/IAA基因异常表达,导致突变体颖壳不能正常开放、花药不开裂萌发以及出现单性结实。另外DAO调节IAA 水平,进而影响生长素信号调节级联IAAOsARF18-OsARF2-OsSUT1 新机制来介导水稻生殖发育过程中的碳水化合物分配,籽粒产量增加[57]。另外,OsARF4功能丧失导致水稻籽粒增大[41]。
水稻胚乳是种子围绕胚芽的部分,是籽粒形状和产量的主要决定因素。在拟南芥中,氨基转移酶TAA家族可以将色氨酸转化为吲哚-3-丙酮酸(IPA),IPA在YUCCA(YUC)黄素单加氧酶的催化下生成IAA[58,86]。YUCCA基因家族编码生长素合成中的关键酶,由14个成员组成,YUCCA基因过表达导致水稻生长素过量产生[87]。4 个成员基因(OSYUC1、OSYUC9、OSYUC11和OSYUC12)参与调控胚乳发育,生长素在胚乳早期发育增加,较高的生长素导致种子籽粒长度增加。特别是OsYUC11,它是水稻胚乳中生长素生物合成的关键因子,OsYUC11介导的植物生长素生物合成在水稻胚乳发育过程中起到重要作用,OsYUC11突变阻碍水稻籽粒灌浆和贮藏产物的积累,osyuc11突变体产生籽粒减小和垩白度增加的表型,通过在突变体植株开花后的穗部喷洒外源生长素α-萘乙酸(NAA),种子质量增加,垩白度增加得到缓解[58]。
SAURs(Small auxin-up RNAs)基因是植物特有的、数量最多的一类生长素响应基因,它在一系列发育过程中起作用。人们对SAURs在植物生长和发育中的作用知之甚少,特别是在单子叶植物中。OsSAUR45在水稻叶片和叶鞘与茎的维管组织有较强表达,并定位于细胞质,OsSAUR45过表达植株中的生长素水平和转运能力降低,植株表现出多效性发育缺陷,包括株高和主根长度降低、不定根减少、叶片变窄和结实率降低。OsSAUR45通过抑制水稻中的OsYUCCA和OsPIN基因表达来影响生长素的合成和运输,从而参与植物生长[59]。ZHAO 等[60]发现一个调控种子活力的生长素响应基因OsSAUR33,OsSAUR33在成熟籽粒和早发种子中的表达率较高,与蔗糖非酵解蛋白激酶OsSnRK1A相互作用,OsSAUR33基因缺失后,影响水稻种子发芽过程中糖信号传导相关基因的表达,增加了种子在早期发芽过程中的可溶性糖含量,导致种子活力显著降低,发芽率下降。
6 讨论与展望
生长素是许多农业重要性状的关键调节因子。近年来,水稻花器官发育分子调控机制的研究已经取得较大进展。与双子叶植物拟南芥相比,水稻器官发育受到生长素相关基因相似的作用网络调控,比如生长素输入载体AUX/LAX 蛋白家族和输出载体PIN 蛋白家族[62]。但是,越来越多结果显示,仍有很多基因在单子叶植物水稻中发生了功能分化甚至进化,比如在拟南芥整个花器官形成发育过程起调控作用的LEAFY基因[76-80],在水稻中仍未克隆及进行功能分析。对调控胚乳发育OsYUC11基因的研究表明,外源生长素的施用对植株发育的影响也为大家所接受[87],对生长素生物合成、极性运输、响应因子的突变体的研究也使我们对生长素在水稻中可能存在的调控途径有了深入了解。
在水稻中,生长素调控发育网络仍未有较清晰的架构;生长素如何精准调控基因,并作用于植株生长发育的分子机理仍未被完全发现,如何利用依赖生长素的突变体表型进行植物开发等仍存在问题,及许多其他未知领域等待着人们去探索和研究。

