薄荷McZFP1基因克隆及表达分析
郑晓薇, 柏 杨, 亓希武, 于 盱, 房海灵, 李 莉, 刘冬梅, 梁呈元
〔江苏省中国科学院植物研究所(南京中山植物园) 江苏省植物资源研究与利用重点实验室, 江苏 南京 210014〕
薄荷(MenthacanadensisLinn.)隶属于唇形科(Lamiaceae)薄荷属(MenthaLinn.),为常见的药用草本植物,其地上部分干燥后可入药,主要归肺经和肝经,具有疏风散热、清利头目和疏肝行气等功效,主治风热感冒和风温初起等症状[1]。薄荷的茎和叶均密布腺毛,是产生、分泌及贮存薄荷精油的重要部位[2-3]。薄荷精油是其主要药用成分[4],具有抑菌、抗菌和保鲜等作用,也可作为重要香料在食品和日用化工等领域广泛应用[5]。
土壤盐碱化、干旱、高温、冷害以及洪涝等非生物胁迫会限制植物生长,降低作物产量。薄荷属植物在生长过程中易受到盐、干旱和高温等胁迫的影响,这不仅危害其正常的生长发育,还会导致精油产量的严重下降,甚至明显改变精油成分[6-8]。薄荷对盐渍化土壤有一定的适应性,但过量的盐分不利于其正常生长,甚至导致植株死亡[9]。在盐胁迫下,辣薄荷(Mentha×piperitaLinn.)精油合成代谢反应中的基因表达和酶活性等均受到抑制,导致精油产量显著下降[10]。干旱胁迫会严重抑制辣薄荷的生长发育,降低精油产量,并影响精油成分的丰富程度[11]。严重的渗透胁迫会抑制辣薄荷叶片气体交换,改变植物细胞结构特征,造成细胞水平上的损害,并降低辣薄荷精油的含量和质量[12]。此外,在一定温度范围内,薄荷属植物精油产量随着温度的升高而降低,其主要成分薄荷醇含量显著降低,但胡薄荷酮含量升高[8]。为了应对非生物胁迫,植物进化出复杂的调控机制,主要通过激活或抑制一系列转录因子的表达来调节[13-15]。目前已发现一些转录因子参与了植物对非生物胁迫的生理反应,主要包括脱水应答元件结合因子(dehydration-responsive element binding factor,DREB)、乙烯应答元件结合因子(ethylene-responsive element binding factor,ERF)、V-Myb禽成髓细胞瘤病毒癌基因同源物(V-Myb avian myeloblastosis viral oncogene homolog,MYB)、碱性亮氨酸拉链(basic leucine zipper,bZIP)和锌指蛋白(zinc finger protein,ZFP)等[14-19]。
锌指蛋白是一类在植物基因转录中发挥重要调控作用的DNA结合蛋白,其结构域中的半胱氨酸(Cys)和组氨酸(His)残基与Zn2+配位形成稳定的“手指”状结构,该结构通过与DNA特异性结合,直接调节靶基因的表达[20-21]。根据锌指蛋白中Cys和His残基数目和顺序的不同,可将锌指蛋白转录因子家族分为C2H2、C8、C6、C3HC4、C2HC、C2HC5、C4、C4HC3和CCCH 9大类[22]。C2H2型锌指蛋白转录因子家族是目前研究最为深入的家族之一,其含有植物特有的QALGGH保守序列,可与其他转录因子家族结合,或协同各类植物信号激素共同发挥作用,调控植物的多个生物学过程,包括营养生长、生殖发育、光调节形态建成、逆境响应和激素信号转导等[20-24]。目前已有许多研究报道了ZFP参与调控植物的非生物胁迫反应。例如:拟南芥〔Arabidopsisthaliana(Linn.) Heynh.〕C2H2型锌指蛋白转录因子基因AtZFP3的过表达诱导了胁迫相关基因KIN1、RD22、RD29B和AtP5CS1的表达,增强了植物对盐胁迫和渗透胁迫的耐受性,而拟南芥zfp3突变体对盐胁迫的耐受性则显著降低[25]。在烟草(NicotianatabacumLinn.)和水稻(OryzasativaLinn.)中,过表达水稻基因OsZFP182可增强植株的抗盐性;过表达OsZFP252的转基因水稻植株中游离脯氨酸和可溶性糖含量升高,胁迫防御基因的表达量增加,比野生型有更高的盐和干旱胁迫耐受能力[26-27],[28]65-70。
目前,有关薄荷锌指蛋白转录因子基因的研究尚未见报道。通过分析作者所在课题组茉莉酸甲酯处理的薄荷转录组数据,克隆获得1个锌指蛋白转录因子基因Unigene0033253,根据其蛋白质序列分析了结构特征、理化性质及系统进化关系,并分析了该基因编码蛋白的亚细胞定位和转录自激活活性,继而检测该基因在薄荷不同组织以及NaCl、甘露醇、脱落酸和茉莉酸甲酯处理后的表达变化,以期为进一步研究该薄荷基因的生物学功能提供研究基础。
1 材料和方法
1.1 材料
供试薄荷生长于江苏省中国科学院植物研究所资源圃(东经118°49′50″、北纬32°03′33″)。于2022年8月上旬,从长势基本一致的3株野生型薄荷(约5个月株龄)上分别采集不定根、茎、根状茎、幼叶、成熟叶和花(盛花期),即为3个生物学重复。所采集的样品迅速用液氮速冻后保存于-80 ℃冰箱,待用[29]。另取长势基本一致的薄荷茎尖于透明玻璃瓶中水培生根,约2~3 d换1次水,置于温度25 ℃、光照度30 000 lx、光照时间16 h·d-1的植物培养室中培养14 d,然后分别进行高盐(150 mmol·L-1NaCl)[10]、干旱(300 mmol·L-1甘露醇)[30]、200 μmol·L-1脱落酸[30]和200 μmol·L-1茉莉酸甲酯[31]水培处理。每处理3株,即为3个生物学重复。分别于处理0、2、4、8、12和24 h对其幼叶和不定根取样,液氮速冻后,提取RNA。
供试本氏烟草(NicotianabenthamianaDomin)和拟南芥〔哥伦比亚生态型(Col-0)〕种子均由作者所在实验室保存。将本氏烟草种子播撒于泥炭土-蛭石(体积比1∶1)混合基质(南京寿德生物科技有限公司)中,生长1个月后用于瞬时表达实验;拟南芥种子在MS培养基上生长1周后移栽至泥炭土-蛭石(体积比1∶1)混合基质中,生长2个月后用于侵染实验。
1.2 主要试剂
Eastep®Super总RNA提取试剂盒(上海普洛麦格生物产品有限公司);两步法RT-qPCR(去基因组)试剂盒、Phanta Max Super-Fidelity DNA Polymerase和平末端/TA兼容性入门克隆试剂盒(南京诺唯赞生物科技股份有限公司);2×GS AntiQ qPCR SYBR Green Fast Mix(北京金沙生物科技有限公司);NaCl、甘露醇、MES monohydrate、SanPrep Column DNA Gel Extraction Kit、SanPrep Column Plasmid Mini-Preps Kit、乙酰丁香酮、卡那霉素和大观霉素〔生工生物工程(上海)股份有限公司〕;限制性内切酶XhoⅠ和EcoRⅠ(美国New England Biolabs公司);大肠杆菌感受态DH5α、根癌农杆菌感受态GV3101、酵母感受态Y2H Gold(北京擎科生物科技股份有限公司);酵母基础培养基Minimal SD Base(上海诺宁生物科技有限公司);氨基酸缺失混合物DO Supplement -Trp和DO Supplement -Ade/-Trp/-His(上海懋康生物科技有限公司);脱落酸(上海如吉生物科技发展有限公司);茉莉酸甲酯(上海麦克林生化科技股份有限公司);Murashige & Skoog (MS) Basal Medium with Vitamins(美国Phyto Technology Laboratorise公司);4′,6-二脒基-2-苯基吲哚(DAPI)染液、X-α-gal和表面活性剂L-77(北京酷来搏科技有限公司)。
1.3 方法
1.3.1 基因克隆及载体构建 薄荷幼叶总RNA提取按照RNA提取试剂盒说明书操作,检测质量后根据反转录试剂盒说明书合成第1链cDNA。根据作者所在课题组已有的茉莉酸甲酯处理的薄荷转录组数据(NCBI登录号SRP132644)中检索到的cDNA序列,设计特异性引物Unigene0033253-SF和Unigene0033253-SR(表1)。以得到的薄荷幼叶cDNA为模板,PCR扩增Unigene0033253全长基因。PCR反应体系总体积50 μL,包含Phanta Max Super-Fidelity DNA Polymerase 1 μL、2×Phanta Max Buffer 25 μL、dNTP Mix 1 μL、上游和下游引物各2 μL、cDNA 1 μL以及ddH2O 18 μL。PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s、54 ℃退火30 s、72 ℃延伸50 s,35个循环;72 ℃复性7 min。4 ℃保存。PCR产物经质量体积分数1.0%琼脂糖凝胶电泳检测后,使用DNA胶回收试剂盒将目的片段回收,连接到作者所在实验室通用载体pCE2 TA/Blunt-Zero上,37 ℃金属浴反应5 min,加入大肠杆菌感受态DH5α并混匀,冰浴30 min,42 ℃水浴热激45 s,加入LB液体培养基,于160 r·min-1摇床中培养1 h后均匀涂布于含50 μg·mL-1卡那霉素的固体培养基上,然后置于37 ℃培养箱过夜培养;挑选单菌落,PCR验证后得到阳性克隆,交由生工生物工程(上海)股份有限公司测序。

表1 用于薄荷McZFP1基因克隆和功能研究的引物及其序列
1.3.2 生物信息学分析 利用NCBI的Open Reading Frame Finder在线程序(https:∥www.ncbi.nlm.nih.gov/orffinder/)分析McZFP1cDNA序列的开放阅读框;利用Protparam在线工具(https:∥web.expasy.org/protparam/)分析McZFP1的理化性质,包括理论相对分子质量、氨基酸组成、蛋白质稳定性以及理论等电点等相关参数;利用DNAMAN软件比对分析McZFP1及其同源蛋白的氨基酸序列;利用MEGA11.0软件,采用最大似然(maximum likelihood)法构建McZFP1及其同源蛋白的系统进化树。利用在线软件SOPMA(https:∥npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)分析McZFP1的二级结构;通过ProtScale网站(https:∥web.expasy.org/protscale/)分析氨基酸的亲水性和疏水性;通过SMART网站(http:∥smart.embl-heidelberg.de/)分析McZFP1的功能结构域;利用TMHMM在线软件(http:∥www.cbs.dtu.dk/services/TMHMM/)分析McZFP1是否具有跨膜性;通过NetPhos-3.1网站(https:∥services.healthtech.dtu.dk/services/NetPhos-3.1/)预测McZFP1的磷酸化位点[32]。
1.3.3 实时荧光定量PCR(qRT-PCR)分析 根据McZFP1cDNA序列设计qRT-PCR引物McZFP1-qF和McZFP1-qR,内参基因McActin的引物为McActin-qF和McActin-qR(表1)。按照实时荧光定量PCR试剂盒的说明书对薄荷不同组织以及不同处理下幼叶和不定根中McZFP1的表达量进行分析。PCR反应体系总体积20 μL,包含上游和下游引物各1 μL、2×GS AntiQ qPCR SYBR Green Fast Mix 10 μL、cDNA 1 μL及ddH2O 7 μL。使用BIO-RAD CFX-Opus 96荧光定量PCR仪(美国BIO-RAD公司)进行PCR反应,反应程序:95 ℃预变性30 s;95 ℃变性10 s、60 ℃退火及延伸共30 s,40个循环;72 ℃采集荧光信号。每个样品3个技术重复。采用2-ΔΔCT法[33]计算相对表达量。
1.3.4 载体构建 构建35S:McZFP1-GFP和pGBKT7-McZFP1(BD-McZFP1)2种表达载体,分别用于分析McZFP1的亚细胞定位和转录自激活活性。pHellsgate-GFP载体经限制性内切酶XhoⅠ酶切后,回收获得其线性化载体,使用引物McZFP1-GFP-F和McZFP1-GFP-R(表1)扩增目的片段,利用同源重组技术构建35S:McZFP1-GFP表达载体。pGBKT7载体经限制性内切酶EcoRⅠ酶切后,获得其线性化载体,使用引物BD-McZFP1-F和BD-McZFP1-R扩增片段,利用同源重组方法构建pGBKT7-McZFP1(BD-McZFP1)表达载体。目的片段的扩增、回收、连接目的载体、转化大肠杆菌以及单菌落验证等步骤同“1.3.1”。
1.3.5 亚细胞定位 利用在线工具CELLO2GO(http:∥cello.life.nctu.edu.tw/cello2go/)预测McZFP1的亚细胞定位[32]。通过根癌农杆菌介导的烟草叶片瞬时表达技术[34]确定McZFP1蛋白在细胞中的分布情况。转化测序正确的35S:McZFP1-GFP质粒至根癌农杆菌感受态GV3101,经抗性筛选及菌落PCR验证后,将阳性单菌落接种于含50 mg·L-1利福平和50 mg·L-1大观霉素的LB液体培养基中,28 ℃恒温摇床培养至菌液OD600值为1.0,于4 ℃、5 000 r·min-1离心5 min,收集菌体,用配制好的侵染液〔包含10 mmol·L-12-(N-吗啉代)乙烷磺酸一水、10 mmol·L-1MgCl2和200 μmol·L-1乙酰丁香酮,pH 5.6〕重悬至OD600值约1.0。使用注射器将菌液注射到生长状态好的本氏烟草叶片背面,暗培养3 d后,取适当大小的叶片组织,用稀释50~100倍的4′,6-二脒基-2-苯基吲哚(DAPI)染液染色1~2 h后,使用Zeiss激光扫描共聚焦显微镜(德国Zeiss公司)分别在波长488和405 nm激发光及明场下观察并拍照。
1.3.6 转录自激活活性验证 按照产品说明书分别转化pGBKT7-McZFP1(BD-McZFP1)、pGBKT7空质粒(BD-plasmid)及pGBKT7-AtSIZ1(BD-AtSIZ1)质粒至酵母感受态Y2H Gold中。将转化产物分别涂布于SD/-Trp固体培养基中,28 ℃培养3~4 d后,挑选单菌落,PCR验证后得到阳性单克隆BD-McZFP1、BD-plasmid和BD-AtSIZ1,分别用SD/-Trp液体培养基摇菌至OD600值约1.0,将不同酵母菌液梯度稀释10、100和1 000倍后,分别在SD/-Trp和SD/-Ade/-Trp/-His固体培养基上进行点斑验证,BD-AtSIZ1作为阳性对照,BD-plasmid作为空质粒对照。培养基置于28 ℃恒温培养箱中培养2~3 d,观察并拍照。
1.3.7 拟南芥的遗传转化及筛选鉴定 拟南芥遗传转化采用蘸花法[35]。将“1.3.5”中的阳性农杆菌接种于含50 mg·L-1利福平和50 mg·L-1大观霉素的50 mL LB液体培养基中,在28 ℃恒温摇床过夜培养至菌液OD600值约1.8;于4 ℃、5 000 r·min-1离心5 min,收集菌体后用50 mL重悬液(含2.5 g蔗糖和20 μL表面活性剂L-77,ddH2O定容至50 mL)重悬。将植株的花序在侵染液中浸泡1~2 min后拿出,除去多余菌液,放入温度23 ℃、光照度30 000 lx、光照时间14 h·d-1的光照培养箱中生长7 d后再次侵染,待果荚成熟后收集成熟种子。将氯气灭菌后的种子播撒在卡那霉素抗性的1/2 MS固体培养基上进行生长筛选,挑选具有抗性的拟南芥幼苗,初步鉴定为阳性苗。将阳性拟南芥幼苗栽植于营养土中生长,采用CTAB法[36]提取其莲座叶的DNA,利用RNA提取试剂盒提取其莲座叶的RNA并反转录为cDNA,将二者分别作为模板,引物为McZFP1-GFP-F和McZFP1-GFP-R,进行PCR检测,内参引物为AtActin2-qF和AtActin2-qR,反应体系与运行程序同“1.3.1”。PCR产物使用质量体积分数1.0%的琼脂糖凝胶电泳检测。以McZFP1-qF和McZFP1-qR为鉴定引物,McActin-qF和McActin-qR为内参引物(表1),对野生型拟南芥以及转基因阳性苗中McZFP1的表达水平进行实时荧光定量PCR分析。PCR反应体系、运行程序及计算方法同“1.3.3”。
1.4 数据处理和统计分析
利用IBM SPSS 26.0软件对数据进行统计分析,数据为3次重复的具有标准差的平均值。通过单因素方差分析(one-way ANOVA)和邓肯检验进行显著性分析。
2 结果和分析
2.1 薄荷McZFP1基因克隆及系统进化树构建
以薄荷幼叶cDNA为扩增模板扩增目的基因Unigene0033253,其PCR扩增产物的电泳结果见图1,该基因的核苷酸序列及其编码的氨基酸序列见图2。结果显示:PCR扩增获得1条长度约550 bp的条带,该基因开放阅读框长度为558 bp,编码185个氨基酸。与拟南芥C2H2型锌指蛋白转录因子的进化关系分析结果(图3)表明:该蛋白与拟南芥AtZFP1的相似性最高,故将Unigene0033253命名为McZFP1。

M: DL2000 DNA marker; 1: McZFP1.

*: 终止密码子Termination codon.
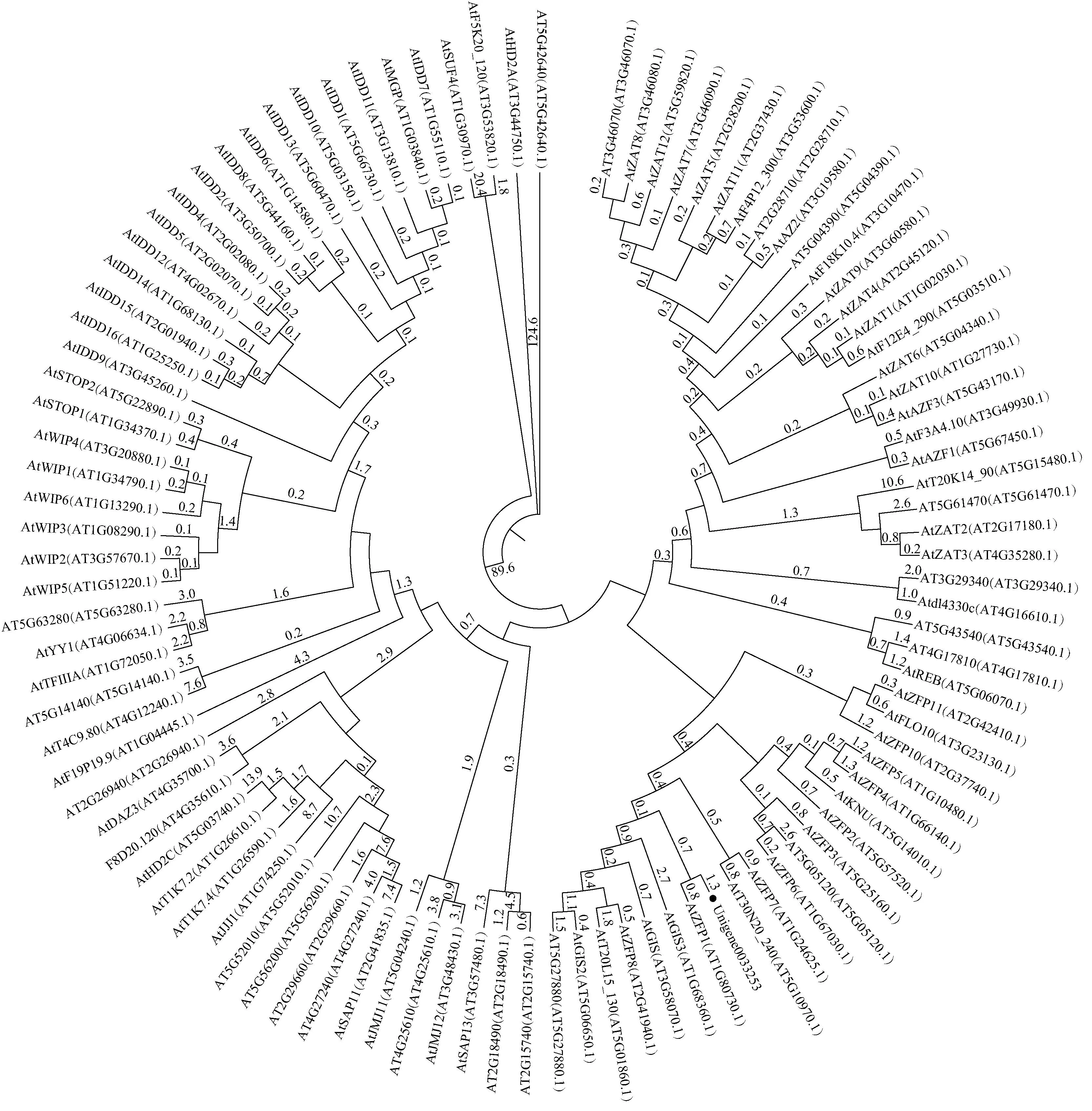
分支上的数值为进化分支长度(仅标出大于或等于0.1的数值),代表遗传变异度The values on the branches are evolutionary branch lengths (only values greater than or equal to 0.1 are showed) and represent the genetic variability. 括号中编号为Tair登录号Nos. in the brackets are accession numbers in Tair.
2.2 薄荷McZFP1结构分析
对薄荷McZFP1进行生物信息学分析,结果显示:McZFP1的分子式为C920H1452N292O266S9,理论相对分子质量为21 147.99,不稳定指数为64.89,属于不稳定蛋白,脂肪指数为61.73,理论等电点为pI 9.77;该蛋白的总平均亲水指数(GRAVY)为-0.878,且大多数肽链处于0.0以下的区域(亲水区)(图4-A),预测其为亲水性蛋白。功能结构域分析结果(图4-B)显示:McZFP1具有典型的ZFP家族保守结构域。二级结构预测结果(图4-C)显示:McZFP1的二级结构包括24.32%的α螺旋、3.24%的β转角、17.30%的延伸链和55.14%的无规卷曲。跨膜结构域分析结果(图4-D)显示:McZFP1不具有跨膜性。磷酸化位点预测结果(图4-E)显示:在阈值大于0.5的条件下,McZFP1有19个磷酸化位点,包括13个丝氨酸、3个酪氨酸和3个苏氨酸的磷酸化位点。
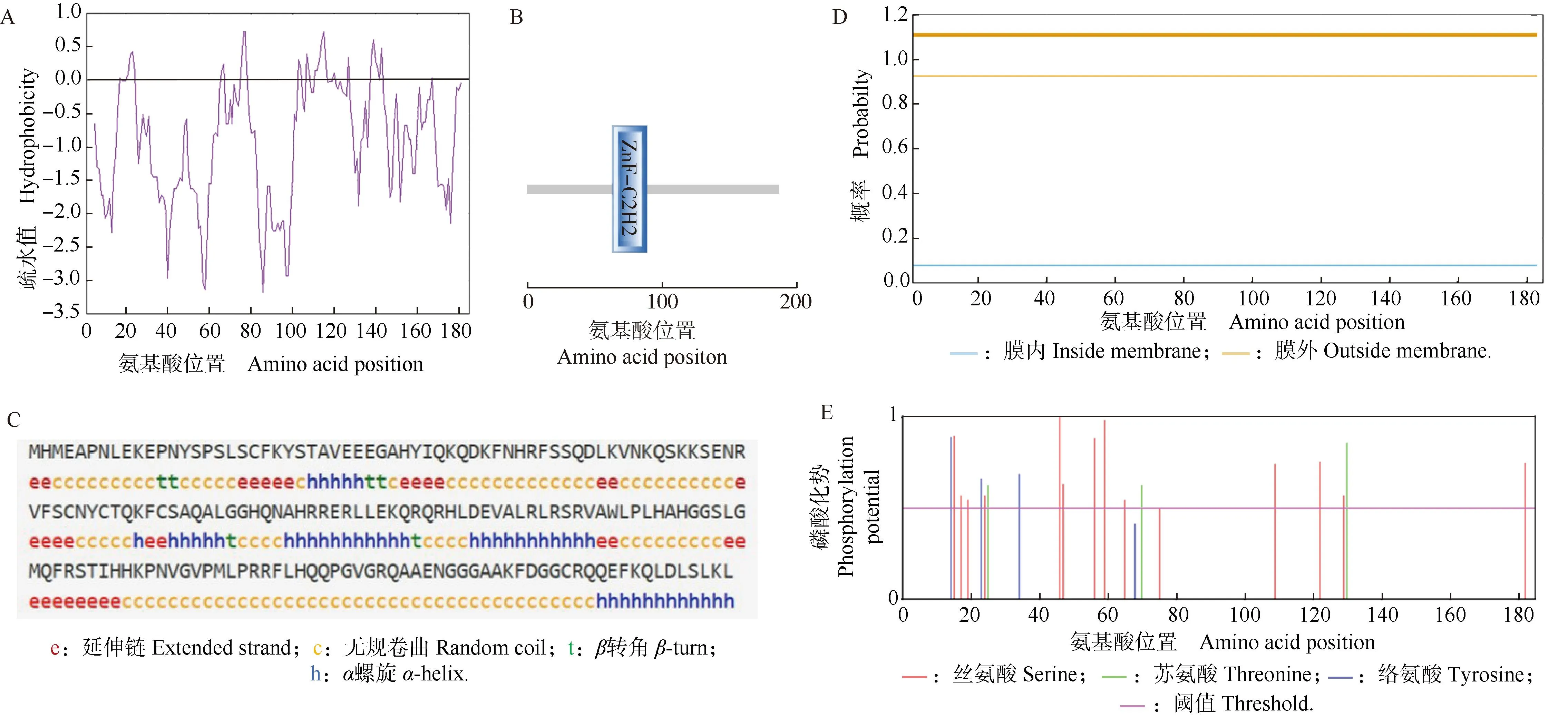
A: McZFP1的亲水性和疏水性Hydrophilicity and hydrophobicity of McZFP1; B: McZFP1的功能结构域Functional domain of McZFP1; C: McZFP1的二级结构Secondary structure of McZFP1; D: McZFP1的跨膜结构域Transmembrane domain of McZFP1; E: McZFP1的磷酸化位点Phosphorylation site of McZFP1.
2.3 薄荷McZFP1的氨基酸序列同源性分析及系统进化树构建
薄荷McZFP1与其他10种植物同源蛋白的氨基酸序列比对和系统进化树见图5。结果显示:薄荷McZFP1及其他10种植物同源蛋白的氨基酸序列均具有一段QALGGH保守序列,是典型的锌指蛋白转录因子。薄荷McZFP1与一串红(SalviasplendensKer-Gawler)同源蛋白SsZFP7(NCBI登录号XP_042063591.1)最先聚在一起,说明二者的亲缘关系最近。

括号中编号为NCBI登录号Nos. in the brackets are accession numbers in NCBI.
2.4 薄荷McZFP1的表达模式分析
薄荷McZFP1在不同组织以及不同非生物胁迫下幼叶和不定根中的表达水平见图6。结果显示:薄荷McZFP1在其不定根、茎、根状茎、幼叶、成熟叶和花中均有表达,其中,在根状茎中的相对表达量最高,显著高于其他组织;在不定根和幼叶中的相对表达量也较高;在茎、成熟叶和花中的相对表达量较低。
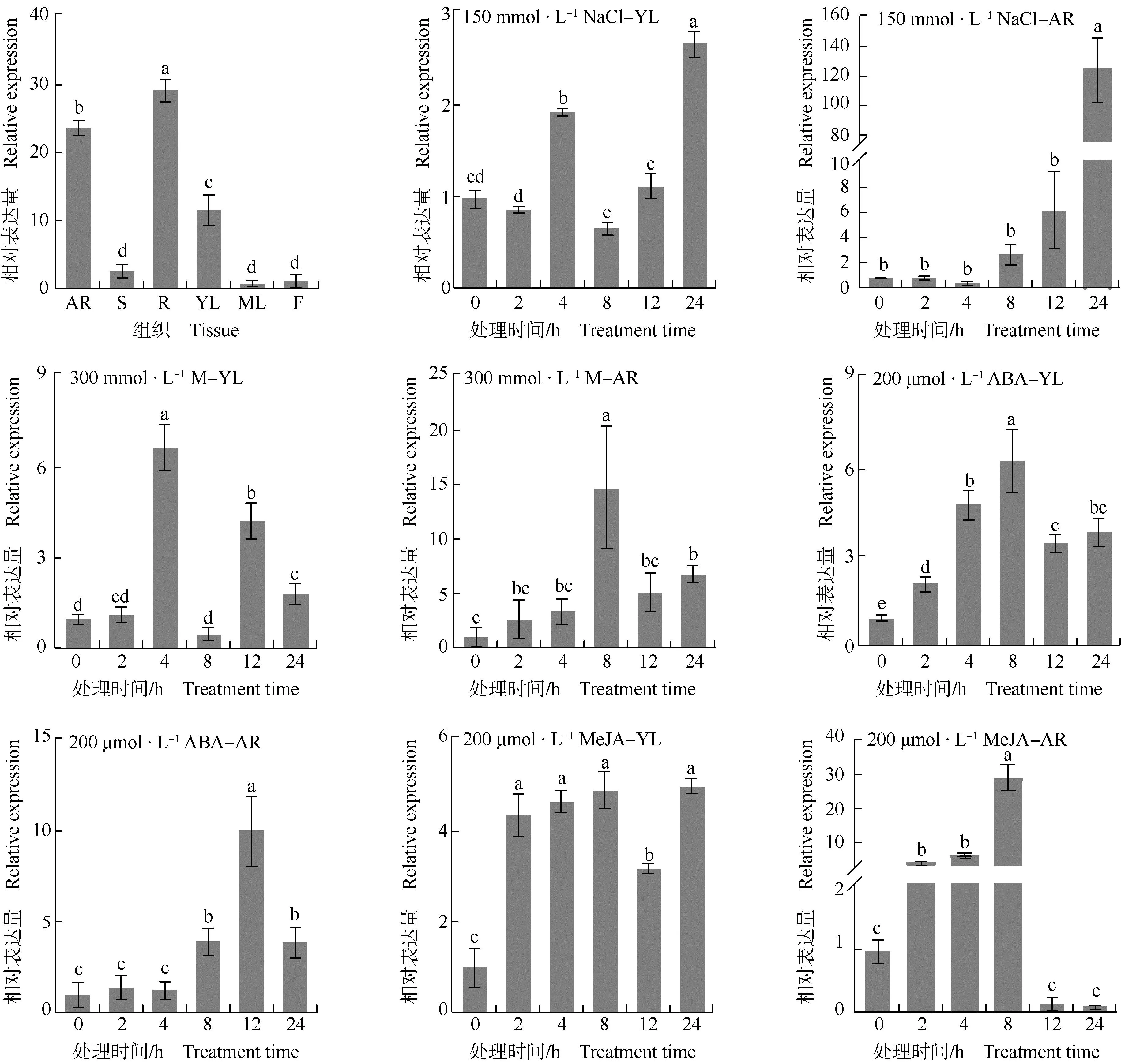
AR: 不定根Adventitious root; S: 茎Stem; R: 根状茎Rhizome; YL: 幼叶Young leaf; ML: 成熟叶Mature leaf; F: 花Flower. M: 甘露醇Mannitol; ABA: 脱落酸Abscisic acid; MeJA: 茉莉酸甲酯Methyl jasmonate. 同一图中不同小写字母表示差异显著(P<0.05) Different lowercases in the same graph indicate the significant (P<0.05) differences.
在150 mmol·L-1NaCl处理下,薄荷幼叶中McZFP1的相对表达量随着处理时间的延长总体呈“升高—降低—升高”的变化趋势,其中,处理2和12 hMcZFP1的相对表达量与处理0 h差异不显著;处理4和8 h的McZFP1相对表达量分别显著高于和低于处理0 h;处理24 hMcZFP1的相对表达量升至最高,为处理0 h的2.7倍。薄荷不定根中McZFP1的相对表达量在处理0、2、4、8、12 h差异不显著,在处理24 h急剧升高,其相对表达量为处理0 h的125.3倍。
在300 mmol·L-1甘露醇处理下,薄荷幼叶中McZFP1的相对表达量随着处理时间的延长总体呈“升高—降低—升高—降低”的变化趋势,其中,处理2和8 hMcZFP1的相对表达量与处理0 h差异不显著;处理4 hMcZFP1的相对表达量达到峰值,为处理0 h的6.7倍;处理12和24 hMcZFP1的相对表达量显著高于处理0 h。薄荷不定根中McZFP1的相对表达量随着处理时间的延长总体呈先升高后降低的变化趋势,其中,处理2、4和12 hMcZFP1的相对表达量高于处理0 h,但差异不显著;处理8和24 hMcZFP1的相对表达量显著高于处理0 h,且在处理8 h达到峰值,为处理0 h的14.9倍。
在200 μmol·L-1脱落酸处理下,薄荷幼叶中McZFP1的相对表达量随着处理时间的延长总体呈先升高后降低的变化趋势,处理2~24 hMcZFP1的相对表达量均显著高于处理0 h,其中,处理8 h达到峰值,为处理0 h的6.4倍。薄荷不定根中McZFP1的相对表达量随着处理时间的延长呈先升高后降低的变化趋势,其中,处理2和4 hMcZFP1的相对表达量与处理0 h差异不显著,处理8、12和24 hMcZFP1的相对表达量显著高于处理0 h,且在处理12 h达到峰值,为处理0 h的10.2倍。
在200 μmol·L-1茉莉酸甲酯处理下,处理2~24 h薄荷幼叶中McZFP1的相对表达量均显著高于处理0 h。薄荷不定根中McZFP1的相对表达量随着处理时间的延长呈先升高后降低的变化趋势,其中,处理2、4和8 hMcZFP1的相对表达量显著高于处理0 h,且在处理8 h达到峰值,为处理0 h的29.2倍;处理12和24 hMcZFP1的相对表达量与处理0 h差异不显著。
2.5 薄荷McZFP1的亚细胞定位分析
利用在线工具CELLO2GO预测薄荷McZFP1的亚细胞定位,该蛋白定位于细胞核的数值(2.773)远大于定位于细胞内其他部位的数值(0.005~1.471),预测McZFP1可能定位于细胞核。进一步构建McZFP1与绿色荧光蛋白(GFP)的融合表达载体,并利用农杆菌介导的本氏烟草叶片瞬时表达分析其亚细胞定位。荧光信号检测结果(图7)显示:McZFP1-GFP融合蛋白与细胞核指示染料4′,6-二脒基-2-苯基吲哚(DAPI)的定位标记基本一致,说明了McZFP1是定位于细胞核的蛋白质。

McZFP1-GFP: McZFP1与绿色荧光蛋白的融合蛋白Merged protein of McZFP1 with green fluorescent protein; DAPI: 4′,6-二脒基-2-苯基吲哚4′,6-diamidino-2-phenylindole; M: 叠加视野Merged field.
2.6 薄荷McZFP1的转录自激活活性分析
转录自激活验证实验结果(图8)表明:转pGBKT7空质粒(BD-plasmid)、pGBKT7-McZFP1(BD-McZFP1)及pGBKT7-AtSIZ1(BD-AtSIZ1)的酵母均可以在SD/-Trp固体培养基上正常生长;转BD-plasmid和BD-McZFP1的酵母均不能在SD/-Ade/-Trp/-His固体培养基上生长,而转BD-AtSIZ1的酵母则能正常生长,表明McZFP1不具有转录自激活活性。
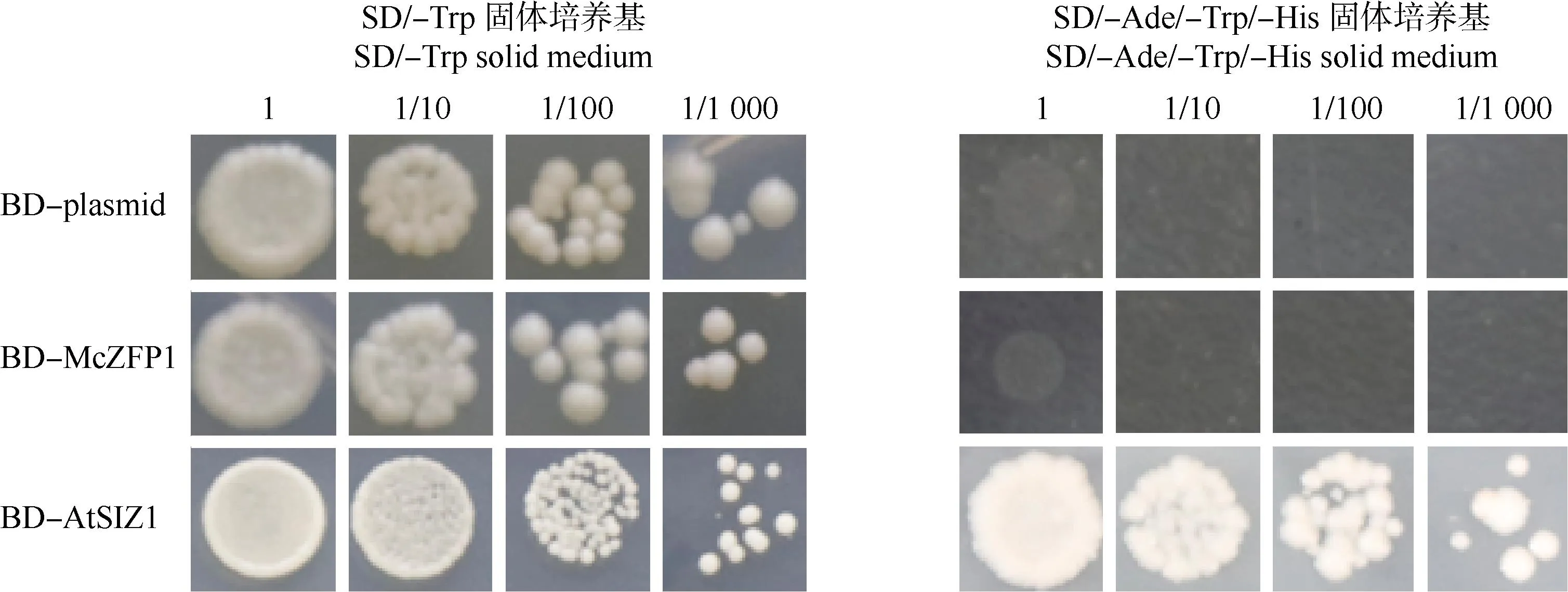
1,1/10,1/100,1/1 000: 分别表示酵母菌液不稀释以及稀释10、100和1 000倍Indicating that the yeast solution is not diluted and diluted 10, 100, and 1 000 times, respectively. BD-plasmid: 转pGBKT7空质粒的酵母Yeast transformed with pGBKT7 empty plasmid; BD-McZFP1: 转pGBKT7-McZFP1的酵母Yeast transformed with pGBKT7-McZFP1; BD-AtSIZ1: 转pGBKT7-AtSIZ1的酵母Yeast transformed with pGBKT7-AtSIZ1.
2.7 过表达McZFP1转基因拟南芥的获得及鉴定
35S:McZFP1-GFP转基因拟南芥阳性苗的鉴定结果见图9。结果显示:初步鉴定叶片绿色健康、根系生长良好的拟南芥幼苗为转基因阳性苗,命名为OE1和OE2。以拟南芥植株DNA为模板,从DNA水平对转基因拟南芥阳性苗进行PCR鉴定,同时以拟南芥植株RNA反转录产物为模板,利用RT-PCR技术鉴定转基因阳性苗,鉴定结果显示:得到的2个转基因苗确定为阳性苗。利用实时荧光定量PCR技术检测转基因植株中McZFP1的相对表达量,结果表明所获得的OE1和OE2是McZFP1转基因阳性苗。
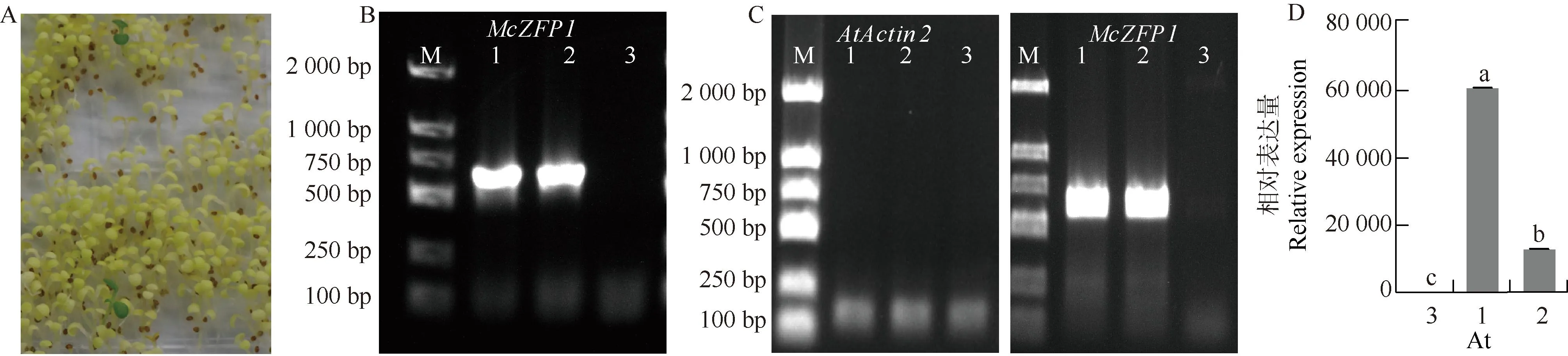
M: DL2000 DNA marker; 1: 35S:McZFP1-GFP-OE1; 2: 35S:McZFP1-GFP-OE2; 3: 野生型Wild type; At: 拟南芥 Arabidopsis thaliana (Linn.) Heynh. 图D中不同小写字母表示差异显著(P<0.05) Different lowercases in the graph D indicate the significant (P<0.05) differences.
3 讨论和结论
盐和干旱等非生物胁迫因子会使植物代谢水平降低,生长发育受到抑制,甚至可能对植物造成不可逆的损害,严重时可能导致植物死亡[37]。薄荷受到高盐和干旱胁迫后,其精油的产量会受到抑制,精油成分也会受到影响,从而影响生产加工。逆境胁迫下,转录因子通过调控一系列抗逆基因的表达,提高植物的抗逆性[38]。C2H2型锌指蛋白类转录因子是植物体内分布最广泛且在许多生理生化反应中具有关键调控作用的一类转录因子,其成员在植物的生长发育以及应对环境胁迫中发挥着重要作用[39]。
本研究从薄荷中克隆了1个C2H2型锌指蛋白转录因子基因McZFP1。McZFP1具有C2H2保守结构域,与许多锌指蛋白转录因子具有较高的同源性,该蛋白定位于细胞核,表明McZFP1是典型的锌指蛋白转录因子,其功能可能类似于已报道的C2H2型锌指蛋白类转录因子,在植物的生长发育以及应对环境胁迫中具有潜在的作用,如营养生长、生殖发育、光调节形态建成、逆境响应和激素信号转导等[20-27],[28]18-25。此外,McZFP1在薄荷的不定根、茎、根状茎、幼叶、成熟叶和花中均有表达,在根状茎中相对表达量最高,在不定根和幼叶中相对表达量也较高,在茎、花和成熟叶中相对表达量较低,暗示该基因可能主要在根状茎和不定根的发育或者行使相关功能中发挥作用。
ZFP亚家族在植物发育与抗逆中发挥着重要的调控作用[40]。拟南芥AtZFP1正调控表皮毛发育[41],并在植株顶端包括顶端分生组织以及发育中的叶和维管系统中高表达,可能参与茎顶端发育[42]。近年来,在一些药用植物中也报道了ZFP参与植物抵抗逆境胁迫。沙蒿(ArtemisiadesertorumSpreng.)锌指蛋白转录因子基因AdZFP1的转录本在一定程度上受外源脱落酸以及盐、低温、高温、干旱胁迫的诱导,在烟草中过表达AdZFP1可显著提高植株的耐旱性[43]。人参(PanaxginsengC. A. Meyer)PgZFP基因家族中PgZFP31、PgZFP78-01、PgZFP38和PgZFP39-01在受到盐胁迫时表达量显著升高,推测其可能在人参对盐胁迫的响应中发挥着重要作用[44]。本研究中,薄荷幼叶和不定根中McZFP1的相对表达量在150 mmol·L-1NaCl和300 mmol·L-1甘露醇处理24 h内存在显著变化,说明其响应高盐和干旱胁迫。脱落酸作为一种重要的胁迫激素,参与植物对盐和干旱等非生物胁迫的响应[45]。拟南芥AtZFP3及其同源基因AtZFP1、AtZFP4、AtZFP6和AtZFP7均是脱落酸响应的负调控因子,拟南芥中过表达AtZFP3导致种子对脱落酸的敏感性降低,而zfp3/zfp4双突变体对脱落酸的敏感性增强[46]。拟南芥AtZFP3通过调控脱落酸信号途径中的RESPONSIVETOABSCISICACID18(RAB18)和ABSCISICACID-INSENSITIVE4(ABI4)等基因的表达来负调控脱落酸信号途径,进而调控拟南芥种子萌发,影响其营养和生殖生长。马铃薯(SolanumtuberosumLinn.)StZFP1受脱落酸诱导表达,在拟南芥rd29A启动子的驱动下,StZFP1在转基因烟草中的异位表达提高了烟草对盐和干旱胁迫的耐受性,表明StZFP1可能通过脱落酸依赖性途径参与调控马铃薯对盐和干旱胁迫的反应[19]。茉莉酸甲酯作为一种新型的植物生长调节剂,与植物的抗逆性密切相关,可以通过保护植物的光合系统、提高抗氧化酶活性和提高渗透调节物质含量等方式缓解植物受到的逆境伤害[47-51]。水稻OsWRKY76和OsbHLH148直接与OsDREB1E启动子结合,激活OsDREB1E的表达以响应干旱胁迫,OsHLH148介导的茉莉酸信号途径正调控水稻的耐旱性[52]。苹果(MalusdomesticaMill.)中C2H2型锌指蛋白转录因子基因MdZAT10受茉莉酸甲酯诱导表达,调控苹果叶片对干旱胁迫的响应,同时加速茉莉酸诱导的叶片衰老过程[53-54]。本研究中,200 μmol·L-1脱落酸和200 μmol·L-1茉莉酸甲酯处理可诱导薄荷幼叶和不定根中McZFP1的表达,推测McZFP1可能通过介导脱落酸信号和茉莉酸信号调控薄荷对盐和干旱等非生物胁迫的应答。
综上所述,本研究成功克隆了薄荷McZFP1,并对其进行了生物信息学分析。McZFP1定位于细胞核但不具备转录自激活活性,该基因在薄荷植物体内的组织中广泛表达,在根状茎和不定根中的表达水平较高,受盐和干旱胁迫诱导表达显著,并响应脱落酸信号和茉莉酸信号。此外,筛选并获得了McZFP1转基因拟南芥T0代阳性苗及其种子,这将有助于进一步深入研究McZFP1的功能。本研究结果为薄荷McZFP1的后续功能验证以及培育优质的耐盐、耐旱薄荷品种提供了基础。

