淫羊藿苷对抑郁症模型小胶质细胞表型转化的调控作用
曹利华,高 松,王笑雨,王真真,贺红娟,李 娜,白 明,苗明三*
1河南中医药大学中医药科学院,郑州 450046;2仲景宛西制药股份有限公司河南省中药固体制剂技术创新中心,西峡 474550;3河南中医药大学 药学院,郑州 450046
抑郁症是一种情感性精神障碍,其发病率高,易反复发作,严重者危及生命,已成为全球性公共健康问题[1]。抑郁症患者临床表现主要有抑郁情绪、快感减退、无价值感或内疚感以及自杀意念。由于抑郁症的复杂生物学机制和涉及众多系统,发病机制尚未完全了解,抗抑郁药的研究是世界范围内的焦点,但进展缓慢[2,3]。寻找治疗抑郁症的新途径和新药物靶点已成为一个紧迫的问题。
应激引起的神经炎症反应在抑郁症的发病机制中日益受到重视[4],小胶质细胞是中枢神经系统一类固有免疫细胞,与脑内神经炎症反应有着密切的关系,有望成为新的治疗靶点[5]。经典的M1型极化,释放炎症因子白细胞介素6(interleukin-6,IL-6)、白细胞介素1(interleukin-1,IL-1)、肿瘤坏死因子α(tumor necrosis factorα,TNF-α)等,引起神经炎症反应;替代激活的M2型极化,分泌白细胞介素10(interleukin-10,IL-10)、转化生长因子(transforming growth factor beta,TGF-β)等,诱导组织修复,发挥神经保护作用[6]。调节小胶质细胞表型转化是干预抑郁症发生发展的重要途径之一[7]。中医药一直以来在抑郁症防治方面都有着明显的优势,中医学中,肾阳虚是抑郁症发病的重要机制之一,从肾论治为治疗抑郁症提供了思路[8]。临床中,补肾阳中药淫羊藿常与其他中药配伍(仙茅、巴戟天、夜交藤等),用于治疗肾阳虚型抑郁症[9,10]。在前期研究中观察到补肾阳中药淫羊藿(小檗科植物淫羊藿EpimediumbrevicomuMaxim.干燥叶)活性成分淫羊藿苷具有良好的抗抑郁作用[11],但其机理仍不清楚。本研究拟采用慢性不可预知温和应激致抑郁症模型,结合脂多糖(lipopolysaccharide,LPS)诱导的BV-2细胞极化模型,探索淫羊藿苷抗抑郁的作用机制。
1 材料与方法
1.1 仪器
DW-86L728J超低温保存箱(海尔股份有限公司);FilterMAX F5酶标仪(美国Molecular Devices);3111二氧化碳培养箱(赛默飞);Amersham Imager 600超灵敏多功能成像仪(美国GE);ABI 7500 FAST实时荧光定量PCR仪(美国ABI 7500 FAST);OFT-100D大小鼠开场活动实验系统(成都泰盟软件有限公司)。
1.2 材料与试剂
材料:淫羊藿苷(批号20190801,成都瑞芬思生物科技有限公司,纯度>98%);盐酸氟西汀(批号T739411W,苏州中化药品工业有限公司)。
试剂:小鼠 IL-6、IL-10酶联免疫吸附剂实验(enzyme linked immunosorbent assay,ELISA)检测试剂盒(批号3361-1A-6、3432-1A-6,Mabtech);小鼠五羟色胺(5-hydroxytryptamine,5-HT)、多巴胺(dopamine,DA)、去甲肾上腺素(norepinephrine,NE)ELISA试剂盒(批号ADI-900-175、ENZ-KIT188-0001、ASB-OKEH02565,Enzo Biochem);蛋白免疫印迹(Western Blot)所需抗体:诱导性一氧化氮合酶(inducible nitric oxide synthase,iNOS)抗体(批号CY5993,Abways Technology);分化簇206(cluster of differentiation 206,CD206)抗体(批号YT5640,Immunoway);二抗Goat Anti-Rabbit IgG(H+L)HRP(批号AB0101,Abways Technology)。免疫荧光技术所需抗体:一抗:iNOS抗体(批号ab283655,Abcam);CD206抗体(批号AF2535-SP,R&D Systems);二抗Cy3 conjugated Goat Anti-Rabbit IgG(H+L)(批号GB21303,Servicebio);4′,6-二脒基-2-苯基吲哚二乳酸盐(4′,6-diamidino-2-phenylindole,DAPI)(批号D3571,Thermo Fisher);实时荧光定量PCR(quantitative real-time PCR,RT-PCR)引物(生工生物工程(上海)股份有限公司)。
细胞:小鼠小胶质细胞(BV-2)(批号:CL-0493,武汉普赛诺生命科技有限公司)。
动物:SPF级,雄性,KM小鼠,体质量18~22 g,购自北京维通利华实验动物技术有限公司(动物使用许可证:SYXK(浙)2019-0001)。操作符合动物实验3R原则和动物实验伦理要求(经河南中医药大学动物实验中心审批,审批号为DELL202103164)。
1.3 方法
1.3.1 模型制备及分组给药
模型制备:以连续56 d慢性不可预知性应激(chronic unpredictable mild stress,CUMS)建立抑郁症小鼠模型。将7种刺激,随机安排到56 d内,每天随机安排1种刺激方法,每种刺激避免重复出现,以免发生适应性。7种刺激方法:剥夺饮食(禁水禁食12 h);热刺激(将小鼠放入烘箱为45 ℃中刺激5 min后取出);冷刺激(将小鼠中放入水温为4 ℃冷水中,冰水浴刺激5 min后取出,低温烘干);疼痛刺激(在小鼠尾部1 cm处进行夹尾刺激5 min,以小鼠发出哀鸣声为宜);潮湿刺激(小鼠处于垫料和水以1∶2的比例的潮湿环境中24 h);颠倒昼夜节律(昼/夜颠倒24 h:于当日8∶30关闭实验室内光源,营造黑夜环境,至20∶30开启光源,模仿白昼环境,使其白昼颠倒,直至次日8∶30恢复正常白昼环境);倾斜鼠笼(12 h倾斜鼠笼,约45°)。
分组给药:将小鼠随机分为5组,每组6只:空白组(control,Con)、模型组(model,Mod)、盐酸氟西汀组(fluoxetine hydrochloride,Flx,10 mg/kg)、淫羊藿苷高(high-dose icariin,ICA-H,50 mg/kg)、低剂量组(low-dose icariin,ICA-L,25 mg/kg)。除空白组外,其余小鼠进行造模,于造模第1 d,在造模的同时,给药组灌服相应的药物,每天1次,连续56 d,灌胃体积0.1 mL/g,空白组及模型组灌服同体积生理盐水。
1.3.2 行为学及生化指标检测
于给药后第53~56 d,分别对各组小鼠进行行为学测试(糖水消耗测试、强迫游泳测试、旷场活动测试)。
糖水消耗测试:在造模开始之前(作为基线)和造模结束后进行。经过48 h的适应期:给予小鼠两个水瓶(1%蔗糖溶液),24 h后,将其中一瓶蔗糖溶液替换普通饮用水,持续24 h。24 h禁食禁水后,分别给予小鼠两瓶装有水和1%蔗糖溶液的水瓶(各100 mL),12 h后,记录各组小鼠消耗的纯净水和蔗糖溶液,计算糖水偏好百分比(糖水消耗量/(糖水消耗量+纯水消耗量)×100%)。
旷场活动测试:采用OFT-100D大小鼠开场活动实验系统,观察各组小鼠5 min内的水平活动距离,每只小鼠结束后,用75%酒精,对开场活动实验箱进行清理和消毒。
强迫游泳测试:采用小鼠全自动强迫游泳实验系统,记录各组小鼠5 min内的游泳不动时间。
末次给药后,脱颈椎处死,取小鼠脑组织。一部分脑组织制备脑组织匀浆(脑组织:生理盐水=1∶10),离心,取上清。分离另一部分脑组织海马区:采用Trizol法提取各组小鼠海马区脑组织RNA,反转录;采用RIPA裂解液提取各组小鼠海马区脑组织蛋白,采用二喹啉甲酸(bicinchoninic acid,BCA)法测定蛋白浓度;所有样品,存于-20 ℃冰箱备用。
ELISA检测脑匀浆IL-6、IL-10、5-HT、DA、NE水平。RT-PCR检测脑组织IL-6、IL-10、iNOS、CD206 mRNA表达水平。RT-PCR采用SYBR Green法。根据前期实验设定RT-PCR反应条件[12,13],实验所需引物购自生工生物工程(上海)股份有限公司(见表1)。采用Western blot检测脑组织iNOS,CD206蛋白表达,并用Image J进行分析。

表1 引物序列
1.3.3 小鼠小胶质细胞(BV-2)培养
于37 ℃、5 % CO2孵箱内培养,采用DMEM培养基(含10%胎牛血清)。
1.3.4 淫羊藿苷适宜受试浓度筛选
96孔板接种BV-2细胞(2×104个/孔),培养24 h后,完全培养基换液并加入淫羊藿苷,其终浓度为100、80、60、30、15、0 μg/mL,孵箱内培养24 h后,采用细胞增殖与毒性检测试剂盒(Cell Counting Kit-8,CCK-8)法检测细胞活力。
1.3.5 药物处理及指标检测
根据“1.3.4”实验结果选取淫羊藿苷适宜受试浓度。实验分组如下:空白组(control,Con)、模型组(LPS 100 μg/mL,Mod)、淫羊藿苷高剂量组(30 μg/mL+LPS,ICA-30)、淫羊藿苷低剂量组(15 μg/mL+LPS,ICA-15)。
于6孔板内,放置细胞爬片,接种BV-2细胞,培养24 h后,完全培养基换液每组分别加入相应浓度的淫羊藿苷或LPS,孵箱内培养48 h后,收集各组细胞爬片,多聚甲醛固定30 min。用0.1%Triton X-100处理20 min,然后在室温下用5%牛血清白蛋白封闭30 min。将细胞与iNOS抗体或CD206抗体孵育4 ℃过夜。用冰冷的PBS洗涤三次后,将细胞与二抗体在室温下孵育1 h。三次洗涤后,细胞核用DAPI在37 ℃下复染10 min。荧光显微镜观察不同的小胶质细胞状态标记。
1.3.6 数据处理
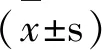
2 结果与分析
2.1 淫羊藿苷对抑郁症小鼠抑郁样行为的影响
与空白组相比较,模型组小鼠的运动距离显著缩短(P<0.01),糖水消耗明显减少(P<0.01),强迫游泳不动时间明显增加(P<0.01)。与模型组比较,盐酸氟西汀、淫羊藿苷高剂量可增加模型小鼠的运动距离(P<0.01)和糖水消耗量(P<0.01),降低模型小鼠游泳不动时间(P<0.05、P<0.01);淫羊藿苷低剂量可增加小鼠的运动距离(P<0.01),降低模型小鼠游泳不动时间(P<0.05),有增加模型小鼠糖水消耗的趋势,但差异无统计学意义(P>0.05),结果见图1。

图1 淫羊藿苷对抑郁症小鼠抑郁样行为的影响
2.2 淫羊藿苷对抑郁症小鼠脑组织单胺类神经递质的影响
与空白组相比较,模型组小鼠脑组织单胺类神经递质5-HT、DA、NA水平显著减少(P<0.01,P<0.05)。与模型组相比较,盐酸氟西汀可增加模型小鼠的脑组织5-HT水平(P<0.01)和NE水平(P<0.05),有增加DA水平的趋势;淫羊藿苷高剂量可增加小鼠单胺类神经递质5-HT,DA,NA水平(P<0.05),淫羊藿苷低剂量有增加模型小鼠单胺类神经递质水平的趋势,但差异无统计学意义(P>0.05),结果见图2。

图2 淫羊藿苷对抑郁症小鼠脑组织单胺类神经递质的影响
2.3 淫羊藿苷对抑郁症小鼠脑组织IL-6、IL-10水平及海马区IL-6、IL-10 mRNA的影响
与空白组相比较,模型组小鼠脑组织IL-6水平、IL-6 mRNA表达显著升高(P<0.05),但IL-10水平、IL-10 mRNA表达仅有升高的趋势,差异无统计学意义(P>0.05)。与模型组相比较,盐酸氟西汀可降低模型小鼠的脑组织IL-6水平和IL-6 mRNA表达(P<0.01、P<0.05),有增加IL-10水平、IL-10 mRNA表达的趋势,但差异无统计学意义(P>0.05);淫羊藿苷高、低剂量可降低IL-6水平、IL-6 mRNA表达(P<0.01、P<0.05),增加小鼠脑组织IL-10水平、IL-10 mRNA表达(P<0.01、P<0.05),结果见图3。

图3 淫羊藿苷对抑郁症小鼠脑组织IL-6、IL-10水平及海马区IL-6、IL-10 mRNA的影响
2.4 淫羊藿苷对抑郁症小鼠海马区小胶质细胞表型转化的影响
与空白组相比较,模型组小鼠脑组织iNOS蛋白相对表达量显著升高(P<0.05),CD206蛋白相对表达量仅有升高的趋势。与模型组相比较,盐酸氟西汀可降低模型小鼠的脑组织iNOS蛋白相对表达量和iNOS mRNA表达(P<0.01);淫羊藿苷高剂量可降低iNOS蛋白相对表达量(P<0.01),并促进CD206 mRNA表达(P<0.01);淫羊藿苷低剂量可降低小鼠脑组织iNOS蛋白相对表达量和iNOS mRNA表达(P<0.01、P<0.05),升高小鼠脑组织CD206蛋白相对表达量和CD206 mRNA表达(P<0.05),结果见图4。

图4 淫羊藿苷对抑郁症小鼠海马区小胶质细胞表型转化的影响
2.5 淫羊藿苷对小胶质细胞(BV-2)表型转化的影响
根据细胞活力实验,选取淫羊藿苷高、低剂量(30、15 μg/mL)为适宜的受试浓度;与空白组相比较,模型组细胞iNOS蛋白表达显著升高(P<0.05),CD206蛋白表达仅有升高的趋势。与模型组相比较,淫羊藿苷高、低剂量可降低iNOS蛋白表达(P<0.01),并促进CD206蛋白表达(P<0.01)结果见图5。
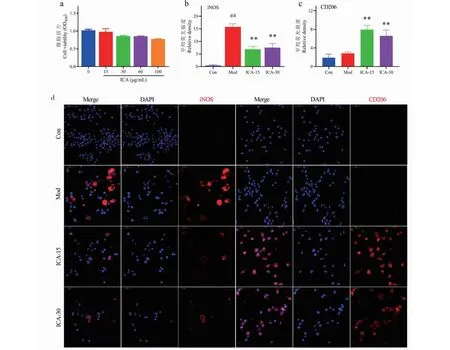
图5 淫羊藿苷对LPS刺激的小胶质细胞(BV-2)表型转化的影响
3 讨论与结论
抑郁症是严重的精神疾患,因发病机制复杂,尚缺乏理想的治疗方法。中医药在治疗抑郁症方面具有自身特色和优势[14]。目前,抑郁症发病机制尚不完全清楚,目前形成的假说主要有:炎性免疫假说,下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal,HPA)轴功能紊乱假说,单胺类神经递质假说,神经营养因子假说等[15,16]。随着研究的深入,炎性免疫假说受到国内外广泛关注[17]。研究表明,抑郁症患者体内不仅存在外周炎性反应,还存在中枢神经系统的免疫激活[18]。小胶质细胞是中枢神经系统中重要的一种免疫细胞,与中枢神经系统炎症反应密切相关,长期应激状态下,其结构和功能异常,导致情绪和精神状态等变化,是抑郁症发生发展的重要因素[19,20]。
经典激活型(M1型)以及替代激活型(M2型)是小胶质细胞的两种主要的极化表型[18,21,22]。M1型占活化细胞的绝大部分,可合成与分泌促炎介质TNF-α、IL-1、IL-6和一氧化氮合酶iNOS等,引发免疫炎症级联反应;M2型(三种亚型M2a型、M2b免疫表型、M2c失活性表型)可被白细胞介素4(interleukin-4,IL-4)、白细胞介素13(interleukin-13,IL-13)等刺激产生,释放抗炎因子IL-10和CD206等,发挥抑制炎症反应及神经保护功能,在大脑神经修复和可塑性中起着重要作用[23]。动物实验研究表明,暴露于CUMS的小鼠和大鼠前额叶皮层中的小胶质细胞高度激活并伴随着相关炎症介质的高表达,此类炎症介质可导致与抑郁症相关的炎症相关神经元变性[24,25]。一项尸检结果表明,重度抑郁症患者前扣带皮质区及腹侧前额叶白质区小胶质细胞密度显著增加呈现激活状态,但M2型小胶质细胞典型标志物CD206显著下调[26]。上述研究提示,小胶质细胞过度活化,M1型和M2型小胶质细胞极化状态在抑郁症的发生发展中起重要作用。
本研究发现,在CUMS致抑郁症小鼠海马区,促炎细胞因子IL-6水平升高,IL-6 mRNA、iNOS mRNA和iNOS蛋白过度表达并伴随着抑郁样行为的增加(强迫游泳不动时间增加,糖水消耗、运动距离减少),提示抑郁症小鼠海马区经典激活型M1型小胶质细胞显著增加。淫羊藿苷一方面可抑制小胶质细胞M1型激活,减少促炎细胞因子IL-6水平,降低IL-6 mRNA、iNOS mRNA和iNOS蛋白过度表达,抑制模型小鼠大脑炎症反应;另一方面,淫羊藿苷可促进小胶质细胞M2型激活,增加CUMS暴露小鼠海马区IL-10水平,促进IL-10 mRNA、CD206 mRNA和CD206蛋白表达,从而抑制模型小鼠的抑郁样行为。体外实验也表明,在LPS刺激下,小胶质细胞M1型极化增加,淫羊藿苷可抑制小胶质细胞M1型极化,并促进M2型极化。这提示,淫羊藿苷通过调节小胶质细胞表型转化来减轻过度的神经炎症。
单胺类神经递质5-HT、DA、NE代谢紊乱与抑郁症等神经精神疾病的发生发展密切相关[27]。CUMS致抑郁症模型大鼠大脑单胺类神经递质5-HT、DA、NE水平显著减少,地黄可降低模型大鼠海马区5-HT、DA和NE水平,改善抑郁症大鼠的抑郁样行为[28]。丹参多酚酸能有效改善大鼠抑郁样行为,可能通过抑制非受体型酪氨酸蛋白激酶2(Janus kinase 2)/信号转导与转录激活因子3(signal transducer and activator of transcription,STAT3)信号通路,减轻神经炎症,调节单胺类神经递质水平[29]。越来越多的证据开始表明,与压力相关的情绪可能通过影响单胺氧化酶的活性,激活初级免疫细胞-小胶质细胞。活化的小胶质细胞诱导许多炎症因子白细胞介素1β(interleukin-1β,IL-1β)、TNF-α、TGF-β等的释放,这些炎症因子可影响单胺类神经元的功能,通过氧化应激诱导单胺能神经传递减少,被认为是抑郁症的重要因素。已证实,单胺能药物可阻断小胶质细胞的激活,并以某种方式逆转抑郁症[30]。研究发现,四氢生物喋呤(tetrahydrobiopterin,BH4)作为抑郁症公认的标志物,是合成5-HT、DA和NE所需的关键酶促辅因子[31],BH4缺失可能会导致抑郁。M1型小胶质细胞可能会导致BH4分解代谢[32],抑制小胶质细胞M1极化可限制BH4的分解代谢,促进单胺类神经递质的合成和分泌[33]。本研究结果显示,CUMS致小鼠抑郁模型大脑海马区单胺类神经递质减少伴随着小鼠抑郁样行为的增加,淫羊藿苷可增加模型小鼠海马区单胺类神经递质的水平,可能是淫羊藿苷抗抑郁的作用机制之一,与之前的报道一致。但淫羊藿苷是否通过调控小胶质细胞表型转化,促进抑郁模型小鼠海马区单胺类神经递质合成和分泌,仍有待深入研究。
综上所述,本研究采用CUMS建立抑郁症小鼠模型和LPS诱导的小胶质细胞极化模型,发现补肾阳中药淫羊藿活性成分淫羊藿苷抑制小胶质细胞M1型极化、促进M2型极化,减轻抑郁小鼠海马区炎症反应,促进单胺类神经递质的产生是其抗抑郁的作用机制之一。

