薰衣草精油对皮肤屏障紫外损伤的保护机制研究
刘 菲, 王 倩, 韩婷婷, 杨素珍, 王文翠, 郭凤娇
(1. 山东福瑞达生物股份有限公司, 济南 250101; 2. 上海交通大学设计学院, 上海 200240)
作为皮肤的最外层,表皮是皮肤屏障功能的主要承担者,对维持人体内环境稳态十分重要。皮肤细胞的正常增殖和分化、角化包膜的完整性、细胞间脂质的正常代谢等,都是维持皮肤屏障健康的关键因素,如屏障相关蛋白丝聚蛋白(Filaggrin, FLG)、兜甲蛋白(Loricrin, LOR)、转谷氨酰胺酶1(Transglutaminase, TGM1)和紧密连接蛋白1(Claudin, CLDN1)等。研究表明:FLG缺乏会导致脂质双分子层结构紊乱、成熟延迟,同时造成角质层细胞紧密度降低,细胞间渗透性增强和光保护作用下降,最终导致皮肤屏障受损[1];LOR缺乏会导致屏障机械完整性降低;TGM1缺乏会导致角化包膜形成异常或无法形成,引发皮肤病;CLDN1蛋白表达的异常会导致屏障渗透性改变,影响信号传导途径[2]。此外,CD44受体在表皮分化、脂质合成和皮肤屏障功能中起着重要作用[3]。研究发现,CD44受体可通过激活ROS-Akt信号通路参与氧化还原状态的调控,CD44的缺失会降低Akt和mTOR的磷酸化,导致p21(细胞周期抑制物)及促凋亡蛋白Bax表达增加以及抗凋亡蛋白Bcl2表达降低,造成细胞凋亡,还会对紧密连接蛋白的含量、定位及功能产生影响,造成屏障功能的受损[3-5],甚至加重慢性皮肤炎症[6]。
紫外线(Ultraviolet, UV)是造成皮肤屏障损伤的常见因素之一,中波紫外线(Ultraviolet B, UVB)照射皮肤后,会造成皮肤中活性氧自由基(Reactive oxygen species, ROS)水平的升高以及抗氧化酶活性的降低。适度的ROS可作为信号分子,有利于细胞间的信息传递,帮助机体消灭恶性细胞及病原体,过量的ROS则会超出人体自身的清除速度,损害细胞膜脂及蛋白的结构和功能,造成细胞的氧化应激反应,引起机体内源性损伤相关分子模式(Damage associated molecular patterns, DAMPs)产生和细胞因子释放,激活多条信号通路,如炎症反应、屏障结构相关蛋白表达异常、CD44受体蛋白表达异常等,影响细胞的生长、增殖、代谢过程,对皮肤屏障造成损伤[7-9]。
薰衣草精油(Lavender essential oil, LEO)含有芳樟醇、乙酸芳樟酯、薰衣草醇、乙酸薰衣草酯、α-蒎烯、1,8-桉叶油醇等多种脂溶性小分子活性成分,具有抗菌、抗氧化、抗炎、抗焦虑等多重药理活性[10-11]。近年来,LEO被广泛应用于护肤品中,但多作为芳香剂使用;而事实上,LEO渗透性极好,可快速渗透皮肤并发挥作用[12-14],作为功效性护肤成分具有极大的应用潜力,但目前对LEO护肤作用机制的研究并不深入。
3D表皮皮肤模型具有高度类似于天然皮肤的组织结构、生理及代谢功能,可以更好地模拟物质在表皮上的代谢及其作用机制。采用3D表皮皮肤模型,通过UVB辐照建立皮肤屏障紫外损伤模型,探讨LEO对皮肤屏障紫外损伤的保护机制,旨在为LEO在该领域的应用提供理论支撑。
1 材料与方法
1.1 材料
3D表皮皮肤模型(EpiKutis®)购自广东博溪生物科技有限公司,批号为ES220303;原代角质形成细胞购自广东博溪生物科技有限公司,从人包皮组织提取分离得到的原代细胞;LEO由2020年6月自新疆伊犁地区采摘的狭叶薰衣草(Lavandulaangustifolia)花、茎部分,通过水蒸气蒸馏法提取制得,购自新疆伊帕尔汗香料股份有限公司;EpiGrowth培养液购自广东博溪生物科技有限公司;PBS购自博士德公司;MTT、地塞米松、维生素E、二甲基亚砜(DMSO)购自Sigma公司;IL-1α ELISA 试剂盒、PGE2 ELISA 试剂盒、TNF-α ELISA 试剂盒购自Abcam公司;CuZn/Mn-SOD活性检测试剂盒(WST-8法)、BCA蛋白浓度测定试剂盒、活性氧检测试剂盒、苏木素染色液、伊红染色液购自上海碧云天生物技术有限公司;多聚甲醛购自国药集团化学试剂有限公司;荧光染料购自Takara公司;Epoch酶标仪为BioTek公司产品;BX53正置显微镜为Olympus公司产品;DM2500荧光显微镜为Leica公司产品;7890B-5977A气相色谱-质谱联用仪为美国安捷伦公司产品;UVB辐照设备灯架为自制装置,UVB紫外灯管(型号:PL-S 9W/01/2P)为PHILIPS公司产品。
1.2 方法
1.2.1 LEO成分分析
将乙醇与正己烷以1∶1的体积比进行混合,混合均匀后加入LEO,稀释体积比比例为100∶1。采用气相色谱-质谱联用(Gas chromatography-mass spectrometry, GC-MS)方法对LEO进行成分检测分析。色谱条件:DB-WAX色谱柱(30 m×250 μm×0.25 μm);进样口温度260 ℃;载气为氦气(纯度>99.999%),流速1 mL/min;进样量1 μL;分流比30∶1;升温程序:初始柱温为50 ℃,维持3 min,随后以4 ℃/min升至120 ℃,维持10 min,再以2 ℃/min升至220 ℃,维持2 min。质谱条件:四级杆温度150 ℃,离子源温度230 ℃;EI源电离能量70 eV;全扫描质量范围35~450 amu,扫描方式为全扫描,数据库为NIST14谱库。
1.2.2 细胞毒性检测
在朱永刚等[15]实验方法的基础上,稍作修改。将处于对数生长期状态良好的原代角质形成细胞以8×103个/孔的密度接种于96孔培养板中,样品体积分数为0.008%~1%,稀释9个浓度梯度,采用四甲基偶氮唑蓝(Methyl thiazolyl tetrazolium, MTT)比色法检测LEO对原代角质形成细胞活力的影响。
1.2.3 工作液配制
7 μg/mL 维生素E(Vitamin E, VE)工作液、质量比为0.01%的地塞米松(Dexamethasone, DXM)工作液及体积比为1%/0.1%的LEO工作液均先以DMSO为溶剂,稀释为一定浓度的母液,再以EpiGrowth培养液为溶剂将母液稀释至相应作用浓度。
1.2.4 组织形态检测
将3D表皮皮肤模型预先转移至6孔板中,实验设置未给药+UVB未照射组、未给药+UVB照射组、质量比为0.01%的DXM+UVB照射组及体积比为0.1%/1%的LEO+UVB照射组,每组3个平行,将不同组别工作液分别加于模型表面,除未给药+UVB未照射组外,其余组别采用600 mJ/cm2剂量的UVB进行辐照(辐照强度为2.38 mW/cm2,照射时间为4 min 12 s,辐照剂量=辐照强度×辐照时间),于37 ℃、5% CO2条件下继续孵育24 h。孵育结束后,清洗模型表面残留的受试物。将用于组织形态检测的模型环切取下,使用4%多聚甲醛固定24 h 后,进行苏木精-伊红 (Hematoxylin-Eosin, H&E )染色处理,显微镜下拍照观察,采集图片。
1.2.5 ROS含量检测
将3D表皮皮肤模型预先转移至6孔板中,实验设置未给药+UVB未照射组、未给药+UVB照射组、7 μg/mL VE+UVB照射组及体积比为0.1%的LEO+UVB照射组,每组3个平行,将不同组别工作液分别加于模型表面,于37 ℃、5% CO2条件下孵育24 h。孵育结束后,将3D表皮皮肤模型转移至含有20 μmol/L DCFH-DA探针的工作液中,于培养箱(5% CO2,37 ℃)孵育1 h。用PBS的洗瓶冲洗模型底部,将清洗后的模型转移至含有PBS的6孔板中,除未给药+UVB未照射组外,其余组别以600 mJ/cm2剂量的UVB进行辐照(辐照强度为2.38 mW/cm2,照射时间为4 min 12 s,辐照剂量=辐照强度×辐照时间)。UVB辐照结束后,立即切取模型,置于1.5 mL EP管中,并在管中加1 mL 4%多聚甲醛固定液,进行冰冻切片,荧光显微镜下拍照观察,采集图片并分析。
1.2.6 超氧化物歧化酶(Superoxide dismutase, SOD)酶活力检测
将3D表皮皮肤模型预先转移至6孔板中,实验组别设置同1.2.5节,每组3个平行,将不同组别工作液分别加于模型表面,除未给药+UVB未照射组外,其余组别采用600 mJ/cm2剂量的UVB进行辐照(辐照强度为2.38 mW/cm2,照射时间为4 min 12 s,辐照剂量=辐照强度×辐照时间),于37 ℃、5% CO2条件下继续孵育24 h。孵育结束后,清洗模型表面残留的受试物后,收集模型,根据BCA及SOD试剂盒的操作说明书进行检测。
1.2.7 炎症因子检测
实验设置未给药+UVB未照射组、未给药+UVB照射组、质量比为0.01%的DXM+UVB照射组及体积比为0.1%的LEO+UVB照射组,每组3个平行,处理方法同1.2.6节,清洗模型表面残留的受试物后,收集模型培养液于EP管中,置于-80 ℃冰箱冷冻保存,根据酶联免疫吸附测定法 (Enzyme-linked immunosorbent assay, ELISA)检测试剂盒的操作说明书对白介素1α(Interleukin 1α, IL-1α)、肿瘤坏死因子α(Tumor necrosis factor α, TNF-α)、前列腺素E2(Prostaglandin E2, PGE2)表达量进行检测。
1.2.8 屏障相关蛋白表达检测
实验分组与模型处理方法同1.2.7节,清洗模型表面残留的受试物后,将用于检测的模型环切取下,用 4%多聚甲醛进行固定处理,固定24 h后,对屏障相关蛋白FLG和LOR进行免疫荧光(Immunofluorescence, IF)检测; LEO对屏障相关蛋白TGM1和CLDN1的影响采用免疫组化(Immunohistochemisty, IHC)法进行检测,分别在荧光显微镜或显微镜下拍照观察,每组采集3个视野照片,采用ipwin32图片分析软件对图片中的目标信号进行积分光密度(Integral optical density, IOD)分析,计算平均IOD值,以未给药+UVB未照射组为基准,计算相对IOD平均值来表征蛋白相对表达量。
1.2.9 CD44受体表达检测
实验分组与模型处理方法同1.2.7节,清洗模型表面残留的受试物后,测定不同分组对CD44受体表达的影响,根据IHC法的具体操作步骤进行操作,在显微镜下拍照观察,每组采集3个视野照片,采用ipwin32图片分析软件对图片中的目标信号进行IOD分析,计算平均IOD值,以未给药+UVB未照射组为基准,计算相对IOD平均值来表征蛋白相对表达量。
1.2.10 统计学分析
2 结果与分析
2.1 LEO成分分析
LEO的活性主要取决于其活性成分,而活性成分的含量受品种、提取时期、部位、地域、提取方式等影响[16-19]。通过GC-MS检测分析LEO的成分组成,共鉴定出51种化学成分,占检出总成分的99.965 7%,具体成分及含量如表1所示,主要成分乙酸芳樟酯(39.348 2%)、芳樟醇(28.073 7%)、乙酸薰衣草酯(5.339 0%)、樟脑(0.215 4%)的相对含量均在国家标准GB/T 12653—2008规定的含量范围之内。

表1 LEO的GC-MS成分鉴定及相对含量结果Table 1 The results of LEO components identification and relative contents by GC-MS
2.2 LEO对原代角质形成细胞活力的影响
LEO对原代角质形成细胞的活力影响如图1所示,LEO在体积比为0.1%的浓度范围内,原代角质形成细胞相对活力均在80%以上,未表现出细胞毒性。
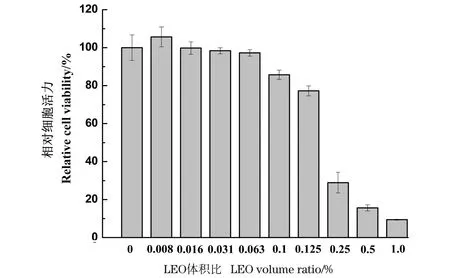
图1 LEO对原代角质形成细胞的活力影响Figure 1 The effects of LEO on keratinocyte cell viability
为进一步观察LEO对3D表皮皮肤模型组织形态的影响,且综合考虑到3D表皮皮肤模型的皮层结构、渗透性及实际应用情况,选择体积分数(下同)为0.1%及1%的LEO继续观察其对UVB诱导的皮肤屏障损伤模型的组织形态改善情况。
2.3 LEO对3D表皮皮肤模型组织形态的影响
不同处理对3D表皮皮肤模型组织形态影响结果及晒伤细胞阳性率统计结果如图2所示,与未给药+UVB未照射组相比,经UVB辐照后,3D表皮皮肤模型的角质层结构松散,表皮活细胞层厚度减小,活细胞层出现细胞核皱缩现象,基底层细胞数量减少,晒伤细胞大幅增多,说明紫外线会对皮肤组织造成损伤。与未给药+UVB照射组相比,0.1%的LEO以及阳性对照0.01% DXM均能显著改善紫外线造成的组织损伤,3D表皮皮肤模型的角质层松散程度降低,活细胞层厚度增加,活细胞层细胞核皱缩和基底层细胞数量减少的情况明显改善,细胞空泡化减少,晒伤细胞数显著降低,说明0.1%的LEO对UVB造成的3D表皮皮肤模型的组织损伤具有一定的保护效果。1%的LEO对紫外线造成的皮肤组织损伤无明显作用,可能由于LEO含量过高,对细胞活力存在一定影响,故选择体积分数为0.1%的LEO进行后续保护作用机制的探究。
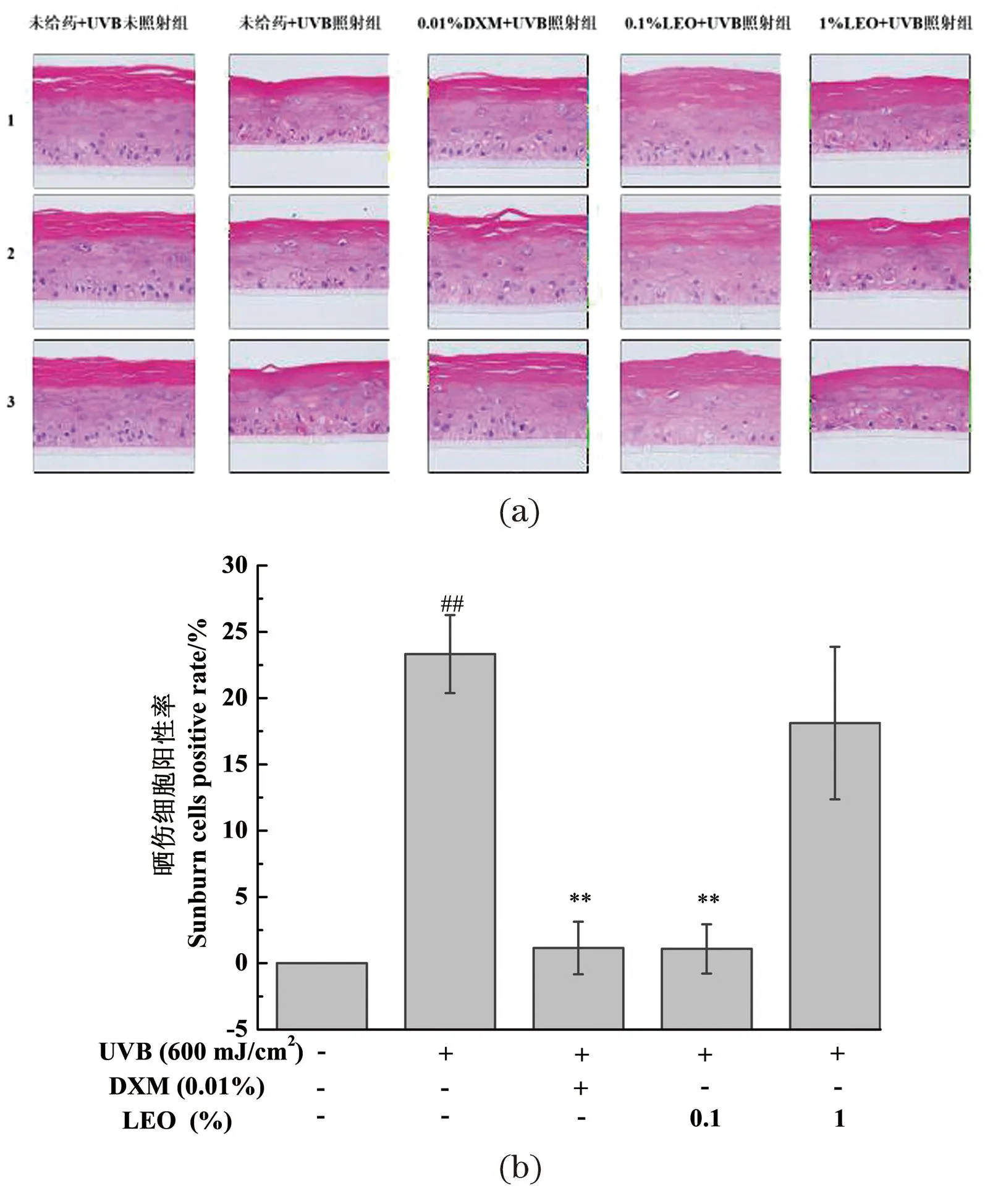
(a)3D表皮皮肤模型组织形态H&E染色图;(b)不同处理对3D表皮皮肤模型晒伤细胞阳性率的影响结果;##为P<0.01, vs.未给药+UVB未照射组;** 为P<0.01, vs.未给药+UVB照射组。图2 不同处理对3D表皮皮肤模型组织形态影响结果Figure 2 The results of 3D epidermal skin model tissue morphology with different treatments
2.4 LEO下调UVB诱导的3D表皮皮肤模型的ROS水平
图3为不同处理对3D表皮皮肤模型ROS水平的影响结果,与未给药+UVB未照射组相比,UVB刺激后会导致3D表皮皮肤模型的ROS水平显著增加(P<0.01),与未给药+UVB照射组相比,0.1%的LEO以及阳性对照7 μg/mL VE处理均能显著降低ROS的水平(P<0.01),减少氧化应激反应。
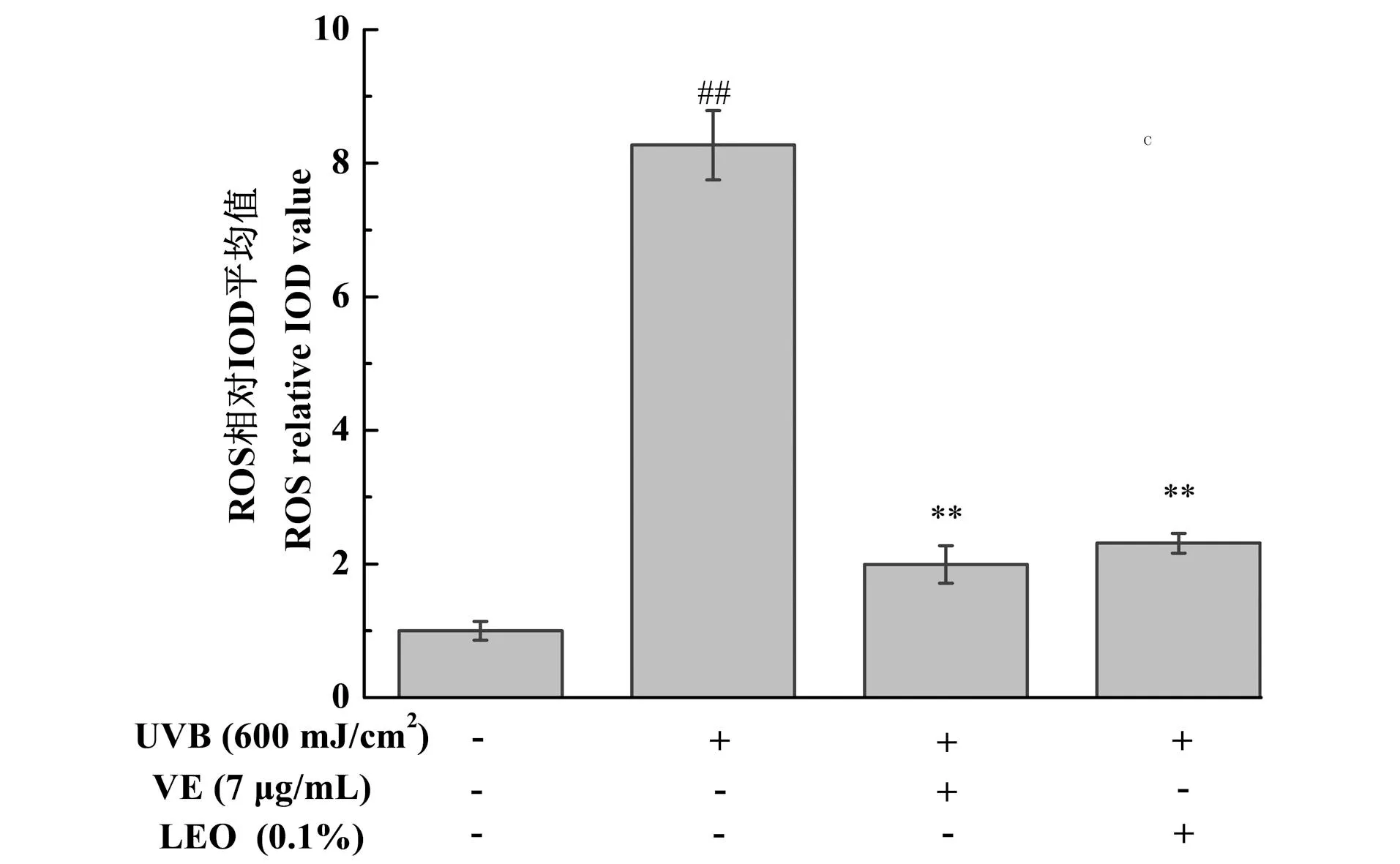
##为P<0.01, vs.未给药+UVB未照射组;** 为P<0.01, vs.未给药+UVB照射组。图3 不同处理对3D表皮皮肤模型ROS水平的影响结果Figure 3 The results of ROS levels in 3D epidermal skin models with different treatments
2.5 LEO抑制UVB诱导的3D表皮皮肤模型的SOD酶活力下降
不同处理对3D表皮皮肤模型SOD酶活力的影响结果如图4所示,与未给药+UVB未照射组相比,UVB照射后,可引起3D表皮皮肤模型的SOD酶活力显著降低(P<0.01)。与未给药+UVB照射组相比,LEO以及阳性对照7 μg/mL VE处理均能显著提升SOD酶活力(P<0.01),且LEO的效果优于VE,具有较强的抗氧化性,可提高皮肤自身抗氧化能力,减少氧化损伤。
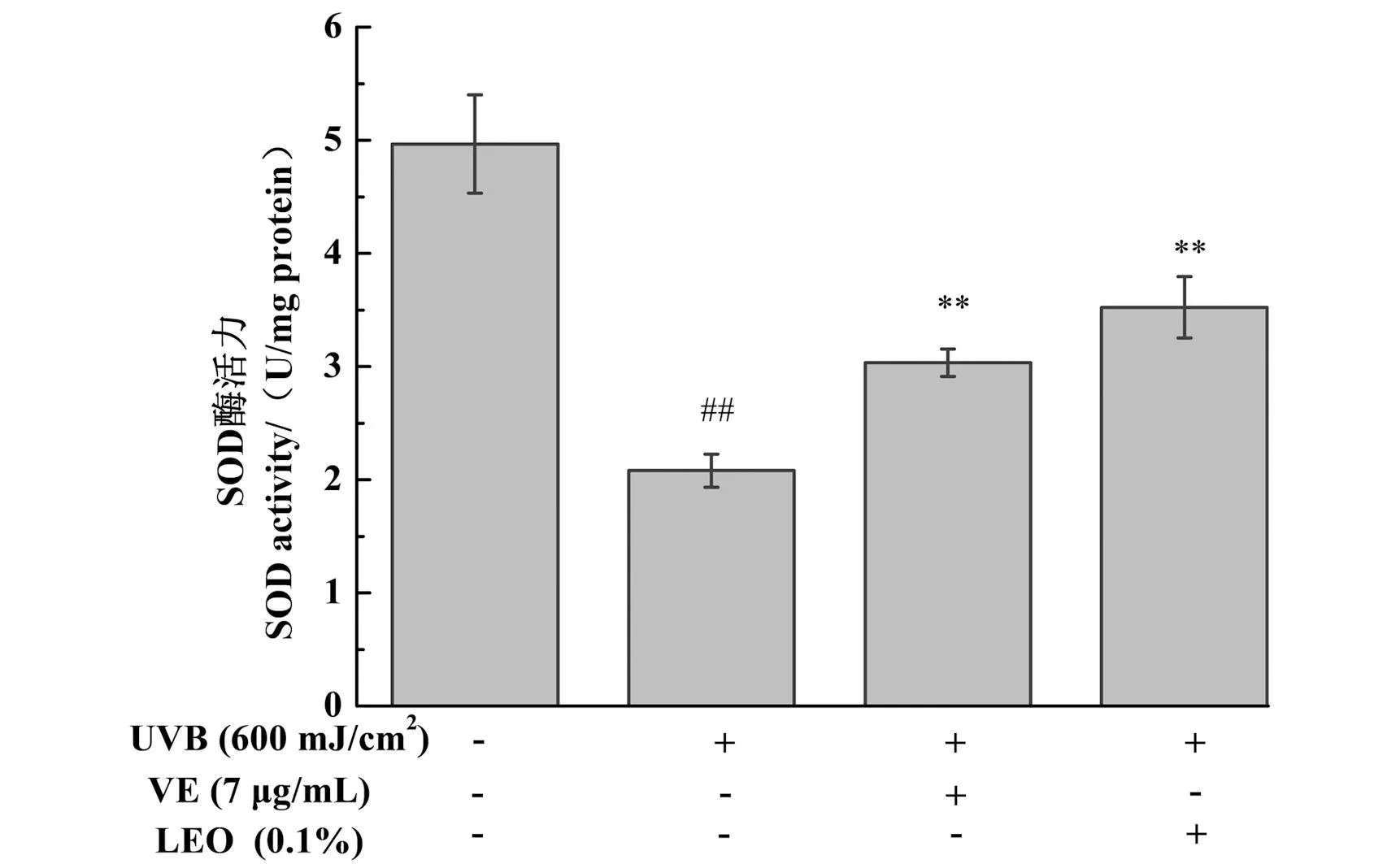
##为P<0.01, vs.未给药+UVB未照射组;** 为P<0.01, vs.未给药+UVB照射组。图4 不同处理对3D表皮皮肤模型SOD酶活力的影响结果Figure 4 The results of SOD enzyme activity in 3D epidermal skin models with different treatments
2.6 LEO下调UVB诱导的3D表皮皮肤模型的炎症因子表达
不同处理对炎症因子蛋白表达量的影响结果如图5所示,UVB刺激后会导致3D表皮皮肤模型的IL-1α[图5(a)]、TNF-α[图5(b)]及PGE2[图5(c)]蛋白表达量显著增加(P<0.01)。相较未给药+UVB照射组,LEO和阳性对照0.01% DXM处理均可显著降低UVB诱导的IL-1α、TNF-α及PGE2表达量的增加(P<0.05),LEO效果略逊于DXM,表明LEO可通过减少炎症因子的表达来降低UVB诱导的皮肤屏障损伤。
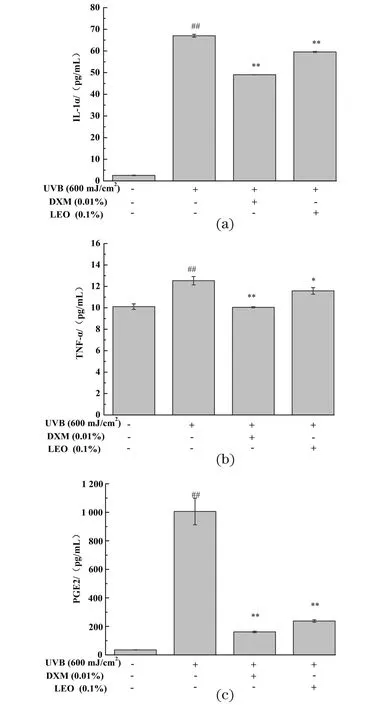
(a)IL-1α蛋白表达量;(b)TNF-α蛋白表达量;(c)PGE2表达量;##为P<0.01, vs.未给药+UVB未照射组;* 为P<0.05,** 为P<0.01, vs. 未给药+UVB照射组。图5 不同处理对3D表皮皮肤模型炎症因子表达量的影响结果Figure 5 The results of inflammatory factor in 3D epidermal skin model with different treatments
2.7 LEO抑制UVB诱导的3D表皮皮肤模型的屏障相关蛋白表达下降
不同处理对屏障相关蛋白表达量的影响如图6所示,与未给药+UVB未照射组相比,UVB辐照下,4种屏障相关蛋白表达量均显著降低(P<0.01),表明UVB对皮肤屏障结构有一定的损伤作用;相较未给药+UVB照射组,LEO及DXM处理均能显著提高屏障相关蛋白TGM1、FLG、LOR和CLDN1的表达量(P<0.01);其中,对LOR和CLDN1,LEO的促进效果优于DXM。表明LEO对UVB诱导的皮肤屏障结构损伤具有一定的保护效果。
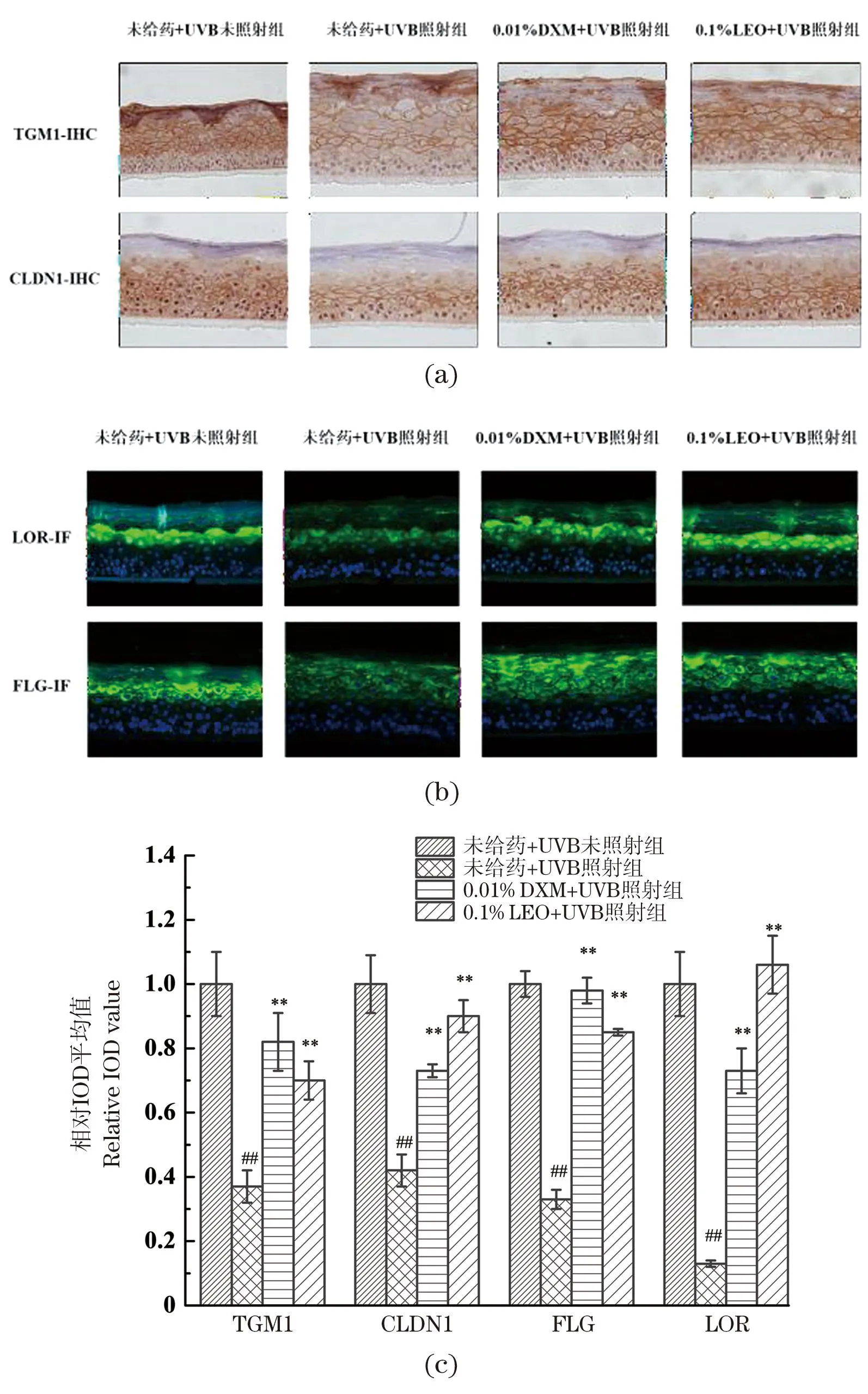
(a)TGM1及CLDN1免疫组化代表性结果图;(b)LOR及FLG免疫荧光代表性结果图;(c)4种屏障相关蛋白相对表达量;##为P<0.01, vs.未给药+UVB未照射组;** 为P<0.01, vs.未给药+UVB照射组。图6 不同处理对3D表皮皮肤模型屏障相关蛋白表达量的影响结果Figure 6 The results of barrier-related proteins expression in 3D epidermal skin models with different treatments
2.8 LEO抑制UVB诱导的3D表皮皮肤模型的CD44受体表达下降
不同处理对3D表皮皮肤模型CD44受体蛋白表达量的影响结果如图7所示,与未给药+UVB未照射组相比,UVB辐照可引起3D表皮皮肤模型中CD44受体蛋白表达量显著降低(P<0.01)。相较模型组,LEO以及阳性对照DXM处理均能显著提高CD44受体蛋白的表达量(P<0.01),且LEO效果优于DXM。LEO促进受损皮肤屏障中CD44受体蛋白表达量恢复至正常水平,有利于调节氧化平衡,减少皮肤炎症,促进表皮正常分化,减少UVB诱导的皮肤屏障损伤。
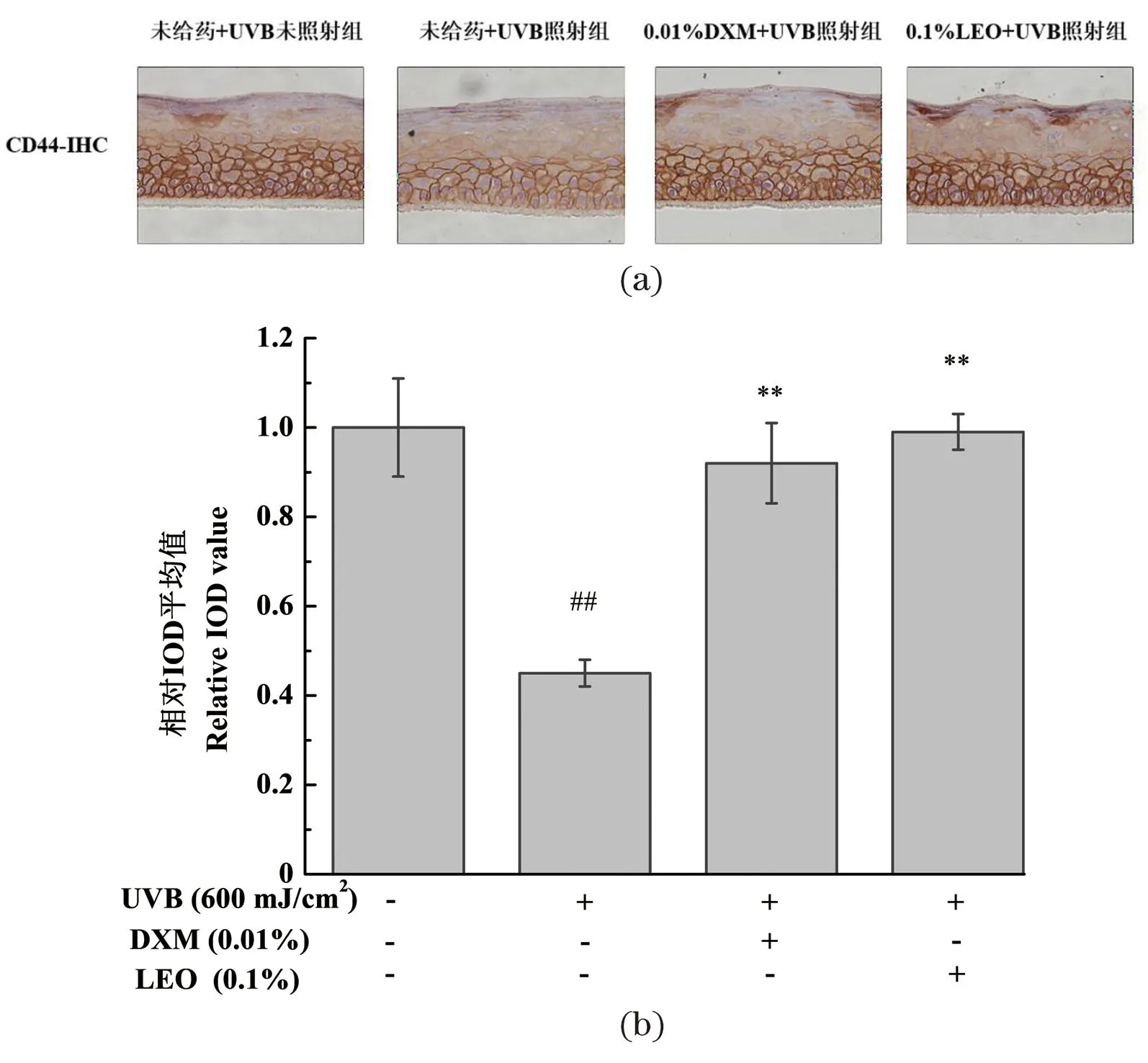
(a)CD44免疫组化代表性结果图;(b)CD44蛋白相对表达量;##为P<0.01, vs.未给药+UVB未照射组;** 为P<0.01, vs.未给药+UVB照射组。图7 不同处理对3D表皮皮肤模型CD44受体蛋白表达量的影响结果Figure 7 The results of CD44 receptor expression in 3D epidermal skin models with different treatments
3 讨论与结论
以上研究提示,LEO对多种条件诱导的炎症反应及氧化应激反应均有一定的抑制作用,基于现有研究结果推断LEO的生物活性可能与其主要成分芳樟醇关系较大,其他活性成分如1,8-桉叶油醇、月桂烯、柠檬烯、α-蒎烯等也起到重要作用。但上述实验结果基于的实验模型与皮肤组织相差较大,缺少皮肤渗透吸收过程及细胞代谢过程,LEO是否在皮肤上也能起到与上述研究相似的结果还有待验证。在本研究中,我们通过UVB诱导3D表皮皮肤模型建立皮肤屏障紫外损伤模型,从LEO对氧化应激、炎症反应、屏障结构相关蛋白以及CD44受体的影响,探究LEO对皮肤屏障紫外损伤的保护作用及相关机制。研究结果提示,0.1%的LEO对UVB诱导的皮肤屏障损伤有一定的保护作用,其机制可能是LEO通过减少ROS的产生并提高SOD酶活力,参与氧化还原平衡调控;通过抑制炎症因子IL-1α、TNF-α和PGE2的表达,减轻炎症反应;促进屏障相关蛋白TGM1、FLG、LOR和CLDN1的正常表达,保障屏障结构的完整性与强度。此外,本研究还发现,LEO可抑制UVB诱导的皮肤CD44受体表达的减少。CD44受体的缺乏会激活氧化应激、加重炎症反应、影响表皮正常分化、促进细胞凋亡等,是皮肤屏障损伤的重要原因之一。LEO对UVB诱导的受损皮肤屏障中氧化应激、炎症反应、屏障蛋白表达的调控是否与CD44受体相关,还有待进一步探索。

