碳离子束辐照对马铃薯组培苗生长及生理特性的影响
王 琦, 杨江伟,2, 许超丽,2, 周利斌, 张 宁,2, 司怀军,2
(1. 甘肃农业大学生命科学技术学院, 兰州 730070; 2. 甘肃农业大学省部共建干旱生境作物学国家重点实验室, 兰州 730070; 3. 中国科学院近代物理研究所生物物理室, 兰州 730000)
马铃薯(SolanumtuberosumL.)是原产于南美洲安第斯山脉的多年生草本植物,16至19世纪马铃薯通过中国西北和华南地区传入国内[1]。马铃薯适应生存环境能力强,种植品种类型多,单位面积产量高,既适合多种生态地区种植,又是抗旱、救灾的主要农作物之一。现如今它已成为继小麦(Triticumaestivum)、水稻(Oryzasativa)和玉米(Zeamays)之后的第四大主要粮食作物[2]。马铃薯栽培品种为同源四倍体,具有高度杂合的基因组,存在严重阻碍遗传分析与品质改良的问题。主要表现在产量下降、品质变劣、生长势降低等方面[3]。目前,马铃薯野生资源的应用和探索以及种质资源的改良进展缓慢[4-6]。因此,马铃薯育种面临巨大挑战[7]。
辐射诱变是进行种质资源创新的有效途径之一[8],其中,高能重离子束作为辐照诱变育种技术中的一种新的诱变源,已被广泛应用于植物的诱变育种[9],比如水稻[10]、小麦[11]、玉米[12]、大豆(Glycinemax)[13]和甜高粱(Sorghumbicolor)[14]等。尽管重离子束辐照诱变技术已广泛应用于许多粮食作物的品种改良[15],然而将重离子束辐照诱变应用于马铃薯育种的报道却很少。本研究以马铃薯品种‘新大坪’组培苗茎切段为材料,开展不同剂量的高能碳离子束辐照处理,对处理后的马铃薯组培苗茎切段生长指标、幼苗形态和生理指标等开展研究,以期确定适宜马铃薯品种‘新大坪’辐照诱变的剂量范围,为进一步开展马铃薯辐照诱变育种提供理论基础。
1 材料与方法
1.1 材料
以马铃薯品种‘新大坪’的无菌组培苗为供试材料,组培苗由甘肃农业大学生命科学技术学院提供。
1.2 方法
1.2.1 马铃薯组培苗样品制备
挑选生长情况一致的马铃薯品种‘新大坪 ’组培苗,在超净工作台上剪取只带有一个腋芽的茎切段外植体(10~15 mm),迅速接入灭菌后含有基础MS培养基的直径35 mm圆形培养皿中,每皿装载20个样品,并用Parafilm膜进行封口,做好标记后置于光照培养箱中培养1 d,后续进行高能碳离子束的辐射处理。
1.2.2 高能碳离子束辐射处理
将上述制备好的马铃薯组培苗茎切段样品进行高能碳离子束辐照处理,使用高能碳离子束(12C6+)[中国科学院近代物理研究所兰州重离子研究装置(Heavy Ion Research Facility in Lanzhou,HIRFL)提供],束流能量为80.55 MeV/u,到达样品的平均LET值为34 keV/μm,辐照的剂量率约为20 Gy/min,辐照剂量设置为10、20、30和40 Gy。对照组(0 Gy)保存放置的环境与处理组相同,但不进行辐照处理,整个辐照处理的过程均在室温条件下进行。
1.2.3 马铃薯组培苗样品的继代培养
配制MS固体培养基,调节pH值范围为5.8~6.0,将调节好的培养基装入150 mL的培养瓶中(每瓶50 mL),封口,121 ℃高压灭菌20 min后备用。将经高能碳离子束辐照后的马铃薯组培苗茎切段与对照组马铃薯组培苗茎切段在超净工作台进行扩繁,扩繁后剪取约1 cm的带有1个叶片和腋芽的茎切段接种至MS固体培养基上,每个处理15瓶,每瓶5株。放入恒温光照培养箱进行培养,设定生长温度(21±2) ℃,光照周期h/d=16 h/8 h,光照强度4 000 lx的生长条件,生长30 d后进行表型性状和生物化学指标测定。
1.2.4 形态指标测定
观察并记录马铃薯组培苗茎切段辐照后30 d的生长情况以及变异情况,分析不同辐照剂量处理下的生理性状差异。
致死率=死亡的组培苗茎切段数/辐照茎切段总数×100%
侧芽形成率=生出侧芽的组培苗茎切段数/辐照茎切段总数×100%
形态变异率=形态产生变化的组培苗茎切段数/辐照茎切段总数×100%
1.2.5 生理指标测定
辐照后30 d对不同高能碳离子束辐照处理后的幼苗地上部分取样,未辐照组为对照,称量鲜重后液氮快速冷冻,并置于-80 ℃冷冻保存,用于进行后续生理指标的测定分析。
粗酶液提取:称取样品放入预冷的研钵中,加入磷酸缓冲液(0.5 mol/L,pH 7.8),冰浴研磨,匀浆倒入离心管中,在10 000 r/min、4 ℃下离心20 min,上清液为粗酶液,将其分装至离心管中,置于-20 ℃冷冻保存,用于后续试验。
(1)超氧化物歧化酶活性测定。超氧化物歧化酶(Superoxidedismutase,SOD)活性测定采用氮蓝四唑光化学还原法[16]。将磷酸缓冲液(0.5 mol/L,pH 7.8)、甲硫氨酸(130 mmol/L)、氮蓝四唑(750 μmol/L)、乙二胺四乙酸二钠(100 μmol/L)、核黄素(20 μmol/L)和水按15∶3∶3∶3∶3∶2.5配制混匀,得到SOD反应液。将20 μL粗酶提取液和3 mL反应液添加至5 mL离心管中。将参比管置于暗处,样品与对照置于4 000 lx条件下光照30 min后于560 nm波长处测定吸光值,以参比管OD值调零,对SOD活性进行计算。SOD酶活力定义:将氮蓝四唑(NBT)还原抑制到对照一半(50%)时,定义为1个酶活力单位(U)。
(2)过氧化物酶活性测定。过氧化物酶(Peroxidase,POD)活性测定采用愈创木酚法[16]。将磷酸缓冲液(0.1 mol/L,pH 6.0)50 mL和愈创木酚28 μL加热搅拌使之完全溶解,冷却后加入19 μL的30% H2O2溶液,得到POD反应液。将10 μL粗酶提取液和3 mL POD反应液置于比色皿中,在470 nm波长下每隔1 min测定一次吸光值。POD酶活力定义:每克样品在每毫升反应体系中每分钟A470变化0.01为1个酶活力单位(U)。
(3)过氧化氢酶活性测定。过氧化氢酶(Catalase,CAT)活性测定采用过氧化氢分解法[16]。磷酸缓冲液(0.1 mol/L,pH 7.0)和H2O2(0.1 mol/L)按4∶1配制混匀,得到CAT反应液。将50 μL粗酶提取液和2.5 mL CAT反应液置于比色皿中,在240 nm波长下每隔1 min测定一次吸光值。CAT酶活力定义:每克样品在反应体系中每分钟催化1 μmol H2O2降解定义为1个酶活力单位(U)。
(4)丙二醛含量测定。丙二醛(Malondialdehyde,MDA)含量测定采用硫代巴比妥酸法[16]。少量NaOH溶液(1 mol/L )溶解0.6 g硫代巴比妥酸,用10%三氯乙酸定容至100 mL,得到MDA反应液。将1 mL粗酶提取液和2 mL MDA反应液混匀封口,置沸水浴15 min,迅速冷却后在4 000 r/min、4 ℃下离心5 min,取上清液,在600、532和450 nm 3个波长下比色。
1.2.6 半致死剂量确定
在一定辐照剂量范围内,提高辐照剂量可以提高植物的突变频率,但也会增加植物的生理性损伤。辐照剂量的选择应该依据植物受到伤害程度低的前提下实现植物产生更多遗传变异的原则,所以辐照诱变的适宜剂量一般采用半致死剂量(Lethal dose at 50 percent, LD50)较为合适。根据‘新大坪’组培苗茎切段在不同剂量照射下的存活率,利用SPSS软件拟合线性回归方程y=a+bx推导出LD50,以此确定‘新大坪’组培苗茎切段的半致死辐照剂量,从而找出高能碳离子束辐照马铃薯的适宜辐照剂量。
1.3 统计分析
利用Microsoft Excel 2019进行数据的整理和计算。使用SPSS 26.0统计软件进行Duncan显著性分析,每组处理均设置3次生物学重复,采用Origin 2020进行作图。
2 结果与分析
2.1 不同辐射剂量对马铃薯组培苗茎切段成活的影响
通过表1分析可知,经过碳离子束辐照处理后的马铃薯品种‘新大坪 ’组培苗茎切段的致死率随辐照剂量增加而提高。当辐照剂量为10 Gy时,‘新大坪’的致死率与对照组相比并无显著差异且植株生长旺盛。当辐照剂量范围为20~40 Gy时,‘新大坪’的致死率明显高于对照组。辐照剂量为20 Gy时,‘新大坪’的生长良好,但辐照剂量在30~40 Gy时,植株的生长情况差。结果表明,随着辐照剂量不断增加,‘新大坪’组培苗茎切段的存活率与辐照剂量呈现负相关性,而致死率与辐照剂量呈现正相关性。

表1 不同辐射剂量对马铃薯组培苗茎切段的影响Table 1 Effects of different radiation doses on tissue culture plantlet stem segments of potato varieties
2.2 不同辐照剂量对马铃薯组培苗生长和变异的影响
从表2可知,‘新大坪’在10 Gy时的生根率和侧芽形成率与对照组相比没有明显的差异,当剂量超过20 Gy时,随着辐照剂量升高,生根率显著下降。当剂量超过30 Gy时,‘新大坪’的侧芽形成率显著降低。在20 Gy剂量辐照下,‘新大坪’的形态变异率有小幅度提高,形态变异率为64.00%;随着辐照剂量增高,‘新大坪’的形态变异率显著下降。观察到‘新大坪’在40 Gy处理组中有2株组培苗形成根,但这2株组培苗在15 d后开始陆续死亡。综上所述,40 Gy已接近马铃薯组培苗茎切段的致死辐照剂量。
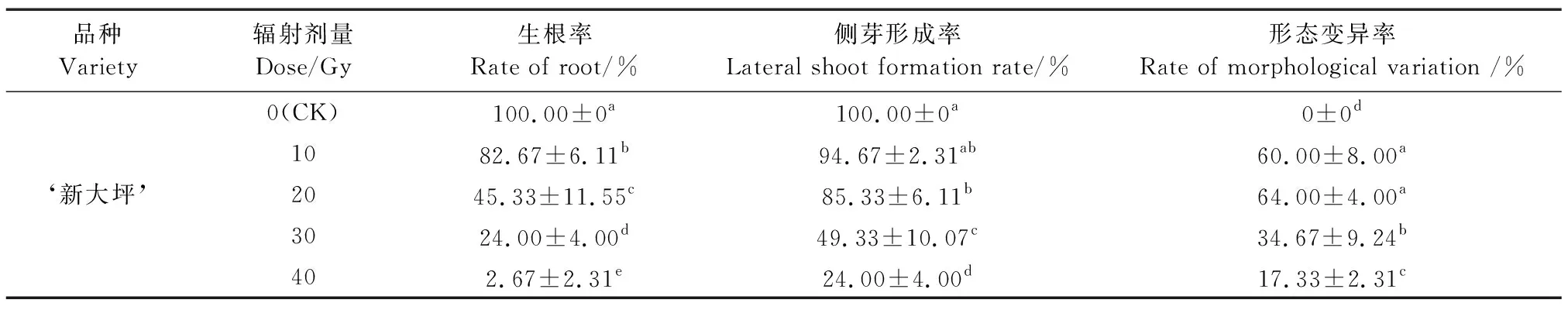
表2 不同辐射剂量对马铃薯组培苗生长及变异影响Table 2 Effects of different radiation doses on the growth and variation of potato tissue-cultured plantlets
与对照相比,‘新大坪’组培苗形态发生明显变化 (图1),植株的变化主要表现为叶片不对称、叶缘不规则[图1(b)]、茎变异伸长、叶片丛生[图1(c)]、叶片卷曲狭长[图1(d)]、茎上结薯生根[图1(e)]、叶片丛生[图1(f)]、叶片缺失[图1(g)]、部分小叶变小[图1(h)]、叶片粘连[图1(i)]、小叶变小、叶缘不规则[图1(j)]等。

(a)对照组植株;(b)叶片不对称、叶缘不规则;(c)茎伸长、叶片丛生;(d)叶片卷曲狭长;(e)茎上结薯生根;(f)叶片丛生;(g)叶片缺失;(h)部分小叶变小;(i)叶片粘连;(j)叶片变小,叶缘不规则。图1 碳离子束辐射对植株形态改变的影响Figure 1 Morphological variation of tissue-cultured plantlets irradiated by carbon ion beams
2.3 不同辐照剂量的高能碳离子束对马铃薯生理指标的影响
2.3.1 碳离子束辐照对马铃薯相关抗氧化酶活性的影响
为探讨马铃薯组培苗对碳离子束辐照诱导的氧化应激的抗氧化反应,测定了3种具有代表性的胞内抗氧化酶的活性。‘新大坪’组培苗茎切段经不同剂量的高能碳离子束辐照处理后,其组培苗叶片中SOD的活性呈现出先升高后下降的现象[图2(a)]。10 Gy和20 Gy处理的SOD活性分别为236.80和230.89 U/gFW,高于对照(180.48 U/gFW);30 Gy时的SOD活性为156.17 U/gFW。10 Gy时SOD活性最高,随着辐照剂量的升高,SOD活性逐渐降低,30 Gy处理组的SOD活性略低于对照。
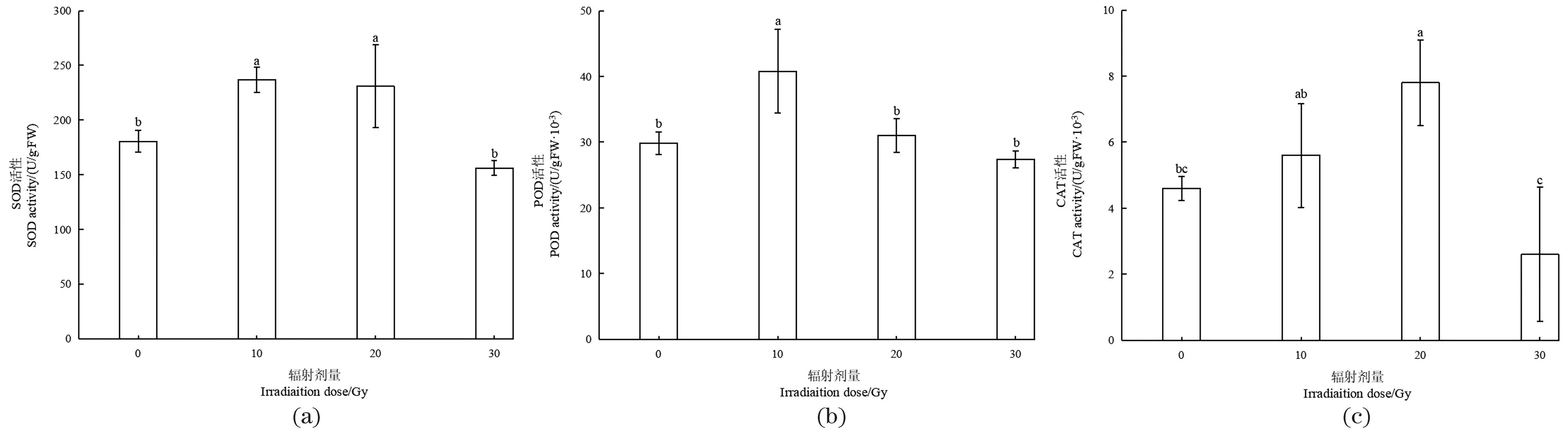
(a)SOD活性;(b)POD活性;(c)CAT活性。图中不同小写字母代表处理间差异显著(P<0.05)。图2 高能碳离子束对马铃薯组培苗抗氧化酶活性的影响Figure 2 Effect of high-energy carbon ion beam on antioxidant enzyme activity of potato tissue-cultured plantlets
随着高能碳离子束辐照剂量的增加,‘新大坪’组培苗叶片中的POD活性呈现出先升高后下降的现象[图2(b)]。对照组的POD活性为29.87×103U/gFW,当高能碳离子束辐照剂量为10 Gy时,其POD活性为40.78×103U/gFW,显著高于对照及其他剂量的辐照处理组;当辐照剂量增加到20 Gy时,POD活性开始显著下降,POD活性为31.02×103U/gFW,30 Gy时的POD活性为27.41×103U/gFW,略低于对照组。
高能碳离子束辐照使组培苗叶片中CAT活性先逐步提高,在达到一定辐照剂量后,CAT活性开始降低。如图2(c)所示,对照组的CAT活性为4.61×10-3U/gFW,随着辐照剂量的增加,CAT活性增高,10 Gy时的CAT活性为5.64×10-3U/gFW;当辐照剂量为20 Gy时,‘新大坪’幼苗叶片的CAT活性显著上升(7.79×10-3U/gFW);辐照剂量增加到30 Gy时,CAT活性降低为2.63×10-3U/gFW,显著低于对照组。
2.3.2 碳离子束辐照对马铃薯丙二醛含量的影响
MDA是衡量氧化胁迫程度的常用指标之一,反映植物膜脂过氧化的程度。不同程度的高能碳离子束剂量处理后,幼苗叶片内MDA含量出现波动(图3)。随着辐照剂量增加,MDA含量先增加后降低,而后又显著升高。对照组的MDA含量为15.34×10-3nmol/gFW,10 Gy时MDA含量开始显著上升(26.15×10-3nmol/gFW);当辐照剂量上升到20 Gy时,MDA含量为21.08×10-3nmol/gFW,较10 Gy组的MDA含量有小幅下降,但仍高于对照组;当辐照剂量为30 Gy时,MDA含量显著上升,为40.95×10-3nmol/gFW,显著高于对照及其他处理组。
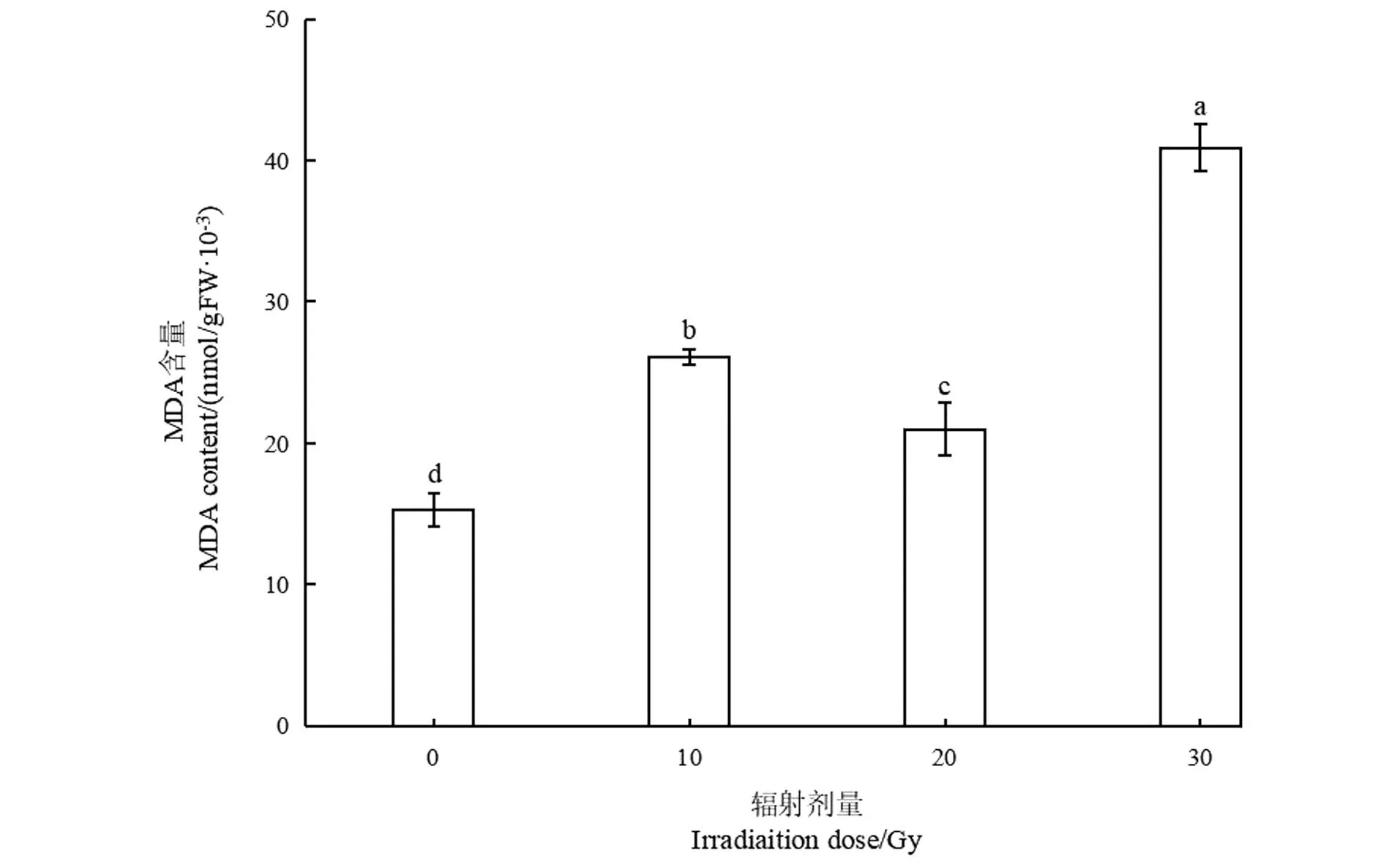
图中不同小写字母代表处理间差异显著(P<0.05)。图3 高能碳离子束对马铃薯组培苗丙二醛含量的影响Figure 3 Effect of high-energy carbon ion beam on malondialdehyde content of potato tissue culture plantlets
2.4 高能碳离子束辐照马铃薯的半致死辐照剂量的确定
根据碳离子束辐照剂量与致死率之间得到的线性回归可得知(表3),马铃薯‘新大坪’的回归系数b为2.53,截距a为-1.60,可以得知‘新大坪’的线性回归方程为y=-1.60+2.53x,其中,因变量y为致死率,自变量x为碳离子束辐照剂量。从线性回归方程可得,当‘新大坪’的致死率为50%时,即y为50,x=20.37,即‘新大坪’的半致死辐照剂量LD50=20.37 Gy,约为20.00 Gy。表3中的P值若小于0.01则可以表明自变量对因变量具有极显著影响。‘新大坪’的P值为0.001(<0.01),即辐照剂量和致死率之间存在极显著的线性关系。
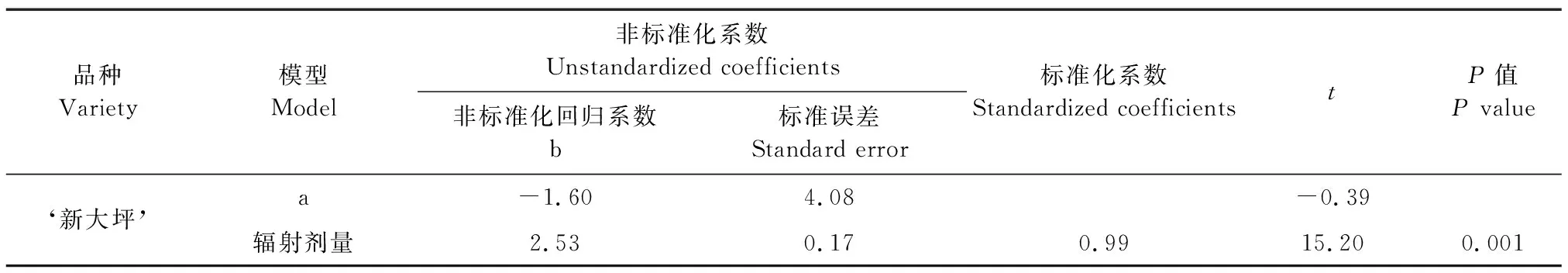
表3 马铃薯组培苗辐射后的一元一次方程回归系数及检验结果Table 3 Regression coefficients and test results of univariate linear equation of tissue cultured plantlets of potato after radiation
3 讨论
作为有显著效果的物理诱变技术,高能重离子束可以影响植物生长发育,对植物的生理造成损伤。本研究发现,高能碳离子束处理的辐照剂量和‘新大坪’组培苗茎切段的生根率呈负相关。高辐照剂量的损伤效应明显,植株会产生严重且不可逆转的生理性损伤甚至全部死亡,该结果与刘玲等[17]和石紫薇等[18]的研究结果一致。高辐照剂量处理在一定程度上对马铃薯组培苗的侧芽形成产生抑制效应,这与吴大利[19]对一串红和胡麻进行辐射研究的结果相符合。高能重离子束可以影响细胞DNA等生物分子,特定能量及剂量的电子束辐照植物,可导致DNA分子发生断裂及重组,从而诱发基因突变,产生表型变异。如王静等[20]辐射燕山早丰后其接穗叶片的面积增大,发现叶片卷曲。本研究发现将碳离子束辐照后的马铃薯组培苗茎切段继代培养,其表型改变主要表现在叶柄、叶缘、叶片和叶顶端;表型变化主要为叶片不对称、叶缘不规则、茎变异伸长、叶片丛生和叶片粘连等。当植物受到伤害时,活性氧产生和清除机制的动态平衡会被破坏,植物为保护自身不被活性氧伤害,形成了酶促抗氧化系统来清除过多的活性氧。本试验结果表明,在10 Gy辐照处理下,‘新大坪’组培苗叶片中的SOD、CAT、POD活性升高,表明辐照处理下‘新大坪’组培苗茎切段通过提高细胞内SOD、CAT、POD的酶活来消除过多的活性氧,以减轻辐射带来的损伤。随着辐照剂量升高,其SOD、CAT和POD的酶活下降,说明高剂量的碳离子束辐照对组织细胞损伤增加,当活性氧的累积超出自身损伤最大值时,酶促抗氧化系统被破坏,从而导致致酶活降低。MDA是衡量氧化胁迫程度的常用指标之一,可以反映植物膜脂过氧化的程度[21]。本研究中10 Gy的辐照剂量下,‘新大坪’组培苗的MDA含量升高,说明低剂量辐照使其积累渗透调节物质来增强对逆境的抵抗。当辐照剂量为20 Gy时,‘新大坪’组培苗的MDA含量较峰值略有下降,表明此时抵御逆境的机制仍在发挥作用,但合成效率降低,对辐射的抵御效果减弱。当辐照剂量为30 Gy时,MDA含量显著上升,说明高辐照剂量使其产生较为严重的膜质过氧化损伤,使得植物产生的活性氧的自由基累积超过自身所承受阈值,从而导致膜结构被破坏。在辐照诱变育种研究中,辐照剂量的选择应该依据植物受到伤害程度低的前提下实现植物产生更多遗传变异的原则,所以辐照诱变的适宜剂量一般采用半致死剂量。通过辐照剂量与致死率之间得到的线性回归可得知马铃薯品种‘新大坪’组培苗的碳离子束辐照LD50为20.37 Gy,剂量率为20 Gy/min。
4 结论
马铃薯组培苗茎切段随着高能碳离子束辐照剂量的升高,组培苗生长受到明显抑制作用,尤其是高剂量(40 Gy)严重影响组培苗存活率及其生长;SOD活性、POD活性和CAT活性随辐照剂量的增加都呈先升后降趋势,MDA含量则呈先升后降,随后又升高的现象。根据半致死辐照剂量回归方程可以得出马铃薯品种‘新大坪’组培苗的碳离子束辐照LD50为20.37 Gy,初步认为在20 Gy/min高剂量率辐照条件下, 以20 Gy左右剂量进行辐照较为适宜。

