基于临床和CT影像学特征的胰腺囊性病变进展预测模型的建立及验证
邓文祎 谢飞扬 毛丽 李秀丽 孙照勇 徐凯 朱亮 金征宇 李骁 薛华丹
1中国医学科学院北京协和医学院 北京协和医院放射科,北京 100730;2深睿医疗人工智能研究院,北京 100080;3南京大学医学院附属金陵医院(东部战区总医院)放射诊断科,南京 210002
随着影像检查设备的不断进步和人们健康意识的不断提升,胰腺囊性病变(pancreatic cystic lesions, PCLs)的检出率逐年升高。研究显示在磁共振胆胰管成像中,PCLs的检出率高达49.1%[1]。PCLs存在恶变风险[2],但较低[3],而其手术并发症的发生率高达30%[4],因此绝大多数患者选择接受长期影像学随访。然而随之而来的检查费用给患者带来巨大的经济负担,因此制定准确的病灶进展预测策略,是PCLs临床管理的关键点之一[5]。有研究探讨了PCLs进展的风险因素,但是未形成有效的预测模型[6-8]。机器学习通过输入特征之间的高阶交互建立模型,以预测目标结果,广泛应用于疾病的诊断、鉴别诊断和预后预测研究[9-11]。本研究拟基于患者基线临床及CT影像特征,建立无手术征象的随访PCLs进展风险预测机器学习模型,以帮助临床更高效地管理PCLs患者,合理分配医疗资源。
资料与方法
一、研究对象
回顾性分析2014年7月至2022年12月间北京协和医院放射科行腹部薄层增强CT扫描的177例患者、200个PCLs病灶的基线临床和影像学资料。纳入标准:基线检查时无欧洲PCLs研究小组指南规定的手术征象[12](病灶≥4 cm、壁结节或实性成分、主胰管扩张≥10 mm、显性黄疸、细胞学或病理检查阳性)。排除标准:(1)有胰腺实性占位、活动性癌症或胰腺癌家族史;(2)图像质量不佳;(3)病灶<5 mm。根据随访3年间PCLs病灶是否出现手术征象,将其分为进展组和无进展组。将200个病灶以3∶1的比例随机分为训练集(150个)和内部测试集(50个),训练集进展组病灶51个,无进展组病灶99个;内部测试集进展组病灶17个,无进展组病灶33个。回顾性收集2011年10月至2020年5月间南京大学医学院附属金陵医院放射科行腹部薄层增强CT扫描的14例患者、15个病灶作为外部测试集,其中进展组病灶6个,无进展组病灶9个。本研究经医院伦理委员会批准(批准号:K23C2395),所有患者均签署知情同意书。
二、CT扫描方法
患者基线检查CT设备为西门子SOMATOM Definition Flash、SOMATOM Force、SOMATOM go.All和飞利浦IQon Spectral CT。扫描参数:管电压120 kVp,管电流采用自动mA调节技术,旋转时间0.5 s,层厚1~3 mm,层间距1 mm,矩阵512×512。经肘静脉以3.0 ml/s的速率注射对比剂碘普罗胺(优维显,德国先灵公司)1.2 ml/kg。分别在注射对比剂后20、60、120 s行动脉期、门静脉期、延迟期扫描。扫描范围从膈顶到肾脏下缘。
三、观察指标
1.临床资料:性别、年龄、血清总胆红素水平、隐性黄疸、糖尿病史、胰腺炎史及血清CEA、CA19-9水平。
2.CT影像学资料:病灶位置、病灶大小、主胰管管径、囊壁增厚(>2 mm)或强化、分隔、分隔增厚(>2 mm)或强化、病灶钙化、胰腺萎缩。其中胰腺萎缩定义为胰头厚度<2 cm、胰体厚度<2 cm或胰尾厚度<1 cm。
3.随访资料:以CT检查当天为随访开始时间,截止时间为影像学(增强CT或MRI)或实验室检查结果提示PCLs病灶出现手术征象时,或CT检查后3年。记录患者的病灶大小、主胰管管径、病灶内是否存在壁结节或实性成分、血清总胆红素水平及细胞学或病理检查结果。
四、机器学习模型建立和筛选
由2名影像科医师在对患者的临床表现和病理信息不知情的情况下完成影像学评估。如测量结果不一致,则与1名高级别影像科医师讨论达成一致意见。纳入两名影像科医师间测量一致性较好的特征建模,即连续变量组内相关系数(intraclass correlation efficient, ICC)>0.75、分类变量Kappa>0.4的特征。其中连续变量特征采用Z分数归一化处理,分类变量特征采用独热编码处理。
采用多种特征选择方法、多种机器学习模型进行组合,并基于10折交叉验证法筛选最优机器学习模型。其中特征选择方法包括基于F检验的特征选择算法和L1范数特征选择算法;机器学习模型包括支持向量机(support vector machine, SVM)、线性判别分析、逻辑回归、高斯朴素贝叶斯分类器、伯努利朴素贝叶斯分类器、K邻域分类器和决策树分类器。
五、最优模型预测性能评价
在10折交叉验证集上绘制各模型的受试者工作特征曲线(receiver operating characteristic curve,ROC),计算曲线下面积(area under the curve, AUC),取AUC值最高的模型作为最优模型,并在训练集上重新训练模型,作为最终的预测模型。在测试集上计算AUC值、灵敏度、特异度和准确度,以评估模型的预测效能。使用置换重要性评估纳入最优模型特征的重要程度。建立最优模型的校准曲线,采用Hosmer-Lemeshow检验评估模型的临床适用性。
六、统计学处理
采用SPSS 20.0进行统计学分析。正态分布的计量资料以±s表示,组间比较采用独立样本t检验;非正态分布计量资料以M(Q1、Q3)表示,组间比较采用Mann-Whitney检验;计数资料以个数(%)表示,组间比较采用χ2检验或Fisher确切概率法。P<0.05为差异有统计学意义。
结 果
一、一般资料
两名医师重复测量影像特征的ICC值为0.857~0.948,Kappa值为0.438~0.793,代表中等至很强的一致性。
训练集及内部测试集200个PCLs病灶和外部测试集15个PCLs病灶的基线临床及影像学特征见表1。训练集和内部测试集的进展组与无进展组在胰腺炎史、病灶大小、主胰管管径、主胰管扩张、囊壁增厚、分隔存在、分隔增厚间的差异及内部测试集的两组在性别、病灶钙化和胰腺萎缩间的差异均有统计学意义(P值均<0.05)。外部测试集的进展组与无进展组的病灶大小和胰管扩张差异亦有统计学意义(P值均<0.05)。

表1 训练集、内部测试集、外部测试集进展组和无进展组胰腺囊性病变基线临床及影像学特征比较
内部测试集进展组中位随访时间为10.57个月,17个病灶中,8个病灶≥4 cm,4个壁结节或实性成分,2个胰管扩张≥10 mm,2个病灶所在患者显性黄疸,4个细胞学或病理检查阳性,出现病灶同时存在两种及以上手术征象。外部测试集进展组中位随访时间为0.48个月,6个病灶中,4个病灶≥4 cm,2个细胞学或病理检查阳性。
二、机器学习模型的建立及预测效能
应用基于F检验的特征选择算法,从8项临床特征及11项影像学特征中最终筛选出1项临床特征(胰腺炎病史)和4项影像学特征(基线病灶大小、囊壁增厚、主胰管管径和主胰管扩张)进入预测模型(图1)。SVM、线性判别分析、逻辑回归、高斯朴素贝叶斯分类器、伯努利朴素贝叶斯分类器、K邻域分类器和决策树分类器在交叉验证集上的AUC值分别为0.899、0.897、0.897、0.888、0.876、0.848和0.830,其中SVM模型的AUC值最高,故作为最优模型进一步评估。
在训练集、内部及外部测试集上,SVM模型对PCLs进展预测的ROC曲线见图2,AUC值分别为0.910、0.909、0.944,灵敏度分别为84.3%、82.4%、100%,特异度分别为83.8%、72.7%、77.8%,准确度分别为84.0%、76.0%、86.7%,提示模型预测结果准确且模型可推广性强。SVM模型在内、外部测试集上的校准曲线如图3所示,曲线接近对角线。Hosmer-Lemeshow拟合优度检验显示,内部测试集P=0.636,外部测试集P=0.840,代表模型对测试集PCLs进展真实情况的拟合较好。
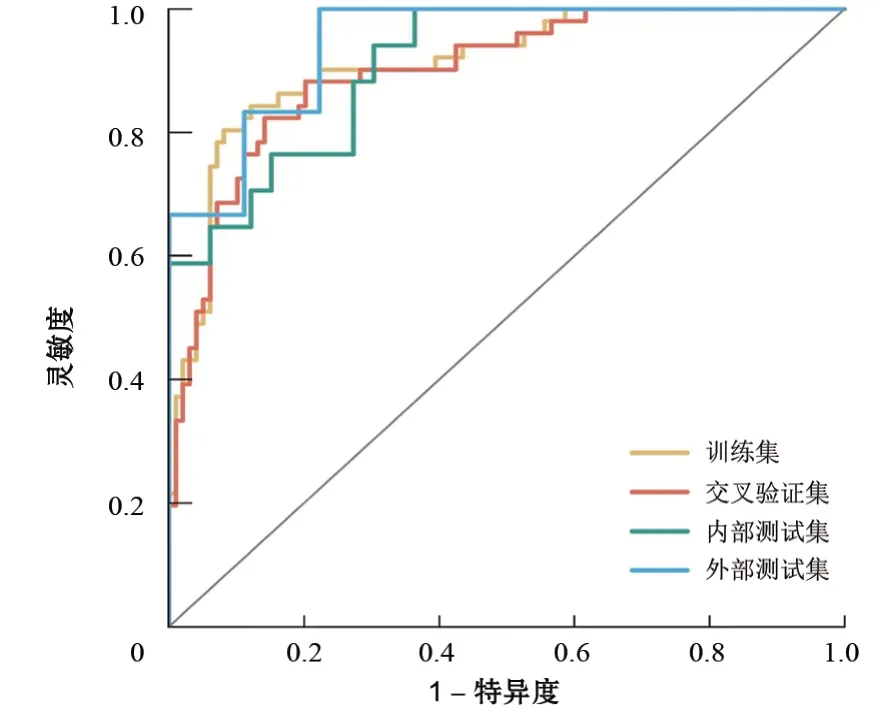
图2 SVM模型在训练集、交叉验证集、内部及外部测试集上预测胰腺囊性病变进展的ROC曲线

图3 SVM模型在内部(3A)和外部(3B)测试集上预测胰腺囊性病变进展的校准曲线
讨 论
近年来,随着PCLs检出率的增加,随访患者数量增长,PCLs进展危险因素被广泛关注。Pandey等[8]发现基线病灶较大的组更易发生美国放射学会偶发病变委员会白皮书中定义的病灶增大。Oyama等[6]发现基线病灶大和主胰管管径宽与PCLs恶变相关。Tsai等[13]发现分隔和扩张的胰管在进展组(囊生长速度>1 mm/年)PCLs更多见。上述研究显示通过宏观影像特征进行PCLs进展风险分层的潜在价值。本研究筛选出基线病灶大小、囊壁增厚、主胰管管径和主胰管扩张4项影像特征纳入模型,其中,基线病灶大小是置换重要性最高的特征,同前述研究结果一致,且福冈指南[14]、美国胃肠病学会指南[15]都推荐以基线病灶大小指导随访间隔。Vullierme等[16]发现包括囊壁增厚在内的4个影像学特征与恶性胰腺黏液性囊腺瘤有关。本研究中主胰管扩张和主胰管管径对PCLs进展风险的预测作用也与前述研究一致。此外,Procacci等[17]发现囊壁或分隔上的钙化与胰腺黏液性囊性肿瘤恶性风险有关。Nakahodo等[18]发现局灶胰腺萎缩是高级别异型增生的危险因素。本研究中,训练集和内、外部测试集的进展组病灶钙化和胰腺萎缩均较无进展组更多见,但仅在内部测试集中差异有统计学意义。本研究还将指南[12,15]中与PCLs恶性相关的临床危险因素纳入分析,最终筛选出胰腺炎史纳入模型,与Ohtsuka等[19]的研究结果一致。值得注意的是,上述研究及本研究所选出的与PCLs进展相关的特征均略有不同,原因可能在于不同研究对于进展的定义不同。本研究旨在高效管理PCLs患者,使病灶稳定的患者减少随访频率,而进展高风险患者应密切随访以早期发现恶变并手术,故将进展定义为出现手术征象。此外,本研究设置了外部测试集,能够更全面地评估预测模型的可推广性,促进模型在临床上应用。
本研究结果表明,基于PCLs病灶的基线临床和CT影像特征的SVM模型,能够在病灶进展发生前相当长的一段时间(内部测试集进展组中位随访时间10.57个月)预测进展发生与否,且预测AUC值在内、外部测试集上分别达0.909、0.944,校准曲线显示,模型的预测概率与实际PCLs进展概率基本相当。该模型纳入的特征均是可解释性强的临床及宏观影像特征,经独立的内、外部测试集验证具有良好且稳定的预测效能,能够有效地帮助临床更高效地管理PCLs患者,合理分配医疗资源。
本研究存在一定局限性。首先,本研究为回顾性研究,样本量较小,有待后续纳入来自多个中心的随访患者,以建立更加稳定可推广的模型。其次,本研究仅基于CT图像建模。尽管MRI是指南推荐的PCLs随访影像检查手段之一[12],但因其检查时间长、对患者要求高(憋气时间长、体内不能有金属植入物)、价格昂贵,在国内应用不及CT广泛。多项研究显示,初诊PCLs更常见于CT检查[20],且CT与MRI对恶性PCLs的诊断准确度相当[21]。综上所述,本研究基于患者临床及宏观CT影像学特征建立PCLs进展的预测模型,后续将进一步结合影像组学及囊液生物标志物建立综合预测模型,为PCLs的随访策略提供更精准的指导。
利益冲突所有作者声明无利益冲突
作者贡献声明邓文祎:研究操作、数据整理、统计学分析、论文撰写;谢飞扬、毛丽:研究操作、数据整理、统计学分析;孙照勇、徐凯:工作支持;李秀丽、朱亮、金征宇:研究指导、工作支持;李骁、薛华丹:研究设计、研究指导、论文修改、经费支持

