小春花木犀草素提取工艺优化及其抗氧化活性研究
何若男,陈 欢,易 超,林启凰,张豫杰,吴 婷,陈仲巍
(厦门医学院药学系,福建 厦门 361023)
小春花为阴地蕨(Sceptridium ternatum(Thunb.)Lyon)植物的带根全草[1],广泛分布于我国大部分省区,其全草均可入药,为福建民间常用草药[2],具有清热解毒、止咳平喘及化痰之功效。福建省立医院药剂科参考民间经验将小春花结合其他药物开发为复方药剂——小伏口服液[3],临床主要用于久咳、病后声哑、支气管哮喘等疾病的治疗[4-5]。前期研究发现,小春花中含有大量黄酮类化合物,主要为木犀草素、槲皮素、山奈酚、阴地蕨素[6],其毒性较低,小鼠的最大耐受灌胃给药量为80 g/kg,临床用药较安全[7],但目前对其临床及药理相关报道仍较少,未被收录进2015 版《中华人民共和国药典》,仅被收录入同年的《浙江省中药炮制规范》,也仅有小伏口服液这款单一药品问世,其潜在价值亟待开发。
木犀草素是小春花的主要成分之一,木犀草素含量高的植物在伊朗、中国和巴西常被用于传统药物中治疗炎症相关疾病,因此受到诸多关注。已有研究发现,木犀草素有助于减轻皮肤炎症[8]和肝脏纤维化[9],对肿瘤(MA肿瘤细胞)[10]、病毒[11]、肠道沙门氏菌均有抑制作用[12]。近年来还发现其对各种大脑慢性病(包括阿尔茨海默病)具有治疗作用[13],使用前景已由抗菌药物拓展到神经保护保健品、食品保护剂等多个方向。小春花是目前已知含木犀草素较高且来源丰富的植物资源[14-15],是制备木犀草素的理想原料[16-19]。
此外,市面上一些合成类抗氧化剂的潜在毒性正逐步凸显,如二丁基羟基甲苯(BHT)和丁基羟基茴香醚(BHA)。有研究表明,定量摄取BHT 可促进化学物质诱发的小鼠肺癌的发生,合成类化学物质的毒副作用限制了其抗氧化能力的应用范围,因而筛选安全、天然的抗氧化活性成分备受关注。
当前,一些植物源抗氧化剂已有良好的市场应用前景,如提取自迷迭香和茶叶的抗氧化剂均已通过国家卫生健康委员会的安全检验,成为食品安全级抗氧化剂。其中,迷迭香提取剂的抗氧化效果可达合成氧化剂的3~6倍,且耐热性良好,在持续190 ℃高温油炸下仍具有抗氧化效果。此外,它还适用于各种复杂的类脂物抗氧化,应用广泛[20]。市场信心方面,消费者普遍认为天然抗氧化剂更为安全,也成为其一大优势[21]。小春花富含包括木犀草素的多种具有抗氧化性的黄酮类物质,因此,对其抗氧化性进行评价,将为小春花的开发及应用奠定一定的理论基础。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
小春花,采摘自福建省厦门市同安区五显镇;木犀草素标准品(纯度99.063%),成都瑞芬思生物科技有限公司;VC、芦丁、总还原力(T-AOC)试剂盒,北京索莱宝公司;乙醇、甲醇、乙酸等试剂均为分析纯,西陇化工股份有限公司。
1.1.2 仪器与设备
3K15型离心机,美国Sigma公司;DHG-9140鼓风干燥箱,上海精宏实验设备有限公司;SpectraMax i3X酶标仪,美谷分子仪器(上海)有限公司;N-1300VWB 旋转蒸发仪,日本东京理化器械株式会社。
1.2 方法
1.2.1 小春花中木犀草素的提取
用蒸馏水将采摘的新鲜小春花洗净,太阳光下自然风干,后置于50 ℃鼓风干燥箱干燥,粉碎后过100 目筛备用。取小春花干粉1 g,按照不同的料液比加入不同浓度的乙醇溶剂,混合均匀后分别设定不同的超声功率、时间和温度进行超声提取,再离心(10 000 r/min,4 ℃)10 min,吸出上清液备用。沉淀残渣重复上述步骤再提取2 次。合并上清液,进行单因素试验和正交试验。以上试验均重复3 次。
1.2.2 单因素试验设计
固定液料比20∶1(mL/g),乙醇体积分数70%,超声功率350 W,超声温度70 ℃,超声时间30 min,分别考察不同超声温度(40、50、60、70、80、90 ℃)、超声时间(10、20、30、40、50 min)、液料比(10∶1、20∶1、30∶1、40∶1、50∶1(mL/g))及乙醇体积分数(10%、30%、50%、70%、90%)对木犀草素提取量的影响。
1.2.3 正交试验设计
在单因素试验结果的基础上,以超声温度、超声时间、液料比及乙醇体积分数为主要影响因素,以木犀草素提取量为考察指标,进行L9(34)正交试验,试验因素水平见表1。
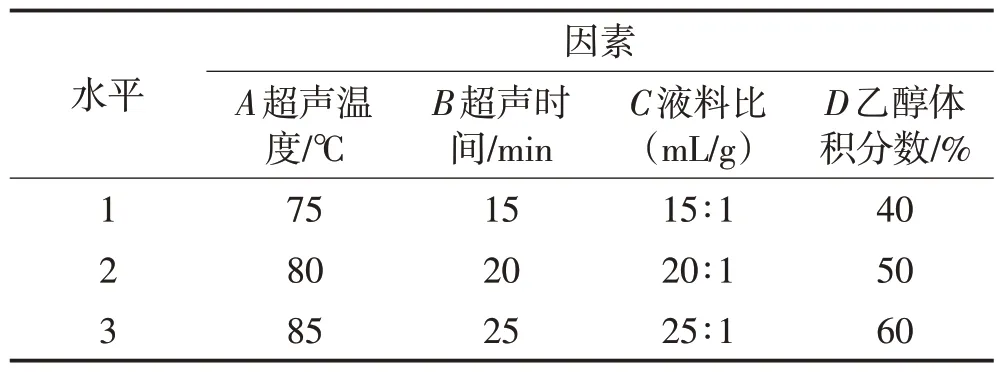
表1 正交试验因素水平表Table 1 Factors and levels table of orthogonal test
1.2.4 木犀草素标准曲线的绘制
参考王春红等[22]的方法,精确称取20.000 mg 的70 ℃下烘干至恒重的木犀草素标准品,以适量的50%甲醇溶液(辅以水浴加热)溶解后,再以无水甲醇定容摇匀,精确制取以0.002 mg/mL 为浓度梯度的0~0.012 mg/mL 的木犀草素标准品溶液,测定其在408 nm处的吸光度值(OD408nm),绘制标准曲线。
1.2.5 木犀草素提取量的测定
将0.5 mL 提取液与1 mL 提前配制的0.1 mol/L AlCl3溶液快速混匀,随即与1.6 mL 浓度为1 mol/L 的乙酸钾溶液混匀,于室温静置15 min 后测定其OD408nm[23-24],带入下式计算样品(小春花干粉)提取液中木犀草素提取量。计算公式如下:
式中:C为测得的吸光度代入回归方程式计算得到的木犀草素的质量浓度,mg/mL;V为提取液体积,mL;K为稀释倍数;m为小春花干粉质量,g。
1.2.6 小春花体外抗氧化能力的测定
精确称取小春花提取物经旋蒸所得干样品,用无水乙醇溶解配制成不同浓度样品液,以文献[25-26]中的方法进行1,1-二苯基-2-三硝基苯肼自由基(DPPH·)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS+)自由基、羟基自由基(·OH)清除能力及总还原力测定,每个样品重复测定3 次,并以天然抗氧化物VC和天然黄酮苷芦丁作为对照。
1.2.6.1 DPPH·清除能力测定
分别将质量浓度为20、40、60、80、100 mg/L的VC溶液、小春花样液、芦丁样液100µL置于不同试管中,取等量当天新鲜配制的DPPH溶液(0.2 mol/L)于避光处混合均匀,避光常温(25 ℃)反应40 min 后立即测定其在517 nm 处的吸光度值A1,将其中去离子水替换为小春花样液测得A2,将DPPH溶液替换为无水乙醇测得A0,重复3次。DPPH·清除率计算公式为:
1.2.6.2 ·OH清除能力测定
于96孔板中依次加入精确配制的质量浓度为20、40、60、80、100 mg/L的小春花样液25µL,之后分别添加1.76 mmol/L水杨酸-乙醇溶液(以50%乙醇作溶剂)25 µL 和1.76 mmol/L FeSO4(当天新鲜配制)25µL,混匀,随后添加1.76 mmol/L H2O2试液25µL以启动反应,37 ℃避光水浴30 min后,测定其在510 nm处的吸光度值A′1。以25µL小春花样液与75µL无水乙醇混合测定其在510 nm 处的吸光度值A′0,以去离子水替代小春花样液作空白对照A′2,重复3 次,并测定同浓度下VC、芦丁对·OH 的清除率。·OH 清除率计算公式为:
1.2.6.3 ABTS+自由基清除能力测定
将97.5 mg ABTS粉末与16.5 mg K2S2O8溶解于超纯水并定容至25 mL,待4 ℃避光16 h 溶液变稳定后得到ABTS 储备液。将储备液与无水乙醇以体积比1∶75 比例混合,使OD734nm为0.700±0.015,得ABTS 工作液。将10µL梯度浓度(20、40、60、80、100 mg/L)样品液与500 µL 新鲜配制的ABTS 工作液避光混匀,6 min 后测定其在734 nm 处的吸光度值A″1,以无水乙醇代替小春花样液得A″0,以无水乙醇代替ABTS工作液得A″2,重复3 次,并测定同浓度下VC、芦丁的清除率。ABTS+自由基清除率计算公式为:
1.2.6.4 总还原力测定
参考试剂盒的方法测定小春花提取物总还原力。于96 孔板中依次加入新鲜配制的FRAP 工作液(配制参照T-AOC试剂盒)180µL,梯度浓度(20、40、60、80、100 mg/L)小春花样品液6µL,蒸馏水18µL,室温混合10 min后,吸取200µL测定其在593 nm处的吸光度值A3,用蒸馏水替代样品得A3′,重复3次,并测定同浓度下VC、芦丁的总还原力,总还原力单位为mmol/L。
1.2.7 数据处理
采用SPSS 20.0软件进行方差和组间差异显著性SSR 检验分析,P<0.05 表示具有显著差异,P<0.01表示具有极显著差异。
2 结果与分析
2.1 木犀草素标准曲线绘制
以“1.2.4”中的方法拟合回归方程为:y=125.86x-0.014 3(R2=0.999 8),由图1可见,木犀草素标准品在质量浓度0~0.012 mg/mL范围内线性关系良好。
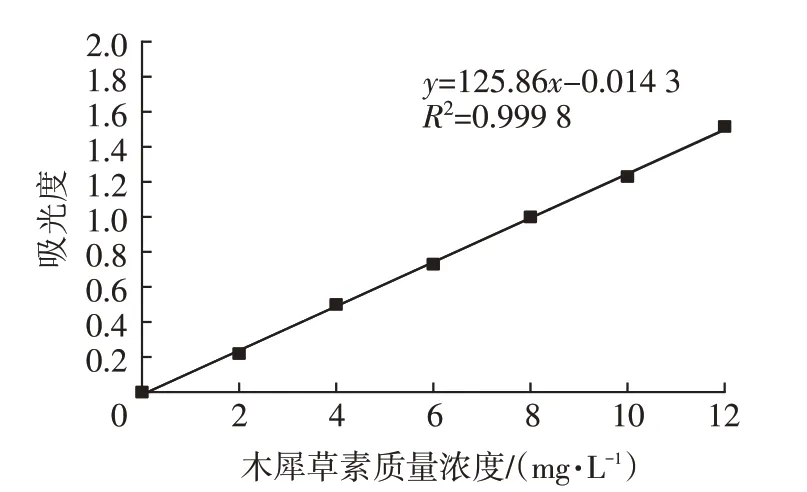
图1 木犀草素标准曲线Fig.1 Standard curve of luteolin
2.2 单因素试验结果
由图2和图3可知,随着超声温度与时间的增加,小春花木犀草素提取量均表现为先升高后降低的趋势,最佳超声温度和提取时间分别为80 ℃和20 min。早期温度升高和提取时间延长均会促进细胞内物质的溶出,随后的降低可能是因为温度过高会促进其余细胞内容物更多的溶出,溶液黏度增加,对木犀草素的进一步溶出形成阻碍[25];亦或当超声时间过长时,超声波的剪切力破环了木犀草素的化学键,导致木犀草素提取量下降。由图4和图5可知,最佳液料比和乙醇体积分数分别为20∶1(mL/g)和50%。前期木犀草素提取量增加是因为溶质分子越多越有利于其余溶质分子的溶出,后续降低则是因为杂质过多对木犀草素提取产生不良影响[27]。
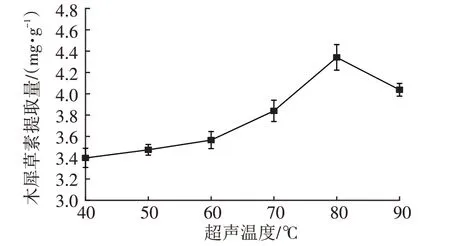
图2 超声温度对木犀草素提取量的影响Fig.2 Influence of ultrasonic temperatures on the extraction amounts of luteolin
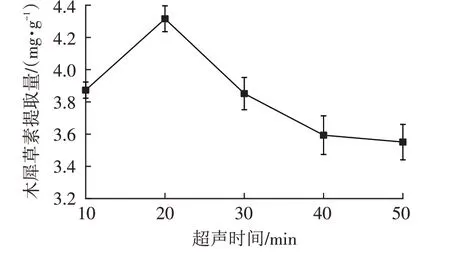
图3 超声时间对木犀草素提取量的影响Fig.3 Influence of ultrasonic time on the extraction amounts of luteolin

图4 液料比对木犀草素提取量的影响Fig.4 Effects of liquid-solid ratios on the extraction amounts of luteolin

图5 乙醇体积分数对木犀草素提取量的影响Fig.5 Effects of ethanol concentrations on the extraction amounts of luteolin
2.3 正交试验结果
如表2 所示,4 个因素对木犀草素提取量影响的主次顺序为:C>A>D>B,即液料比>超声温度>乙醇体积分数>超声时间;最佳提取工艺条件为:A3B3C3D3,即超声温度85 ℃,超声时间25 min,液料比25∶1(mL/g),乙醇体积分数60%。方差及显著性分析结果如表3 所示,4 个因素对提取量均具有极显著性影响(P<0.01)。
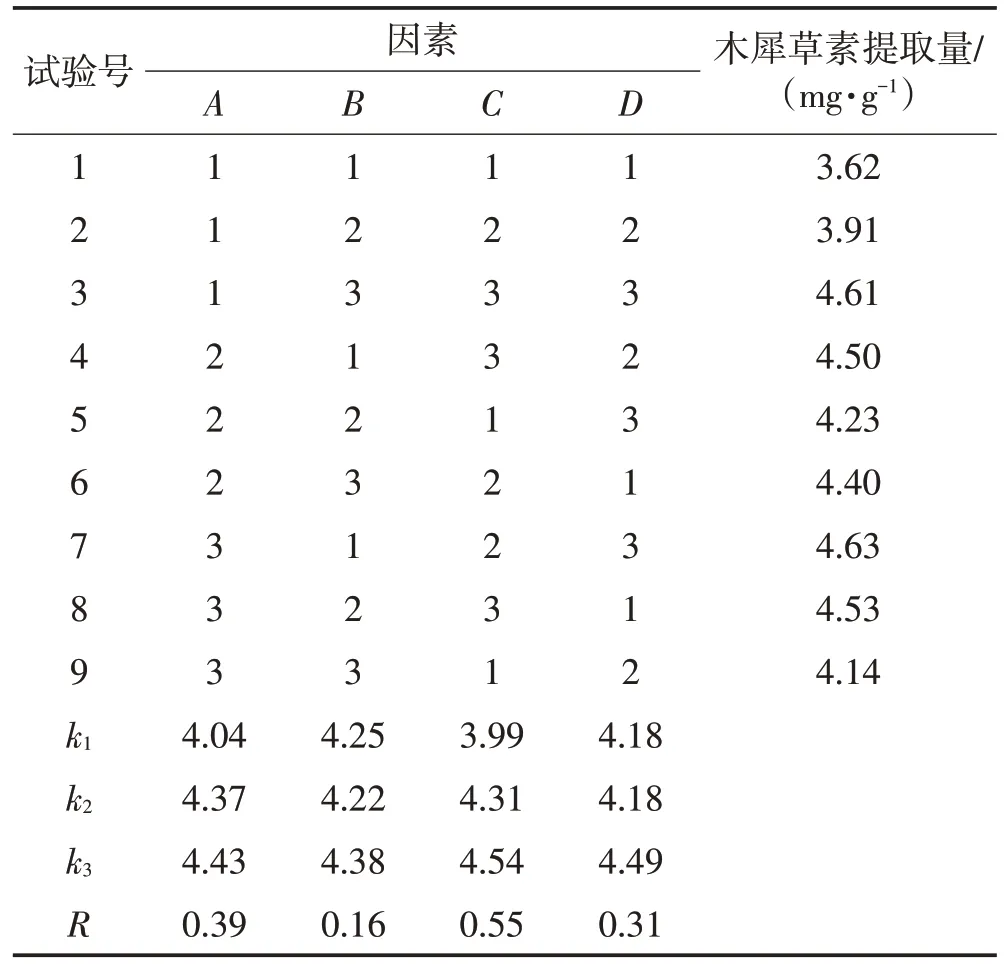
表2 正交试验结果Table 2 Orthogonal experimental results

表3 正交试验结果方差分析Table 3 Variance analysis of orthogonal results
2.4 组间差异显著性SSR检验
采用SPSS 20.0软件对正交试验结果进行组间差异显著性SSR 检验分析[28]。结果如表4 所示,因素A的水平1与水平2、水平3之间均具有显著性差异(P<0.05),水平2 和水平3 之间无显著性差异;因素B的各水平间均无显著性差异;因素C的水平1与水平2、水平3之间均具有极显著性差异(P<0.01),水平2和水平3之间无显著性差异;因素D的水平1和水平3,水平2 和水平3 之间有显著性差异(P<0.05),水平1和水平2 之间无显著性差异。根据此结果修正最佳工艺条件为:A2B1C2D3,即超声温度80 ℃、超声时间15 min、液料比20∶1(mL/g)、乙醇体积分数60%。

表4 组间差异显著性SSR检验Table 4 SSR test for significance of differences between groups
2.5 验证试验结果分析
对试验所得最佳提取工艺进行验证,试验重复3 次,结果表明,正交试验优化的最佳工艺条件下得到的木犀草素提取量(4.88 mg/g)高于组间差异显著性SSR检验结果(4.63 mg/g),且高于正交试验各试验号的提取结果。
2.6 小春花提取物体外抗氧化活性
2.6.1 DPPH·清除能力
如图6 所示,VC、芦丁与小春花样品均具备DPPH·清除能力,且清除力强弱与质量浓度存在量效关系。当小春花提取物质量浓度达到20 mg/L时,其清除率已超出50%,与VC相当;当质量浓度为80 mg/L及100 mg/L 时,清除率分别为90.1%和92.8%,与VC接近(97.6%)。但质量浓度为40 mg/L 时,其清除率显著低于VC(P<0.05)。小春花提取物清除DPPH·的IC50为14.9 mg/L,总体而言其DPPH·清除能力高于芦丁(IC50=16.4 mg/L),且其在一定质量浓度范围内与VC(IC50=14.8 mg/L)接近,清除能力较强。
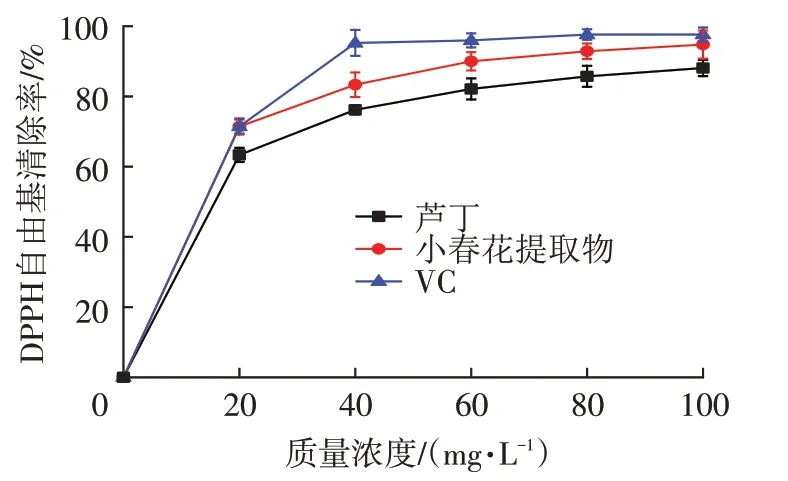
图6 VC、芦丁及小春花提取物对DPPH·的清除能力Fig.6 Scavenging abilities of VC,rutin and Botrychium ternatum extract against DPPH·
2.6.2 羟基自由基清除能力
还原剂与试液发生Fenton 反应,产生·OH,其与水杨酸反应显红色,色泽轻重与·OH 质量浓度呈正相关。如图7所示,样品质量浓度在20~100 mg/L时,其对·OH 清除能力随样品质量浓度的提高而增强。当小春花提取物质量浓度为20、40、100 mg/L时,·OH清除率分别达31.2%、36.6%和70.5%,与VC(34.5%、38.8%、74.5%)接近,小春花提取物清除·OH的IC50为78.6 mg/L,芦 丁 与VC 的IC50分别为105.3 mg/L 和61.2 mg/L。

图7 VC、芦丁及小春花提取物对·OH的清除能力Fig.7 Scavenging abilities of VC,rutin and Botrychium ternatum extract against·OH
2.6.3 ABTS+自由基清除能力
常态下,ABTS+的离子基团经氧化后形成更为稳定的水溶性离子基团,溶液由浅色变为蓝绿色。而还原剂的加入可减弱氧化进程,使溶液颜色变浅,特征峰值降低,因此,反应液褪色越明显(特征峰值越低)则表明该检测物(小春花)的抗氧化能力越强[29]。如图8 所示,样品质量浓度在20~100 mg/L 时,ABTS+自由基的清除能力与芦丁、小春花样品提取物、VC质量浓度呈显著正相关,相对呈线性关系,且芦丁对ABTS+自由基的清除率远低于小春花提取液和VC。当小春花提取物质量浓度达到60 mg/L 时,清除率可达42.5%,与VC(43.4%)接近,远高于芦丁(13.6%),小春花提取物清除ABTS+自由基的IC50为80.2 mg/L,芦丁与VC的IC50分别为248.3 mg/L和76.6 mg/L。

图8 VC、芦丁及小春花提取物对ABTS+自由基的清除能力Fig.8 Scavenging abilities of VC,rutin and Botrychium ternatum extract against ABTS+free radical
2.6.4 总还原力测定
该测定中包括了各种还原性大分子、还原性小分子及酶的总体还原力水平,在酸性条件下,测样中的还原性物质将三价铁离子Fe3+-TPTZ(赤血盐K3Fe(CN)6)还原生成普鲁士蓝色的二价铁离子Fe2+-TPTZ(黄血盐K4Fe(CN)6),进而使试样溶液变色,测定其OD700nm可通过检测普鲁士蓝的深浅来评价待测样的还原力[30]。如图9 所示,3 个测试品的还原力均与质量浓度呈明显量效关系。同质量浓度下,小春花提取物的还原力显著强于芦丁(P<0.05),但显著弱于VC(P<0.05),表明其具有一定的还原力。
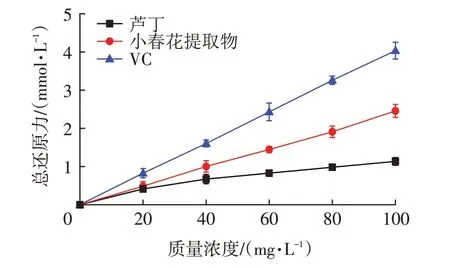
图9 VC、芦丁及小春花提取物的总还原力Fig.9 Total reducing power of VC,rutin and Botrychium ternatum extract
3 讨论与结论
小春花自古便为福建草药[31],福建省立医院采用小春花为主要成分制作了小伏口服液应用于临床。最近有研究表明,给予肺动脉高压SD大鼠(野百合碱所致)模型以小春花总黄酮给药干预后,各组肺心病的症状均出现缓解[32]。但小春花作为地方性传统中药,并未载入新版《中华人民共和国药典》,其药材质量标准仍需制定,具体活性成分仍需进一步解析。本文对小春花中主要成分木犀草素提取进行了研究,获得自小春花中提取天然木犀草素的最佳条件为:超声时间25 min,液料比25∶1(mL/g),乙醇体积分数60%,超声温度85 ℃。该条件下的木犀草素提取量达4.88 mg/g,抗氧化试验结果表明,小春花提取物具有较强的抗氧化性,可为后续相关研究提供参考。
近年来,木犀草素在食物保鲜和功能性食品领域有了新应用。在酚醛离子液体中添加木犀草素用以保鲜红苹果片,可保留其感官特性和风味[33];将从椰子壳中提取所得的木犀草素添加至木瓜切片中,发现其对食源性致病菌——肠道链球菌、单核细胞增生乳杆菌和大肠杆菌均表现出显著的抑制能力[34]。木犀草素通过多光谱进行分子结合形成的复合物可抑制过氧化物酶活性,防止食物褐变与变质[35]。木犀草素也可胶囊化,用于开发功能性食品,以其为主要成分的“Algonot Neuroprotek”品牌产品具有减轻肠道与大脑屏障受损及抑制氧化应激和炎症等功效,暂无副作用报道[36]。此外,木犀草素还可调节细胞间通讯信号,破坏肿瘤细胞,抑制肿瘤附着的血管生长,还能减轻癌症患者化疗的副作用[37-38]。木犀草素对其靶细胞具有特异性、选择性。有研究表明,木犀草素对突变细胞具有细胞毒性,但不影响其他健康的身体组织,具有较高研究价值。当前小春花相关开发应用仍较少,其对肺部作用的药理机制和其中有价值的化合物有待进一步挖掘研究。

