内陆地区南美白对虾淡化养殖池塘浮游植物群落结构特征及其生态影响因子
孙世萍,咸玉兰,韩军军,陈韩飞,热比古丽·沙吾提,米乃瓦尔·木依提,陈朋,陈牧霞,祁峰
(1.新疆维吾尔自治区水产科学研究所,新疆 乌鲁木齐 830000;2.农业农村部西北地区渔业资源环境科学观测实验站,新疆 乌鲁木齐 830000)
南美白对虾(Litopenaeus vannamei)耐高温、耐低盐、生长快、抗病力强、离水存活时间长,突破苗种繁育技术后养殖规模逐年扩大,成为我国对虾养殖的主要种类之一,其养殖产量一度占据国内对虾养殖总产量的70%以上[1]。近年来,南美白对虾在我国内陆逐渐发展起来,生长速度也较快,西北的新疆地区近年南美白对虾养殖业相继发展较快,但新疆南美白对虾产量较低,病害频发,养殖关键技术亟待解决。
浮游植物是水生态系统中重要的初级生产者,对环境条件的变化响应复杂而快速[2,3],是水生态系统结构与功能的重要调控者。调控浮游植物群落是人工养殖生产中水体环境控制策略的核心内容。
不同水体浮游植物群落结构特征差异明显[4-7],受水体不同理化因子的影响[8-10],其中有关南美白对虾养殖池塘的相关报道主要集中在我国沿海地区,且多为海水养殖池塘。对于内陆干旱半干旱地区对虾淡化养殖池塘浮游植物群落特征的研究较为少见,尤其是其对理化因子的响应等相关研究尚少有报道。因此,对我国内陆干旱半干旱地区开展对虾养殖池塘浮游植物群落特征及其生态影响因子的研究具有显著的地域特色和生态学意义。基于此,本文通过调查新疆昌吉地区南美白对虾淡化养殖池塘中浮游植物群落结构特征的变化,分析其对不同生态因子的响应程度及差异,以期为调控南美白对虾养殖池塘水质提供科学依据,推动西北内陆地区对虾产业科学持续发展。
1 材料与方法
1.1 池塘条件及样品采集
试验区位于新疆昌吉市森淼渔业专业合作社。南美白对虾苗种首先在池塘内设的温棚中淡化养殖12 d 左右,密度约为(2 200~3 600)尾/m3,入塘初始盐度为18.2,逐步淡化至0.8 左右。淡化后拆除池塘内的温棚逐渐升高水位,至平均水深约1.6 m,池塘放养密度约为45 ind./m3,池塘面积为6 667 m2。投放虾苗当天上午12 点左右即开始第一次采样,每周采样1 次,共12 次,采样时间固定。池塘水深至1.5 m 以上时,开始分层采样,表层样品在水面下10 cm 处采集,底层样品距池底约20 cm,中层为水深1/2 处取样。各样品编号记作Dxy[x 代表采样次数,D1~D12 为采集次序;y 代表采样水层(图1),1代表表层,2 代表中层,3 代表底层]。
1.2 理化因子样品的采集和测定
现场采集浮游植物样品的同时,同位测定14项水体理化参数。包括水温(T),pH,溶解氧(DO),铵态氮(NH4-N),亚硝酸态氮(NO2-N),硝酸态氮(NO3-N),活性磷(PO4-P),可溶性硅酸盐(SiO3-Si),高锰酸盐指数(CODMn),叶绿素a(chl-a),硫化物(sul),矿化度(MW),碱度(ALk)和水总硬度(TH)。
采用便携式溶解氧测试仪(哈希HQ30d,德国)和pH 测试仪(哈希HQ11d,德国)现场测定水温、溶解氧和pH,其他水化学参数取5 L 水样低温保存带回实验室检测。按照《水和废水检测分析方法(第四版)》[5]进行测定。
1.3 浮游生物样品采集与观察
浮游生物定性、定量标本按照《淡水浮游生物研究方法》[6]中所描述的方法进行采集、计数,计算现存量。浮游植物种类鉴定主要参照胡鸿钧等[7]文献,浮游动物的种类鉴定主要参照王家楫[8]、蒋燮治等[9]和中国科学院动物研究所甲壳动物研究组[10]的专著。
1.4 数据分析
本文图形及数理统计分析均使用R 软件,冗余分析(RDA)主要使用ggplot2 和ggrepel,并根据Legendre 等[11]的方法对物种数据进行Hellinger 转化后再用于分析。首先进行物种数据弦转化、环境数据标准化,使用全部环境变量rda,进行R2校正,约束轴的置换检验和P 值校正,利用vegan 包ordistep 函数进行前向选择,然后再根据排序图,summary 函数统计结果,重新解读模型,观察比较变量选择前后的差异,重新校正模型R2以及检验约束轴,最终选择合适的约束轴。
用优势度(Y)评价浮游植物的优势种[12],计算公式为为第i 种的数量;N 为浮游植物总个体数;fi为该种出现的频率。
2 结果与分析
2.1 主要环境因子状况
17 个主要环境因子参数如表1 所示,MW、TH和Sul 在温棚养殖阶段均值分别为6 020.0 mg/L、1 113.37 mg/L 和0.88 mg/L,均显著高于(P<0.01)池塘养殖阶段含量(均值分别为554.39 mg/L、260.57 mg/L 和0.12 mg/L)。NH4-N 和PO4-P 在养殖前、中期(D1~D10)变动不大,均值分别为0.32 mg/L和0.08 mg/L,且略呈现相反的水平变动,养殖后期(D11~D12)均达到较高含量(最高值分别达3.72 mg/L和0.73 mg/L)。NO2-N 在整个养殖期内变化不大,均值为(0.020±0.009)mg/L(变幅为0.003~0.037 mg/L)。NO3-N 在高水温期(29 ℃)有所升高,达到1.80 mg/L,其他时期变化不大,均值为(0.24±0.18)mg/L(此期变幅为0.001~0.800 mg/L)。chl-a 和CODMn在温棚养殖期含量较高,均值分别为250.02 mg/L 和16.27 mg/L,在池塘养殖阶段有逐渐升高趋势,此期均值分别为7.58 mg/L 和51.13 mg/L。垂直分布上,chl-a 和CODMn有相似的分布特征,多为底层高于中层和表层。水温在养殖期内变动不大,均值为(26.60±2.06)℃(变幅为19.80~29.20 ℃),在7 月上旬,出现底层水温高于表层状况。pH、DO 和Alk含量在整个养殖期内变化均不大,均值分别为8.09±0.52(变幅为7.34~9.26)、8.03±0.69 mg/L(变幅为7.23~10.33 mg/L)和138.60±12.40 mg/L(变幅为104.00~160.00 mg/L)。

表1 对虾养殖池塘水体主要环境因子Tab.1 Main environmental factors in the Pacific white leg shrimp culture ponds
轮虫密度在D12 达到峰值(638.40 ind./L),其余检测样品轮虫密度均值3.15 ind./L(变幅为0~27.80 ind./L)。枝角类最高值出现在温棚养殖期(40.00 ind./L),其次是在D12 样品中(22.40 ind./L),其余样品枝角类密度均值为0.92 ind./L(变幅为0~3.80 ind./L)。桡足类密度峰值出现在D6(14.60 ind./L),养殖期内均值为5.60 ind./L(变幅为0~14.60 ind./L)。
2.2 浮游植物群落结构特征
2.2.1 浮游植物种类组成、优势种及变动
本次调查共鉴定出浮游植物103 种(属),其中绿藻门最多39 种(属),占总种(属)数的37.9%,硅藻门次之29 种(属),占总种(属)数的28.2%,其余依次为蓝藻门23 种(属),裸藻门4 种(属),甲藻门和隐藻门均3 种(属),金藻门2 种(属),分别占总种(属)数的22.3%、3.9%、2.9%和1.9%(表2)。形成过优势类群(优势度Y>0.02)的种类共8 种(属),分别为月牙藻(Selenastrum bibraianum)、衣藻(Chlamydomonas spp.)、蛋白核小球藻(Chlorella pyrenoidosa)、席藻(Phormidium sp.)、伪鱼腥藻(Pseudoanabaena sp.)、具星小环藻(Cyclotella stelligera)、谷皮菱形藻(Nitzschia palea)和弯形尖头藻(Raphidiopsis curvata)。

表2 南美白对虾养殖池塘浮游植物种类组成Tab.2 Phytoplankton species composition in the Pacific white leg shrimp culture ponds
温棚养殖阶段具星小环藻是主导优势种类,此期尚出现一定量的咸水、半咸水种类,如长菱形藻、直链藻等。池塘养殖前、中期(D5-D8),具星小环藻优势地位逐渐减弱,谷皮菱形藻成为群落优势种类之一;同时,绿球藻目的月牙藻、衣藻和蛋白核小球藻成为群落优势种类之一。至D11-D12,这些硅藻类和绿藻类优势种类逐渐消退,蓝藻门的弯形尖头藻、伪鱼腥藻和席藻成为优势类群。
2.2.2 游植物各门藻类现存量及变动
为了更直观体现低现存量值的变化,对密度和生物量值做了对数转换(图1):调查期间南美白对虾养殖池塘浮游植物的总平均密度为(2.05±2.93)×108ind./L,变幅为4.58×102~9.66×108ind./L,总平均生物量为(30.49±33.81)mg/L,变幅为0.80~101.47 mg/L。水体初始现存量较低(D1),生物量为1.87 mg/L(密度为521.71 ind./L)。温棚养殖期(D1-D4),浮游植物平均生物量为(74.22±48.34)mg/L(平均密度6.70×104ind./L);池塘养殖阶段(D5-D12),浮游植物生物量逐渐升高,由初始1.16 mg/L(480.38 ind./L)增至88.66 mg/L(2.93×104ind./L),平均值为21.28 mg/L(1.21×104ind./L)。
温棚养殖期,硅藻的密度和生物量占绝对优势,硅藻的数量和生物量占比可达95.1%~98.6%和80.5%~95.6%。池塘养殖前期(D5-D6),硅藻生物量仍占浮游植物总生物量的92.5%~97.5%。至D7-D10,硅藻占比逐渐降低(12.7%~73.6%),绿藻门占比增加(12.0%~45.7%)。之后(D11-D12),蓝藻生物量占比可达63.1%~75.7%。D12 时甲藻门生物量占比达最高,为15.1%。裸藻在D11 达到最高,为12.3%。养殖期间隐藻和金藻虽有出现,但占比不到6%。方差分析表明,浮游植物生物量和密度在上层、中层和底层间差异均不显著(P>0.05)。
2.3 浮游植物种类分布与主要生态因子关系
17 个环境变量与浮游植物种类(为简化图形去除非优势种类)的冗余分析(RDA)表明,校正R2=0.892 9,前两轴累计解释总变异的69.7%(图2)。经P 值校正,全模型前3 约束轴的结果显著(前2 约束轴P<0.01,第3 约束轴P<0.05)。表明给定的环境变量对浮游植物群落物种组成分布具有相当高的解释度。经ordiR2step 函数向前选择,最终保留12 个环境变量(R2=0.872 7)。
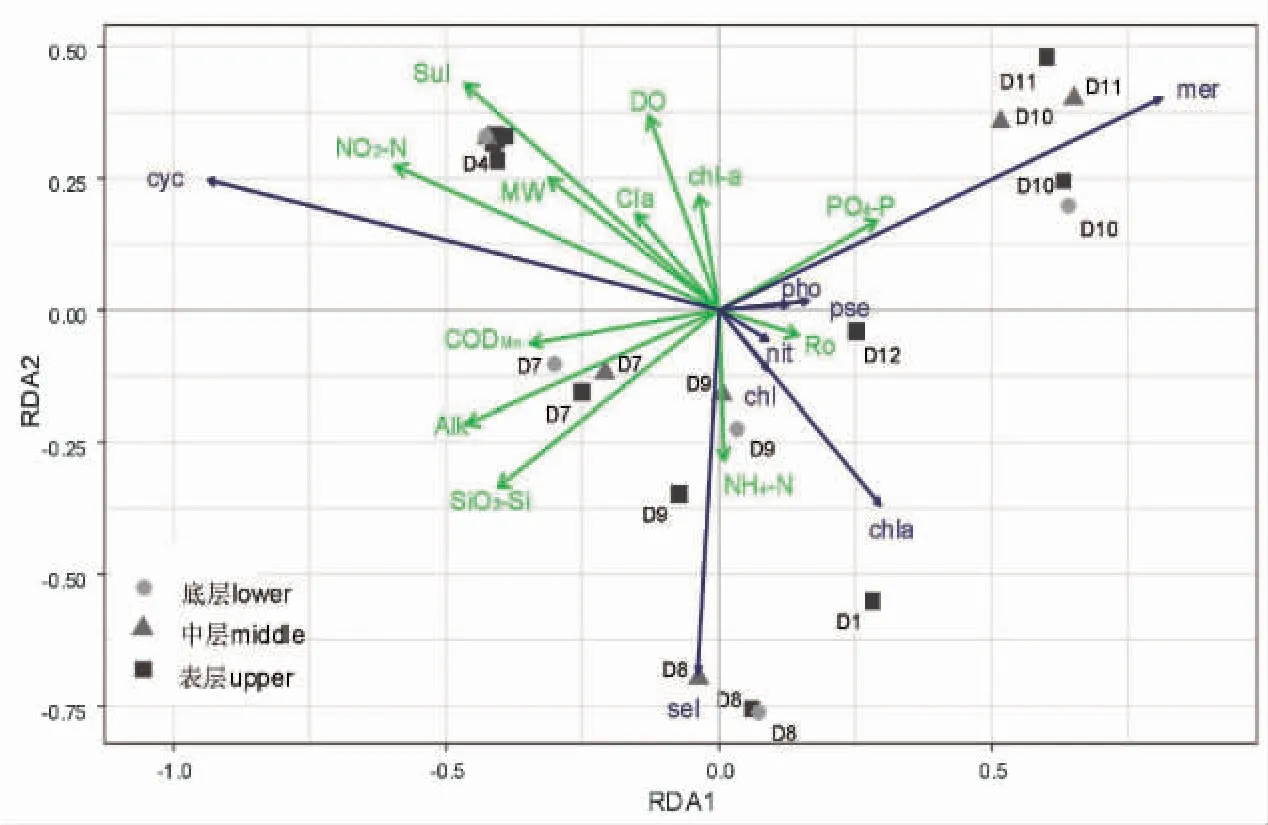
图2 浮游植物种类分布与环境因子之间的关系(Ⅱ型标尺)Fig.2 The associations of phytoplankton species with environmental factors (scaling Ⅱ)
如图2 所示,小环藻在前期(D2-D6)样品中占比较高,是绝对优势种类,在D12 中数量最低;小环藻与NO2-N 和CODMn有较高的正相关性,与轮虫呈负相关,与伪鱼腥藻、席藻、谷皮菱形藻和蛋白核小球藻呈较大的负相关。弯形尖头藻在D10 和D11 样品数量上占据优势,与PO4-P 呈高度正相关,与SiO3-Si 和Alk 呈负相关,在D7 样品中数量占比最少。月牙藻在D9、尤其是D8 样品中数量占比最大,为此期的绝对优势种类,与叶绿素a 和溶解氧含量呈负相关。
3 讨论
3.1 南美白对虾养殖池塘浮游植物群落特征及其演替
本次调查中,在对虾养殖池塘中共鉴定出浮游植物103 种(属),其中绿藻门39 种(属)最多,硅藻门29 种(属)次之,蓝藻门23 种(属),其他门类种类数较少。王旭娜等[13]在上海的三口淡水对虾养殖池塘中发现浮游植物113 种;孟得微等[12]调查黑龙江盐碱对虾养殖池塘中有浮游植物65 种(属);珠海淡化对虾养殖池塘发现浮游植物113 种[14];莲虾共作池塘发现71 种[15]。这些调查的浮游植物种(属)数均是绿藻门最多,其次为硅藻门和蓝藻门,这可能是对虾淡化养殖池塘中较为常见的种类组成特征。
本研究中,小环藻首先出现,现存量上占优势种类。Sommer 等(1986)[16]提出的PEG 模型中也指出,小型中心硅藻纲的种类会首先形成优势类群,随后会被植食性浮游动物牧食,使水体呈现“清水期”。本研究中,养殖前期浮游动物牧食压力较低,轮虫、枝角类和桡足类密度之和为1.0~16.6 ind./L,没有出现“清水期”,浮游植物现存量逐渐增加。其原因可能与对虾的下行效应有关,使浮游动物丰度保持在较低水平,对浮游植物的牧食压力减弱,为浮游植物的繁殖创造了有利条件。之后,小型浮游绿藻,如月牙藻和蛋白核小球藻,迅速增殖,硅藻优势种类也发生演替,小环藻优势地位被谷皮菱形藻取代,其生物量占比超过绿藻。在此之前,蓝藻虽有出现,但不占据优势地位。蓝藻首先占据优势地位的种类是尖头藻、席藻和伪鱼腥藻。此期浮游植物生物量达30 mg/L 以上,之后蓝藻一直占据优势地位,浮游植物生物量也不断增加,监测到最高值达88.66 mg/L。孙耀等(1998)[17]、关仁磊(2013)[18]、张瑜斌等(2009 年)[7]、陈辉煌(2013)[8]和覃丽蓉(2019)[18]等众多研究也发现蓝藻极易在夏末和秋初形成水华。其原因可能是:①当水体浮游植物含量较高藻体自遮蔽作用大时,蓝藻具有更强的光捕获能力;②当营养限制最严重时,它们具有对氮和磷更高的亲和力;③它们可以通过伪空泡调节在水体中的位置,充分利用水域丰富的营养和(或)光照[19]。
3.2 环境因子与浮游植物群落关系
环境因子的变动对浮游植物群落演替起着重要的调控作用,以致一定程度地改变浮游植物群落的质和量[20-22]。RDA 分析初步反映了新疆对虾淡化养殖池塘浮游植物群落与主要的生物和非生物因子之间的相关关系。
本研究中,养殖前、中期(D5-D9),池塘中浮游植物现存量较低(均值9.56 mg/L),主要呈现硅藻和绿藻的相互竞争关系。RDA 分析中,月牙藻、蛋白核小球藻和衣藻等绿藻与NH4-N 呈正相关,而与PO4-P 相关性很低,表明这些绿球藻目的种类更易在高NH4-N 环境中建立优势地位。养殖过程中随着投饵、代谢等活动增加,氨氮含量增加,这可能在一定程度上促进了绿球藻目种类的繁殖,使水体从硅藻型水体转变成硅藻-绿藻型水体。
虽然绿藻在群落中占据一定优势地位(生物量占比最高达39.7%),但此期(D5-D9)硅藻类在竞争中仍占据优势,尽管硅藻类中优势种群发生了转变,即具星小环藻的主导地位被菱形藻取代。其原因可能与营养盐类的动态变化有关。RDA 分析发现,NH4-N 和PO4-P 与小环藻的相关性较低,与SiO3-Si 呈正相关,而菱形藻与SiO3-Si 相关性较低(图2),可见小环藻更易受到对水体SiO3-Si 含量的影响。随着养殖过程中SiO3-Si 含量的降低,菱形藻逐渐取代小环藻成为硅藻门的优势种类。本次调查发现,谷皮菱形藻不但对小型中心硅藻纲的种类占据优势,在与绿藻(月牙藻、小球藻和衣藻等)的竞争中也占据优势。Sommer 通过竞争实验发现,在较高的Si-P 比条件下,较大个体的硅藻比绿藻更具竞争优势[18]。本次调查中,养殖前期Si-P 比在185.7~266.7 之间,后期(硅藻不占据优势地位)Si-P比在16.4~53.3 之间,可见Si-P 比可能在一定程度上影响对虾养殖池塘浮游植物群落动态。
与PO4-P 相关性最高的优势种类是弯形尖头藻,其次是席藻和伪鱼腥藻。这些藻类随着养殖后期(D11~D12)PO4-P 含量的增加而大量出现,形成优势类群,硅藻不再占据优势地位。Qiao 等[21]研究发现,南美白对虾养殖水体中SiO3-Si 含量的降低可导致硅藻丰度下降。本次调查SiO3-Si 含量由前期的峰值17.0 mg/L 降至后期(D12)的4.12 mg/L,SiO3-Si 含量的降低可能是硅藻衰退的重要因素。综合上述分析可见,小型绿球藻目的种类易在较高氮含量(尤其是NH4-N)的环境中形成优势,而蓝藻更易在高PO4-P 含量的水环境中形成优势类群。孟顺龙等[22]和骆云惠等[23]的研究也获得类似结果。
本研究RDA 模型中保留的生物环境因子有轮虫和枝角类。它们与浮游植物间呈负相关:当轮虫数量增大时呈现小型硅藻(小环藻)向菱形藻以及席藻、伪鱼腥藻转变;当枝角类数量增加,小球藻、衣藻和菱形藻数量减少。可见植食性浮游动物的牧食压力影响浮游植物群落演替。这种演替更倾向于从小型可食性浮游植物到较大个体或非可食性浮游植物种类的转变[24,26]。
综上所述,本次调查的新疆南美白对虾养殖池塘,养殖前、中期水质状况稳定、较好,后期铵态氮、活性磷、COD 含量显著升高,浮游植物,尤其是蓝藻,大量增殖,水质趋向恶化,此期将是水质调控的重点和难点。多变量分析提示,活性磷含量增加可能是蓝藻增殖的一个因素,控制磷含量的注入,合理施用硅肥,增加Si-P 比,可能是抑制蓝藻繁殖的调控手段。本研究表明,牧食压力可能影响浮游植物群落,可以考虑利用浮游动物下行效应调控浮游植物(尤其是小型浮游植物)的现存量,避免因药物杀藻对水环境养殖生物的不利影响。

