藏红花素缓解野百合碱诱导动脉型肺动脉高压大鼠右心室损伤的机制研究*
盛艳玲, 宫小薇, 李志娟, 张 旋, 田 涛, 袁雅冬
(1华北石油管理局总医院呼吸与危重症医学科,河北 任丘 062552;2河北医科大学第二医院呼吸与危重症医学科,河北 石家庄 050000)
动脉型肺动脉高压(pulmonary arterial hypertension, PAH)是一种恶性进行性心肺疾病,以肺动脉远端闭塞为特征,引起肺血管阻力增加,并最终导致右心衰竭[1]。肺血管重塑,包括肺动脉狭窄和血管壁增厚,是PAH的病理基础[2],其中,炎症被认为在PAH的发生发展中起着重要作用,更是肺血管重塑的关键因素[3]。研究表明,炎症细胞包括巨噬细胞、肥大细胞和树突状细胞等的浸润是PAH发病机制中的重要触发和驱动因素[4]。目前急需有效的治疗方法来逆转肺血管重塑和改变疾病进程,因为现有的靶向药物仅仅针对肺血管内皮功能障碍,无法实现这一目标[5]。应用中药治疗疾病在我国历史悠久,并且相比西药安全性高,作用温和持久,具有较大的开发价值和潜力。藏红花是我国传统的中药材,一直以来用于治疗各种疾病,包括哮喘、肝病、月经紊乱、疼痛和肿瘤等。藏红花中的黏蛋白能快速激活核因子κB(nuclear factor-κB, NF-κB)和蛋白激酶C,进而活化巨噬细胞,因而具有免疫调节的功能。藏红花素(crocin),又称为西红花苷,是藏红花的主要生物活性成分,也是自然界唯一存在的水溶性类胡萝卜素。藏红花素具有抗癌、抗凋亡、抗炎和抗氧化等作用[6-7]。研究表明,藏红花素通过抑制炎性因子caspase1和白细胞介素1β(interleukin-1β, IL-1β)表达保护视网膜缺血再灌注损伤小鼠的鼠视网膜神经节细胞[8]。Li等[9]也发现藏红花素能通过诱导M2巨噬细胞极化而减轻冠状动脉粥样硬化。目前关于藏红花素对PAH的影响的研究报导极少,本研究旨在分析藏红花素能否通过调节炎症从而缓解野百合碱(monocrotaline, MCT)诱导的PAH大鼠右心室损伤。
材料和方法
1 实验材料
藏红花素(25 g;分子式:C44H64O24;分子量:976.97;批号:SSLBJ-MB)购自东京化学工业有限公司;MCT(20 mg;批号:AGPG-89251)购自上海广锐生物科技有限公司;西地那非(sildenafil;50 mg;批号:1160012)购自广州白云山医药集团有限公司;IL-1β、IL-6和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)检测试剂盒均购自上海蓝基生物科技有限公司;NF-κB P65抗体(80979-1-RR)和CCL2抗体(66272-1-Ig)购 自Proteintech;p-NF-κB P65抗 体(3033S)购自CST;p38丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)抗 体(bs-0637R)、p-p38 MARK抗体(bs-5476R)、CCR2抗体(ab273050)和CD68抗 体(ab201340)购 自Bioss。VECG-2303B动物心电图机购自广州市三锐电子科技有限公司;FA1004型电子天平购自上海精科天平;动物天平TCS.200购自中国武汉;PowerLab生理记录仪购自澳大利亚AD仪器公司;石蜡包埋机及恒温冷冻切片机购自Leica;PCR仪购自Bio-Rad;-80 ℃超低温冰箱、电泳仪及多功能读板机购自Thermo Fisher;冻台购自武汉俊杰电子有限公司;恒温摇床购自苏州市国飞实验室仪器有限公司;脱色摇床及匀浆仪购自赛维尔生物;光学显微镜购自日本奥林巴斯公司;酶标检测仪购自Rayto;蛋白浓度定量仪及移液枪购自Eppendorf;光源购自Zeiss。
2 实验动物分组
40只SPF级雄性SD大鼠,体重(200±20) g,购自北京华富康动物公司(实验动物使用许可证号为IRM-DWLL-2020075),并遵循美国国家学术研究委员会实验动物饲养管理和使用指南。大鼠在带有饲料的塑料笼中饲养,定期添加和更换饮用水和垫料。适应性喂养1周后,大鼠随机分为normal组、PAH组、crocin组和sildenafil组,每组10只。PAH组、crocin组和sildenafil组大鼠单次皮下注射MCT(50 mg/kg),以建立PAH模型;normal组大鼠皮下注射等体积生理盐水。自MCT注射之日起,crocin组大鼠给予藏红花素(200 mg/kg)[10],sildenafil组大鼠给予sildenafil(30 mg/kg),PAH组和normal组大鼠给予等体积生理盐水,每日1次灌胃,持续4周。
3 主要实验方法
3.1 血流动力学及指数的测定 4周后,所有大鼠称量体重,予3%戊巴比妥钠(45 mg/kg)腹腔注射进行麻醉,仰卧位固定于蛙板上,剪去大鼠右侧颈部体毛,75%医用乙醇消毒,做右颈部外上至内下斜行切口至锁骨上部,钝性分离皮下组织和肌肉,暴露右侧颈外静脉,游离约1 cm,棉线结扎静脉远心端后,提起颈外静脉,朝心室方向剪开一个2~3 mm“V”形切口,插入微导管,并通过压力传感器连接至Powerlab生理记录仪,导管送至右心室,测定心率,在生理记录仪显示屏上可以见到振幅较大的心室波,通过显示的波形曲线和压力值测量右心室收缩压(right ventricular systolic pressure, RVSP),导管继续往里前进,通过压力波形变化来判断导管所处位置,待导管行至肺动脉后记录大鼠平均肺动脉压(mean pulmonary artery pressure, mPAP)。测压结束后放血处死大鼠,取出大鼠心脏并称重,去除脂肪、血管及心房、心耳组织,沿室间隔分离右心室游离壁,剩余的部分即为左心室及室间隔组织。随后,吸干水分,天平秤量右心室和左心室+室间隔的重量,计算右心室质量指数[right ventricular mass index, RVMI;RVMI=右心室重量(mg)/体重(g)]和右心室肥大指数(right ventricular hypertrophy index, RVHI;RVHI=右心室重量/左心室及室间隔重量),以反映右心室肥大程度。
3.2 右心室组织学检查 将大鼠右心室组织浸泡在4%多聚甲醛中固定24 h,脱水后二甲苯透明化,石蜡包埋固定,切成5 mm切片。切片用masson三色染色,光学显微镜观察右心室染色标本,检测右心室胶原纤维及心肌细胞形态学的变化。
3.3 ELISA测量炎症细胞因子 取右心室组织0.1 g,置于0.9%生理盐水中超声研磨。之后以3 000 r/min离心15 min获得肺组织和右心室组织匀浆。ELISA试剂盒测定炎性因子IL-1β、IL-6和TNF-α的蛋白含量,具体程序参照试剂盒说明书操作。
3.4 RT-qPCR测量炎症细胞因子 使用RNA提取试剂盒从100 mg大鼠右心室组织中制备和纯化总RNA,以紫外分光光度计测定总RNA的浓度与纯度,将提取的总RNA分装每管2 μL,于-80 ℃冰箱保存。取2 μL总RNA配成gDNA去除反应体系混合液,另外配制反转录反应体系混合液,将反转录反应体系混合液加到gDNA去除反应体系混合液中充分混匀,42 ℃孵育15 min,之后95 ℃孵育3 min,得到cDNA。配制反应体系20 μL,行PCR扩增,反应条件:95 ℃预变性15 min;95 ℃变性10 s,60 ℃退火20 s,66 ℃延伸32 s,40个循环。内参照选用β-actin。用2-ΔΔCt法计算mRNA相对表达水平。扩增引物序列见表1。
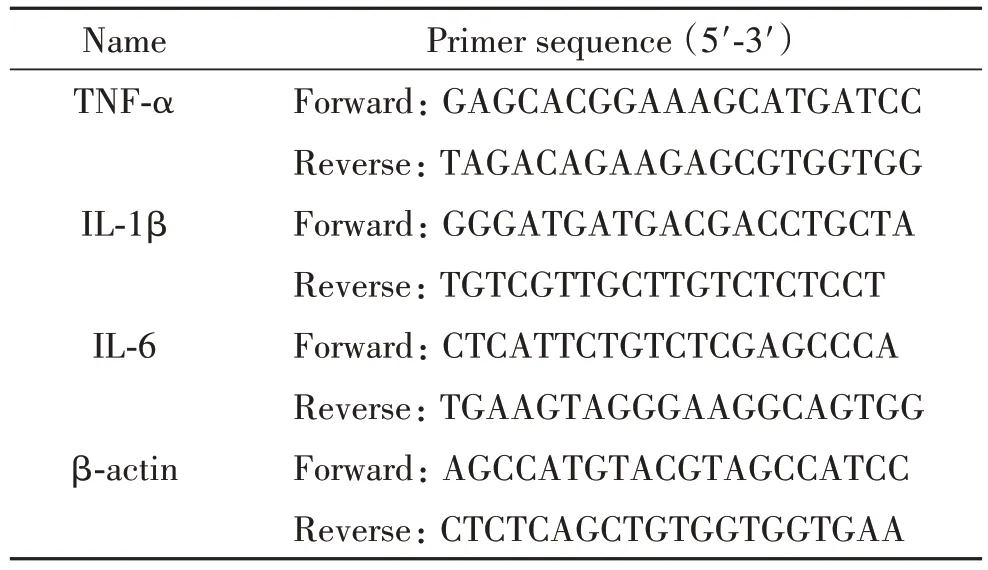
表1 引物序列Table 1.Sequences of the primers
3.5 Western blot检测p38 MAPK、p-p38 MAPK、NFκB P65、p-NF-κB P65和CCL2水平 取大鼠右心室100 mg放入匀浆器中提取组织蛋白,配制BCA工作液,加热使蛋白变性,用酶标仪在562 nm波长下测定吸光值,根据标准品曲线,计算蛋白浓度及上样量。制备凝胶,在30 mA恒流下进行SDS-聚丙烯酰胺凝胶电泳,分离后在电压100 V、电流200 mA下以湿转法电转移动至聚偏二氟乙烯(polyvinylidene fluoride, PVDF)膜上,时间为2 h。室温下将膜密封在Tris-buffered saline/0.1% Tween 20/5%脱脂奶粉(TBST/B)中1 h,然后将膜与Ⅰ抗溶液(抗体稀释比例:p38 MAPK为1∶500,p-p38 MAPK为1∶500,NFκB P65为1∶1 000,p-NF-κB P65为1:1 000,CCL2为1∶1 000,GAPDH为1∶1 000)在4 ℃下轻轻摇动孵育过夜,用TBST/B洗膜3次后立即转移到Ⅱ抗[HRPGoat Anti-Rabbit IgG(H+L)]溶液中,室温孵育1 h,将膜再次洗涤3次,并用Luminata crescendo Western HRP底物显色。使用Molecular Imager ChemiDoc XRS系统凝胶成像分析仪获取图像,用ImageJ图像软件分析各条带的灰度值,比较各组间差异。
3.6 免疫荧光分析 右心室组织切片与波形蛋白抗体(1∶200)、CCR2抗体(1∶200)和CD68抗体(1∶200)在4 ℃下培养过夜,添加Ⅱ抗[CoraLite594 标记的纯山羊抗小鼠IgG(H+L)],37 ℃孵育 2 h。细胞核用4′-6-二氨基-2-苯基吲哚(DAPI)复染。在荧光显微镜下观察组织的病理变化。使用Image-Pro Plus 6.0对免疫荧光染色进行量化。
4 统计学处理
应用SPSS 20.0软件(SPSS,Inc.,Chicago,IL,USA)进行统计分析,实验中所有变量数据均进行正态性检验,呈正态分布的计量资料以均数±标准差(mean±SD)表示,通过单因素方差分析来检查各组之间的统计差异,P<0.05表明差异具有统计学意义。曲线拟合使用GraphPad Prism 5进行。
结 果
1 藏红花素对大鼠一般情况的影响
在适应性饲养阶段,各组大鼠精神状态良好,毛色光亮,进食好,活跃,反应灵敏,无异常。在实验过程中,normal组大鼠一般情况较前无明显变化;PAH组大鼠逐渐出现精神萎靡、行动迟缓、食量减少、反应迟钝、体毛晦暗和呼吸急促等症状,最后以静卧为主;crocin组和sildenafil组大鼠一般情况介于对照组和PAH组大鼠之间。
2 藏红花素对大鼠体重及心率的影响
实验开始前,各组间大鼠体重比较差异无统计学意义(P>0.05)。4周后,各组间大鼠体重及心率比较差异无统计学意义(P>0.05)。见表2。
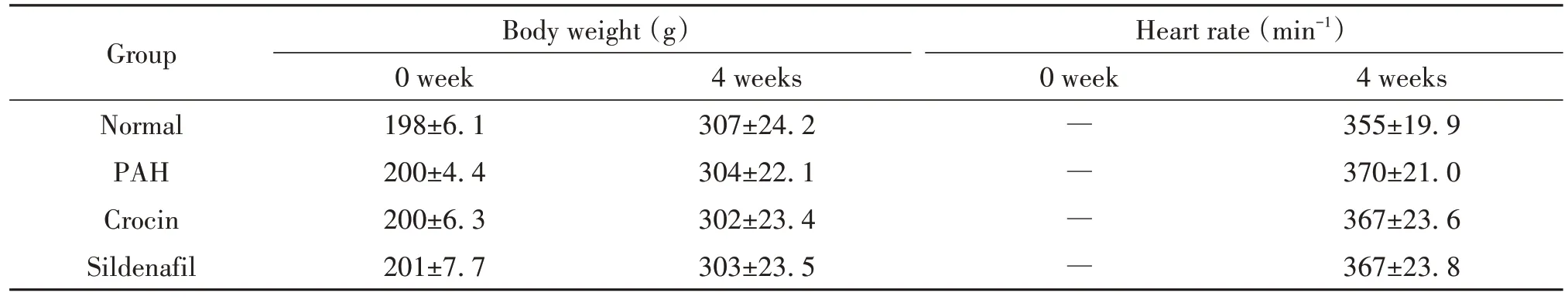
表2 藏红花素对大鼠体重和心率的影响Table 2.Effects of crocin on rat body weight and heart rate
3 藏红花素对大鼠血流动力学的影响
与normal组相比,PAH组大鼠RVSP及mPAP显著升高(P<0.01);与PAH组相比,crocin组和sildenafil组大鼠RVSP显著下降(P<0.01);crocin组和sildenafil组大鼠mPAP显著下降(P<0.05),见图1。

Figure 1.Effects of crocin on rat hemodynamics.Mean±SD.n=10.☆☆P<0.01 vs normal group;●P<0.05, ●●P<0.01 vs PAH group.图1 藏红花素对大鼠血流动力学的影响
4 藏红花素对大鼠右心指数的影响
与normal组相比,PAH组大鼠RVHI及RVMI显著升高(P<0.01);与PAH组相比,crocin组和sildenafil组大鼠RVHI及RVMI显著下降(P<0.01),见图2。
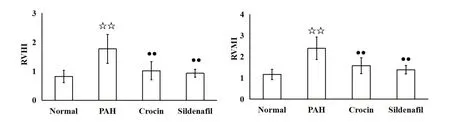
Figure 2.Effects of crocin on rat right ventricular indexes.Mean±SD.n=10.☆☆P<0.01 vs Normal group;●●P<0.01 vs PAH group.图2 藏红花素对大鼠右心指数的影响
5 藏红花素对大鼠右心室组织病理学的影响
Masson染色显示右心室胶原纤维蓝染。Normal组大鼠心肌细胞呈红色,紧密排列,细胞核呈褐色,心肌细胞间隙窄而清晰可见,基质中有少量蓝色胶原纤维,分布稀疏,染色浅;PAH组大鼠心肌间隙明显增宽,心肌纤维大小不等,排列混乱,部分断裂,心肌细胞水肿,部分细胞核溶解消失,间质内可见较多蓝色胶原纤维,与心肌间质呈现出紊乱的漩涡状或栅栏状排列;crocin组和sildenafil组大鼠的心肌细胞排列紧密,轻度水肿,胶原纤维轻度增生,见图3。
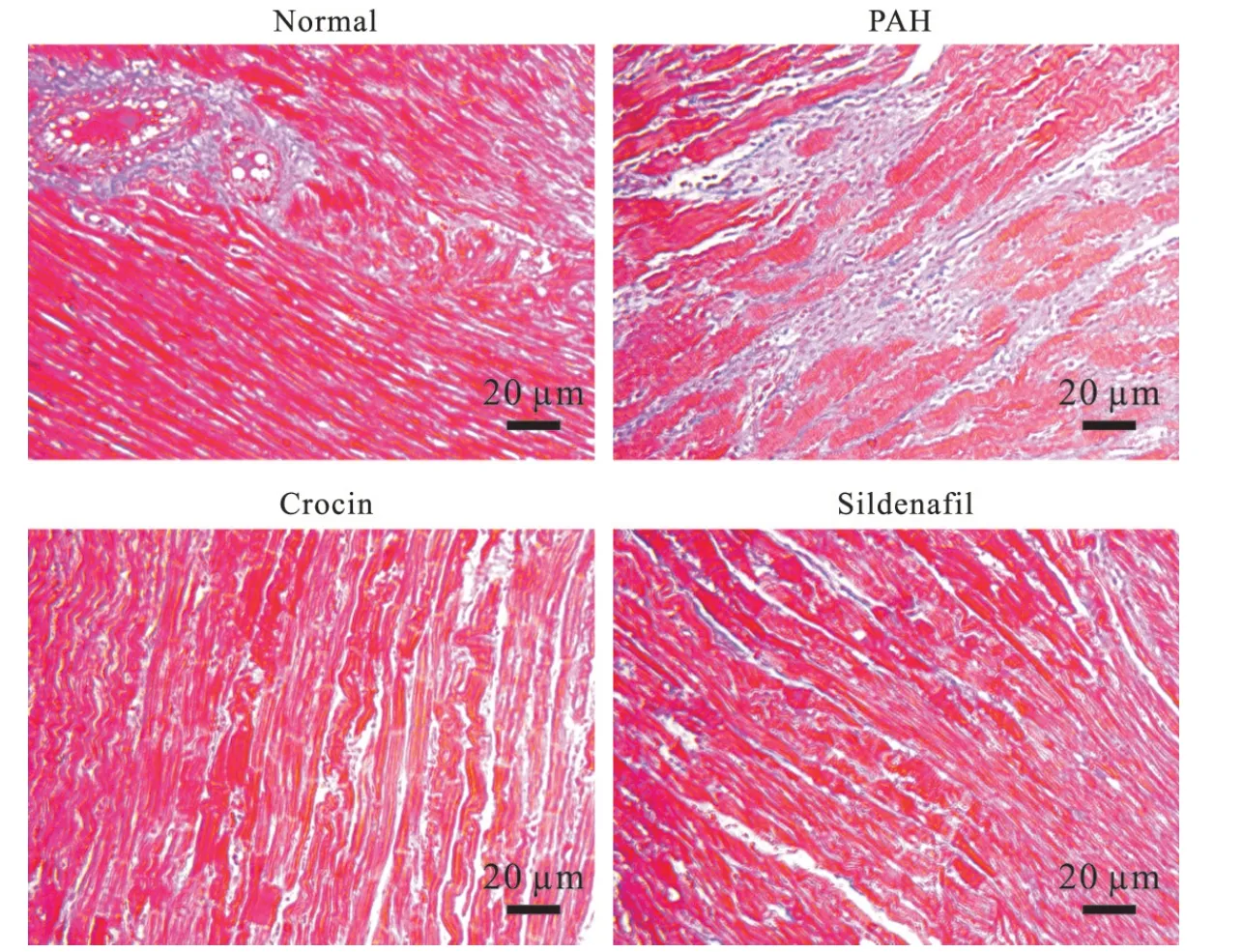
Figure 3.Masson staining of rat right ventricles.Scale bar=20 μm.图3 大鼠右心室masson染色
6 藏红花素对大鼠右心室IL-1β、IL-6和TNF-α的影响
ELISA检测结果显示,与normal组相比,PAH组大鼠右心室IL-1β、IL-6和TNF-α的蛋白水平显著增加(P<0.01);与PAH组相比,藏红花素及西地那非干预降低了以上3种炎症细胞因子的蛋白水平,差异有统计学意义(P<0.05),见图4A。RT-qPCR显示,与normal组相比,PAH组大鼠右心室IL-1β、IL-6和TNF-α mRNA表达水平均显著升高(P<0.01);与PAH组相比,crocin组及sildenafil组IL-1β、IL-6和TNF-α mRNA显著降低(P<0.01),见图4B。
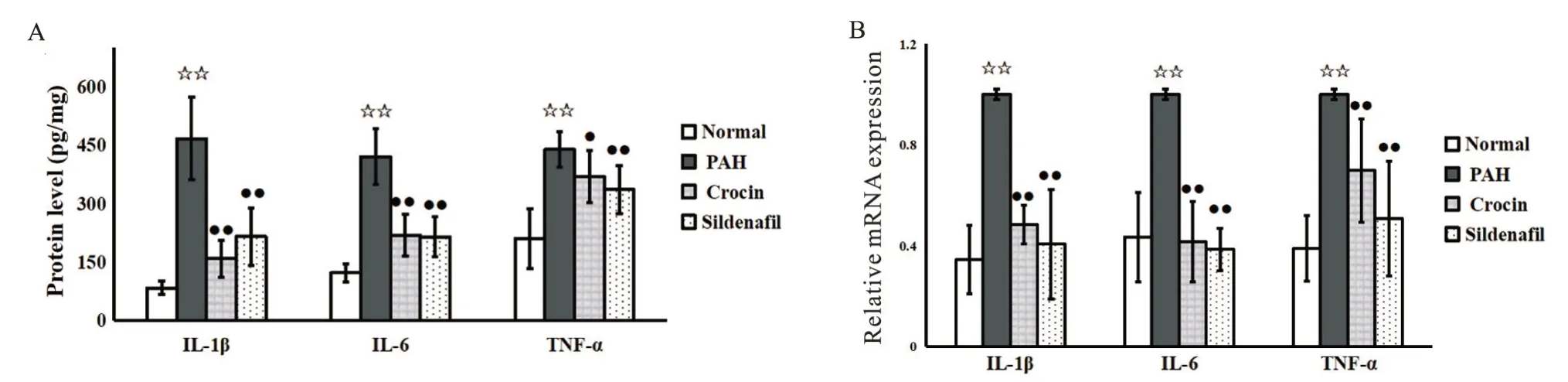
Figure 4.Effect of crocin on protein levels (A) and relative mRNA expression levels (B) of IL-1β, IL-6 and TNF-α in rat right ventricles.Mean±SD.n=10.☆☆P<0.01 vs Normal group;●P<0.05, ●●P<0.01 vs PAH group.图4 藏红花素对大鼠右心室IL-1β、IL-6、TNF-α的蛋白和mRNA表达水平的影响
7 藏红花素对大鼠右心室p38 MAPK/NF-κB通路的影响
Western blot实验结果显示,与normal组相比,PAH组大鼠右心室细胞中p-p38 MAPK表达显著上调,p-p38 MAPK与p38 MAPK比值显著升高(P<0.05),p-NF-κB P65表达显著上调,p-NF-κB P65与NF-κB P65比值显著升高(P<0.01);与PAH组相比,crocin组、sildenafil组大鼠右心室细胞中p-p38 MAPK表达显著下调,p-p38 MAPK与p38 MAPK比值显著降低(P<0.05),p-NF-κB P65表达显著下调,p-NFκB P65与NF-κB P65比值显著降低(P<0.05),见图5。
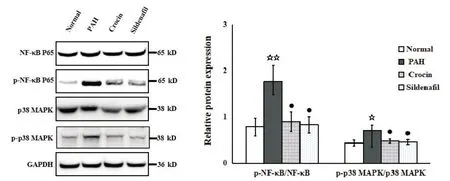
Figure 5.Effects of crocin on the p38 MAPK/NF-κB pathway in rat right ventricle lung tissues.Relative protein expression levels were detected by Western blot.Mean±SD.n=10.☆P<0.05, ☆☆P<0.01 vs normal group;●P<0.05 vs PAH group.图5 藏红花素对大鼠右心室p38 MAPK/NF-κB通路的影响
8 藏红花素对大鼠右心室CCL2/CCR2通路及巨噬细胞的影响
8.1 藏红花素对大鼠右心室CCL2的影响 Western blot实验结果显示,与normal组相比,PAH组大鼠右心室中CCL2蛋白水平显著升高(P<0.01);与PAH组相比,crocin组及sildenafil大鼠CCL2蛋白水平显著降低(P<0.05),见图6。
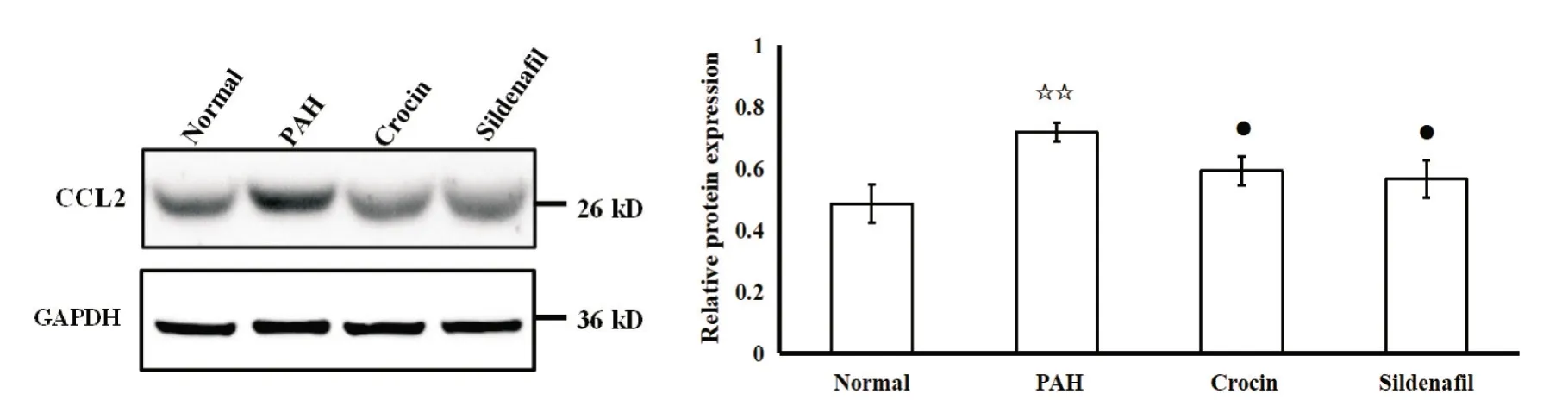
Figure 6.Effect of crocin on CCL2 in rat right ventricles.Relative protein expression levels were detected by Western blot.Mean±SD.n=10.☆☆P<0.01 vs normal group;●P<0.05 vs PAH group.图6 藏红花素对大鼠右心室CCL2的影响
8.2 藏红花素对大鼠右心室CCR2及巨噬细胞的影响 将大鼠右心室切片进行CCR2和CD68免疫荧光共染。结果显示,normal、PAH、crocin和sildenafil组大鼠右心室CCR2+反应区(红色荧光所示)均与CD68+反应区(绿色荧光所示)相重叠。与normal组相比,PAH组中CCR2+/CD68+荧光表达明显增多;与PAH组相比,crocin及sildenafil组CCR2+/CD68+荧光表达明显减少。见图7。

Figure 7.Immunofluorescence staining of rat right ventricles.Scale bar=50 μm.White arrows indicate CD68+/CCR2+ positive areas.图7 大鼠右心室免疫荧光染色
对免疫荧光染色进行量化分析发现,与normal组相比,PAH组大鼠右心室中CCR2+/CD68+反应强度显著增加(P<0.01);与PAH组相比,crocin组及sildenafil组CCR2+/CD68+反应强度显著下降(P<0.01),见图8。
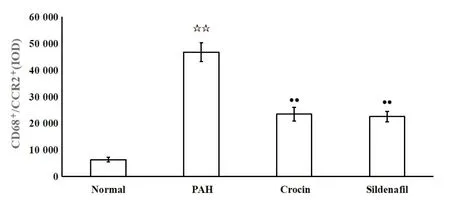
Figure 8.Effects of crocin on the intensity of CCR2+/CD68+ reaction in rat right ventricles.Mean±SD.n=10.☆☆P<0.01 vs normal group;●●P<0.01 vs PAH group.图8 藏红花素对大鼠右心室CCR2+/CD68+反应强度的影响
讨 论
在本研究中我们使用了由MCT诱导的啮齿类PAH动物模型,结果显示PAH组mPAP异常升高,表明PAH模型的建立是成功的。先前的研究证实,在大鼠单次注射野百合碱后 21 d内诱发的恶病质,可导致严重的体重减轻[11],本研究未发现PAH组大鼠与其它组别相比有明显的体重下降,其原因可能与PAH大鼠在中后期行动减少并且出现胸腔积液有关,导致体重无明显差异。西地那非是治疗PAH的有效药物,在许多研究PAH的文章中用做阳性对照药物。在本研究中,我们也将西地那非用做阳性对照药物,结果表明,藏红花素可显著缓解MCT诱导PAH大鼠的右心室损伤,其作用与本实验剂量下西地那非的作用相当。
右心室功能是PAH患者临床预后和生存的主要决定因素,随着PAH的进展,肺血管阻力不断增加,右心室出现肥大扩张及纤维化[12],最终导致右心衰竭,是PAH患者死亡的主要原因[13]。因此,积极寻找PAH 患者右心重塑的发病机制并进行早期干预,对患者的预后非常关键。
心力衰竭与炎症密切相关。Hanna等[14]报道炎性细胞因子调节所有心肌细胞的表型和功能,抑制心肌细胞的收缩功能,诱导巨噬细胞的炎症激活,刺激微血管炎症和功能障碍,促进成纤维细胞的基质降解表型。在许多心肌疾病中,成纤维细胞活化是由炎症反应触发导致的[15]。本研究也在PAH大鼠的右心室观察到胶原纤维沉积,而藏红花素干预对大鼠右心室的胶原沉积有明显的改善作用。
NF-κB是炎症反应的关键转录激活因子,研究显示NF-κB的激活与PASMCs的增殖有关[16]。P38丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)是MAPK家族中调控炎症反应最重要的成员,当无炎症时p38 MAPK呈低表达,在受到炎性因子刺激后p38 MAPK磷酸化水平升高,可以调节多种炎性因子的表达[17],被认为是天然药物抗炎作用的潜在靶点。研究表明p38 MAPK与肺动脉内皮细胞凋亡[18]和PASMCs增殖[19]密切相关。有报道抑制p38 MAPK的磷酸化,能抑制炎症反应,降低PAH[20]。NF-κB是p38 MAPK的下游信号分子之一,p38 MAPK信号通路与NF-κB可以通过交互作用共同影响炎症的发生发展[21]。当机体发生炎症反应时,炎症因子IL-6、IL-8、TNF-a等激活p38 MAPK信号转导通路,磷酸化的p38 MAPK通过特异性底物激活NF-κB通路,使胞质内NF-κB 部分磷酸化,进而启动炎症因子的翻译转录,释放大量的炎症因子比如IL-1β、 IL-6和TNF-α等[22],导致炎症因子的“瀑布效应”。而抑制 p38 MAPK可抑制NF-κB的活性进而降低TNF-α、IL-1β及IL-6 等细胞因子的产生,减轻肺部病理损伤[23]。在巨噬细胞中下调NF-κB和MAPK信号通路,可下调IL-1β、 IL-6、TNF-α和CCL2的表达,进而降低巨噬细胞炎症反应[24];而对p38 MAPK 的抑制可介导对NF-κB通路的抑制作用[25]。以往的研究就已经发现,中药成分可以通过抑制MAPK和NF-kB信号通路而发挥抗炎作用[26]。本研究结果也显示,PAH模型大鼠肺组织以及右心室中p-p38 MAPK和p-NF-κB 蛋白表达水平较正常大鼠显著升高,p38 MAPK及NF-κB P65 磷酸化水平反映其活化状态,提示其共同参与了MCT诱导的PAH的炎症调控过程。经藏红花素干预后p38 MAPK 及NF-κB P65 磷酸化水平与模型组比较呈明显降低,同时NF-κB下游因子的表达水平也被显著下调,提示藏红花素的抗炎作用与抑制p38 MAPK /NF-κB信号通路有关。这表明NF-κB与p38 MAPK可能是PAH中潜在的作用靶点。
巨噬细胞在机体炎症反应中发挥着巨大的作用。吸引巨噬细胞的趋化因子很多,其中以CCL2 最为重要,它通过与巨噬细胞表面受体CCR2结合发挥作用, 是单核/巨噬细胞细胞募集和激活的最具生物活性的趋化因子[27],可将巨噬细胞吸引至炎症部位。活化的巨噬细胞释放包括IL-1 、IL-6、IL-8以及TNFa 等多种细胞因子,参与炎症反应的调节[28]。CD68是巨噬细胞标志物[29],为了验证CCR2主要在巨噬细胞表面表达,我们将右心室组织进行CCR2 和CD68免疫荧光共染。结果显示:各组CD68+巨噬细胞表达区域均与CCR2+表达区域明显重合。结果还表明,PAH组大鼠右心室中巨噬细胞浸润较正常组明显增加,而藏红花素及西地那非干预组右心室中巨噬细胞浸润较PAH组明显减轻,说明巨噬细胞诱导的炎症反应在PAH右心室损伤中也发挥了作用。Al-Qazazi等[30]也在PAH模型和患者失代偿的右心室中发现巨噬细胞的激活,从而认为右心室炎症也是PAH右心室衰竭的原因,而不仅仅是由右心室负荷升高引起的,这为PAH提出了一种新的治疗模式。经过刺激的巨噬细胞,可以活化NF-κB,进而促进炎性细胞因子的表达和分泌。Zimmer等[31]还发现血管平滑肌细胞中的 CCL2水平受到NF-κB的调节,这说明巨噬细胞与NF-κB相互影响、相互促进,使炎症反应级联放大。本研究也显示CCL2/CCR2 通路和巨噬细胞分布的变化趋势与p38 MAPK/NF-κB的变化相同。因此,抑制CCL2 的过度表达,减少巨噬细胞的聚集,从而抑制NF-κB等炎症因子的释放,使失控的炎症反应得以控制,将有望成为治疗PAH的新思路。
本研究也存在一些局限性:首先,抗炎已成为治疗PAH的理念之一,但目前的研究仅限于动物模型,尚未应用于PAH患者,本研究也是如此。再者,巨噬细胞的激活状态对疾病的具体作用以及NF-κB通路与CCL2 相互促进的具体机制尚不完全清楚,有待于进一步的研究。

