miR-19a在食管鳞癌组织及细胞中的功能机制研究
刘 涛, 古丽亚·买买提, 谭依依, 彭天元, 王 薇, 卢晓梅
(1省部共建中亚高发病成因与防治国家重点实验室, 2新疆医科大学第一附属医院检验科,3新疆医科大学第一附属医院临床医学研究院, 乌鲁木齐 830011)
食管癌是常见的消化道恶性肿瘤之一,2023年全球癌症统计报告数据显示,其发病率排名恶性肿瘤中第8位而死亡率排名第6位。根据组织学病理分型,食管癌可以分为鳞状细胞癌和腺癌两种不同类型,其中每年90%以上的食管鳞癌新发病例发生在中国[1]。尽管近几年在食管鳞癌领域的研究报道对其致病的分子机制和临床特征有了更多的了解,对食管鳞癌的早期诊断和临床治疗效果及预后也有了明显的提高和改善[2],但由于其本身早期临床症状不明显的特点,以及缺乏有效的早诊分子靶标,易发生局部浸润和转移,导致食管癌的5年预后生存率仍然很低[3-4]。MicroRNAs(miRNAs)是一类长度为18~25个核苷酸的内源性小分子RNA,主要通过转录后调控靶基因mRNA的降解或翻译抑制等。miRNAs在细胞增殖、分化、凋亡和炎症等生理和病理过程中起重要作用[5]。前期课题组在3对食管鳞癌转移组中应用生物芯片筛选发现,miR-19a在食管鳞癌中呈现高表达现象[6]。另有研究显示,miR-19a在癌组织以及其他疾病或病理状态中也异常表达,是导致多种恶性肿瘤患者预后较差的潜在危险因素[7-9]。因此,本文拟探讨miR-19a在食管鳞癌发生发展中的作用,为食管鳞癌的早诊和个体化的临床诊疗及预后预测分子靶标提供理论依据。
1 材料与方法
1.1 材料收集新疆医科大学第一附属医院2013-2014年住院患者手术切除的30对新鲜食管鳞癌组织及癌旁正常组织,其中高-中分化组17例,中-低分化组13例,根据是否有淋巴结转移分为淋巴结转移组(12例)和未转移组(18例)。所有患者术前均未接受过任何放化疗治疗,并通过新疆医科大学第一附属医院伦理委员会伦理审查,签署患者家属知情同意书。食管鳞癌细胞系Eca109由本实验室保存,细胞培养RPMI-1640培养基、胰蛋白酶、青链霉素抗生素、胎牛血清等均购自美国Gibco公司,细胞周期/凋亡试剂及MTT(四甲基偶氮唑盐)购自美国Invitrogen公司,实时荧光定量PCR检测试剂购自日本Takara公司。
1.2 qRT-PCR检测采用Trizol法提取30对食管新鲜鳞癌组织及癌旁组织总RNA,根据反转录试剂盒说明书合成cDNA,以U6为内参,采用qRT-PCR检测miR-19a在食管鳞癌癌旁组织及癌组织中的相对表达量。
1.3 细胞培养和细胞转染复苏食管鳞癌Eca109细胞于1640培养液(含10%胎牛血清)中,在37℃、5%CO2细胞培养箱中培养。24 h后细胞换液,48 h待细胞铺满培养瓶底部,胰酶消化,传代至6孔细胞培养板,每孔调整细胞浓度为2×105个,24 h后,按Lipofectamine3000脂质体转染说明书,分别转染miR-19a模拟物(Mimics组),抑制剂(Inhibitor组)及随机对照序列(Negative control,NC组)。
1.4 食管鳞癌细胞Eca109中miR-19a的转染效率检测转染24 h后,细胞换液,荧光显微镜下观察细胞状态及转染效率并拍照,48 h后,收集各组细胞,qRT-PCR检测miR-19a在Mimics组、Inhibitor组和NC组中的相对表达量。
1.5 食管鳞癌细胞Eca109转染miR-19a后的细胞增殖检测取对数生长期细胞,分别转染miR-19a NC,Mimics,Inhibitor,同时设置正常培养组(Normal组),每组平行设置3个复孔。分别于转染0、24、48、72、96 h后,每孔加入20 μL MTT,37℃、5%CO2培养箱孵育4 h后,再按每孔180 μL加入甲基亚砜,微型振荡器上振荡10 min,酶标仪检测各组细胞在490 nm处的吸光度值(OD值),根据吸光度值绘制细胞增殖曲线。
1.6 食管鳞癌细胞Eca109转染miR-19a后的细胞迁移检测取对数生长期细胞,调整细胞浓度,按5×105/孔接种于6孔板,待第二天细胞铺至底面积60%~70%时,10 μL无菌枪头划痕,PBS润洗2遍,弃去上清培养液,换成新鲜低血清培养液培养,分别于转染0、24、48、72 h时,荧光倒置显微镜下观察划痕愈合距离并拍照,Image J软件测量划痕愈合距离。
1.7 食管鳞癌细胞Eca109转染miR-19a后的细胞侵袭检测取对数生长期细胞,调整细胞浓度,按2×105/孔接种于24孔Transwell小室内,分别转染miR-19a NC,Mimics和Inhibitor,每组平行设置3个复孔,转染36 h后取出Transwell小室,PBS漂洗2遍,擦去上室底部未侵袭的细胞,加入甲醇固定30 min,0.1%结晶紫避光染色30~60 min,倒置显微镜下观察拍照并计数。
1.8 细胞周期和细胞凋亡检测消化转染miR-19a后的各组食管鳞癌Eca109细胞,分别按照细胞周期检测试剂盒和细胞凋亡检测试剂盒说明书,固定、标记、染色、流式细胞仪检测,记录各组细胞的G1期、G2期和S期的百分比及细胞凋亡率。
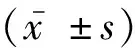
2 结果
2.1 miR-19a在食管鳞癌及癌旁组织中的表达qRT-PCR检测30对食管鳞癌及癌旁新鲜组织中miR-19a的相对表达,发现在30对食管鳞癌组织中,有21对癌组织表达量高于癌旁组织,9对癌组织表达量低于癌旁组织(图1),miR-19a在食管鳞癌组织的相对表达量为(11.07±12.08),高于癌旁组织表达量(1.36±1.03),差异有统计学意义(P<0.05)。
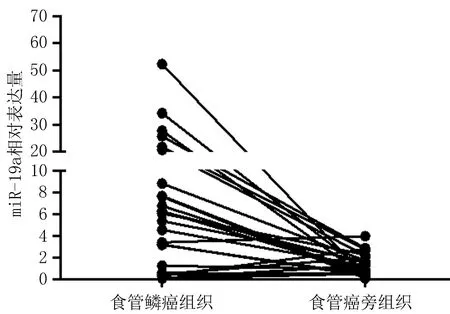
图1 miR-19a在食管鳞癌及癌旁组织中的表达
2.2 miR-19a在食管鳞癌不同分化程度及转移情况中的表达与食管鳞癌高-中分化组miR-19a表达量(2.92±2.84)相比,食管鳞癌中-低分化组中miR-19a表达量(6.92±3.61)显著增加,差异具有统计学意义(P<0.05);与食管鳞癌淋巴结转移组中miR-19a表达量(6.50±4.21)相比,食管鳞癌淋巴结未转移组中miR-19a表达量(2.55±2.06)显著减少,差异有统计学意义(P<0.05)。
2.3 miR-19a在食管鳞癌细胞中的转染率比较取对数生长期Eca109细胞,转染miR-19a NC,Mimics和Inhibitor,24 h后荧光显微镜下观察转染效率,结果显示3个组的转染效率均达90%以上(图2A)。转染48 h后,收集3组的食管鳞癌细胞,qRT-PCR检测miR-19a表达量,结果显示,Mimics组miR-19a的表达量(4.30±0.28)是NC组(0.96±0.05)的4.48倍,Inhibitor组miR-19a的表达量(0.26±0.04)是NC组(0.96±0.05)的0.27倍(图2B)。

注: A, 荧光显微镜观察转染效率(10×10); B, qRT-PCR检测转染后miR-19a的表达。
2.4 转染miR-19a后各组食管鳞癌细胞增殖情况比较检测食管鳞癌细胞Eca109在转染miR-19a NC,Mimics和Inhibitor后,在0、24、48、72、96 h的吸光度值,绘制细胞生长曲线(图3)。结果显示,与正常培养组和NC组相比,转染miR-19a Mimics组的食管鳞癌细胞增殖明显,而转染miR-19a Inhibitor组的食管鳞癌细胞增殖明显受到抑制,在72 h和96 h时差异具有统计学意义(P<0.05)。
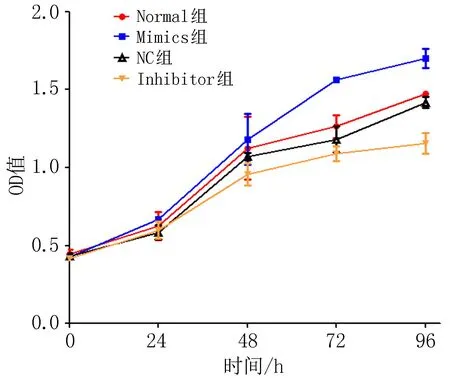
图3 转染miR-19a后食管鳞癌细胞Eca109的生长曲线
2.5 转染miR-19a后各组食管鳞癌细胞迁移和侵袭情况比较食管鳞癌细胞Eca109中分别转染miR-19a NC,Mimics和Inhibitor后,划痕试验结果显示,与正常培养组和NC组相比,转染miR-19a Mimics后,Eca109细胞划痕距离愈合较快,而转染miR-19a Inhibitor后,划痕距离愈合较慢,并在转染24、48和72 h时,差异具有统计学意义(P<0.05)(图4)。侵袭试验结果显示,转染miR-19a 36 h后,Mimics组穿透基质胶的细胞数量(469.00±16.37)明显多于正常培养组(355.67±17.10)和NC组(347.00±7.81),而转染miR-19a Inhibitor后的细胞数量(155.67±11.37)明显少于正常培养组和NC组,差异有统计学意义(P<0.05)(图5)。
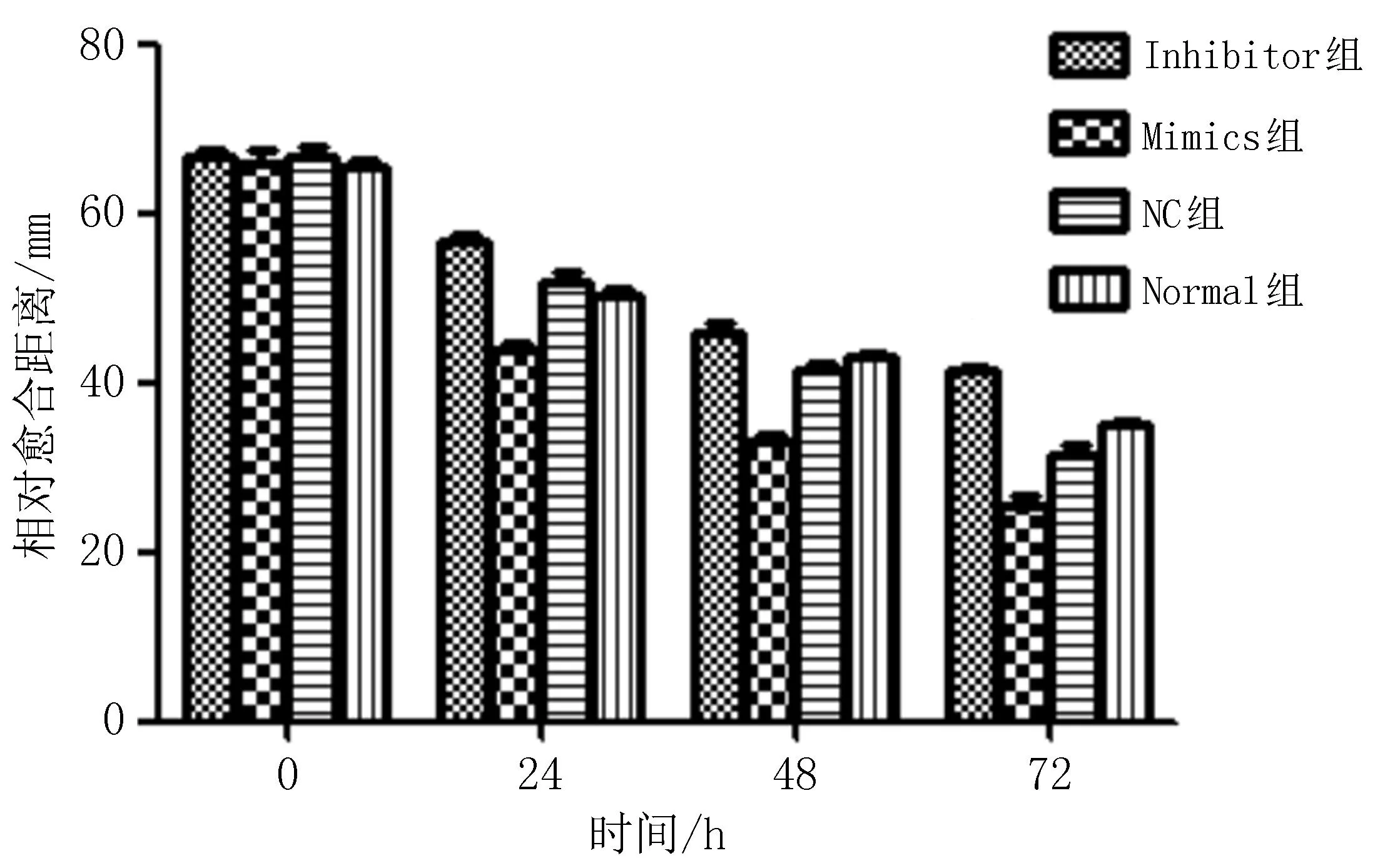
图4 miR-19a对Eca109细胞迁移能力的影响

图5 miR-19a对Eca109细胞侵袭能力的影响
2.6 转染miR-19a后各组食管鳞癌细胞的周期和凋亡情况比较转染miR-19a后,细胞周期结果显示,与正常培养组和NC组相比,Inhibitor组G2期的细胞明显增多,而S期细胞显著减少,Mimics组G2期细胞较少而进入S期细胞数量明显增多,差异有统计学意义(P<0.05)。细胞凋亡结果显示,转染miR-19a Inhibitor组的晚期细胞凋亡率(56.7%)明显高于正常培养组(14.5%)和NC组(9.7%),而转染miR-19a Mimics组的细胞凋亡率(3.6%)低于正常培养组(14.5%)和NC组(9.7%)(P<0.05),见图6。

图6 miR-19a对食管鳞癌细胞Eca109周期和凋亡的影响
3 讨论
食管癌发病因素可能与地域环境、饮食习惯、遗传因素等有关[10]。MicroRNAs(miRNAs)是一类内源性单链RNA分子,其转录后调控靶基因,可对靶基因起到抑制或过表达的作用,在维持细胞稳态,参与肿瘤进程的细胞增殖、凋亡及转移等多个环节起到重要作用[11]。
MiR-19a位于人类染色体13q31.3上,是miR-17-92基因簇的成员之一,在炎症、肿瘤的发生发展及血管性疾病中均具有重要调控作用,特别是在造血系统恶性肿瘤和实体瘤中[12]。据报道,miR-19a在乳腺癌、肺癌、结肠癌、前列腺癌和胰腺癌中均扮演者癌基因的角色,呈高表达或异常扩增的状态[13]。Wu等[14]报道,miR-19a-3p在喉鳞癌患者中表达上调,并与颈部淋巴结转移、分化不良和总生存率呈正相关,可能负调控TIMP-2通路参与喉鳞癌的恶性增殖。在非小细胞肺癌中,miR-19a与肺癌组织的不良预后、转移和增殖呈正相关,促进磷酸酶-张力蛋白基因(PTEN)和p53诱导核蛋白1(TP53INP1)的表达,调控苏氨酸/丝氨酸蛋白激酶B(AKT)信号通路参与了肺癌的病理生理过程[15]。Zou等[16]的研究发现miR-19a在骨肉瘤组织中的表达明显高于非癌性骨组织,且miR-19a的高表达与肿瘤大小、临床分期晚期、远处转移和化疗耐药呈正相关。同时可以抑制人ras同源物基因家族成员b(RhoB)的表达,促进骨肉瘤细胞的肺转移,是AKT1去磷酸化的关键调节因子。Xu等[17]的研究发现,miR-19a-3p/miR-19b-3p对食管癌患者的临床病理因素和预后有一定的影响,miR-19b-3p的表达与肿瘤大小、淋巴结转移和临床分期呈正相关。Zhong等[18]的研究显示,miR-19a的表达上调与食管癌的肿瘤进展和淋巴结转移的发生呈正相关,本研究结果显示,与食管鳞癌癌旁组织相比,miR-19a在食管鳞癌癌组织中呈现高表达状态,表达率为70%(21/30),且中-低分化组中miR-19a的表达量明显高于高-中分化组,差异具有统计学意义。在淋巴结转移组,miR-19a的表达量也明显高于未转移组,其具体的机制可能与miR-19在肿瘤组织中扮演癌基因的角色,负调控抑癌基因,促进肿瘤细胞的增殖相关。表明miR-19a可以作为食管鳞癌预后预测的一个新型生物标志物。
在细胞水平上,miR-19a可通过调控圆柱瘤蛋白CYLD及PTEN的表达促进急性淋巴细胞白血病的发生发展[19]。Gu等[20]的研究证实,miR-19a-3p通过靶向微管相关支架蛋白1(MTUS1)促进肺癌细胞的增殖和迁移。Chen等[21]也报道了miR-19a-3p过表达通过靶向胶质瘤中的RhoB促进细胞增殖和侵袭,提示miR-19a可能在胶质瘤中起到致癌基因的作用。过表达miR-19a可促进乳腺癌细胞增殖、侵袭和骨转移[22]。此外,Niu等[23]指出,miR-19a-3p直接靶向RhoB的30个非编码翻译区,促进肿瘤发生和发展。本研究细胞水平结果显示,在食管鳞癌细胞系Eca109中,过表达miR-19a促进了食管鳞癌细胞的增殖、迁移和侵袭,而加入抑制剂降低miR-19a的表达,明显抑制了食管鳞癌的增殖、迁移和侵袭,其作用机制可能是负调控抑癌基因,促进抑癌基因的表达从而抑制了食管鳞癌细胞的恶性表型,但其具体的抑制基因及参与的信号通路有待于进一步研究,流式细胞术结果显示,转染miR-19a Inhibitor可将食管鳞癌Eca109阻滞在S期,减少细胞进入M期,抑制细胞增殖,促进细胞凋亡,而转染miR-19a Mimics可抑制食管鳞癌细胞Eca109的凋亡,从本研究组织水平和细胞水平所获得的研究结果提示,miR-19a有可能作为一个食管鳞癌临床诊疗及预后的潜在分子靶点。
综上所述,miR-19a在食管鳞癌发生发展中扮演癌基因的角色,起到致癌的作用,促进了食管鳞癌细胞的增殖迁移和侵袭,并且与食管鳞癌的分化程度和淋巴结转移情况密切相关。因miRNA具有高度稳定性和保守型,本研究有待进一步扩大样本量,从外周血中检测miR-19a的表达,为食管鳞癌临床诊断和预后预测提供坚实的理论基础。

