基于银-硫配位的协同抗菌水凝胶的制备与性能
剧芳
(合肥工业大学化学与化工学院,先进催化材料与反应工程安徽省重点实验室,安徽 合肥 230009)
众所周知,抗生素是治疗细菌感染的最常见药物[1],但随着抗生素的滥用,细菌等微生物获得抵抗药物的能力而产生耐药性[2]。无机纳米颗粒具有广谱抗菌性且不会产生耐药性,已被广泛用于抗菌剂[3],特别强调的是银等纳米颗粒(Ag NPs)[4]。由于Ag NPs 的比表面积大,同时拥有单质银与纳米尺寸的主要特征,其抑菌能力要明显大于尺寸大的银单质,具有广谱抗菌、高效抗菌以及安全无毒等优势[5]。水凝胶是一种能够在水中溶胀但不溶解于水的三维网状结构的高分子材料[6],拥有与天然软组织结构相似的细胞外基质[7-8],可以模拟生物系统中的双相(水和聚合物)自然环境,拥有良好的生物相容性[9]。一系列的天然水凝胶(纤维素[10]、透明质酸[11]、海藻酸盐[12]等)和合成水凝胶(聚丙烯酰胺[13]、聚乙烯醇[14]、聚丙烯酸[15]等)已应用于生活的各个领域。其中聚丙烯酰胺毒性较低,原料价格相对低廉[16]。金属纳米颗粒复合水凝胶具有协同作用的性质[17],但限制其广泛应用的因素是NPs的聚集倾向问题。有研究表明交联水凝胶基质可以与NPs 结合[18],用于稳定NPs,使其均匀分散[19]。因此,可以通过聚合物官能团与金属颗粒之间的电子相互作用提高有机与无机组分在界面的相容性[20-21]。
本文通过简单有效的化学原位还原方法,避免了其他表面活性剂的污染及提纯,制备了一种基于银-硫配位作用的协同抗菌水凝胶。首先设计一种乙烯基官能化的线型聚硫醚(P1),再通过巯-烯click 反应引入足够量的羧基得到P2,赋予其水溶性。由P2 作为表面活性剂,硼氢化钠将硝酸银原位还原成Ag NPs。利用P2 聚合物链上的硫原子与Ag NPs 相互作用得到复合交联剂(Ag NPs@P2),在过硫酸钾(KPS)的引发下,与丙烯酰胺(Am)单体通过自由基聚合获得水凝胶。由于Ag NPs 和P2 的存在,Ag NPs@P2/PAm 复合水凝胶具备协同抗菌的能力,有望应用于抗菌敷料或其他生物医学领域。且Ag NPs 能够均匀分布在水凝胶中,克服了无机/有机组分极性相差较大的缺陷。
1 实验部分
1.1 实验试剂与仪器
1-烯丙氧基-2,3-环氧丙烷(质量分数99%)、硫氰酸钾(KSCN,分析纯)、丙烯酰胺(Am,分析纯)、PBS 缓冲液(1mol/L)、氢化钙(分析纯)和过硫酸钾(KPS,分析纯),阿拉丁化学试剂有限公司;N-甲基吡咯烷酮(NMP,分析纯),上海皓鸿生物医药科技有限公司;2,2-二甲氧基-2-苯基苯乙酮(DMPA,质量分数99%)、对甲苯基异氰酸酯(分析纯)、苯硫酚(质量分数99%)、四丁基氯化铵(分析纯)、硼氢化钠(NaBH4,分析纯)、3-巯基丙酸(质量分数98%),上海麦克林生化科技有限公司;1,2-二氯乙烷(DCE,分析纯)、三乙胺(TEA,分析纯)、三氯甲烷(CHCl3,分析纯)、碳酸氢钠(NaHCO3,分析纯)、乙醚(分析纯)、无水硫酸钠(分析纯)、甲醇(分析纯)和正己烷(分析纯),国药集团化学试剂有限公司;LB 肉汤(生物试剂)和LB 琼脂粉(生物试剂),生工生物工程股份有限公司;大肠杆菌,华越洋生物科技有限公司;去离子水由Millipore纯水仪制备(18.5MΩ·cm)。1,2-二氯乙烷、三乙胺和N-甲基吡咯烷酮在氢化钙上干燥,并在使用前通过蒸馏纯化。
核磁共振波谱仪,600MHz Bruker 型,美国Agilent Technologies 公司;傅里叶红外光谱仪,Nicolet 型,美国Thermo Nicolet 公司;场发射透射电子显微镜,JEM-2100F 型,日本JEOL 公司;热场发射扫描电子显微镜,Gemini 500 型,德国Carl Zeiss AG公司;X射线光电子能谱仪,ESCALAB25 0Xi型,美国Thermo fisher公司;高效液相色谱仪,Waters 2414 型,美国Waters 公司;万能材料试验机,Instron 5965A型,美国Instron公司;冷冻干燥机,FD-1A-50型,上海恒逸实业有限公司;高温高压蒸汽灭菌锅,Hirayama HVE-50型,上海土森视觉科技有限公司;恒温振荡器,Crystal IS-RDV1型,河北恒仪电子科技有限公司;400W 紫外灯,保定佳兴机电设备厂;真空干燥箱,DZF-6034型,上海一恒科学仪器有限公司。
1.2 线型聚硫醚P2的制备
合成1∶1-烯丙氧基-2,3-环硫丙烷单体按照文献方法合成[22]。将0.1mol 的1-烯丙氧基-2,3-环氧丙烷和0.4mol 的硫氰酸钾加入到50mL 水中,随后混合物于40℃反应24h。反应结束后,混合物冷却至室温分层,水相用20mL 乙醚萃取3 次,有机相合并后加入无水硫酸钠干燥,抽滤,浓缩,减压蒸馏后得到1-烯丙氧基-2,3-环硫丙烷(10.53g,收率81%)。其结构和纯度通过核磁共振氢谱确定(图1),1H NMR (600MHz, CDCl3):δ5.91 (ddt,J1=17.0Hz,J2=10.4Hz,J3=5.7Hz, 1H), 5.29 (ddd,J1=17.3Hz,J2=3.2Hz,J3=1.5Hz, 1H), 5.20 (dd,J1=10.4Hz,J2=1.4Hz, 1H), 4.05 (dd,J1=5.7Hz,J2=1.3Hz, 2H),3.65 (dd,J1=10.7Hz,J2=5.7Hz, 1H), 3.45 (dd,J1=10.6Hz,J2=6.8Hz, 1H), 3.14~3.03 (m, 1H), 2.52 (d,J=6.2Hz, 1H), 2.22 (dd,J1=5.4Hz,J2=1.1Hz, 1H)。
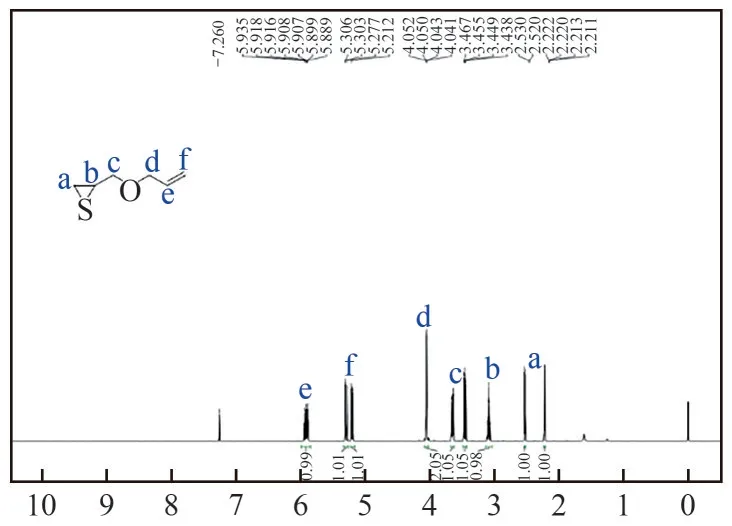
图1 1-烯丙氧基-2,3-环氧丙烷(1)的核磁氢谱
合成引发剂:S-苯基对甲苯基硫代氨基甲酸酯(2)按照文献方法合成[23]。向25mL两口瓶中加入10mmol 的对甲苯基异氰酸酯、10mmol 的苯硫酚、10mmol的无水三乙胺和10mL的无水1,2-二氯乙烷。于25℃下搅拌30min后,将反应后的溶液倒入100mL 正己烷中,析出白色固体。抽滤后所得固体置于正己烷与三氯甲烷的混合溶剂中重结晶,纯化得到白色固体(1.82, 收率75%)。其核磁氢谱如图2 所示,1H NMR (600MHz, CDCl3):δ7.64~7.62(m, 1H), 7.49~7.46 (m, 3H), 7.39~7.36 (m, 1H), 7.28~7.27 (m, 1H), 7.13~7.08 (m, 2H), 7.04 (s, 1H), 2.47 (s,1H), 2.31 (d,J=9.9Hz, 3H)。
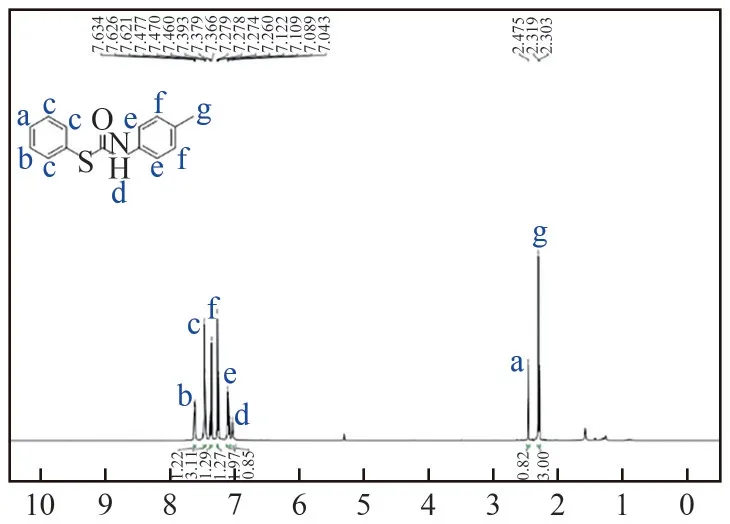
图2 引发剂S-苯基对甲苯基硫代氨基甲酸酯(2)的核磁氢谱
合成P1:线型聚硫醚P1采用阴离子开环聚合方法制备[23]。将1mmol的S-苯基对甲苯基硫代氨基甲酸酯、40mmol 的1-烯丙氧基-2,3-环硫丙烷、1.0mmol 的四丁基氯化铵和5.2mL 的NMP 加入到10mL的聚合瓶中。聚合瓶用液氮冷冻-解冻置换氮气-密封循环3次,然后在60℃下反应24h。冷却至室温,粗产物用大量甲醇沉淀3次,室温下真空干燥72h,得到线性聚硫醚P1 为无色黏稠液体(5.18g, 收率95%),其核磁氢谱及凝胶渗透色谱如图3、图4 所示。1H NMR (600MHz, CDCl3):δ7.37(d,J=8.0Hz, 3H), 7.28 (d,J=7.8Hz, 4H), 7.18 (d,J=7.3Hz, 1H), 7.10 (d,J=8.1Hz, 2H), 5.89 (ddd,J1=22.2Hz,J2=10.6Hz,J3=5.4Hz, 38H), 5.27 (d,J=17.2Hz, 38H), 5.17 (d,J=10.2Hz, 38H), 3.99 (d,J=5.2Hz, 76H), 3.70~3.64 (m, 38H), 3.60 (dd,J1=9.3Hz,J2=6.3Hz, 38H), 2.96 (dd,J1=24.4Hz,J2=7.7Hz, 76H),2.92~2.83 (m, 38H), 2.30 (s, 3H).Mn=4.1kDa, 聚合物分散系数(PDI)= 1.09。

图3 线型聚硫醚P1的核磁氢谱

图4 线型聚硫醚P1的凝胶渗透色谱
合成P2:由于制备的线型聚硫醚P1 不溶于水,为了赋予其水溶性,将P1 上的部分双键通过巯-烯click 反应得到羧基官能化的线型聚硫醚P2。其合成路线如图5 所示。具体合成步骤如下:将40mmol(双键含量)的P1、8mmol 的2,2-二甲氧基-2-苯基苯乙酮、32mmol 的3-巯基丙酸和20mL的无水NMP加入到50mL的单口瓶中,然后把溶液鼓30min氮气除去瓶内氧气,在365nm紫外灯下室温光照3h,得到部分侧链带有羧基的线性聚硫醚P2 混合物。再向混合物中加入饱和碳酸氢钠水溶液,直至不冒泡为止,使得侧基羧酸完全转化为羧酸钠。同时混合物中有大量白色固体析出,抽滤后收集滤液,将滤液装入到截留分子量为3500 的透析袋中,在去离子水中透析2天,期间每隔6h换一次水,最后经过冷冻干燥得到P2 为淡黄色的固体(7.91g, 收率83%)。

图5 线型聚硫醚P2的合成路线
1.3 银纳米颗粒的制备
Ag NPs@P2 采用简单有效的化学原位还原法制备(图6)。主要机理是以硝酸银为银源,P2 作为表面活性剂。在制备Ag NPs 的过程中,P2 聚合物链上含有大量的羧酸钠,具有一定的化学活性。当硝酸银加入到P2溶液时,P2能够与银离子形成羧酸银,把银离子束缚在P2 分子上,减弱了Ag+的游离能力。再加入还原剂时,Ag+被原位还原成银单质,使银原子具有很高的表面活性,在溶液中不断聚集成Ag NPs。由于P2 聚合物链上含有大量的硫原子,能够通过银-硫配位作用将Ag NPs包裹在其中,从而起到了很好的稳定和保护的作用。

图6 Ag NPs@P2的制备过程
具体操作如下:向100mL两口瓶中加入500mg的P2、0.25mmol 硝酸银与20mL 去离子水,搅拌0.5h 后用注射器向溶液中缓慢加入5mL 的1mol/L NaBH4水溶液,于室温下继续搅拌12h。反应结束后溶液由淡黄色变成黑色,标志着Ag NPs的形成。将混合溶液装入到截留分子量为3500 的透析中,用去离子水透析2天,期间每隔6h换一次水。最后变为红棕色的Ag NPs@P2 溶液,冷冻干燥后得到黑色固体。
1.4 AgNPs@P2/PAm复合水凝胶的制备
将0.6mmol 的KPS 与21mmol 的Am 溶于3.5mL去离子水中,称量5组相同的药品后再向其中分别加入30mg 的P2 和30mg、60mg、120mg、180mg 的Ag NPs@P2。将混合溶液分别转移至聚四氟乙烯材质的圆柱状模具中,在氮气气氛中65℃反应2h,即可得到5组Ag NPs@P2/PAm复合水凝胶样品。
1.5 AgNPs@P2/PAm复合水凝胶的抗菌实验
LB 液体培养基的配制:量取100mL 去离子水倒入250mL 锥形瓶中,加入2.5g 的LB 肉汤培养基混合均匀后,置于121℃高温高压蒸汽灭菌锅中灭菌15min后备用。
LB 固体培养基的制备:量取100mL 去离子水倒入250mL 锥形瓶中,加入2.5g 的LB 肉汤培养基和1.5g 琼脂粉,混合均匀后置于121℃高温高压蒸汽灭菌锅中灭菌处理15min。待培养基冷却至50℃左右,用移液管吸取15mL 培养基倒入一次性无菌表面皿中。
细菌悬液的制备:向两支12mL 细菌培养管中各加入3mL 的LB 液体培养基,再从大肠杆菌固体培养基上挑取单菌落接种于液体培养基中,另一支作为空白对照。放于200r/min恒温振荡器37℃下过夜培养15h。
抗菌性能测试:采用抑菌圈测试法,用无菌PBS 溶液将大肠杆菌菌液稀释至1×106CFU/mL,吸取100μL 均匀涂布于LB 固体琼脂培养基表面。将5组样品(8mm×5mm圆柱体)分别放至培养基上,并用无菌镊子轻轻按压,使样品与培养基充分接触。最后将培养皿转移至37℃恒温培养箱中培养24h。培养完成后测量记录各个抑菌圈大小,每组样品做3次平行实验。
1.6 Ag NPs@P2/PAm 复合水凝胶的力学性能实验
拉伸样品参照GB/T 1040—92 Ⅱ型标准制样,以GB/T 1040.3—2006 方法使用万能材料试验机对5 组样条的力学性能进行3 次平行测试,拉伸速度为100mm/min。
2 结果与讨论
2.1 Ag NPs@P2/PAm水凝胶的设计
Ag NPs@P2/PAm 复合水凝胶采用常规的自由基聚合制备(图7)。主要思路是:作为表面活性剂的P2 侧链还残留未反应完全的双键,与Ag NPs通过银-硫配位作用后得到的Ag NPs@P2可作为复合交联剂,将其与Am 及KPS 在水中混合溶解后,注入到聚四氟乙烯模具中,在氮气气氛中原位聚合得到Ag NPs@P2/PAm 水凝胶。该水凝胶中聚合物链与Ag NPs 通过银-硫相互作用“黏结”在一起,阻止Ag NPs沉降聚集,使其均匀分散在水凝胶中。除此之外,聚合物链中还含有氨基和羧基,这些基团之间和水会形成丰富的氢键,防止分子链滑移,保证水凝胶具有一定的力学性能,在使用过程中不易被损坏。
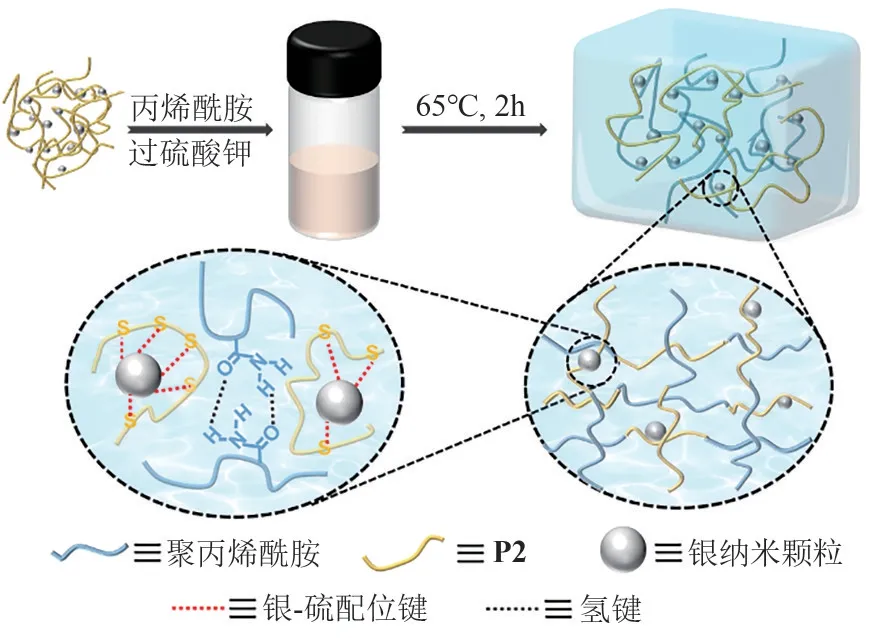
图7 Ag NPs@P2/PAm复合水凝胶的合成工艺及内部结构
2.2 线性聚硫醚P1和P2的结构表征
线性聚硫醚P2 是通过P1 巯-烯click 化学反应得到。由图8中可以看出,在3000cm-1附近出现了不饱和双键—C—H伸缩振动峰,1713~1615cm-1为不饱和双键C= = C上的伸缩振动峰。然后将P1上的部分双键与3-巯基丙酸在无水无氧的条件下进行巯-烯click 化学反应,为P1 引入足够的羧基,此时P1 的水溶性还相对较弱。再将羧基与过量的碳酸氢钠反应,溶液透析后呈碱性,得到水溶性的线性聚硫醚P2。从图8 可以看到在1572cm-1和1415cm-1出现了羧酸盐的吸收特征峰。证明在P2聚合物链上成功引入羧酸基团。

图8 P1与P2的红外光谱
2.3 Ag NPs@P2形貌与结构表征
通过TEM 对Ag NPs@P2 的形貌和尺寸进行了表征。从图9可以观察到产物近似球形颗粒,且粒径范围为5~20nm。粒径尺寸分布不均匀可能是因为NaBH4的还原性较强,硝酸银被还原成银原子的速率较快,银原子之间的碰撞频率增加,颗粒尺寸迅速增大,发生聚集后就会形成尺寸较大的颗粒。由于线性聚硫醚P2 的存在,较大尺寸的颗粒可能基于银-硫配位作用而被刻蚀成小尺寸Ag NPs。

图9 Ag NPs的TEM图像
还通过X 射线光电子能谱(XPS)对合成的Ag NPs@P2做进一步的测试和表征。如图10所示,结合能为367.7eV 和373.6eV 分别对应着Ag0的Ag 3d5/2与Ag 3d3/2,证明了Ag NPs 的形成。此外,其Ag 3d5/2的结合能要小于不含表面活性剂的Ag NPs(368.5eV),而结合能为163.1eV 对应着S 2p,略高于典型的硫醇盐S 2p的结合能(162.0eV),这些结果表明银与硫之间形成了配位键,最终被还原的产物为Ag NPs@P2。与传统的Ag NPs相比,基于银-硫配位作用P2 聚合物上的硫原子能够保证其稳定性。

图10 Ag NPs@P2中Ag 3d与S 2p的XPS图
2.4 Ag NPs@P2/PAm水凝胶的结构与形貌表征
通过热场发射扫描电子显微镜对液氮焠断后冷冻干燥的凝胶样品横断面进行形貌表征,观察到规整的网络多孔结构,这是典型的干凝胶形貌[图11(a)],多孔结构为Ag NPs 或Ag+的移动和扩散提供了空间。通过对同一处横断面进行元素分布分析来研究Ag NPs 的分布情况,可以看出来自Ag NPs@P2 的Ag 和S 元素均匀分布在水凝胶中[图11(b)~(d)],则证明了Ag NPs@P2 与单体Am 聚合过程中没有发生聚集。

图11 Ag NPs@P2/PAm水凝胶的SEM图及Ag和S复合、Ag和S的元素分布图
使用Ag NPs@P2 作为交联剂有两个优点:一方面,亲水性的P2 用于表面改性Ag NPs;另一方面,Ag NPs@P2本身作为交联剂,可以在聚合后均匀分散到整个水凝胶网络中。
2.5 Ag NPs@P2/PAm复合水凝胶的抗菌性能
受伤的皮肤容易受到细菌的侵害而造成细菌感染,不利于伤口愈合,使用抗菌水凝胶可以有效防止伤口感染,促进伤口愈合[24]。选取常用的大肠杆菌作为菌种来源,对Ag NPs@P2/PAm 复合水凝胶进行抗菌性能测试。由图12可知,5组测试样品对大肠杆菌均有显著的抗菌效果,其中质量分数为2%的Ag NPs@P2/PAm水凝胶抑菌圈直径最大,直达19mm(表1)。随着Ag NPs@P2含量的增加,抑菌圈直径先增大后减小。这是因为水凝胶的交联密度随着Ag NPs@P2 含量的增加而增加,导致相同直径但孔径尺寸较小的水凝胶内部Ag NPs或Ag+很难扩散到培养基表面。除此之外,交联密度增加,水凝胶的溶胀响应速率减慢,24h后体积变化逐渐不明显。而交联密度低的水凝胶体积增大速率较快,其孔隙尺寸的增长速率也相对较快,使得Ag NPs或Ag+能够以更快的速度扩散到细菌培养基上,所以抑菌圈较大。

表1 5组样品的抑菌圈直径
然而到目前为止,Ag NPs 的抗菌机制仍然饱受争议。针对于Ag NPs@P2/PAm 水凝胶,Ag NPs的抗菌机制可能是其在水凝胶和溶液中难免会部分氧化成Ag+,Ag NPs 和Ag+再与带负电的细菌细胞壁反应,导致细菌细胞壁和细胞膜结构发生变化,细胞膜的渗透性改变引起了细胞质的成分流失。不仅如此,更方便了Ag NPs和Ag+进入细胞质中,可以抑制DNA 结构复制以及各种酶的活性,最终多种作用机制共同产生抑菌效果。
值得注意的是,未加入Ag NPs 的水凝胶在大肠杆菌培养基上也会产生抑菌圈,直径为9mm(表1),甚至比添加质量分数为8%的Ag NPs@P2水凝胶的抑菌圈还要大。这可能是由于P2 聚合物链上有带正电的阳离子,使带负电的细菌吸附在其表面,依靠静电作用和氢键配位作用与绝大部分的细菌结合,两者结合后很难产生变异,最终破坏细菌的细胞膜,导致细菌死亡,从而具有一定的抑菌能力。
其中Ag NPs@P2 的含量是相对于单体的质量比,而质量分数为0的AgNPs@P2是用质量分数为2%的P2代替,不含Ag NPs。
2.6 Ag NPs@P2/PAm复合水凝胶的力学性能
抗菌水凝胶不仅要具备良好的抗菌能力,还要具有一定的力学性能,防止其在使用过程中受到外力作用时遭到损坏。于是对5 组不同含量的AgNPs@P2水凝胶进行了力学性能测试,图13表明加入Ag NPs@P2 可显著改善水凝胶的拉伸性能。且抗菌效果最好的水凝胶(质量分数2%)的拉伸强度为0.12MPa,比皮肤的杨氏模量(0.01~0.1MPa)稍大一些。在一定范围内提高Ag NPs@P2负载量,水凝胶的断裂强度和断裂伸长率会同时增加,这是因为交联密度增加且Ag NPs 在水凝胶中可以通过耗散能量来减弱应力集中效应产生的影响。

图13 Ag NPs@P2/PAm水凝胶在不同质量分数的AgNPs@P2含量(0~12%)条件下的应力-应变曲线
未掺杂Ag NPs只有P2作为交联剂的PAm水凝胶具备一定的强度是因为其中包含物理交联作用和氢键作用,而掺杂Ag NPs@P2的水凝胶会基于银-硫配位作用显著提高其断裂伸长率。当交联剂增加至质量分数为12%时,水凝胶断裂强度增强,但断裂伸长率减小。这是因为交联密度过高会抑制分子链间的滑移,使水凝胶无法充分耗散内部应力,反而造成应力集中,更容易断裂。总而言之,掺入Ag NPs@P2可以有效改善PAm水凝胶的力学性能。
3 结论
由于P2的存在,硼氢化钠将硝酸银原位还原成Ag NPs,避免了其他表面活性剂的污染。XPS和TEM 证实了成功制备出Ag NPs,粒径尺寸基本上小于20nm,且XPS分析证明Ag NPs与表面的P2聚合物链中的硫元素形成银-硫配位键。SEM 说明Ag NPs@P2与单体丙烯酰胺在聚合过程中未发生团聚现象,改善了无机纳米颗粒与有机聚合物间的相容性。抗菌实验结果表明即使只添加P2的PAm 水凝胶也具备一定的抗菌能力,而负载质量分数为2%的Ag NPs@P2抑菌效果最好,因此Ag NPs@P2/PAm 水凝胶具有协同抗菌的能力。且添加Ag NPs@P2的水凝胶会形成致密的网络,可以提高水凝胶的力学性能,使其拥有与人体皮肤相当的杨氏模量(0.01~0.1MPa),有望应用于皮肤抗菌敷料等领域。通过该方法制备的抗菌水凝胶克服了传统抗生素水凝胶的耐药性问题,为制备新型协同抗菌水凝胶提供了一种新思路。
符号说明
J—— 耦合常数,Hz
Mn—— 数均分子量,kDa
δ—— 峰的化学位移

