一锅法一次性合成片状羟基磷灰石及其对废水中铀的去除性能及机理研究
辛燕 ,赵毅 ,樊小磊,3,4
(1.东华理工大学 水资源与环境工程学院,江西 南昌 330013;2.东华理工大学 核资源与环境国家重点实验室,江西 南昌 330013;3.江西省地质局,江西 南昌 330001;4.核工业华东建设工程集团有限公司,江西 南昌 330000)
0 引言
铀矿石的开采和乏燃料的后处理会产生大量含铀废水,而铀作为一种天然放射性金属元素,如不对含铀废水进行有效的处理,可能对人体及动植物健康造成危害[1-5]。去除废水中铀的方法有很多,如生物修复法、膜过滤法、离子交换法及吸附法等[6-8]。其中,由于吸附法具有效率高、操作简单、成本低等优势,已成为处理含铀废水的常用方法[9-14]。
羟基磷灰石(Ca10(PO4)6(OH)2,HAP)具有特殊的结构,钙离子容易与金属阳离子发生离子交换而被取代[1]。另外,作为生物材料,HAP 具有无毒、环保、羟基丰富、比表面积大及成本低等优点,已被广泛用于溶液中重金属的去除[11]。HAP 对铀的去除在国内已有相关文献报道,陈朝猛等[12]研究两步合成HAP,先制备CaHPO4,后加入Ca(OH)2并调节溶液pH 值,合成温度高达120 ℃,连续加热24 h,该方法存在制备工艺较复杂且成本高等问题;潘志平等[15]报道HAP 处理10 mg·L-1铀时,其用量较大,需达到1.0 g·L-1,造成HAP 使用成本的增加;张益硕[1]等制备的HAP,采用Ca(NO3)2为合成原料,而未完全反应的Ca(NO3)2具有燃爆性、刺激性及氧化性,对环境会产生负面影响。但上述文献均缺乏对HAP 吸附铀机理的详细描述且未进行HAP 的重复利用试验,因此,如何提高HAP 对铀的吸附效率、降低其制备的难度、使用绿色环保的合成原料、控制材料制备成本及研究其对铀的吸附机理和循环性能,已成为亟需解决的问题。
试验选用成本低廉的绿色天然原料CaCO3作为合成原料以代替以往文献使用的Ca(NO3)2,采用一锅法一次性合成羟基磷灰石(OP-HAP),通过SEM、EDS、FTIR、XRD、XPS 对OP-HAP 的表面形貌、元素组成、结构及官能团等进行了表征,并考察了各因素对OP-HAP 吸附铀的影响,最后探讨了OP-HAP 的循环性能和详细吸附机理,以期为含铀废水处理提供一种制备简单、成本低、无二次污染且去除效果好的功能化吸附材料。
1 试验部分
1.1 低浓度含铀废水
低浓度含铀废水的配制[2]:采用精密移液管移取10 mL 浓度为1 000 μg/mL 铀标准溶液并转入1 000 mL 容量瓶中,采用超纯水定容后即可获得10 mg/L 的低浓度含铀废水。试验所用不同铀浓度模拟含铀废水均采用稀释法稀释后得到,并采用ICP-OES 测定稀释后的铀浓度。
1.2 主要试验试剂与仪器
铀标准溶液,1 000 μg/mL,购自北京世纪奥科生物技术有限公司;CaCO3,购自天津市华盛化学试剂有限公司;(NH4)2HPO4,购自西陇科学。
扫描电子显微镜SEM(德国ZEISS Sigma 300)、X 射线衍射仪XRD(德国Bruker D8 Advance)、傅立叶红外光谱FTIR(美国Thermo Scientific Nicolet 6700)、X 射线光电子能谱仪XPS(美国Thermo Scientific ESCALAB Xi +)、HNY-303 型水浴振荡器(南北科仪)、BPZ-6933LC 型真空干燥箱(上海一恒)、奥立龙410C-01A 型pH 计(美国Thermo Scientific)、Agilent 5100 型电感耦合等离子体发射光谱仪(美国ICP-OES)、固体表面Zeta 电位测试仪(奥地利Anton Paar)。
1.3 OP-HAP 的制备及表征
具体合成方法为:取适量的CaCO3和(NH4)2HPO4并置于合适体积的超纯水中,使得钙磷比约为1.67,在363.15K下振荡 240 min,在室温(298.15 K)下老化12 h,得到白色沉淀物,离心过滤分离,超纯水洗净,最后在353.15 K 下真空干燥12 h,即可获得OP-HAP。主要反应见式(1)。
采用SEM、FTIR、XRD、XPS 对OP-HAP 形貌、官能团、物相及吸附机理进行分析。
1.4 OP-HAP 对铀的吸附
将一定量的OP-HAP 置于50 mL 盛有不同铀浓度铀溶液的锥形瓶中,在合适温度下振荡吸附。振荡一定时间后离心取上清液,并用0.22 μm 滤膜过滤去除溶液中悬浮的OP-HAP。采用ICP-OES测定过滤后溶液中剩余的铀浓度。按照公式(2)~(3),计算OP-HAP 对铀的吸附率(R,%)和单位质量吸附量(qe,mg·g-1)。
式中:C0为铀(Ⅵ)初始浓度,mg·L-1;Ce为吸附平衡时铀(Ⅵ)浓度,mg·L-1;m为OP-HAP 的用量,g;V为铀溶液体积,L。
2 试验结果与讨论
2.1 OP-HAP 的表征
2.1.1 X 射线衍射分析(XRD)
如图1 所示,OP-HAP 吸附铀前的衍射峰与HAP 一致,OP-HAP 吸附铀后除包含羟基磷灰石的特征峰外,在10.856°、16.103°、18.086°、24.458°出现了新的特征峰,通过与标准卡片对比,新的特征峰为钙铀云母(Ca(UO2)2(PO4)2·3H2O)[16-17],其新特征峰的存在表明铀成功被OP-HAP 所吸附,且吸附后原有特征峰衍射强度呈下降趋势,这表明OPHAP 吸附铀的过程中存在材料的消耗[18]。

图1 OP-HAP 吸附铀前后的XRD 图谱Fig.1 XRD patterns of OP-HAP before and after uranium adsorption
2.1.2 扫描电镜(SEM)与能谱分析(EDS)采用SEM 观察OP-HAP 及OP-HAP 吸附铀后的表面形貌,如图2 所示。由图可看出,在相同放大倍数下,OP-HAP 表面为相对疏松的层状结构且有孔隙的存在(图2(a)),这不同于传统羟基磷灰石常见的杆状结构[1],表面疏松的材料会对金属阳离子产生较强的吸附作用[19],疏松的结构有利于羟基磷灰石析出大量的,这有利于OP-HAP 与铀发生溶解沉淀反应。OP-HAP 吸附铀后表面发生明显改变,表明有新的物质生成并沉积在OPHAP 表面,基于本研究吸附的为纯的铀酰离子并结合上述XRD 表征,推测该结晶化合物可能为钙铀云母(Ca(UO2)2(PO4)2·3H2O)。

图2 OP-HAP 吸附铀前后的SEM图Fig.2 SEM images of OP-HAP before and after uranium adsorption
为初步研究OP-HAP 对铀的吸附机理,需对OP-HAP 吸附前后分别进行EDS 分析,见图3 和表1。OP-HAP 中钙磷比约为1.68,接近羟基磷灰石的钙磷比1.67,除了O、Ca、P 元素外,OP-HAP 中还出现了C 元素,这可能是由于OP-HAP 样品制备过程中吸附了大气中的CO2所致或来自合成原料方解石(碳酸钙)中碳酸根,以上得出通过一锅法一步合成的OP-HAP 为钙磷系化合物,结合XRD、SEM及EDS 的表征表明羟基磷灰石已成功制备。OPHAP 吸附铀后可看到铀的存在,同时,OP-HAP 表面Ca、P、O 元素的质量分数均发生了变化,表明Ca、P 及O 元素可能参与了OP-HAP 吸附铀的过程。

图3 OP-HAP 吸附铀前后的EDS 分析Fig.3 EDS analysis of OP-HAP before and after uranium adsorption
2.1.3 红外光谱分析(FTIR)
对OP-HAP 吸附铀前后进行红外分析(FTIR),以了解吸附铀前后OP-HAP 表面官能团变化情况以揭示其部分吸附机理。图4 为OP-HAP 吸附铀前后的红外光谱表征分析。566 cm-1和603 cm-1处的特征峰为PO3-4 中的P—O 基团的弯曲振动[20]。一般伸缩振动的能量高于弯曲振动,因此,960 cm-1处的峰对应于ν2 O—P—O 基团弯曲振动而1 031 cm-1对应ν3 P—O 基团伸缩振动[21]。出现1 542 cm-1及1 417 cm-1处的峰,根据EDS 分析及文献[22]的报道可知,此处的2 个特征峰应为,结合XRD 可知并不影响OP-HAP 的纯度。3 446 cm-1和1 645 cm-1处的吸收峰属于羟基的伸缩振动。这些特征峰的出现表明OP-HAP中含有羟基和磷酸盐,再结合XRD、SEM 及EDS 的表征可进一步得出羟基磷灰石已合成成功。值得注意的是,OP-HAP 吸附铀后在923 cm-1处出现一个新的伸缩振动峰,该峰归属于[ =O U =VI O]2+的振动[23],且566 cm-1,603 cm-1,960 cm-1,1 031 cm-1处的基团的特征峰变小,这可能是因为铀可与基团发生化学结合所导致[24]。

图4 OP-HAP 吸附铀前后的红外光谱Fig.4 Infrared spectra of OP-HAP before and after uranium adsorption
2.2 OP-HAP 吸附铀的性能测试
2.2.1 混匀速率与方式的影响
固定试验条件:铀初始浓度为10 mg·L-1,OPHAP 用量0.005 g(0.1 g·L-1),室温(298.15 K),吸附时间24 h,pH=5.0,考察振荡转速和振荡方式对OP-HAP 吸附铀效果的影响,如图5 所示。

图5 振荡速率对铀吸附率的影响Fig.5 The influence of oscillation rates and types on uranium adsorption rate
从图5 可以看出,不同混匀方式对OP-HAP 去除铀的影响不明显,3 种混匀方式对铀的最大吸附率均为94%左右,铀的吸附率均为随着转速的提高(或增加)先升高后降低。这是因为在室温下,随着振荡转速的增加,水样中的铀更易与OP-HAP 充分接触而被吸附去除,转速过高时,OP-HAP 的外部膜传质阻力随着振荡速率的扩大而减少,导致铀与OP-HAP 接触时间不足以扩散到OP-HAP 的内部孔隙中,继而铀脱离OP-HAP 的表面[1],OP-HAP的有效利用率降低,且转速过大时,部分OP-HAP会被振荡到锥形瓶瓶口而未起作用。后续试验采取回旋振荡,振荡转速为165 r/min。
2.2.2 初始浓度对OP-HAP 吸附铀的影响
固定试验条件:OP-HAP 用量0.005 g(0.1 g·L-1),室温(298.15 K),吸附时间24 h,振荡转速165 r/min,pH=5.0,考察铀初始浓度对OP-HAP 吸附铀效果的影响。
吸附材料去除重金属离子存在最大处理浓度极限又存在最小处理浓度的极限,因此有必要考察初始浓度对吸附材料的影响。图6 为初始浓度对OPHAP 去除铀的影响。图6 可知,在铀初始浓度为5 mg·L-1时,OP-HAP 对铀的吸附率为98.36%,表明其对低浓度含铀废水具有较强的吸附能力,后随着铀初始浓度的提升,OP-HAP 对铀的吸附率下降,但吸附量几乎呈直线上升。这是因为铀的初始浓度是克服水中铀与OP-HAP 之间传质阻力的重要驱动力,铀浓度越高,梯度越大,驱动力增强,促进了铀向OP-HAP 表面及内部的扩散,从而增加了吸附材料的吸附量;但单位质量的OP-HAP 由于吸附位点有限,因此其对铀的吸附率下降[1],另外文献[15]认为高浓度的铀酰离子容易水解,同样导致材料对铀的去除率下降。
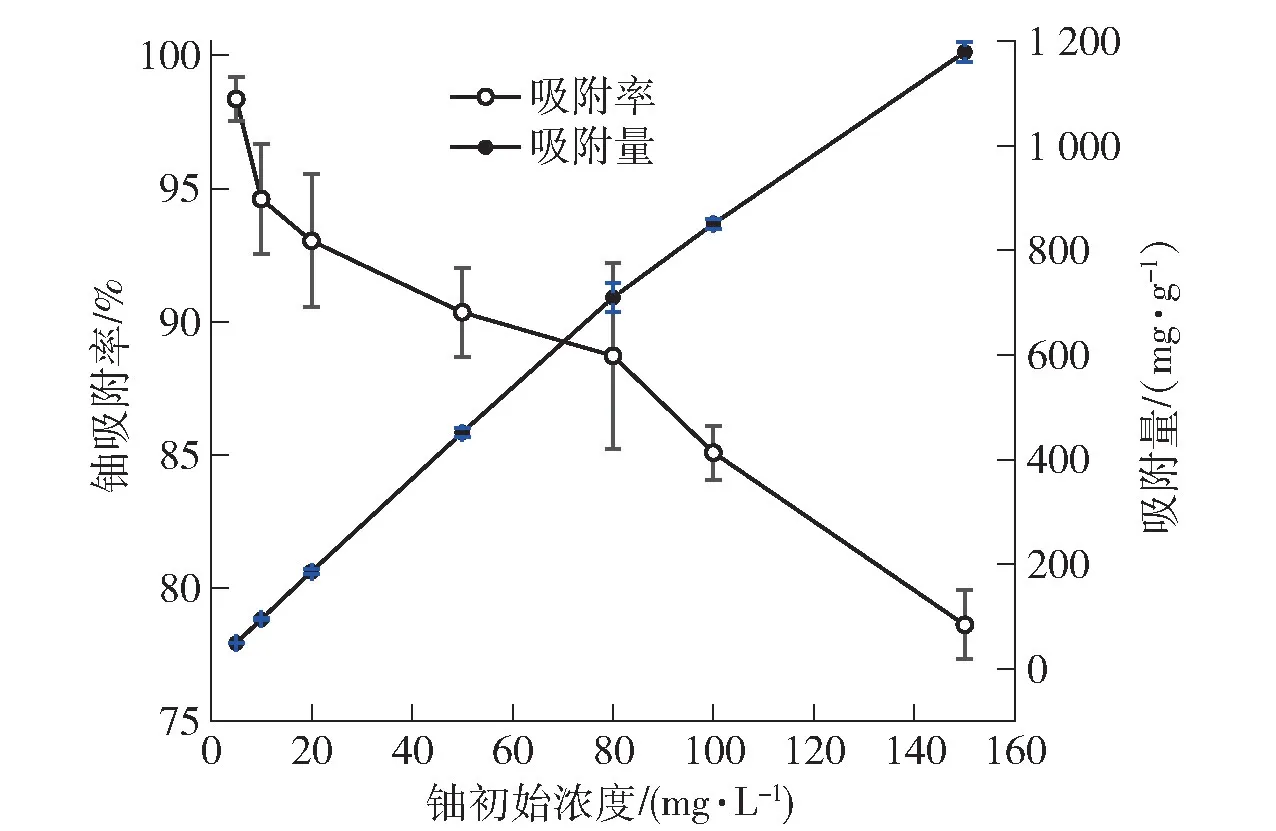
图6 铀初始浓度的影响Fig.6 The influence of initial uranium concentration
2.2.3 温度对OP-HAP 吸附铀的影响
固定试验条件:铀初始浓度为10 mg·L-1,OPHAP 用量0.005 g(0.1 g·L-1),吸附时间5 min,振荡转速165 r/min,考察铀溶液温度对OP-HAP 吸附铀效果的影响。结果如图7 所示。由图7 可知,在吸附时间较短时,温度也会影响铀的吸附率,当温度为298.15~338.15 K 时,OP-HAP 对铀的吸附率随着温度的升高而增加,这可能是由于OP-HAP 对铀的吸附是吸热反应,即温度升高会促进铀在OPHAP 表面的扩散[1],初步推断OP-HAP 对铀的去除主要以化学吸附为主[19]。考虑处理成本,后续试验温度选择室温(298.15 K)进行。

图7 温度对OP-HAP 吸附铀效果的影响Fig.7 The influence of temperature on uranium adsorption rate
2.2.4 初始pH 值对OP-HAP 吸附铀的影响
固定试验条件:铀初始浓度为10 mg·L-1,OPHAP 用量0.005 g(0.1 g·L-1),室温(298.15 K),吸附时间90 min,振荡转速165 r/min,通过盐酸与氢氧化钠调节溶液pH 值,考察铀溶液初始pH 值对OP-HAP 吸附铀效果的影响。
铀溶液体系的pH 值是影响OP-HAP 吸附性能的主要因素之一,其不仅影响吸附材料表面电荷、离子化程度,还影响铀在水溶液中的化合价态,从而导致吸附材料在不同酸度条件下的吸附性能差异较大。在不同pH 值条件下,OP-HAP 对铀的吸附效果如图8 所示。图8(a)得出,在合适的酸性条件下OP-HAP 对铀的吸附效果较好。将溶液pH 值从2.0 增加到5.0 会显著提高OP-HAP 的吸附性能,吸附率从16.87%提升至94.16%,后随着溶液pH值从5.0 升至11.0,铀的吸附率呈下降趋势,当pH=11.0 时,铀的吸附率仅为24.71%。图8(b)可看出OP-HAP 的零点电荷测量值为4.92 mV,当溶液pH 值低于4.92 时,OP-HAP 所带表面电荷为正,这是因为羟基磷灰石在含铀溶液中存在式(4)、式(5)的化学平衡[25],当酸性较强时,≡Ca—OH与≡P—O-基团会消耗水溶液中的H+,两者化学平衡右移,OP-HAP 表面的磷酸盐基团和羟基钙会发生质子化导致羟基磷灰石稳定性下降,其表面带负电荷的活性因子下降导致OP-HAP 表面带正电,造成OP-HAP 表面电荷发生转化。此时,铀在水溶液中的存在形式以为主[20],带正电荷的羟基磷灰石会与带正电荷的铀产生静电斥力,影响材料表面官能团的配合作用,且H+和带正电荷的铀之间存在竞争吸附作用,再者H+可与结合占据孤对电子,转化为对铀吸附能力较弱的以上原因共同导致材料对铀吸附性能的下降。后随着pH 值增加至5.0,H+的浓度下降,材料表面的活性基团去质子化其表面的负电荷活性因子恢复,OP -HAP 表面呈负电且重新转换为,这有利于对带正电的UO2OH+进行吸附去除[15],导致pH=5.0 时,其对铀的吸附率较高。pH 值继续升高,OP-HAP 对铀的吸附率迅速下降,这主要是因为铀的形态转变为稳定的铀配合物(UO2CO3),OP-HAP 对其的吸附亲和力较低[20]。pH >7.0 时,发生水解生成等多核氢氧化合物[26],与带负电荷的OP-HAP 静电排斥增大,而pH 值过高会促进氢氧化物钝化层的形成,且H+减少会影响OP-HAP 的溶解沉淀反应[18],导致吸附率下降。以上分析可以得出,弱酸下有利于OP-HAP 对铀的吸附。因此,pH=5.0 为OP-HAP 吸附铀的最佳pH 值。

图8 (a)溶液初始pH 对OP-HAP 去除铀的影响,(b)OP-HAP 样品的Zeta 电位Fig.8 The influence of initial solution pH on uranium removal by OP-HAP (a),Zeta potential of OP-HAP samples (b)
2.2.5 吸附时间的影响
固定试验条件:铀初始浓度为10 mg·L-1,pH=5.0,室温(298.15 K),OP -HAP 用量0.005 g(0.1 g·L-1),振荡转速165 r·min-1,考察吸附时间对OP-HAP 吸附铀效果的影响,结果见图9。

图9 吸附时间对OP-HAP 吸附铀的影响Fig.9 The influence of adsorption time on uranium adsorption by OP-HAP
由图9 可知,吸附时间对OP-HAP 吸附铀的影响很大,在吸附开始至60 min 前,OP-HAP 对铀的吸附率随时间的增长呈上升趋势,60 min 后吸附率基本不变,表明OP-HAP 对铀的吸附达到动态平衡。在吸附开始阶段,OP-HAP 表面有大量的活性位点及存在足够的可交换离子,吸附率迅速增加,随着吸附的进行,水中的铀浓度逐渐减小,活性位点逐渐被消耗其吸附位点逐渐减少,可交换离子浓度下降,吸附率增长缓慢直至基本稳定。为保证对铀较高的吸附率,OP-HAP 对10 mg·L-1铀的吸附最佳时间定为90 min。
2.2.6 OP-HAP 用量的影响
固定试验条件:铀初始浓度为10 mg·L-1,pH=5.0,室温(298.15 K),吸附时间90 min,振荡转速165 r·min-1,考察吸附材料用量对OP-HAP 吸附铀效果的影响,结果见图10。
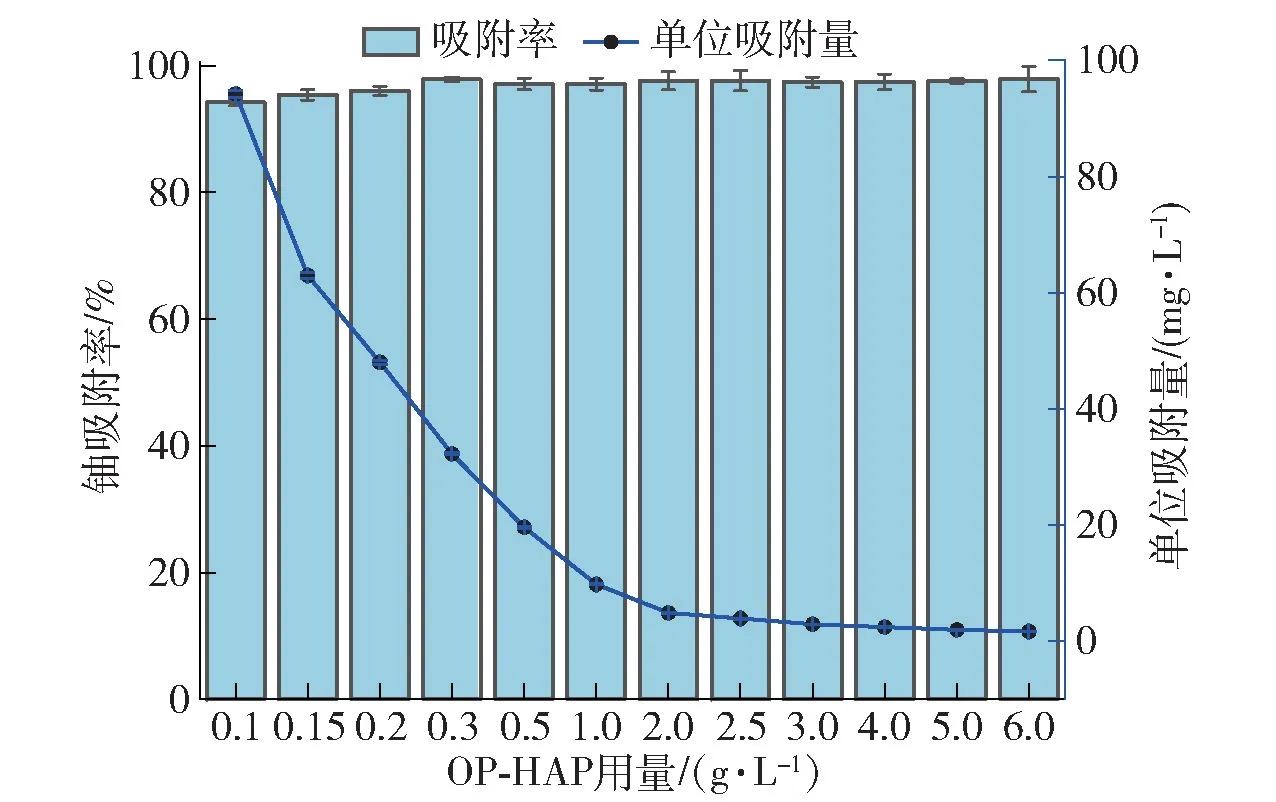
图10 吸附材料用量对OP-HAP 吸附铀的影响Fig.10 The influence of adsorbent dosage on uranium removal by OP-HAP
吸附材料的用量决定了吸附铀过程中有效结合位点的数量,需保证在达到吸附率要求的同时使OP-HAP 的用量最优化。从图10 可以看出,随着OP-HAP 用量逐渐增加,铀的吸附率不断增加,在用量为0.3 g·L-1时达到最高值,吸附率高于97%,而文献[12]报道的HAP 对铀的最大吸附率仅为95%左右。当用量超过0.3 g·L-1后,吸附率曲线趋于平衡状态,这是因为随着OP-HAP 用量的增加,OPHAP 有效活性位点数目增多,对铀的吸附率就会增大,当OP-HAP 用量超过0.3 g·L-1时,由于铀浓度的下降使得多余吸附位点处于空置状态,铀去除率增加缓慢直至不再增加。而吸附材料用量的增加引起单位质量OP-HAP 的吸附量降低,即用量的增加使铀溶液中的铀酰离子不能完全覆盖OP-HAP 上所有可交换位点,并且用量过高还会存在颗粒间黏结力和结合位点的干扰[27]。综合考虑单位吸附量、成本及吸附效果,选择0.3 g·L-1为OP-HAP 最佳用量,该结果远低于潘志平等[15]研究的最佳用量1.0 g·L-1。
2.3 正交试验
保持转速为165 r·min-1,进行OP-HAP 吸附铀的正交试验。正交试验设计见表2,正交试验结果见表3。
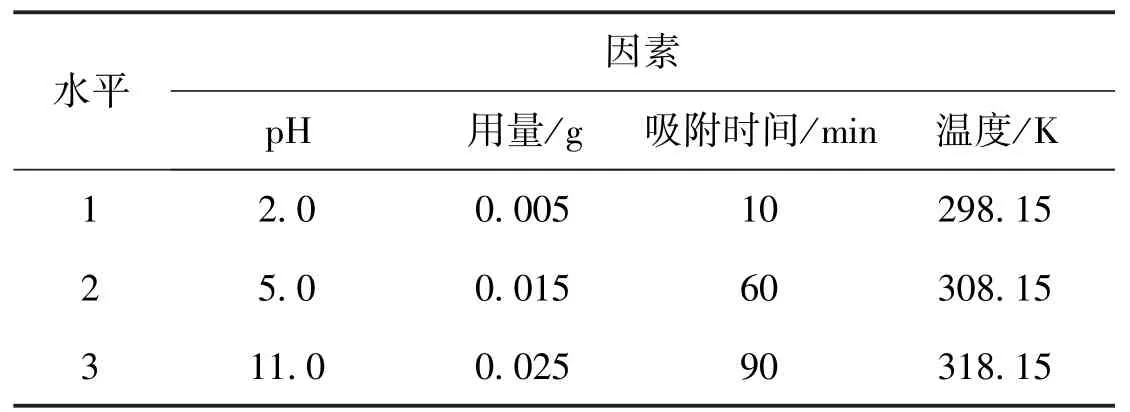
表2 正交试验设计Table 2 Orthogonal experimental design
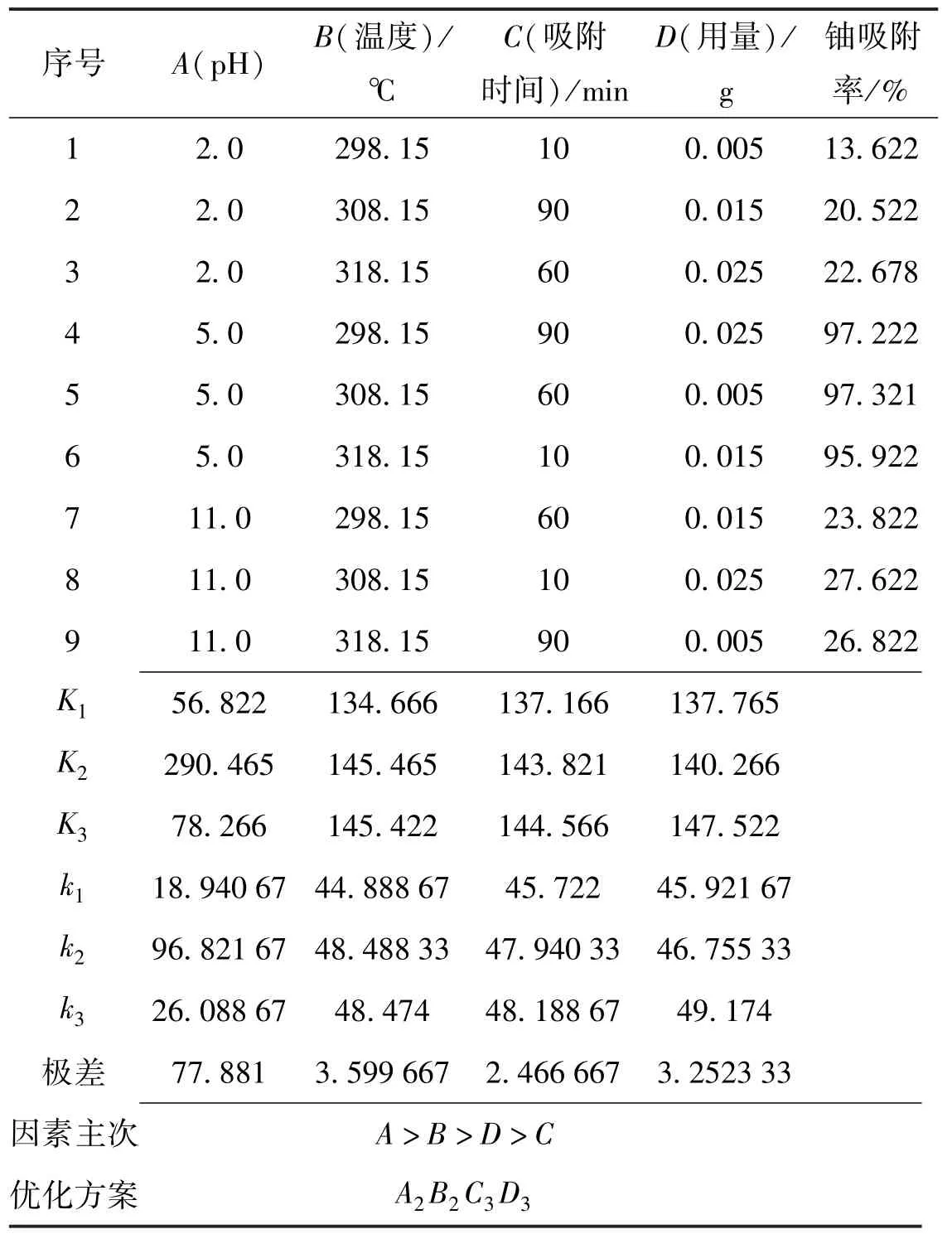
表3 正交试验结果Table 3 Orthogonal experimental results
由表3 中的极差可以看出,各因素作用主次顺序依次为pH 值、温度、用量、吸附时间,表明在转速固定时,pH 对OP-HAP 吸附10 mg/L 铀的影响最大,其次是温度、用量、时间。由此得出工程实际应用中需特别注意pH 对OP-HAP 吸附铀的影响。
2.4 验证性试验
在控制溶液pH=5.0、转速为165 r·min-1、铀初始浓度10 mg·L-1,OP-HAP 用量0.3 g·L-1,吸附时间90 min、室温(298.15 K)的优化条件下进行综合试验,考察OP-HAP 吸附的稳定性,结果见表4。可以得出,3 组试验对铀的平均吸附率为97.2%,表明OP-HAP 对低浓度含铀废水在最佳条件下的吸附具有较好的稳定性。
3 吸附模型研究
3.1 吸附等温线分析
吸附等温线可反映在一定温度下吸附达到平衡时铀在液相与吸附材料之间的浓度分布关系,其是了解铀与OP-HAP 之间相互作用的重要因素。本节分别绘制Langmuir(6)、Freundlich(7)及Temkin(8)等温线,拟合结果如图11 和表5 所示。上述吸附模型及无量纲平衡参数RL的表达式见(6)~(9)。

表5 OP-HAP 吸附铀的等温线模型参数Table 5 Isotherm model parameters for uranium adsorption by OP-HAP

图11 吸附模型拟合结果Fig.11 Adsorption model fitting results
式中:qe为单位质量吸附量,mg·g-1;Ce为吸附平衡时溶液中吸附质的质量浓度,mg·L-1;KL为Langmuir 常数,L·mg-1;KF为Freundlich 常数,L·g-1;n为吸附指数;b为与吸附能量变化的Temkin 常数;R为气体常数,8.314 J·mol-1·K-1;AT为Temkin 模型等温线常数,J/(mol·K);qm为最大吸附容量,mg·g-1。
图11 和表5 得出Langmuir 模型得到的相关系数最高,因此可以认为单分子层吸附为OP-HAP 吸附铀的主要过程,即OP-HAP 对铀的吸附可能是发生在均质表面,并以单分子层吸附的形式进行[28]。另外,从Temkin 等温线拟合曲线得到的R2也相对较好,表明吸附过程中结合能分布较均匀。当无量纲平衡参数RL在0~1 时,可认为吸附过程较易进行[1],通过式(9)计算OP-HAP 的分离系数(RL)如表6 所示,其RL全部位于0~1 之间,表明OP-HAP对铀的吸附较易进行[29]。

表6 不同铀浓度下Langmuir 等温吸附模型RLTable 6 Langmuir isotherm adsorption model RL values at different uranium concentrations
3.2 吸附动力学分析
为了进一步研究OP-HAP 吸附铀的行为,对其进行吸附动力学分析。分别采用Lagergren 准一级动力学、Lagergren 准二级动力学、Elovich 动力学和颗粒内扩散动力学模型拟合OP-HAP 吸附10 mg·L-1铀的动力学过程,各动力学方程表达式分别见(10)~(13)。
式中:qe和qt分别为平衡时和t时刻OP-HAP 对铀(Ⅵ)的吸附容量,mg·g-1;t为吸附时间,min;k1为准一级动力学模型参数,min-1;k2为准二级动力学模型参数,g·mg-1·min-1;a为初始吸附速率常数,mg·(g·min)-1;B为脱附速率常数,g·mg-1;C为截距;ki为颗粒内扩散速率常数,mg·g-1·min-0.5。
图12 和表7 得出以下结论。①Lagergren 准二级动力学模型相较于Lagergren 准一级动力学、Elovich 动力学及颗粒内扩散模型具有较高的相关系数(R2=0.999 49),且准二级动力学模型计算的吸附容量qe,cal=95.694 mg·L-1与试验所得吸附容量(94 mg·L-1)较接近,因此,可以认为准二级动力学模型可更好描述OP-HAP 吸附铀的过程,可得出OP-HAP 对铀的吸附是一种化学反应,其中可能涉及OP -HAP 与铀之间的强螯合与离子交换作用[30]。②Elovich 动力学模型R2=0.983 67,相关系数也较高,这表明OP-HAP 对铀的吸附是以化学吸附为主导的非均相扩散过程。③采用颗粒内扩散模型来拟合试验数据,qt与t0.5具有三元线性关系,表明铀在OP-HAP 上的吸附可能存在3 个过程:首个吸附过程发生在1 <t0.5<3.16 的过程,吸附较快,这归因于OP-HAP 外表面上具有丰富的吸附点位;当OP-HAP 外表面被消耗后,开始第二个吸附阶段(3.87 <t0.5<7.07),此时吸附过程主要为内部扩散;最后出现平台阶段,即OP-HAP 对铀的吸附达到平衡阶段,比较吸附速率发现Ki1(17.363 01)远高于Ki2(1.451 15)和Ki3(0.214 74),表明速率限速步骤为内扩散[20]。内部颗粒扩散模型未过原点(C≠0),又表明内扩散不是控制OP-HAP 吸附铀的唯一过程,表明吸附速率还受其他因素的影响,还可能受沉淀、膜扩散及离子交换的影响[1]。

表7 OP-HAP 吸附铀的动力学模型拟合参数Table 7 Fitting parameters of kinetic models for uranium adsorption by OP-HAP

图12 动力学模型Fig.12 Kinetic model
3.3 吸附热力学分析
为了更好验证OP-HAP 对铀吸附的可行性,对OP-HAP 吸附铀进行热力学分析。
根据式(14)~(16)计算3 个热力学参数的具体数值:自由能变化(ΔG0),焓变化(ΔH0)和熵变化(ΔS0)。
式中:K0为分配系数;Ce为吸附平衡时溶液中吸附质的质量浓度。
图13 和表8 可得出,随着温度的增加,ΔG0逐渐降低且小于0,表明OP-HAP 吸附铀是自发的过程。ΔS0>0,证明OP-HAP 吸附铀的过程中,其固液界面上的随机性增加。ΔH0为正值,表明该吸附过程为吸热反应。此 外,ΔH0=25.458,位 于20.09~418.40 kJ·mol-1,表明铀在OP-HAP 上的吸附主要是化学吸附[31],也验证了Lagergren 准二级动力学的拟合结果。得出,OP-HAP 对铀的吸附是自发吸热且以化学吸附为主的过程。

表8 铀在OP-HAP 上吸附的热力学参数Table 8 Thermodynamic parameters of uranium adsorption on OP-HAP

图13 热力学拟合分析Fig.13 Thermodynamic fitting analysis
4 OP-HAP 性能及吸附机理分析
4.1 离子强度的影响
在控制溶液pH=5.0、转速为165 r·min-1、铀初始浓度10 mg·L-1,OP-HAP 用量0.3 g·L-1,吸附时间24 h、室温(298.15 K)的条件下进行离子强度试验,结果如图14 所示。

图14 离子强度对OP-HAP 去除铀的影响Fig.14 The influence of ionic strength on uranium removal by OP-HAP
图14 可得出,在氯化钠浓度为0~0.45 mol·L-1的条件下,离子强度对OP-HAP 吸附铀的影响较小,表明内层配合可能是OP -HAP 吸附铀的机制之一[32-33]。
4.2 OP-HAP 重复利用试验
从经济学角度来考虑,吸附材料不但需要较大的吸附量,还需要较好的重复使用性。保持综合试验的最佳吸附条件下,采用0.1 mol/L 的氢氧化钠对OP-HAP 进行解吸,解吸完全的OP-HAP 用超纯水不断冲洗,烘干后进行下一次循环试验。从图15 可以看出,经过6 次循环后,OP-HAP 对铀的吸附率仍高于90%,表明OP-HAP 具有较好的可重复使用性。

图15 OP-HAP 循环试验Fig.15 Cycling experiments of OP-HAP
4.3 OP-HAP 保存时长的影响
在控制溶液pH=5.0、转速为165 r·min-1、铀初始浓度10 mg·L-1、OP-HAP 用量0.3 g·L-1、吸附时间90 min 和室温(298.15 K)的条件下,考察OPHAP 保存时间(抽真空保存)对其吸附铀的影响,以进一步研究OP-HAP 的稳定性,结果如图16 所示。在保存40 d 的情况下,OP-HAP 对铀的吸附率基本保持一致,这进一步表明OP-HAP 具有较好的稳定性。

图16 保存时长对OP-HAP 吸附铀的影响Fig.16 The influence of material storage duration on uranium adsorption by OP-HAP
4.4 OP-HAP 吸附铀的机理
为了阐明OP-HAP 吸附铀的机制,对OP-HAP进行XPS 分析,以表征OP-HAP 吸附铀的机理,结果如图17 所示。

图17 (a)XPS 总谱、(b)吸附铀后U 4f 的XPS 分谱、(c)吸附铀前后O 1s 的XPS 分谱、(d)吸附铀前后P 2p 的XPS 分谱、(e)吸附铀前后Ca2p 的XPS 分谱、(f)OP-HAP 吸附铀的机理图Fig.17 XPS total spectrum (a),XPS sub-spectrum of U 4f after uranium adsorption(b),XPS sub-spectrum of O 1s before and after uranium adsorption (c),XPS sub-spectrum of P 2p before and after uranium adsorption (d),XPS sub-spectrum of Ca 2p before and after uranium adsorption (e),Mechanism diagram of uranium adsorption on OP-HAP (f)
图17(a)为XPS 总谱。图17(a)可看出吸附铀前OP-HAP 表面元素主要为羟基磷灰石所含的O、Ca、P,且含有少量C,吸附铀后O、Ca、P 的强度下降并出现了U 元素,这与EDS 表征结果一致。图17(a)嵌入图还可看出,OP-HAP 吸附铀前、后存在明显的颜色变化。图17(b)为OP-HAP 吸附铀后U 的分谱,在381.61 eV 与392.49 eV 出现特征峰,表明OP-HAP 吸附铀的过程中,铀的价态没有发生变化,因此其吸附过程不包含还原或氧化过程[2]。图17(c)为吸附铀前后O 的分谱,吸附铀后—OH 的面积由60.81%减少到51.06%,这是由于OP-HAP表面的羟基与水中铀离子产生配合作用所致[17]。图17(d)为吸附铀前后P 的分谱,吸附铀后P 2p 发生了偏移(幅度为0.61 eV),结合FTIR 的表征结果,这可能是由于与铀反应生成了新的复合物。图17(e)为吸附铀前后Ca 的光谱,OP-HAP 吸附铀前后Ca 的分谱也发生了偏移,这可能是铀与钙之间存在相互作用所导致[1]。通过Zeta 电位及表征分析得出,OP-HAP 对铀的吸附机理主要为静电吸附、羟基(—OH)的配合作用、铀与钙之间的离子交换及磷酸根的溶解沉淀,反应方程见式(17)~(20)。
4.5 与其他羟基磷灰石基吸附材料的比较
OP-HAP 与其他羟基磷灰石基吸附材料的比较如表9 所示。可以看出:OP-HAP 对铀的吸附量达到1 584.79 mg·g-1左右,高于以往文献报道的HAP 及其改性材料和HAP 复合材料,进一步表明OP-HAP 是一种潜在的铀吸附材料。

表9 OP-HAP 与其他羟基磷灰石系吸附材料的比较Table 9 Comparison of OP-HAP with other hydroxyapatite-based adsorbents
5 结论
以低成本的CaCO3和(NH4)2HPO4为原料,通过一锅法一次性合成羟基磷灰石(OP-HAP),并将其应用于去除溶液中的铀。
1)通过简单的水浴搅拌制备OP-HAP。OPHAP 能有效去除水溶液中的铀。试验得出其吸附铀的最佳工艺条件为:pH 值5.0、OP-HAP 用量0.3 g·L-1、吸附时间90 min、室温(298.15 K)、转速165 r·min-1,该条件下吸附率可达97%左右,Langmuir 拟合最大吸附量为1 584.79 mg·g-1。
2)OP-HAP 对铀的吸附过程遵循Langmuir 等温吸附模型和准二级动力学模型;热力学分析表明,吸附过程是吸热且自发的。
3)经Zeta 电位及SEM、EDS、XRD、FTIR 及XPS表征得出,OP-HAP 对铀的吸附机理包括静电吸附、离子交换、配合作用及溶解沉淀。
本试验以绿色环保价格低廉的材料为制备原料、简单的合成方式,为溶液中铀的去除提供了思路。

