鸡蛋参多糖提取工艺优化及其抗氧化活性研究
喻本霞,瞿显友,江维克
(1.贵州中医药大学,贵州 贵阳 550025;2.重庆市中药研究院 中药资源学重庆市重点实验室,重庆 400065)
鸡蛋参是桔梗科(Campanulaceae)党参属(CodonopsisWall.)植物鸡蛋参(Codonopsis convolvulaceaKurz)的干燥块茎,藏药名为“尼哇”。味甘、微苦、涩,性微凉,具有生津清热、补养气血、健脾的功效,可以用于治疗感冒,咳嗽,扁桃体炎,胸痛,食欲不振等[1-3]。鸡蛋参及其变种分布于西藏南部、四川西部、云南、贵州等地,野生资源为主。在藏区以及云南等民族地区使用,民间常与鸡肉或猪肉炖食,制成补肺药膳、养心药膳以及产后体虚药膳,用于病后、产后体虚、肺结核、心悸等[4-5]。鸡蛋参主要含糖类和少量生物碱、植物甾醇、苷类等化学成分[6-11]。近年来,多糖因其来源广泛和安全性,在食品和医药行业中成为研究热点,其多种生物活性比如抗氧化、免疫调节、抗炎、保肝、抗肿瘤、抗高脂血症、改善记忆、抗衰老已得到证实[12-15]。鸡蛋参多糖含量较高,具有较高开发利用价值。
植物多糖因其理化性质可采用水提醇沉法进行提取,此法操作相对简单,且能够扩大化生产,研究发现不同提取工艺所得多糖无论从量上还是质上都存在一定差异[16],多糖要进行深入研究就需先明确提取工艺。本研究采用水提醇沉法对鸡蛋参多糖进行提取,采用响应面法优化提取工艺,然后再进一步探究最优工艺条件下获得的鸡蛋参多糖的抗氧化活性[17],以期为鸡蛋参开发利用提供理论依据。
1 仪器与试剂
1.1 试验仪器
UV-2600 紫外可见分光光度计(日本岛津公司);Infinite M200 PRO 酶标仪(瑞士帝肯公司);AB204-S 高精度电子分析天平(梅特勒-托利多贸易(上海)有限公司);KB-900 智能脱色摇床(海门市其林贝尔仪器制造有限公司)等。
1.2 试剂与试验药材
无水乙醇、丙酮、乙醚、浓硫酸购自重庆川东化工(集团)有限公司,维生素C、葡萄糖、PBS 缓冲液购自上海源叶生物科技有限公司,2,2′-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐(ABTS)、硫酸亚铁、苯酚购自上海麦克林生化科技股份有限公司,1,1-二苯基-2-三硝基苯肼(DPPH)、双氧水(3%)购自金克隆(北京)生物技术有限公司,纯水为实验室自制。鸡蛋参药材购自四川泸定,经重庆市中药研究院瞿显友主任中药师鉴定为鸡蛋参。
2 方法
2.1 多糖的制备
2.1.1 药材脱脂处理
新鲜的鸡蛋参块茎切成薄片,在60℃下烘干,粉碎,过50 目筛,得鸡蛋参药材粗粉,加入10 倍量95%乙醇,密封后磁力搅拌浸泡过夜。次日先用纱布过滤收集粗粉,再减压过滤收集细粉,粗细粉混匀后于40℃下低温烘干,得经脱脂处理的鸡蛋参药材粗粉,备用。
2.1.2 多糖的提取
称取0.20 g经脱脂处理的鸡蛋参药材粗粉于具塞锥形瓶中,经热水浸提后,在5 000 r/min下对提取液进行离心5 min,重复离心2 次,在65℃下对上清液进行旋转蒸发浓缩,直至浓缩液与原药材质量比为2 mL/g,快速搅拌下缓慢加入4倍量无水乙醇,密封,5℃冷藏过夜,倒去上清液,沉淀用乙醇、乙醚、丙酮洗涤,各重复2 次,反复以离心的方式进行分离,于40℃下低温烘干,得鸡蛋参多糖。
2.2 多糖的含量测定
2.2.1 绘制标准曲线
将葡萄糖对照品烘干至恒重,取出,置干燥器内放冷。称取上述葡萄糖20 mg 于100 mL 容量瓶中,加入纯水充分溶解后定容,得葡萄糖对照溶液。分别吸取上述对照溶液0.1、0.2、0.3、0.4、0.5 mL 于具塞试管内,加入纯水至1.0 mL,加入1.0 mL 新鲜配置的4.5%苯酚溶液混匀后,快速加入5.0 mL 浓硫酸,混匀,加塞,在100℃下水浴20 min,取出,冰水浴5 min,超声30 s,测定在485 nm 处吸光度。以纯水代替葡萄糖对照溶液为空白对照。
2.2.2 待测溶液制备
按照2.1.2项下进行提取,精密吸取适量上清液稀释一定浓度后,即得待测溶液。
2.2.3 鸡蛋参多糖提取率的计算
按式(1)计算鸡蛋参多糖提取率:
其中,N为提取液稀释倍数;C为检测样品液多糖浓度(mg/mL);V为提取液的体积(mL);W为经脱脂处理鸡蛋参粉末的称取量(mg)。
2.3 鸡蛋参多糖提取条件单因素实验
精密称取经脱脂处理的鸡蛋参粗粉0.20 g,考察条件为提取时间、液料比、提取温度,60 min、40 mL/g、90℃设定为基本试验条件,考察提取时间30、60、90、120、150 min、液料比20、30、40、50、60 mL/g、提取温度60、70、80、90、100℃的多糖提取率,每次变动一个条件,研究以上3个因素对鸡蛋参多糖提取率的影响。按照2.2 项下测定鸡蛋参多糖提取率。
2.4 响应面法优化鸡蛋参多糖提取工艺
根据所报道的方法[18],运用Design-Expert 13软件设计实验方案。各因素变量范围根据单因素实验确定,选取提取液料比(A)、提取时间(B)、提取温度(C)3个因素作为响应变量,以鸡蛋参多糖提取率为响应值,按照Box-Behnken 原理进行响应面设计,各因素及其实验水平见表1。

表1 Box-Behnken响应面实验设计因素和水平表Tab.1 Variables and levels in the Box-Behnken experimental design
2.5 鸡蛋参多糖体外抗氧化活性
2.5.1 测定鸡蛋参多糖对DPPH 自由基的清除能力
参考纪旭光等的方法稍作修改[16,19],称取8 mg DPPH 于10 mL 容量瓶中,用无水乙醇定容,得2 mmol/L 的DPPH 溶液。称取鸡蛋参多糖40 mg 于10 mL 容量瓶中,用纯水定容,得4 mg/mL 的鸡蛋参多糖溶液,依次将鸡蛋参多糖溶液稀释为2.00、1.00、0.50、0.25、0.13 mg/mL。将上述不同浓度鸡蛋参多糖溶液分别加入100 μL 于96 孔酶标板内,随后加入等体积DPPH 溶液,充分混匀后,避光反应30 min,测定反应液在517 nm 的吸光值A2。用纯水代替多糖溶液作为空白组,其吸光度记为A0;用无水乙醇代替DPPH 溶液作为参照组,其吸光度记为A1。以相同浓度VC 溶液与DPPH 溶液反应作阳性对照。按式(2)计算DPPH自由基清除率:
2.5.2 鸡蛋参多糖对ABTS自由基的清除能力
参考李凤伟等[20]的方法稍作修改,称取6.62 mg过硫酸钾和 38.41 mg ABTS 分别置于10 mL 棕色容量瓶中,用纯水定容,得到2.45 mmol/L 的过硫酸钾溶液和7 mmol/L 的ABTS 溶液,2 者等量混匀后在30℃下暗处反应12 h 后,用PBS 缓冲液稀释25 倍,得ABTS 自由基溶液,现配现用。将2.5.1 项下不同浓度鸡蛋参多糖溶液分别加入50 μL 于96 孔酶标板内,随后加入150 μL ABTS 自由基溶液,混匀,静置10 min,用酶标仪测定反应液在734 nm 的吸光值A1。用纯水代替多糖溶液,其吸光度记为A0。以相同浓度VC 溶液与ABTS 自由基溶液反应作阳性对照。按式(3)计算ABTS自由基清除率:
2.5.3 测定鸡蛋参多糖对羟基自由基的清除能力
参考杭华等[21]的方法稍作修改,称取15.29 mg硫酸亚铁、12.43 mg 水杨酸、吸取100 μL 3%双氧水分别置于10 mL 容量瓶中,硫酸亚铁和双氧水用纯水定容,水杨酸用无水乙醇定容,得到9 mmoL/L 的硫酸亚铁溶液、9 mmoL/L 的水杨酸乙醇溶液以及8.8 mmoL/L的双氧水溶液,现配现用。将2.5.1项下不同浓度鸡蛋参多糖溶液分别加入50 μL 于96 孔酶标板内,随后加入50 μL 硫酸亚铁溶液和50 μL水杨酸乙醇溶液,摇床上振摇反应10 min,随后加入50 μL 双氧水溶液,于37℃下反应30 min,测定反应液在510 nm 的吸光值A2。用纯水代替多糖溶液作为空白组,其吸光度记为A0;用纯水代替双氧水溶液作为参照组,其吸光度记为A1。以相同浓度VC溶液代替多糖溶液反应作阳性对照。按式(4)计算羟基自由基清除率:
2.6 数据处理
应用GraphPad Prism 9.0.2 软件进行数据处理和绘图。差异显著性分析、回归分析以及响应曲面图绘制均采用Design-Expert 13软件进行。
3 结果与分析
3.1 多糖的制备
经过水提醇沉后可得到鸡蛋参多糖,该多糖为浅黄色粉末,质地蓬松,流动性好,无甜味,无气味。
3.2 多糖标准曲线的绘制
以浓度为横坐标,吸光度为纵坐标,绘制葡萄糖标准曲线,得回归方程:Y= 9.860 6X- 0.004 3(R2= 0.999 7 )。
3.3 鸡蛋参多糖提取单因素实验
提取温度为90℃、液料比为40 mL/g条件下,多糖提取率随着时间的增加而增加,分别在60 min 和150 min 出现两次显著上升,考虑时间成本,本次响应面设计0 水平确定为60 min。提取时间为60 min、液料比为40 mL/g 条件下,多糖提取率随着提取温度升高提取率整体上呈现上升趋势,虽在70、80℃略有回调,但与60℃并无显著性差异。为了避免高温对多糖结构的破坏,本次响应面设计0水平确定为60℃。提取时间为60 min、提取温度为90℃条件下,多糖提取率随着液料比的增加整体上呈现下降趋势,可能因为多糖被吸附引起。本次响应面设计0水平确定为20 mL/g。
3.4 响应面法优化
3.4.1 实验设计与结果
鸡蛋参多糖提取工艺响应面优化实验设计方案及结果见表2,该设计方案共设计了17 个实验点的响应面分析实验,其中析因点12 个,0 水平5 次重复。

表2 Box-Behnken设计方案及结果Tab.2 Box-Behnken design matrix and experimental values
3.4.2 鸡蛋参多糖提取工艺回归模型的建立及方差分析
利用 Design-Expert 13 软件对表2 中的实验数据进行回归分析,得到鸡蛋参多糖提取率对提取液料比(A)、提取时间(B)、提取温度(C)3 个因素的回归方程为:鸡蛋参多糖提取率 = 50.29 + 1.47A +2.84B + 2.15C + 0.310 5AB - 0.178 9AC + 0.611 6BC -1.89A2- 0.863 2B2- 3.2C2,方差分析结果见表3。由表3 可以看出:模型F值为28.22,P值为0.000 1,P< 0.05,表明模型是显著的;模型的失拟项P= 0.333 8,P> 0.1,表明失拟不显著,即该模型是稳定的,能较好地预测实际鸡蛋参多糖提取情况。相关系数R2为0.973 2,数值接近1,表明模型可信度良好。拟合模型的调整R2为0.938 7 和预测R2为0.750 2,差异值小于0.2,说明该模型预测情况与实际情况相一致。变异系数为1.81,该系数数值偏低,表明实验值的精度高,可靠性强。因此,该模型对试验的拟合较好,可以预测鸡蛋参多糖不同提取条件下的评价指标。模型一次项A、B、C以及二次项A2、C2差异均极显著(P< 0.01),表明3 个因素对鸡蛋参多糖提取过程具有重要影响,二次项A2、C2对结果也有显著影响,而交互作用系数均大于0.05,表明交互作用对最终结果的影响作用较弱。
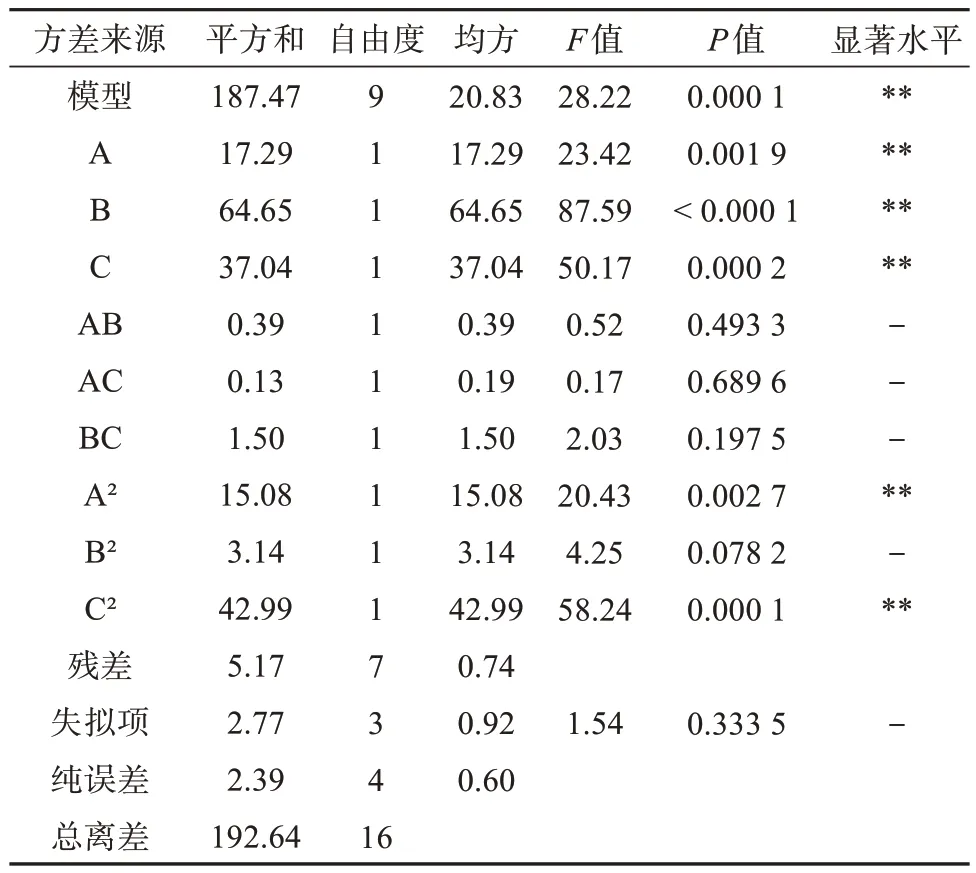
表3 Box-Behnken回归模型方差分析Tab.3 Variance analysis of Box-Behnken response surface regression model
3.4.3 响应面分析及优化
对表2中的数据进行二次多元回归拟合,3个因素之间交互作用对鸡蛋参多糖提取率的影响如图1所示。可根据响应面图坡度陡峭程度、等高线密集度以及等高线形状判断因素间交互作用的影响程度,3 个因素之间的交互作用响应面图有一定坡度,但等高线分布较稀疏,等高线形状接近圆形,表明各因素间交互作用对鸡蛋参多糖提取率的影响均不显著,这与方差分析结果相一致。利用Design-Expert 13 软件进行最佳条件预测,可得出鸡蛋参多糖最佳提取工艺参数,液料比为24.50 mL/g,提取时间为88.79 min,提取温度为62.66℃,多糖提取率为53.11%。为了便于实际操作,将鸡蛋参多糖提取工艺微调为液料比25 mL/g,提取时间为90 min,提取温度为63℃。在此提取工艺参数下,重复5 次提取鸡蛋参多糖,最终得多糖提取率为(52.43 ± 1.61)%,与预测值接近,表明用响应面来优化鸡蛋参多糖的提取工艺条件可行。
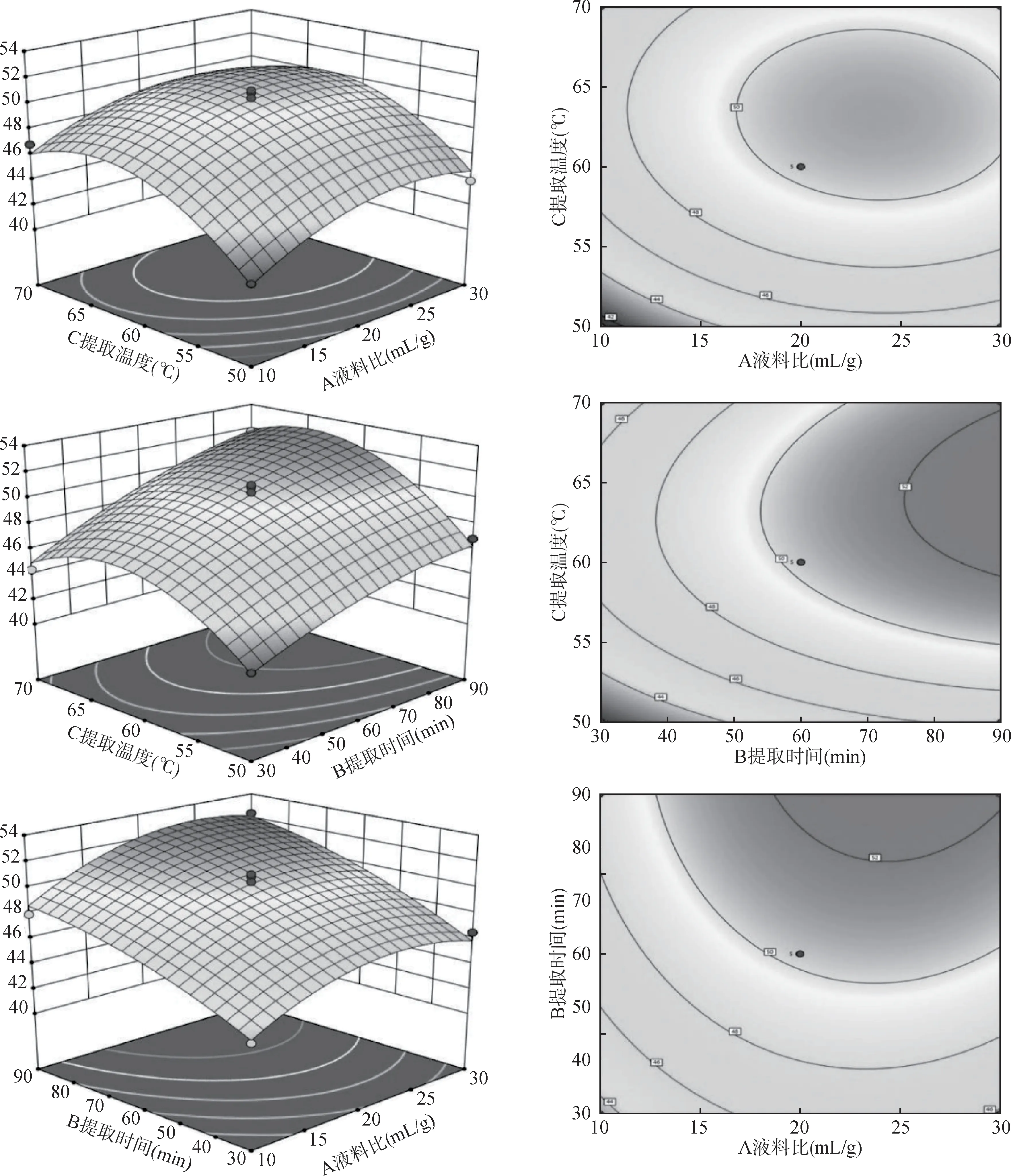
图1 因素间交互作用对鸡蛋参多糖提取率影响的响应面图和等高线图Fig.1 Response surface and contour plot of the interaction between factors on extraction rate of CCP
3.5 鸡蛋参多糖体外抗氧化活性
鸡蛋参多糖体外抗氧化活性结果见图2 ~ 4,其对DPPH 自由基、ABTS 自由基和羟基自由基均具有一定的清除能力,清除ABTS 自由基和羟基自由基的效果较好,DPPH 自由基较弱。在质量浓度范围0.13 ~ 4 mg/mL 内,鸡蛋参多糖溶液对3 者自由基的清除能力呈现非线性依赖性,浓度为4 mg/mL时,羟基自由基清除率为(54.89 ± 2.26)%,ABTS 自由基清除率为(54.37 ± 0.42)%,DPPH 自由基清除率为(38.13 ± 2.56)%,表明鸡蛋参多糖具有一定抗氧化活性。

图2 鸡蛋参多糖对羟基自由基的清除曲线Fig.2 Hydroxyl radical scavenging curve of CCP

图3 鸡蛋参多糖对ABTS自由基的清除曲线Fig.3 ABTS radical scavenging curve of CCP
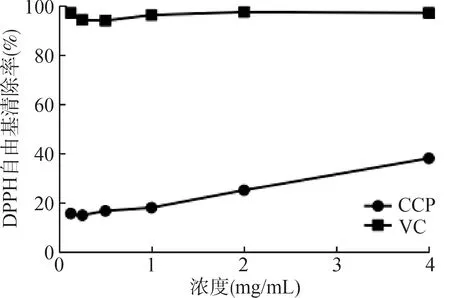
图4 鸡蛋参多糖对DPPH自由基的清除曲线Fig.4 DPPH radical scavenging curve of CCP
4 讨论
鸡蛋参为桔梗科党参属多年生草本植物,块茎具有补养气血、健脾、生津清热的功效,主要分布在我国西南部。鸡蛋参是一种常用的藏药,《卫生部药品标准藏药分册》和《青海省藏药炮制规范(2010年版)》均有收录,其藏药名为“尼哇”,藏成药“十味龙胆花颗粒”和“十味龙胆花胶囊”组方中均含有鸡蛋参。鸡蛋参野生资源并不丰富,甚至多次被列为濒危藏药材,为了保障鸡蛋参药材资源的供给,目前关于鸡蛋参的研究多集中在人工繁育技术方面,而关于鸡蛋参多糖提取及其活性的研究较少,本文对鸡蛋参多糖的提取及抗氧化活性开展了研究。
多糖的提取有多种方法,如超声、微波等,虽然这些方法各具特点,但热水提取法作为一种传统方法,具有易于扩大生产的优势,然而热水提取法存在提取率较低的缺陷。前期实验发现鸡蛋参多糖含量高,即使采用热水浸提法多糖的提取率仍然较高,因此本文选择传统的热水浸提法作为提取鸡蛋参多糖的方法。不同的提取工艺所得到的多糖,其结构及活性都存在一定差异,因此有必要开展多糖提取工艺考察,确保得到稳定的多糖。本文在单因素的基础上综合成本、稳定性等实际情况,采用响应面优化鸡蛋参多糖水提工艺,确定最佳提取条件为:提取时间90 min,提取温度为63℃,液料比25 mL/g,在此条件下鸡蛋参多糖提取率达到52.43%。鸡蛋参多糖的制备需由水提液经过离心、浓缩、醇沉、洗涤而得,在这些制备过程中难免多糖损失,本研究以水提液中多糖提取率为指标考察提取工艺,避免了制备过程中因多糖损失而引起的误差。经优选出的提取工艺所提取的鸡蛋参多糖对自由基具有一定清除能力,表明其具有一定抗氧化活性,且抗氧化作用随着浓度的增大而增强。鸡蛋参多糖含量高、制备简单且具有一定活性,值得进一步开发利用。

