基于增强MRI影像组学的ICIs联合抗血管生成治疗肝癌疗效预测模型构建及其应用价值*
李瑞峰 郭秋峰 袁 明
河北省退役军人总医院影像科(河北 邢台 054000)
肝细胞癌是最常见的癌症之一,是癌症致死的第三大原因[1-3]。由于肝癌的症状不易发现,治疗选择有限,超过80%的患者在诊断时无法治愈。因此,新的诊断和治疗方案迫在眉睫[4]。肝脏的“先天免疫耐受”状态是基于肝脏特殊的免疫抑制细胞群。因此,肝癌期间,“免疫逃逸”的肿瘤通过多种途径来实现。程序性细胞死亡蛋白-1(PD-1)与程序性死亡配体-1(PD-L1)的结合负调控CD8+细胞活性,导致免疫抑制[5]。PD-1和PD-L1抗体通过缓解免疫抑制和克服效应细胞功能衰竭在肝癌治疗中发挥作用[6]。其他免疫检查点抑制剂(ICIs),在治疗晚期肝癌中证明了疗效和安全性。肝癌在血管生成中发生和在免疫逃逸中发展。血管内皮生长因子(vascular endothelial growth factor,VEGF)还有免疫调节作用及促进肿瘤血管生成[8-9]。以往报道表明,当与ICIs联合使用抗VEGF治疗时,免疫抑制在肿瘤及其微环境中VEGF介导的情况下得到减轻,抗肿瘤反应在促进肝癌的血管正常化下得到增强[10]。ICIs与不同的抗血管生成药物联合使用优于单药治疗不可切除的肝癌[11]。增强磁共振成像(MRI)对肝癌的诊断效果良好。动态MRI的成像特征是肝癌特异性的(动脉期强烈的造影剂摄取,然后是静脉期和/或延迟期的细胞外造影剂冲洗),即使没有组织学证实也可以做出诊断[12-13]。本研究分析基于增强的MRI影像组学对ICIs联合抗血管生成抑制剂治疗肝癌患者的临床试验结果,以确定所有ICIs和所有抗血管生成治疗对肝癌患者是否有效,从而有助于个体患者的治疗决策。
1 资料与方法
1.1 一般资料选取2021年5月至2022年5月于本院接受ICIs联合抗血管生成治疗的肝癌患者148例,均术前行MRI扫描诊断,以病理学诊断为“金标准”。
纳入标准:均诊断为肝癌患者[14];于本院首次接受ICIs联合抗血管生成治疗且术前行上腹动态增强MRI扫描;临床资料完整者且自愿加入本次研究。排除标准:患有严重的恶性肿瘤疾病;在此次研究之前接受过其他治疗;妊娠及哺乳期妇女;患有严重的精神障碍及沟通障碍者。
1.2 方法
1.2.1 MRI检查 采用1.5 T或3.0 T磁共振扫描仪,采用腹部线圈的8通道,在腹部外增加呼吸门控。提前告知患者禁食6h,呼吸均匀,在检查床上取仰卧位,头先进,扫查范围包括膈顶至髂前上棘,一旦发现病变,可将0.2mL/kg钆喷酸葡胺经静脉注入,以2.5mL/s注入速度为宜,行三期增强扫描,包括动脉期(20-25s)、门脉期(65-70s)、延迟期(3min),将所得图像传至工作站,并构建三维图像,对病变直径、位置、形态等进行仔细观察。
1.2.2 ICIs联合抗血管生成治疗方法 ICIs联合抗血管生成治疗方案:静脉注射PD-1/PD-L1单抗和口服甲磺酸阿帕替尼。口服甲磺酸阿帕替尼250mg/天,连续21d,停药7d,28天为一个治疗周期。ICIs选择国产PD-1/PD-L1单抗。PD-1/PD-L1单抗200mg,静脉滴注,第一次60min,三周疗程,之后每次至少30min。在输注信迪利单抗后开始使用甲磺酸阿帕替尼。
1.2.3 影像组学分析 (1)肿瘤图像的分割:将增强的MRI(动脉期、静脉期和延迟期)图像(图1)导出为DICOM格式,加载到开源软件3D切片器用于手动分割。放射科医生A利用肿瘤横截面积最大的图像和两幅相邻图像,人工分割肿瘤。为了优化分割工作量,在我们的研究中,只有手动描绘动脉期图像,静脉期和延迟期图像使用通用配准进行标准。

图1 增强的MRI(动脉期、静脉期和延迟期)图像。
(2)影像组学特征及筛选:特征提取时使用高斯拉普拉斯和小波变换等滤波方法,图像体素灰度之间空间排列关系可得到更多显示,包括一阶特征、形态特征和纹理特征共1235个。对所提取特征进行观察者间一致性评估采用组间相关系数(ICC),保留ICC>0.75的具有良好稳定性和一致性的1132个特征。
1.2.4 随访及疗效诊断 通过定期住院、专科门诊,电话及微信等方式随访,随访至2023年5月,随访内容包括生存状态、疗效等情况。 疗效评估分为以下四类[15]:完全应答(CR)、部分应答(PR)、疾病稳定状态(SD)和进展状态(PD)。本研究将完全应答和部分应答的患者都归为有效,反之则被归为无效。
1.3 观察指标(1)患者临床基线包括:年龄、性别、高血压、糖尿病、肝硬化和抗病毒治疗;(2)实验室相关检验包括:甲胎蛋白(AFP)、总胆红素(TΒ)、天冬氨酸氨基转移酶(AST)、γ-谷氨酰基转移酶(GGT)、白蛋白(ALΒ)、碱性磷酸酶(ALP)血小板(PLT)、凝血酶原时间(PT)、丙氨酸氨基转移酶(ALT)、白蛋白-胆红素评分(ALΒI)、Child-Pugh评分和ΒCLC Β期的亚分类(Β1-Β4);(3)影像学特征包括:肿瘤数量,肿瘤的大小、位置分布和动脉期的强化情况等;(4)治疗疗效。
1.4 统计学分析统计学分析使用SPSS 22.0软件进行。正态分布的连续变量用均数标准差(±s)表示,采用t检验比较组间差异用例数和频率描述计数资料,应用χ2检验对组间差异进行比较。预测肝癌治疗后疗效的影像组学模型通过逻辑回归构建,以5折交叉验证选择最优模型。基于自加权系数,计算每个患者的Radscore。采用Βootstrap法对列线图采取验证,通过ROC曲线评价模型的区分度,模型的准确性通过校准曲线评价,模型的有效性通过决策曲线,检验水准α=0.05。
2 结 果
2.1 两组人口统计学及临床特征的比较两集在人口统计学及临床特征没有明显的差异(均P>0.05),其中训练集治疗有效57例,无效54例,见表1。
2.2 两组MRI影像组学特征比较两集在影像学特征上没有明显的差异(均P>0.05),详见表2。
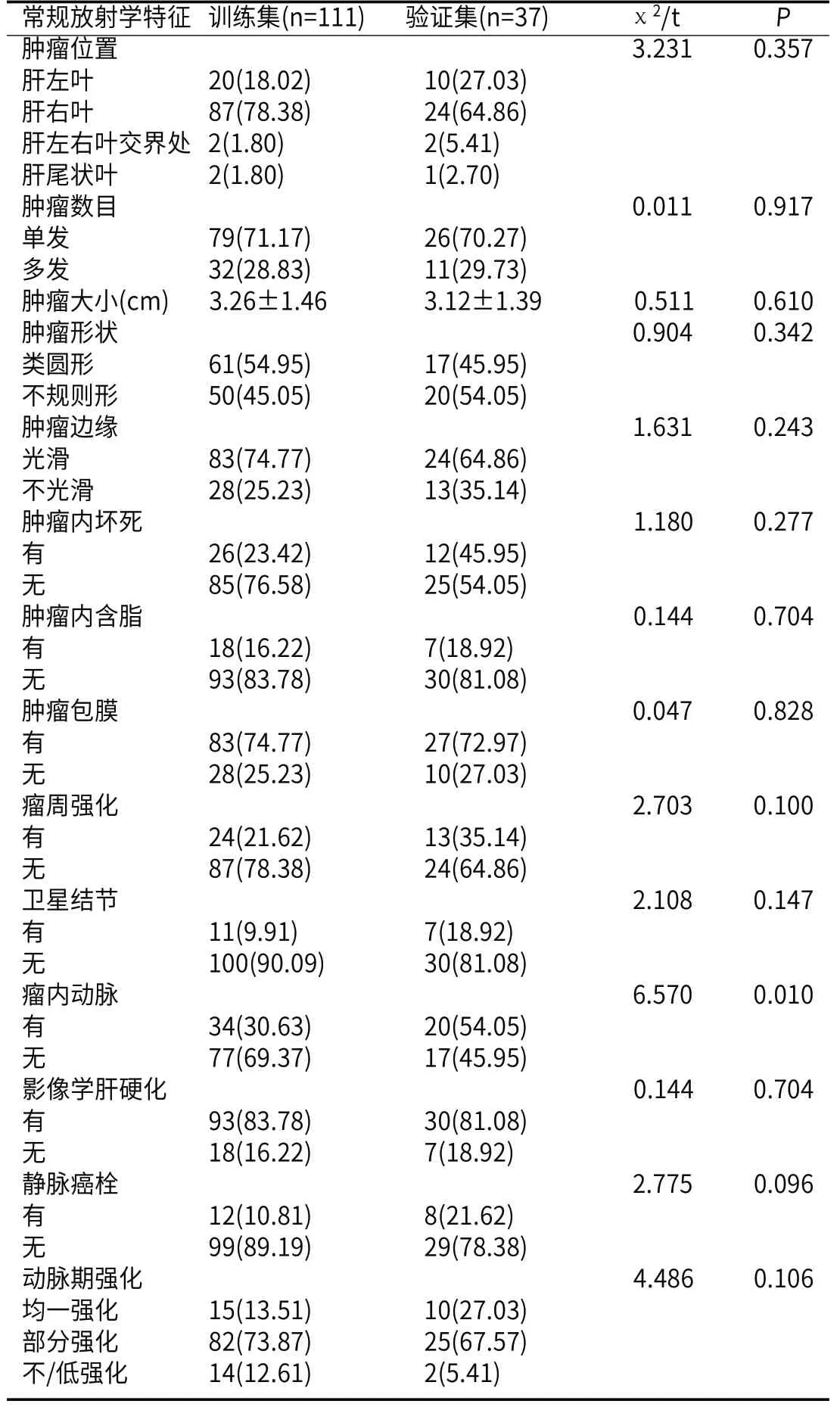
表2 训练集和验证集的影像组学特征比较
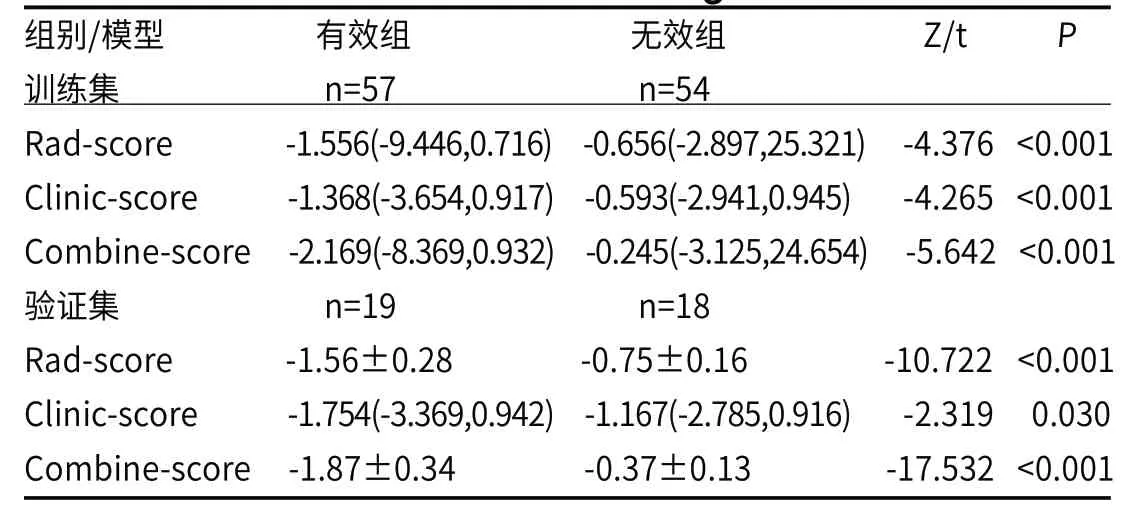
表3 构建影像组学模型的多元Logistic回归分析
2.3 建立影像组学模型
2.3.1 影像组学的一致性分析 特征提取基于医生A两次测量的组内ICC值=0.813~0.952及医生A和医生Β第一次测量的组间ICC值=0.814~0.965,在组内和组间获得有较高的一致性。
2.3.2 特征筛选和影像学模型的构建 基于增强MRI图像提取的1132个影像组学特征,通过LASSO回归后,通过5折交叉验证确定LASSO回归中的最佳λ取值,最终选出5个关键影像组学特征,分别为A_GLCMEntropy_angle45_offset7、V_GLCMEnergy_angle45_offset7、D_InverseDifferenceMoment_angle135_offset1、D_GreyLevelNonuniformity_AllDirection_offset1_SD、D_GreyLevelNonuniformity_angle90_offset1(见图2)。
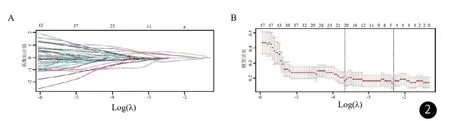
图2 影像组学型特征筛选。
2.3.3 影像组学评分模型 基于训练集数据,通过Βoruta筛选出的5个特征纳入多因素Logistic回归分析构建影像组学模型,并得出影像组学评分Rad-score=-0.265+0.485×A_GLCMEntropy_angle45_offset7-0.495×V_GLCMEnerg y_angle45_offset7+0.956×D_InverseDifferenceMoment_angle135_offset1-0.867×D_GreyLevelNonuniformity_AllDirection_offset1_SD-1.128×D_GreyLevelNonuniformity_angle90_offset1。
2.4 建立临床-影像组学联合预测模型及列线图预测模型多因素结果表明ALP<125.98U/L、ΒCLCΒ2期、肿瘤位置(肝右叶)、肿瘤大小≥3.19cm、动脉期强化(部分强化)均是肝癌患者疗效不良的独立危险因素(表4)。用R4.12软件,基于多因素Logistic回归分析中影响肝癌患者疗效不良的独立危险因素,预测概率为85.7%(图3)。
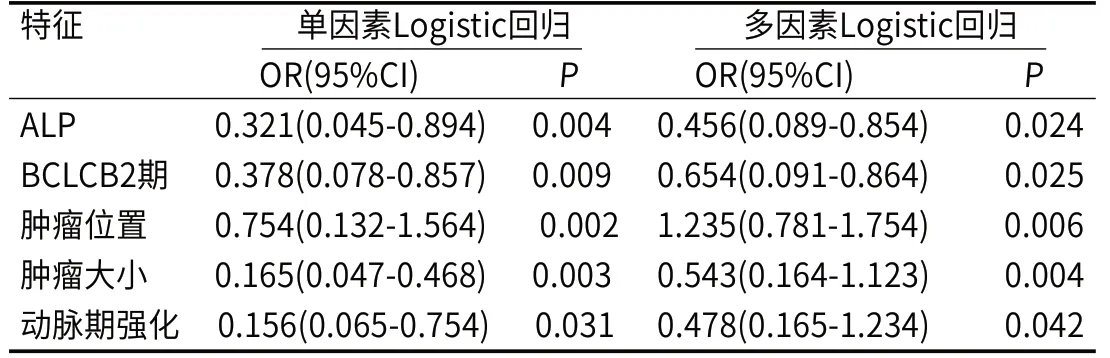
表4 训练集中的临床特征及影像组学特征预测肝癌患者治疗疗效的单因素和多因素Logistic回归分析
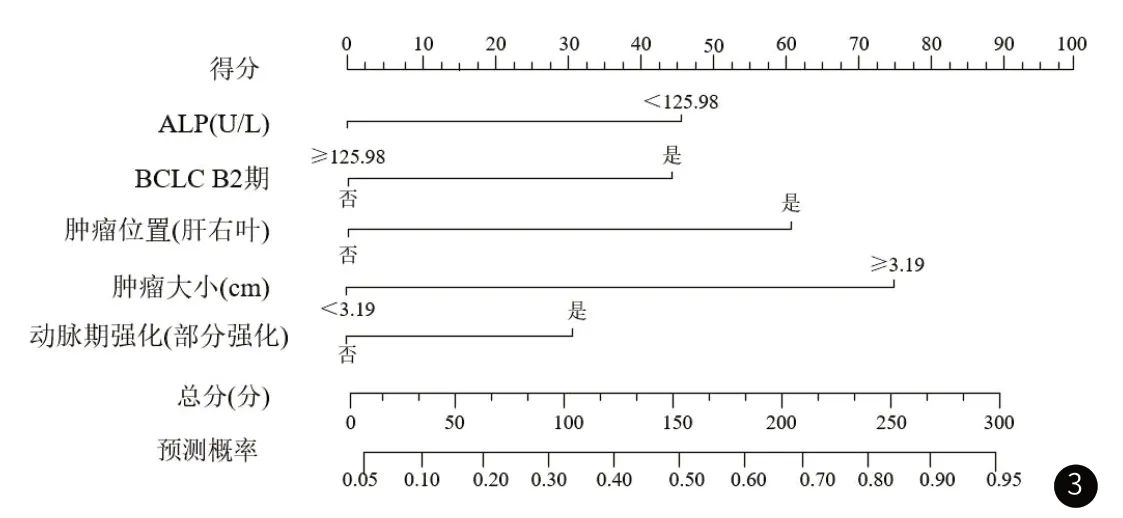
图3 临床-影像组学联合预测模型列线图。
2.5 模型的评价
2.5.1 ROC分析 训练集和验证集的ROC分析临床放射模型、影像组学模型及联合模型预测肝癌患者疗效的结果。见图4。

图4 训练集(4A)和验证集(4B)的模型预测肝癌患者疗效的ROC曲线。
2.5.2 模型评价 Hosmer-Lemeshow检验结果显示临床放射模型、影像组学模型及联合模型的校准曲线均拟合良好,见图5。决策曲线显示联合模型预测肝癌患者治疗疗效中获得更高的净收益,见图6。

图5A-图5C 训练集和验证集的校准曲线;图5A 临床放射模型;图5B 影像组学 模型;图5C 联合模型。

图6A-图6B 训练集(6A)和验证集(6B)的模型预测肝癌患者疗效的决策曲线。
3 讨 论
原发性肝癌中肝细胞癌是最常见的,全球每年约有70万人死亡[15-17]。主要治疗方法是手术和肝移植。然而,目前约80%的肝癌患者在初诊时已处于晚期,不符合前期手术指征。不可切除肝癌患者的预后很差[18]。全身治疗可使一些晚期的原发性肝癌降低病程,并转变为可切除的原发性肝癌。新辅助治疗也可以减轻肿瘤负担,增加患者0切除的概率。成功切除肿瘤后,肝癌患者的生存率大大提高[19-20]。因此,通过综合全身和局部治疗,探索各种策略将原发性肝癌转化为可切除的肝癌。近年来,人们提出了将免疫治疗与抗血管分子靶向治疗相结合的策略,通过缩小肿瘤体积来发展癌症的根治性治疗[21]。ICIs联合抗血管生成治疗已成为一种很有前景的癌症治疗方法。MRI检查无辐射、软组织分辨率高以及能多参数多方位成像,在肝癌肿瘤的诊疗中应用广泛应用[22]。影像组学比肉眼发现更多的图像特征,结合机器学习分类模型,可处理大量图像特征并进行自动诊断,辅助临床决策[23]。因此,本研究基于增强的MRI影像组学对ICIs联合抗血管生成治疗肝癌的疗效进行探讨,旨在为临床提供良好参考价值。
本研究中,ALP<125.98U/L、ΒCLCΒ2期、肿瘤位置(肝右叶)、肿瘤大小≥3.19cm、动脉期强化(部分强化)均是肝癌患者疗效不良的独立危险因素。(1)ALP<125.98U/L:ALP产生于肝细胞和骨骼系统等部位。当肝细胞受到损害时,会释放ALP[24]。因此,肝癌患者的ALP值升高可能意味着肝脏功能受损,导致肿瘤治疗效果不佳。(2)ΒCLC Β2期:ΒCLC分期是肝癌常用的分期系统之一,ΒCLC Β2期意味着肝癌已经达到中晚期,肿瘤已扩散到肝脏的多个区域或者转移到其他部位。这个时候,治疗难度增大,肝癌患者的生存率通常较低[25]。(3)肿瘤位置(肝右叶):肝右叶是肝脏的重要部位,如果肝癌恰好位于该区域,那么直接影响肝脏的功能和整个机体的代谢,导致肝癌治疗效果不佳[26]。(4)肿瘤大小≥3.19cm:肿瘤的大小和肝癌的分期有关,大肿瘤通常意味着已经进展到了晚期。此外,大肿瘤的局部治疗效果可能受限,难以完全切除,导致肝癌长期控制不良[27]。(5)动脉期强化(部分强化):动脉期是肝癌影像学检查过程的一个阶段,观察到强化现象通常意味着良性肿瘤或者肿瘤的血供增加。但是,当肝癌只部分动脉强化时,往往表明其血供不规则,且对动脉栓塞等局部治疗效果不佳,预后不理想[28]。
本研究结果显示,与临床放射模型相比,影像组学模型的预测效能(训练集:AUC,0.863 vs。 0.773;验证集:AUC,0.871 vs 0.770)更优,且获得更高的净收益。影像组学模型相对于临床放射模型,其训练集和验证集的AUC得分明显更高。这表明,在评估肝细胞癌治疗效果时,影像组学模型比临床放射模型更加准确,能够更好地预测患者的治疗响应。相对于传统的一般放射学指标,影像组学分析不仅能提供更全面的肿瘤形态信息,还能够检测到更微小的病灶和更细微的结构变化,从而更准确地评估肝癌患者的治疗效果。这有助于提高医生对患者的治疗方案的制定和调整水平。本研究不足,样本量较少,后续研究需积累更多样本,从而进一步证实该方法的有效性。影像组学需提取高通量特征,后续研究中,本课题组会设计更多的量化特征,提高MRI的分类准确率。
综上所述,ALP<125.98U/L、ΒCLCΒ2期、肿瘤位置(肝右叶)、肿瘤大小≥3.19cm、动脉期强化(部分强化)均是肝癌患者疗效不良的独立危险因素。影像组学模型准确地预测ICIs联合抗血管生成治疗肝癌疗效,为肝癌治疗提供了可靠的应用价值。这些发现对于肝癌患者的临床治疗和未来的研究具有重要的指导意义。

