温和灸对IBS 小鼠结肠Trp-kyn/5-HT 代谢的调控机制研究
马金丹,赵 琛,朱笑吉,陈嘉宜,马晓芃,黄 艳,王照钦,吴璐一,陈子怡,周次利,陆 嫄*,黄儒德
(1.上海市针灸经络研究所,上海 200030;2.上海市嘉定区安亭医院,上海 201805)
肠易激综合征(irritable bowel syndrome,IBS)是一种以反复腹痛,伴有排便习惯改变的功能性胃肠疾病。IBS 的发病率高,造成了较大的公共卫生负担。其病因复杂,可能和遗传、饮食、感染、肠道微生物和心理问题有关[1]。罗马IV 标准认为IBS 是一种典型的脑肠互动障碍,其发病与脑-肠轴具有较大关联[2]。色氨酸(tryptophan,Trp)代谢是参与脑-肠轴的关键通路。研究表明,Trp 代谢与IBS 发病相关,其代谢产物可参与机体内脏痛敏过程,产生内脏痛[3]。本研究以IBS 模型小鼠为研究对象,测定艾灸干预对结肠组织Trp 相关产物含量及限速酶的表达状况的影响,研究艾灸对IBS模型小鼠Trp代谢途径的调节作用机制。
1 材料与方法
1.1 实验动物 本研究采用雄性清洁级C57BL/6J 小鼠,体质量(20±2)g,由上海中医药大学附属岳阳中西医结合医院动物实验中心提供[实验动物使用许可证编号:SYXK(沪)2018-0040]。饲养环境:12 小时昼夜节律交替,室温(20±2)℃,室内湿度50%~70%。实验符合《关于善待实验动物的指导性意见》(伦理编号:YYLAC-2019-032)。7 只为正常对照组,余28 只造模。正常对照组预留1 只、造模组预留4 只作模型鉴定。
1.2 试剂与仪器 2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzene sulfonic acid,TNBS):Sigma-Aldrich Corporation,美国,P2297;DL-4-氯苯丙氨酸(p-chloro-phenylalanine,PCPA):Sigma-Aldrich,美国,C8655;1-甲基-D-色氨酸(1-methyl-D-tryptophan,1-MT):Sigma-Aldrich,美国,452483;抗色氨酸羟化酶1(anti-tryptophan hydroxylase 1, anti-TPH1):Merck,德国,AB15570-I;抗吲哚胺2,3-双加氧酶(anti-Indoleamine 2,3-dioxygenase,anti-IDO):Santa Cruz, 美 国,sc-137012;RT reagent Kit:TAKARA,日本,RR047A;TB Green qPCR 试剂盒:TAKARA,日本,RR420A;LC-MS/MS AB Sciex API 4000 Qtrap,美国, Thermo Fisher;PCR 仪Veriti 96-Well Thermal Cycler(Applied Biosystems);qPCR 仪LightCycler®480II,美国,Roche。
1.3 动物造模方法 制备IBS 小鼠模型[4]。1M TNBS原液(Sigma-Aldrich Corporation,美国,P2297)溶于30%乙醇液中制备(130 ug/mL,30% EtOH)TNBS 乙醇灌肠液。造模组小鼠提前一天予以禁食,排空消化道,5%葡萄糖溶液饮水。造模时,使用1%戊巴比妥钠腹腔注射麻醉小鼠后,单次直肠灌注TNBS 灌肠液0.1 mL/只诱导结肠炎症反应。正常对照组麻醉后灌注0.1 mL 生理盐水。造模完成后,当天取正常对照及造模组各1 只,第3、7、28 天取1 只进行模型鉴定。自制小鼠肠球囊[5],进行腹部撤回反射评分(abdominal withdrawal reflex,AWR)评估小鼠内脏痛敏程度变化。解剖并剪取远端结肠组织作肉眼观察,HE 染色镜下确认无明显炎症溃疡,确认造模成功。
1.4 分组与干预 确认模型成功后,将剩余6 只正常对照归为正常组,余24 只造模小鼠采用随机数字表法随机分为模型组、艾灸组、1-MT 组和PCPA 组,每组6 只:1)正常组(n= 6):不进行任何干预,仅做艾灸组相同的固定,腹腔注射生理盐水。2)模型组(n=6):同正常组。3)艾灸组(n= 6):造模后第28 天,进行固定,行艾灸干预,共7 d,每天1 次。腹腔注射生理盐水。4)1-MT 组(n= 6):与艾灸治疗同时开始,不进行艾灸干预,仅做与艾灸组相同的固定;配置IDO 阻断剂1-MT 10 mg/mL 溶液,1 mL 早晚2 次皮下注射[6-7],共7 d。5)PCPA 组(n= 6):艾灸治疗开始后第5 天,不进行艾灸治疗,仅做与艾灸组相同的固定;采用TPH 阻断剂PCPA 干预[8-9],小鼠腹腔注射PCPA 500 mg /kg,连续3 d。
1.5 艾灸干预操作方法 在通风环境下,由受训人员进行干预。安抚小鼠后,仰面固定于固定架,头套遮住双眼。参照《实验针灸学》取小鼠双侧足三里[10],5 mm 小艾条温和灸干预,红外测温控温(45±1)℃,每日1 次每次10 min,双侧同时施灸。
1.6 标本采集与指标检测
1.6.1 标本采集 观察小鼠一般情况、大便次数及性状等。将小鼠称重后按1%戊巴比妥钠腹腔注射麻醉,自肛门向上2 cm处剪取2~4 cm结肠组织,纵向剖开,靠近肛门端结肠4%多聚甲醛固定后石蜡包埋,4 μm连续切片,HE 染色。其余于-80 ℃备用。
1.6.2 内脏痛敏检测 治疗前后对小鼠进行直结肠扩张刺激,测AWR 评分[5]。操作前12 h 禁食,刺激前抚摸小鼠腹部,促排粪便。小鼠清醒状态下将球囊从肛门顺直肠生理曲度插入,小鼠置于固定器内。扩张强度分别为15、30、45、60 mm Hg(1 mm Hg ≈0.133 kPa)压力分级。每个强度测试3 次,根据小鼠行为进行评分。
1.6.3 小鼠结肠TPH1、IDO1 蛋白及mRNA 表达检测 免疫组化法。每张随机取3 个视野,计算平均AOD 值。
Real-Time PCR 法:冷冻结肠100 mg 研磨至成粉状,1 mL Trizol 裂解10 min,取上清加氯仿后室温10 min,取上清。加入异丙醇混匀,沉淀离心取上清后加入乙醇,吸取乙醇后干燥,加入nucleasefree water,55 ℃水浴溶解RNA,紫外分析浓度。配置反应液,37 ℃孵育15 min,设置两步法PCR 标准程序。定量分析采用2-ΔΔCT法。引物设计参照Gene Bank 库,NCBI Primer-blast 设计引物序列,上海捷瑞生物合成,见表1。

表1 TPH1、IDO1 mRNA 引物序列
1.6.4 小鼠结肠Trp-Kyn/5-HT 代谢物检测 LC-MS/MS 法上机测试结肠Trp、Kyn、5-HTP、5-HT、5-HIAA水平。10 mg 结肠加入80%甲醇300 μL 预冷10 min 后匀浆裂解;4 ℃15 000 r/min 离心10 min;取250 μL 上清液。色谱上样3 μL,流动相流速0.2 mL/min,洗脱液A 相为0.1%甲酸水溶液,洗脱液B 相为0.1%甲酸乙腈溶液。质谱条件:正离子模式,帘气(CUR)40 psi,碰撞气medium,IonsprayVoltage 5 500V,温度500 ℃,Ionsource gas1(GS1)50 psi,Ionsourcegas2(GS2)50 psi。利用Skyline 数据处理。
1.7 统计学方法 采用SPSS 26.0 进行统计学处理。计量数据若服从正态分布且方差齐,组间比较采用单因素方差分析(one-way ANOVA),自身前后对照采用配对样本t检验;若数据不符合正态分布或方差不齐时用Kruskal-Wailis H检验分析,组间两两比较采用Mann-Whitney U检验,自身前后对照采用Wilcoxon 符号秩和检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 小鼠一般情况 正常组小鼠一般情况无异常;小鼠造模后见皮毛干枯,活动减少,饮食尚可,体质量增加减缓,大便质软;干预后1-MT 组及PCPA 组体质量增长缓慢,艾灸组皮毛色泽、精神状态均有不同程度改善,摄食增加。各组小鼠结肠组织肉眼观察状态正常。
2.2 各组小鼠结肠病理学改变 各组小鼠结肠组织学无明显差异,黏膜上皮结构均完整,可见由单层柱状上皮,固有层和黏膜肌层排列整齐,结构完整,未见炎症溃疡,见图1。

图1 各组小鼠结肠病理学观察(HE,×40)
2.3 各组小鼠AWR 评分比较 各组小鼠不同强度刺激,30 mm Hg 下,治疗前模型组小鼠AWR 评分均高于正常组(P<0.05),艾灸组小鼠AWR 评分治疗后较治疗前明显降低(P<0.05),见表2。15、45、60 mm Hg 下AWR 评分无明显差异。
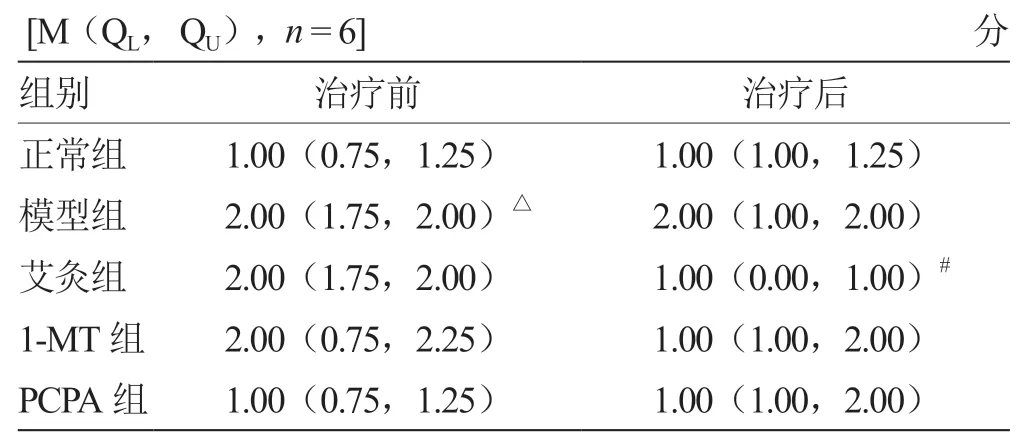
表2 各组小鼠30 mm Hg 下AWR 评分比较
2.4 艾灸对小鼠结肠组织IDO1、TPH1 蛋白表达的干预 各组小鼠结肠IDO1、TPH1 蛋白表达,与正常组相比,模型组小鼠结肠组织IDO1 蛋白表达显著增高(P<0.05),模型组小鼠结肠组织TPH1 蛋白表达显著增高(P<0.05);与模型组相比,艾灸组和1-MT组小鼠结肠组织IDO1 蛋白表达明显下调(P<0.05),艾灸组和PCPA 组小鼠结肠组织TPH1 蛋白明显下调(P<0.05),见表3,图2,图3。
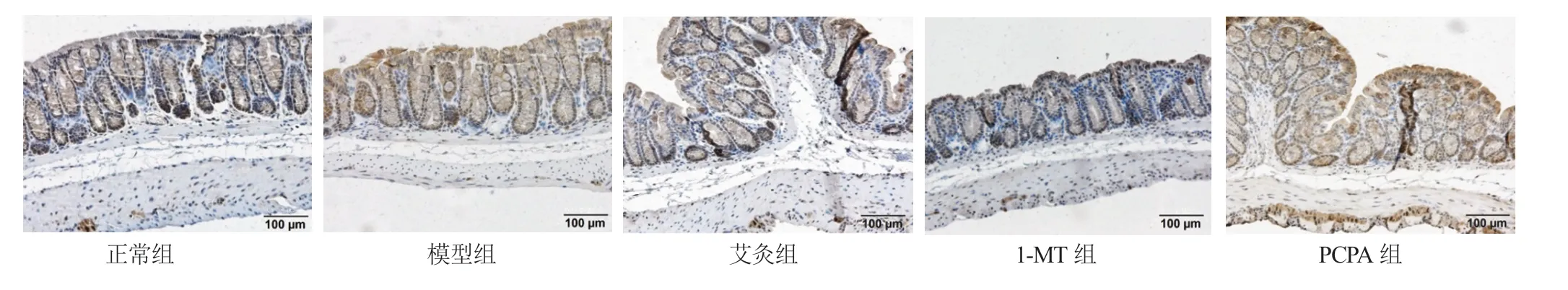
图2 各组小鼠结肠组织IDO1 蛋白表达(免疫组化法)
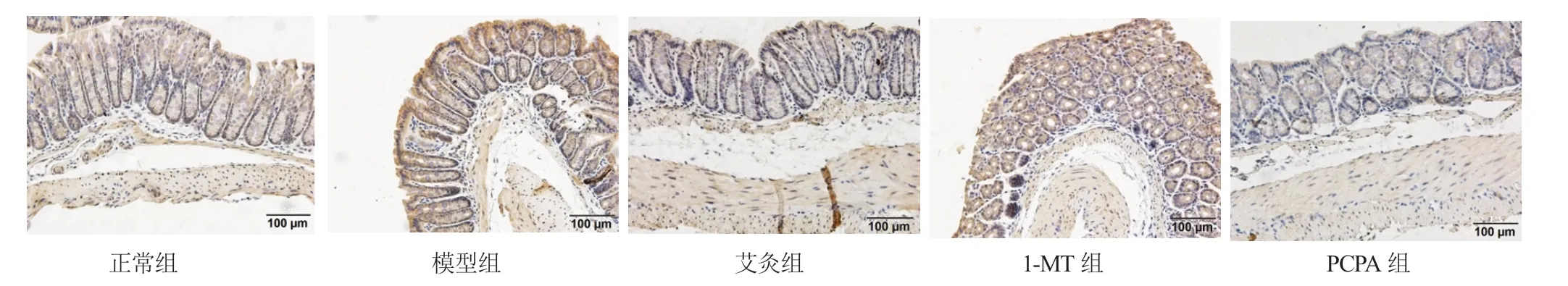
图3 各组小鼠结肠组织TPH1 蛋白表达(免疫组化法)
表3 各组小鼠结肠IDO1、TPH1 蛋白表达比较(± s,n = 6)
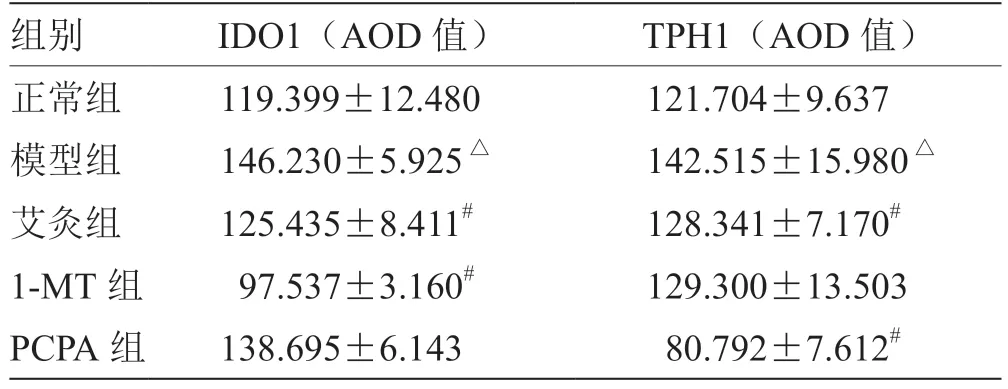
表3 各组小鼠结肠IDO1、TPH1 蛋白表达比较(± s,n = 6)
注:与模型组比较,# P <0.05;与正常组比较,△P <0.05
组别 IDO1(AOD 值) TPH1(AOD 值)正常组 119.399±12.480 121.704±9.637模型组 146.230±5.925△ 142.515±15.980△艾灸组 125.435±8.411# 128.341±7.170#1-MT 组 97.537±3.160# 129.300±13.503 PCPA 组 138.695±6.143 80.792±7.612#
2.5 艾灸对小鼠结肠组织IDO1、TPH1 mRNA 表达的干预 与正常组相比,模型组结肠组织IDO1 mRNA 表达明显升高(P<0.05),模型组结肠组织TPH1 mRNA 表达明显升高(P<0.05);与模型组比较,1-MT 组结肠组织IDO1 mRNA 表达明显降 低(P<0.05),PCPA 组结 肠 组 织TPH1 mRNA 表达明显降低(P<0.05),见表4。
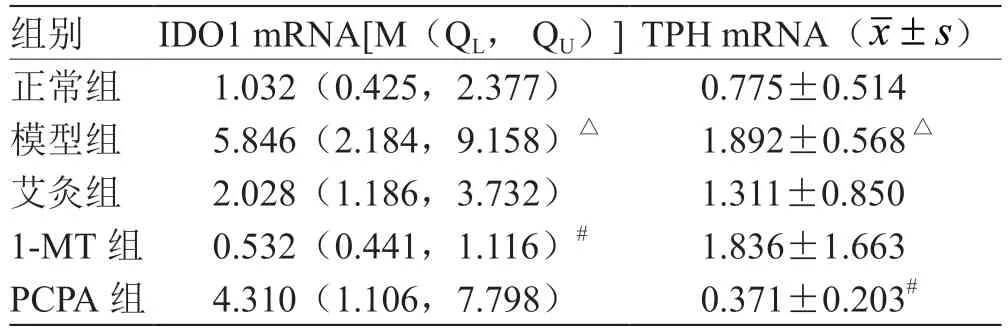
表4 各组小鼠结肠IDO1、TPH mRNA 表达比较(n = 6)
2.6 艾灸对小鼠结肠组织Trp-Kyn/5-HT 代谢的影响
2.6.1 各组小鼠结肠组织Trp-Kyn代谢物含量比较 与正常组相比,模型小鼠Kyn/Trp 比值显著升高(P<0.05);与模型组相比,艾灸组Kyn/Trp 比值、1-MT组Kyn 含量及Kyn/Trp 均显著降低(P<0.05),见表5。

表5 各组小鼠结肠组织Trp-Kyn 代谢相关物质比较[M(QL, QU),n = 6] pg/mL
2.6.2 各组小鼠结肠组织Trp-5-HT 通路相关代谢物含量比较 与正常组相比,模型小鼠结肠组织5-HT 含量显著升高(P<0.05);与模型组比较,PCPA 组5-HT/Trp 含量显著降低(P<0.05),见表6。
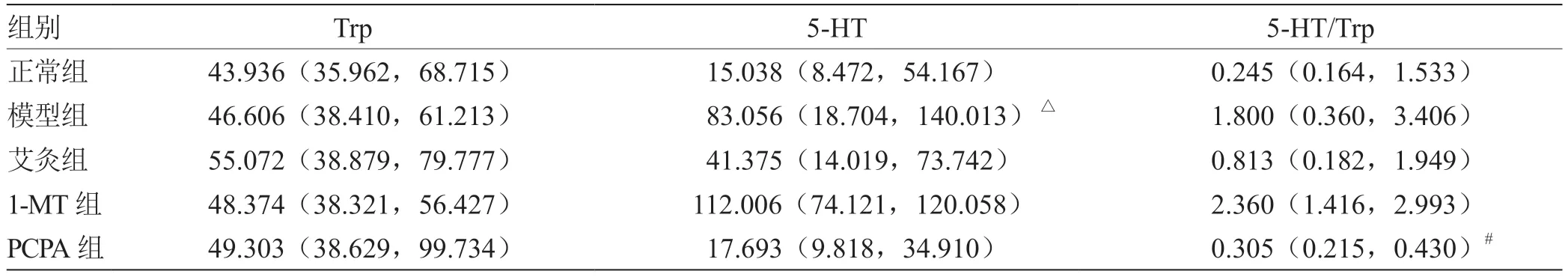
表6 各组小鼠结肠Trp-5-HT 通路代谢物含量比较[M(QL, QU),n = 6)] pg/mL
3 讨论
IBS 治疗包括止泻药、抗抑郁药或肠道微生态调节剂等方式[11]。艾灸是借灸火的温热效应(艾灸温通作用的理论探讨),基于其温经散寒、通腑止痛的功效,通过腹部所过之任脉及胃肠病所属之足阳明胃经为介导,以达到平衡脾胃气机升降之效。前期研究结果表明,艾灸可显著改善IBS 患者腹痛腹胀等症状[12],其镇痛效应研究结果也已证实[13]。艾灸可能通过调节免疫功能、5-羟色胺以及肠道微生物群等途径改善IBS[14],然而尚不清楚艾灸对于IBS 中Trp 代谢的影响。
本实验中选取的足三里是胃肠疾病的首选穴之一,对“腹痛”“泄泻”“便秘”等疾病的古代文献进行数据显示足三里度值最高,与其他穴位连通性好[15]。研究表明,TRPV1 的激活温度大于43℃。本课题组研究显示,以艾灸干预内脏痛模型小鼠,(45±1)℃可增加其足三里局部穴区nTRPV1荧光表达,而(37±1)℃nTRPV1 荧光表达未见增多[16]。
慢性内脏痛是一个中枢外周共同作用产生的病理现象[17-18],隔药灸、温和灸均对慢性炎性内脏痛大鼠有良好的镇痛作用[19-20]。艾灸可改善痛觉过敏大鼠结肠相关镇痛物质浓度,提高痛阈值[21]。其痛敏改变是多种物质及通路共同作用的结果[22]。胃肠道局部病变会导致外周穴区到结肠组织中的肠嗜铬细胞和肥大细胞活化,释放5-HT[23]降低下丘脑异常升高的P物质、5-羟色胺等含量,可提高痛阈[24]。本研究提示正常与模型小鼠间AWR 评分有差异,模型小鼠存在内脏痛敏现象,艾灸可改善IBS 模型小鼠内脏痛敏程度。
慢性疼痛过程中存在Trp 的代谢紊乱,内脏痛为IBS 的主要症状,犬尿氨酸是Trp 参与神经功能调节的重要途径,亦是内脏疼痛的关键[25]。Trp 分解代谢物如Kyn、KA、3-HK 和QA 等具有神经活性,Kyn 代谢物可能通过QA 和KA 调节神经元的兴奋性,从而影响神经系统的正常功能。慢性收缩损伤模型小鼠海马和脊髓中IDO 表达升高,Kyn/Trp 比值升高,5-HT/Trp 比值降低,5-HT/5-HIAA 比值降低[26]。除疼痛等胃肠道症状外,IBS 的共病如情绪障碍等与Kyn 浓度改变也有一定相关性,Kyn/Trp 升高,IDO 活性的增强,导致IBS 精神病共病患者重度抑郁现象[27]。IBS患者5-HIAA 水平和5-HIAA/5-HT 比值较健康对照组降低[28]。5-HT 在肠粘膜与5-HT 受体结合。研究表明IBS 模型动物存在内脏高敏感,且血清5-HT、5-HIAA含量均显著升高,艾灸可通过减少IBS 模型大鼠血清5-HT、5-HIAA 含量改善内脏敏感性[29],与本研究结果相似,提示IBS 模型小鼠内存在内脏高敏感现象,且存在TPH、IDO 蛋白及mRNA 的过表达,Trp-Kyn途径限速酶IDO 活性增强。温和灸治疗可下调IBS 模型小鼠体内TPH、IDO蛋白的过表达,降低IDO酶活性。

