慢性镉暴露小鼠的肝脂质组学研究
郝蓉蓉,李 玲,田 丽,谢 佳,陈梦妍,余争平,皮会丰 (陆军军医大学军事预防医学系军队劳动卫生学教研室/教育部电磁辐射医学防护重点实验室,重庆 400038)
镉属于有毒重金属,其化合物被广泛用于电池、染料、电镀、化妆品、香烟等,在日常生活中十分常见。含镉废物若处理不当会导致镉污染。富含镉的饮食和饮水是人镉暴露的主要途径[1]。镉在人体主要蓄积于肝和肾[2],并对其造成损伤。目前,因脂质代谢异常引发的疾病是最常见的慢病。研究表明,脂质代谢参与了高脂血症、肥胖、2 型糖尿病、动脉粥样硬化和皮肤病变的发生及发展[3]。流行病学研究表明,镉接触与中年人非酒精性脂肪性肝病的患病有关[4]。既往有研究通过氯化镉灌胃成功构建了镉暴露小鼠非酒精性脂肪性肝病模型[5]。还有研究显示,镉暴露会加重原有的非酒精性脂肪性肝病[6]。但目前对于镉暴露诱导肝脂质谱的变化仍然缺乏系统研究。
脂质组学是一种基于高通量分析技术,系统性解析生物体脂质组成与表达变化的研究模式,其可高效研究脂类家族和脂质分子在各种生物过程中的改变与功能,进而阐明相关的生物活动过程与机制[7]。目前,脂质组学分析一般采用液相色谱-质谱联用技术(liquid chromatography-tandem mass spectrometry,LC-MS/MS),主要分为非靶向分析和靶向分析两类。本研究采用基于UPLC-Orbitrap 质谱系统的非靶向脂质组学分析平台[8],并结合LipidSearch(Thermo Scientific™)软件进行脂质鉴定与数据预处理,采用相对定量对组间的差异进行分析,并通过KEGG 富集筛选出差异脂质分子参与的代谢通路,为进一步了解慢性镉暴露诱导非酒精性脂肪性肝病的机制提供依据。
1 材料与方法
1.1 实验材料及主要试剂
本次实验所用均为SPF 级C57BL/6J 雄性小鼠(8 周龄),由陆军军医大学实验动物中心[动物生产许可证号:SCXK(渝)20170002,使用许可证号:SYXK(渝)20170002]提供。本研究实验设计、实验过程及动物处死方法均经陆军军医大学实验动物福利伦理审查委员会审核通过(AMUWEWC2020059)。氯化镉购自美国Sigma-Aldrich公司。
1.2 构建慢性镉暴露小鼠模型和样本收集
雄性C57BL/6J小鼠12只,在SPF级环境中适应性饲养1 周后,将小鼠随机分为对照组(正常水喂养)和实验组[镉水(0.6 mg/L CdCl2)喂养],每组6 只。小鼠自由饮水及进食6 个月后处死,即刻采集肝组织后存放于-80 ℃冰箱中,干冰运送至上海中科新生命有限公司进行LC-MS/MS分析,测定肝脂质组学。
1.3 样本预处理方法
取适量小鼠肝组织样本,剪碎后加入200 μL 水涡旋,加入800 μL 甲基叔丁基醚涡旋混合,加入240 μL预冷甲醇涡旋混合,低温水浴中超声20 min,室温放置30 min,14 000 g 10 ℃离心15 min,取上层有机相,氮气吹干;质谱分析时加入200 μL 90%异丙醇/乙腈溶液复溶,充分涡旋,取90 μL 复溶液,14 000 g 10 ℃离心15 min,取上清进样分析。
1.4 LC-MS/MS
色谱分析:样品采用UHPLC Nexera LC-30A 超高效液相色谱系统进行分离。C18色谱柱;柱温45 ℃;流速300 μL/min。流动相A 为乙腈水溶液(乙腈∶水=6∶4,v/v),流动相B 为乙腈异丙醇溶液(乙腈∶异丙醇=1∶9,v/v)。
质谱分析:采用电喷雾电离(正离子和负离子模式)进行检测,样品经UHPLC分离后采用Q Exactive系列质谱仪(Thermo Scientific™)进行质谱分析。按照下列方法确定脂质分子和脂质碎片的质荷比:每次全扫描后采集10 个碎片图谱(MS2 scan,HCD)。MS1在质荷比为200 时分辨率为70 000,MS2在质荷比为200 时分辨率为17 500。
1.5 脂质组学KEGG分析
通过脂质组学筛选的差异脂质进行KEGG通路富集分析。
1.6 油红O染色
取对照组和实验组小鼠肝冰冻切片,然后用4%多聚甲醛固定,放入新配过滤的油红O 工作液,浸染8~10 min(加盖避光)后进行背景分化,取出切片停留3 s后浸入60%异丙醇10 min,随后进行细胞核苏木素染色3~5 min,最后返蓝液返蓝1 s,自来水中浸洗。
1.7 统计学处理
采用GraphPad Prism 8.0 软件进行分析,计量数据以均数±标准差()表示,2 组间比较采用t检验,多组间比较采用单因素方差分析,每个实验至少重复3 次。P<0.05 为差异有统计学意义,P<0.01 为差异具有极显著性统计学意义。
2 结果
2.1 肝组织油红O染色
取小鼠部分肝组织进行油红O染色,结果显示,对照组和实验组小鼠肝细胞内未见明显脂滴沉积或增多,见图1。

图1 油红O染色
2.2 模型质量验证
本实验通过脂质组学探究镉暴露小鼠脂代谢相关的脂质分子的变化,反映镉暴露对小鼠脂代谢水平的影响。对鉴定到的脂质分子进行主成分分析(principal component analysis,PCA),对照组和实验组在PCA 得分图上均有不同的聚类趋势(图2a),说明2 组小鼠的肝组织中脂质成分存在显著差异。正交偏最小二乘法判别分析(orthogonal partial least squaresdiscriminant analysis,OPLS-DA)得分图显示,实验组样本均远离对照组样本,提示镉暴露可明显改变小鼠体内内源性脂质水平(图2b)。同时,为避免OPLS-DA中发生过拟合,采用置换检验对模型进行检验,以保证模型的有效性。经7次循环交互验证得到的置换检验显示,OPLS-DA 模型评价质量较好(R2y=0.989;Q2=0.921;R2X=0.592),见图2c。火山图显示,调整后的P值与镉暴露后相关的脂质含量变化倍数(fold change,FC)之间的关系(FC>1.5、P<0.05)为FC越大,差异越显著(图2d)。以上检验均提示对照组和实验组样本之间存在显著差异,表明镉暴露导致肝脂质代谢发生了显著改变。
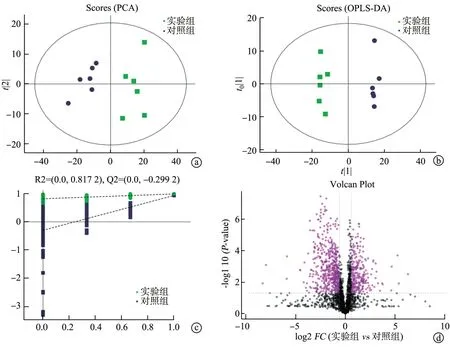
图2 模型质量验证
2.3 脂质组学结果分析
本研究基于OPLS-DA 模型筛选出与镉暴露密切相关的差异代谢物,正、负离子模式下鉴定到的样本中脂质亚类共43种,包含各类中鉴定到的脂质分子共2 709个(图3a)。脂质组成分析发现,实验组中排名前10 的脂质亚类为磷脂酰胆碱(PC)37.572%、三酰甘油(TG)32.22%、磷脂酰乙胺醇(PE)8.916%、二酰甘油(DG)5.747%、磷脂酶C(LPC)4.318%、磷脂(SM)2.051%、鞘神经酰胺(Cer)1.513%、磷脂酰肌醇(PI)1.242%、鞘氨醇(SPH)1.212% 和甾醇酯类(ST)0.942%(图3b)。对照组排名前10 的脂质亚类为三酰甘油(TG)48.316%、磷脂酰胆碱(PC)27.832%、二酰甘油(DG)6.149%、磷脂酰乙胺醇(PE)6.138%、磷脂酶C(LPC)3.864%、鞘磷脂(SM)1.646%、神经酰胺(Cer)0.926%、磷脂酰肌醇(PI)0.85%、鞘氨醇(SPH)0.811%、溶血磷脂酰乙醇胺(LPE)0.704%(图3c)。与对照组相比,实验组磷脂酰乙胺醇(PE)、磷脂酰胆碱(PC)、磷脂酶C(LPC)、鞘磷脂(SM)、磷脂酰肌醇(PI)、鞘氨醇(SPH)、甾醇酯类(ST)、神经酰胺(Cer)占比增加,二酰甘油(DG)、三酰甘油(TG)占比减少,提示在慢性镉暴露下肝组织含甘油占比下降。

图3 脂质亚类组成
2.4 显著性差异脂质分子的鉴定
以VIP>1 和P<0.05 为筛选标准,筛选到144 个具有显著性差异的脂质分子,涉及17 种脂质亚类:三酰甘油(TG)、二酰甘油(DG)、甘油一酯(MG)、甘油磷脂(PA)、磷脂酰胆碱(PC)、磷脂酰乙胺醇(PE)、磷脂酰丝氨酸(PS)、磷脂酰肌醇(PI)、鞘磷脂(SM)、鞘磷脂(phSM)、鞘氨醇(SPH)、甾醇酯类(ST)、心磷脂(CL)、神经酰胺(Cer)、辅酶(Co)、己糖神经酰胺(Hex1Cer)、磷脂酶C(LPC),见图4a。实验组中共有68 种差异脂质分子上调,76种差异脂质分子下调(图4b)。将差异脂质分子通过KEGG 富集得到6 种通路:甘油磷脂代谢、亚油酸代谢、α-亚麻酸代谢、糖基磷脂酰肌醇(GPI)生物合成、甘油脂代谢、花生四烯酸代谢(图4c)。
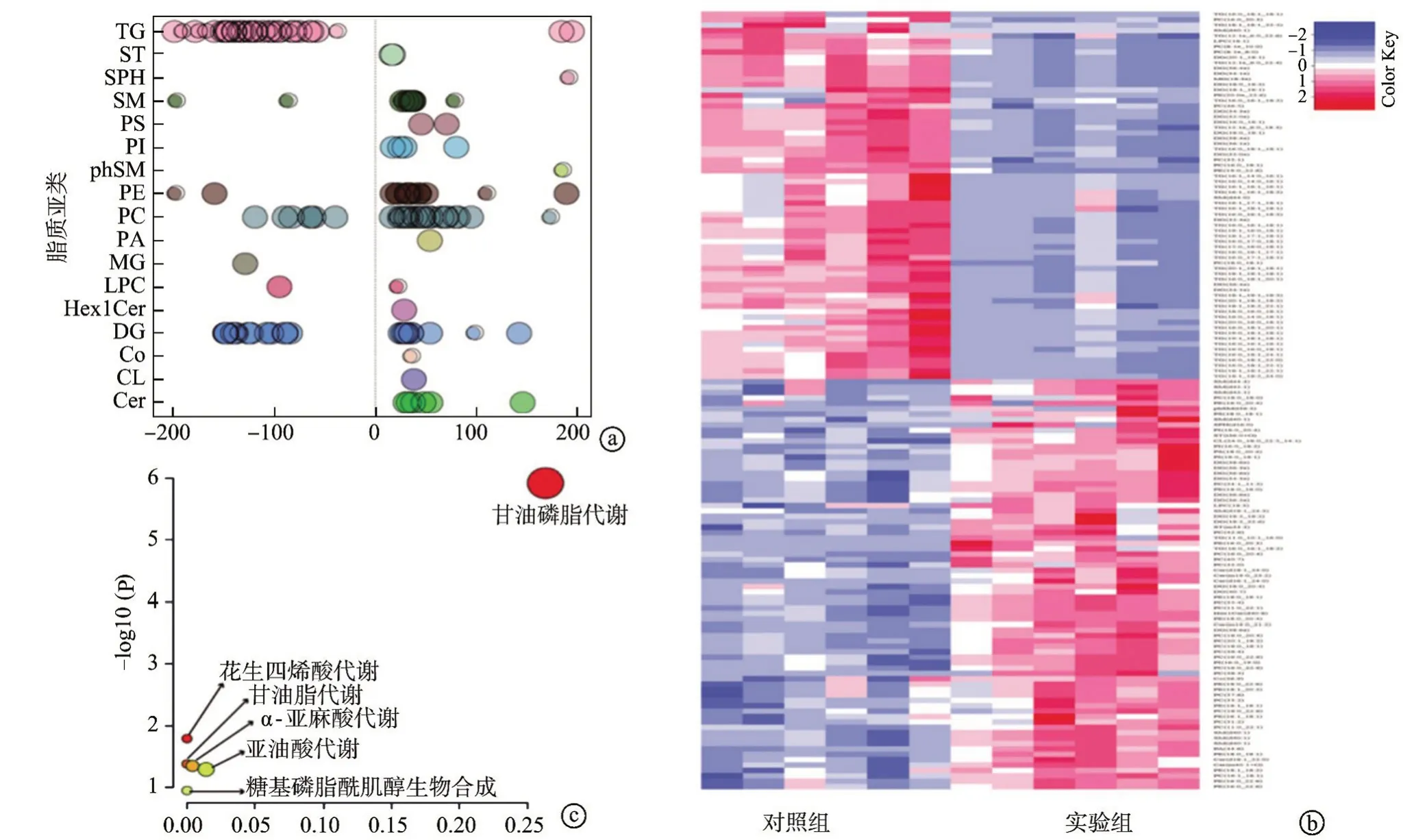
图4 显著差异分子表达
2.5 显著性差异脂质分子的链长度分析
对筛选出来的43 种脂质亚类进行分子层面的分析发现,在碳原子数目总和(C)>21的长链脂肪酸中含有显著性差异的脂质亚类16 种(图5a、b),12 图5 不同碳链长度脂质分子分析 镉作为有毒重金属,进入人体后在体内蓄积,半衰期为10~30年[9]。肝是脂质代谢最主要的场所。本课题组前期研究显示,与对照组相比,慢性镉暴露组小鼠血清中丙氨酸氨基转移酶和天冬氨酸氨基转移酶含量显著增加,HE 染色提示肝组织内炎症细胞浸润,出现局灶性坏死,肝细胞发生气球样变[10]。本研究采用镉水(0.6 mg /L CdCl2)喂养6个月的方式,深入了解慢性镉暴露对肝脂质代谢的影响[11]。既往研究报道,小鼠在饮用镉水(0.6 mg/L CdCl2)13周后测得血镉浓度为0.3~0.4 μg/L[12],与美国一般非吸烟者人群血镉浓度相当[13]。我国成年男性的血镉浓度为0.38~2.88 μg/L,成年女性的血镉浓度为0.31~0.92 μg/L[14]。研究表明,镉污染环境地表水和地下水中镉浓度为0.025~6.26 mg/L[15]。因此,本研究中使用的镉浓度相对较低,与环境相关,能够模拟建立长期镉暴露环境。既往研究通过给C57BL/6J 小鼠自由饮用镉水(10 mg/L)20 周,行脂质油红O 染色发现,实验组小鼠有大量脂滴沉积于肝组织,且出现非酒精性脂肪性肝病的改变[5]。本研究通过对小鼠进行镉水喂养24周后对肝组织进行脂质油红O 染色发现,与对照组相比,实验组小鼠未见脂滴形成。由于本研究所采用的镉浓度(0.6 mg/L CdCl2)远低于10 mg/L,因此考虑剂量差异导致肝组织油红O 染色未见脂滴形成,但不否定肝代谢发生异常变化。我们进一步对肝组织行脂质组学分析,发现了144种具有显著差异的脂质分子;进行通路富集发现,这些差异脂质分子主要参与甘油磷脂代谢、亚油酸代谢、α-亚麻酸代谢、糖基磷脂酰肌醇生物合成、甘油酯代谢、花生四烯酸代谢。 三酰甘油是一种化合物,由甘油的3 个羟基与3 个脂肪酸分子酯化生成的甘油酯,其增高可使血液黏稠度增加,加速动脉粥样硬化,从而引发心血管疾病[16-18]。脂肪在肝细胞内大量积聚可导致非酒精性脂肪性肝病的产生[19]。本研究发现,三酰甘油(11:0_10:1_16:0)和三酰甘油(16:0_16:1_18:2)在实验组中显著增高,可能成为前期非酒精性脂肪性肝病的潜在生物分子指标。二酰甘油具有多种营养功能,能够预防肥胖、高血糖、心血管疾病,抑制胰岛素抵抗,减轻非酒精性脂肪性肝病的症状[20-21]。本研究发现,实验组的二酰甘油明显降低,这一改变可能对非酒精性脂肪性肝病的形成提供了条件。磷脂是生物膜的主要成分,分为甘油磷脂与鞘磷脂两大类。甘油磷脂主要包括磷脂酰胆碱、磷脂酰乙醇胺和磷脂酰肌醇,磷脂酰胆碱分布最广,也是二酰甘油、溶血磷脂酰胆碱和花生四烯酸等脂质信使的前体。有研究表明,磷脂酰乙醇胺n-甲基转移酶敲除(Pemt(-/-))小鼠的磷脂酰胆碱(PC)/磷脂酰乙醇胺(PE)下降会导致细胞膜完整性丧失,引发肝损伤,并发展为非酒精性脂肪性肝病[22]。通过给Pemt(-/-)小鼠喂养缺乏胆碱饮食会发生快速非酒精性脂肪性肝病,导致肝功能衰竭[23]。本研究结果显示,实验组和对照组中磷脂酰胆碱(PC)和磷脂酰乙醇胺(PE)占比均发生改变(实验组中PC/PE 约为4.21,对照组中PC/PE 约为4.46)。根据本次结果,我们认为慢性镉暴露有可能会使PC/PE 降低,进而改变肝细胞膜的完整性,诱发肝损伤,造成非酒精性脂肪性肝病。神经酰胺是由长链脂肪酸与鞘氨醇的氨基经脱水而形成的一类酰胺化合物[24],其可以破坏胰岛素敏感性、胰腺β细胞功能、血管反应性和线粒体代谢,在大鼠和小鼠中抑制神经酰胺生物合成,诱导神经酰胺降解可以改善许多代谢疾病,包括糖尿病、心肌病、胰岛素抵抗、动脉粥样硬化和非酒精性脂肪性肝病[25-27]。小鼠体内实验发现,去除二氢神经酰胺去饱和酶或增加酸性神经酰胺酶活性来降低肝的神经酰胺水平时,肝脂肪变性减少[28]。临床数据显示,非酒精性脂肪性肝病患者神经酰胺水平显著增加[29]。本研究发现,实验组中神经酰胺水平明显升高,但未发现明显脂滴沉积,表明机体存在自我保护机制,有助于抑制因神经酰胺水平升高而引起的非酒精性脂肪性肝病,使机体处于代偿期。同时,差异脂质分子参与甘油酯、亚油酸和花生四烯酸的代谢,这3 种代谢通路均与非酒精性脂肪性肝病的形成有关[30-33]。 综上所述,本研究通过建立慢性镉暴露雄性小鼠模型分析发现,慢性镉暴露可引起肝脂质代谢紊乱,由于机体的自我保护能力和疾病发展的病理生理过程,可能镉暴露的时间进一步延长,其造成的肝脂质紊乱会发展为非酒精性脂肪性肝病。但本研究仅采用雄性小鼠,不能完全代表慢性镉暴露后小鼠的肝脂质代谢的变化情况。后期我们将优化实验设计,通过构建雌雄各半的实验模型,进一步研究慢性镉暴露诱导肝的脂质改变及其具体机制。
3 讨论

