细胞焦亡在糖尿病创面愈合中的研究进展
竺仕林,葛星月,杨雅量,李文武,姚明哲,唐乾利
(1.右江民族医学院研究生院,广西 百色 533000;2.右江民族医学院/广西高校桂西地区高发病防治重点实验室,广西 百色533000)
糖尿病患者损伤后创面愈合延缓或终年难愈,是糖尿病比较严重的并发症之一,也是糖尿病患者致残的重要原因之一,严重威胁着患者的健康。糖尿病创面难以愈合的机制之一是过度的炎症反应,而此与细胞焦亡过程有关。细胞焦亡是一种以Gasdermin 为关键介导因子的程序性细胞死亡过程[1],是机体很重要的一种非特异性免疫机制,其能够在感知外源性病原体的同时识别内源性危险信号,并拮抗这些危险因素。焦亡的特征是Gasdermin 家族蛋白介导的孔形成、细胞裂解和促炎细胞因子的释放。当发生细胞焦亡时,细胞膜上会出现1~2 nm 的小孔,并伴随细胞肿胀,胞内物质(如炎症因子、炎症小体复合物等)经由小孔流出,随后细胞膜裂解,染色质降解,细胞死亡,进而诱发级联放大的炎症反应。近年来,许多研究者将细胞焦亡通路作为糖尿病创面治疗中的重要关注对象,通过拮抗细胞焦亡以达到促进糖尿病创面愈合的效果。本研究对近两年来细胞焦亡在糖尿病创面愈合中作用的相关研究进行综述,讨论糖尿病创面中靶向细胞焦亡的分子与通路,以期为临床治疗糖尿病创面提供新的思路和突破口。
1 细胞焦亡的起源和发展
1989 年,Black 等[2-4]首次发现了一种能够特异性切割白介素1β(IL-1β)前体上特定位点并将其转变为成熟IL-1β 的蛋白酶。起初研究者将其称为白细 胞 介 素-1 转 化 酶(interleukin-1 converting enzyme, ICE),随后这种特异性蛋白酶被命名为半胱天 冬 酶-1(Caspase-1)[5,6]。1992 年,Zychlinsky 等[7]发现志贺菌能够诱导巨噬细胞的“凋亡”,并且这种细胞的“凋亡”与Caspase-1 有着密不可分的联系。2001 年,D'Souza 等[8]认为这种新发现的“凋亡”与之前所认识的细胞凋亡和细胞坏死均有所不同,其特征是在细胞质膜中形成孔,细胞肿胀和破裂以及细胞溶质内容物渗漏,是溶解性和炎性细胞死亡的一种形式,于是将这种炎症程序细胞死亡定义为“细胞 焦 亡”(pyroptosis)。2015 年,2 篇 发 表 于Nature的文章认为Gasdermin D 被炎性Caspase 裂解然后产生的一个小分子结构能够使细胞膜上出现孔洞进而导致细胞焦亡[9,10]。在后续的研究中发现焦亡在宿主防御细胞内病原体感染和各种非感染性疾病中起着重要作用,可发生于不同类型的细胞中。此后,关于细胞焦亡的研究进入了高速发展时期,细胞焦亡成为了免疫领域的研究热点。
2 细胞焦亡相关蛋白分子
2.1 Caspase 家族
最初,有学者发现ICE 和线虫细胞凋亡基因编码的cell death mutant 3(CED-3)具有相同的起源[11],于是将其命名为CED-3/ICE 家族蛋白,但随后又发现了一系列的同源蛋白,遂将其统一命名为Caspase1~10[12],其中“c”意味着它们拥有半胱氨酸(cysteine)蛋白酶的催化功能,“aspase”指它们可以作用于天冬氨酸残基,这也是这类蛋白酶特有的作用机制。之后,研究者们又发现了鼠源Caspase11和Caspase12,牛 源Caspase13,人 源Caspase14。Caspase 家族蛋白在哺乳动物细胞的凋亡和焦亡中起着不可或缺的作用。在细胞凋亡中,一部分Caspase 如Caspase-8/9/10 可以识别来自细胞内外的危险信号进而激活另一部分Caspase 如Caspase-3/6/7,随后切割和激活下游因子引发细胞凋亡[13]。而在细胞焦亡中起重要作用的Caspase 被称为炎性Caspase,包括Caspase-1/4/5/11/12/13/14[14],其中导致细胞焦亡发生最关键的因子是Caspase-1 和Caspase-4/5/11[15]。Caspase 家族见图1。
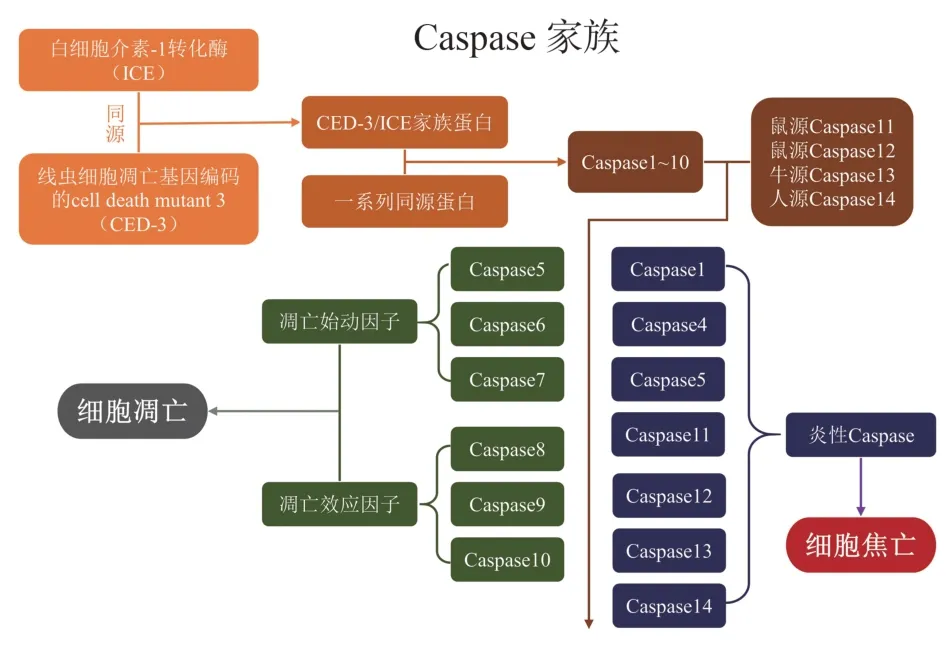
图1 Caspase 家族Fig 1 Caspase family
2.2 Gasdermin 家族
Gasdermin 的名字来源于仅在小鼠的胃肠道(局限于食道和胃)和皮肤上皮细胞中低水平表达的基因Gsdma1[16]。其中,在人体各器官中进行表达 的Gasdermin 家 族 成 员 有GSDMA,GSDMB,GSDMC, GSDMD, GSDME(DFNA5)和PJVK(DFNB59),而在小鼠各器官中进行表达的Gasdermin 家 族 成 员 有Gsdma1,Gsdma2,Gsdma3, Gsdmc1, Gsdmc2, Gsdmc3, Gsdmc4,Gsdmd[17]。其中PJVK 只含有一个N 端结构域,其余成员则含有2 个结构域分别为N 端结构域和C 端结构域,这两个结构域在生理状态下相互结合抑制。其中N 端结构域的大量表达可以产生细胞膜的破孔作用导致细胞焦亡[18]。被关注最多的是,GSDMD 能被活化的Caspase-1/4/5/11 切断结构域连接点而产生上述2个结构域[9],其中N 端可以和多种细胞膜上的脂类物质结合形成寡聚体,然后形成孔洞,进而破坏细胞膜[18]。有报道指出,GSDME 的2 个结构域之间包含一个可以被人为切割的位点,研究者发现可以利用Caspase-3 切割该位点产生活化的N 端结构域从而人为诱导细胞焦亡的发生[19]。
3 细胞焦亡分子机制通路
3.1 炎症小体激活的焦亡
3.1.1 炎症小体 炎症小体是多蛋白复合物,在感知病原体相关分子模式 (PAMP)或危险相关分子模式(DAMP)后聚集在细胞质中,炎症小体的激活是 焦 亡 的 起 点[20]。2002 年,Martinon 等[21]提 出 了“炎症小体”的概念,认为这个由纳赫特(domain present in neuronal apoptosis inhibitory protein(NAIP), CIITA, HET-E, TP1, NACHT)家族成员NALP1、含有CARD 的凋亡相关斑点样蛋白(apoptosis-associated speck-like protein contain a CARD, ASC)和Caspase-1 组成的蛋白复合物介导了Caspase-1 的激活和IL-1β 的成熟,并类比细胞色素-c(Cytochrome-c),凋亡酶激活因子-1(Apaf-1)和Caspase-9 形成的凋亡小体将其命名为炎症小体。炎症小体中的模式识别受体(PRRs)主要包含:NLRP1, NLRP3, NLRP6, NLRP7, NLRC4, NLRC5和PYRIN(pyrin and HIN domaintein)以及AIM2(absent in melanoma 2)等[22]。
3.1.2 经典炎症小体信号通路 胞质中存在的模式识别受体如NLRP3 等可以识别外源微生物相关的保守分子(PAMPs)或损伤相关的内源信号(DAMPs),随后活化并寡聚,接着结合接头蛋白ASC 和Caspase-1 组装形成炎症小体,然后Caspase-1 会切割GSDMD,加工一些炎症因子如pro-IL-1β 和pro-IL-18。GSDMD 被 切 割 后 产 生 的N 端结构域会将细胞膜破孔透化形成GSDMD 孔,同时促进成熟的IL-1β 和IL-18 的释放,之后细胞逐渐裂解,引发细胞焦亡。在细胞膜没有完全裂解之前,GSDMD 孔还可以释放许多大分子物质或结合物比如白细胞介素1α(IL-1α),危险分子如高迁移率族蛋白-1(HMGB-1),甚至整个炎症小体复合物[23,24]。
3.1.3 非经典炎症小体信号通路 Caspase-4/5/11可以直接识别来自革兰阴性菌的脂多糖(LPS)随后活化并寡聚,其切割GSDMD 产生的N 端结构域有细胞膜破孔性并允许钾离子的释放,在此期间一些特定的炎症小体如NLRP3 也能因此活化进而促进炎症因子的成熟。同时,GSDMD 孔使得细胞膜裂解导致细胞焦亡,许多细胞因子得以释放[24]。
3.2 非炎症小体激活的焦亡
在生理状态下,GSDMD 的2 个结构域能够互相抑制而不表现出生物学作用,但是被激活的Caspase-1/4/5/11 可以特异性识别其结合位点并破坏从而获得具有细胞膜破孔性的N 端结构域,进而引发细胞焦亡。研究者发现,将GSDMD 的切割位点改为Caspase-3 识别序列,可以使得原本正在进行的Caspase-3 介导的细胞凋亡转变为焦亡,说明N 端结构域本身就可以引发细胞焦亡[9]。此外,GSDMD的同族蛋白GSDME 及其切割产生的N 端结构域也具有这样的生物学特点[19]。
3.3 Gasdermin D-N 端结构域的负反馈调控作用
最新的研究表明,GSDMD 的N 端结构域可以直接靶向作用并抑制Caspase-1/11 从而缓和炎症小体的激活以抑制焦亡下游环节的触发。研究者确认了GSDMD 的N 端结构域的β1-β2 环中的RFWK模体为关键分子结构,并设计了一种类似分子表现出很强的抗炎作用[25]。
4 糖尿病创面中靶向细胞焦亡的分子与通路
4.1 间隙连接蛋白(Cx43)/活性氧(ROS)信号通路
研究表明,活性氧在NLPR3 炎症小体的激活过程中起着非常重要的作用[26],大量的活性氧可诱导硫氧还蛋白相互作用蛋白(TXNIP)从细胞核转位进入细胞质并结合NLRP3 蛋白从而激活NLRP3炎症小体[27]促进细胞焦亡。而活性氧是少数几种可以通过由血管间隙连接通讯的主要连接蛋白Cx43[28]组 成 的Cx43 通 道 来 传 递 信 号 的 分 子 之一[29]。近年来,生物活性玻璃在软组织,尤其是创面修复领域展现出了巨大的前景[30]。有研究团队结合体内实验和体外实验发现生物活性玻璃(bioactive glass,BG)可以通过下调Cx43/ROS 信号通路抑制内皮细胞焦亡来促进创面愈合。生物玻璃与创面体液接触后,通过离子交换在创面形成碳酸羟基磷灰石(hydroxy-carbonate-apatite,HCA)结构,下调内皮细胞上Cx43 蛋白以降低ROS 活性水平,从而抑制NLRP3 炎症小体对caspase-1 的激活,减弱GSDMD 的破孔活性,最终抑制内皮细胞的焦亡,促进血管的形成加速创面愈合[28]。而活性氧在作为NLPR3 的“触发器”的同时,也大量产生于炎症反应后期免疫细胞激活和浸润的过程中,是NLPR3 的“效 应 器”[26]。抑 制 活 性 氧 的 生 成 不 仅 可 以减少其对细胞的直接损伤,更可以借此抑制细胞焦亡,减少持续炎症对机体的损害,促进创面的修复。糖尿病患者皮肤受损后氧化应激加强,成纤维细胞生物学行为改变,修复细胞功能改变,创面修复困难[31],以活性氧作为糖尿病难愈合创面的治疗靶点,应可取到较好疗效。
4.2 中性粒细胞胞外陷阱(neutrophil extracellulartraps, NETs)和双硫仑
被激活的中性粒细胞会将DNA、组蛋白和颗粒酶(如中性粒细胞弹性酶)等释放到胞外组成一种纤维性细胞外结构,这种结构被称为中性粒细胞胞外 陷 阱(neutrophil extracellular traps, NETs)[32]。过度的NET 会延缓糖尿病患者的伤口愈合[33],有团队通过体外实验和体内糖尿病创面愈合小鼠模型(宽型、NLRP3-/-、Casp-1-/-和GSDMD-/-小鼠)证明了NLRP3 /Caspase-1/ GSDMD 通路可激活糖尿病创面组织中性粒细胞的释放,从而导致NET 的形成,而GSDMD基因缺失可避免NET 的形成[34]。同时发现可以直接共价修饰Cys191 的双硫仑能通过抑制GSDMD 孔的产生来减少NET 的形成从而促进NETs 介导的糖尿病足溃疡的愈合[35]。该团队将着眼点放于细胞焦亡下游的通路和因子,提供了一种新的研究思路。
4.3 毛囊间充质干细胞来源的外泌体(HF-MSC-Exo)
近些年来,外泌体成为了再生医学领域的研究热点[36],有研究者发现lncRNA H19 在毛囊间充质干细胞来源的外泌体(HF-MSC-Exo)中高表达,且HF-MSCs-Exo 可促进糖尿病创面愈合。通过体内和体外实验证实了HF-MSCs-Exo 可以抑制Caspase-1 的激活和GSDMD 的裂解从而抑制细胞焦亡来促进糖尿病小鼠皮肤创面的愈合过程[37]。该研究确定了HF-MSCs-Exo 在NLRP3 介导的细胞焦亡信号通路中的作用,但其作用的具体环节和机制还有待进一步研究,考虑到携带lncRNA 的外泌体在再生医学领域的巨大潜力,笔者认为其将来或可成为糖尿病难愈合创面的一大重要治疗方法,值得深入探索和研究。
4.4 穿孔素-2(P-2)和AIM2 炎症小体
有研究报道驻留在糖尿病足部溃疡(DFUs)表皮内的金黄色葡萄球菌会触发AIM2 炎症小体的激活并诱导焦亡,而穿孔素-2 可以显著抑制金黄色葡萄球菌在DFUs 的表皮细胞内积聚[38],但与此同时,金黄色葡萄球菌也能抑制人类皮肤中的P-2[39]。该团队指出,若在DFUs 组织中P-2 被抑制并且有金黄色葡萄球菌的积聚,即使没有临床感染迹象,也可以认为患者具有较高的感染和进一步并发症的风险[38]。该团队将着眼点放于金黄色葡萄球菌对细胞焦亡的诱导作用及其共同产生的延长糖尿病创面愈合的生物学效应,证明了以抑制细胞焦亡为目的而靶向于细胞内金黄色葡萄球菌对治疗糖尿病难愈合创面有着积极的意义。
4.5 NLRP3 炎性小体的调控
许多研究表明,通过调控NLRP3 炎症小体的激活可以有效控制糖尿病创面修复过程中细胞焦亡的发生。复旦大学中山医院刘坚军团队发现,去泛素化酶USP30 可以通过去泛素化NLRP3 来激活NLRP3 炎症小体,而使用USP30 抑制剂MF-094 治疗可以导致NLRP3 及其下游的Caspase-1 蛋白水平下降从而促进糖尿病大鼠伤口愈合[40]。同时,也有研究者发现双链RNA 依赖性蛋白激酶(PKR)和NALP3 在高糖+LPS 刺激的巨噬细胞以及糖尿病创面中均表达上调,使用PKR 特异性抑制剂C16 抑制PKR 可以减少巨噬细胞和糖尿病创面中NALP3、Caspase-1、IL-1β 的表达,加速糖尿病小鼠创面愈合的过程[41]。该研究明确了PKR-NLRP3 链在糖尿病创面细胞焦亡过程中的生理重要性。此外,一些中药成分也被发现可以参与调控NLRP3 炎症小体。在糖尿病小鼠创口愈合早期,染料木素可使NLRP3 炎症小体恢复到基础水平,并改善炎症(TNFα、iNOS、COX2 和NFκB)和抗氧化防御系统(Nrf2、HO-1、GPx 和过氧化氢酶)[42]。薰衣草精油可以通过抑制巨噬细胞的焦亡来减少炎症因子的产生,改善炎症反应,从而促进包括LPS 诱导的糖尿病创面在内的慢性创面的愈合[43]。芍药苷可通过抑制趋化因子受体CXCR2 有效抑制NLRP3 炎症小体的表达水平,控制炎症,促进DFUs 大鼠的创面愈合[44]。
5 讨论
近年来,许多研究表明细胞焦亡在糖尿病并发症的发生发展中起着重要的作用,通过抑制细胞焦亡可以有效预防和治疗糖尿病的并发症。在糖尿病的状态下,累计的晚期糖基化终产物(AGEs)通过产生ROS 促进NLRP3 炎症小体持续激活可导致角膜伤口愈合延迟和神经再生受损,从遗传学和药理学上阻断AGEs/ROS/ NLRP3 轴可以显著促进糖尿病角膜伤口愈合和神经再生[45]。而H3 松弛素可以通过抑制P2X7 受体(P2X7R)介导的NLRP3炎症小体的激活来缓解高血糖引起的视网膜病变[46]。但是在糖尿病创面愈合方向上细胞焦亡的研究才刚刚起步。许多研究通过检测细胞焦亡相关因子的表达水平变化,来探索某因素对细胞焦亡的影响,但其具体作用的靶点和调控机制很少有进一步研究。遂笔者收集近年来在该领域的研究成果进行综述,对糖尿病创面中靶向细胞焦亡的分子通路作用机制进行论述,期望对糖尿病难愈合创面的临床治疗和糖尿病创面中细胞焦亡的机制研究提供新的思路与方向。希望各位研究者能进一步探索这些已明确的治疗药物或方式对细胞焦亡的精准作用位点,以寻找更为直接、快速、有效的治疗方案,早日攻克糖尿病慢性难愈合创面这一大临床难题。
作者贡献度说明:
竺仕林:选题、检索整理文献、起草论文、修订论文;葛星月:选题、提供项目基金支持;杨雅量:整理文献、修订论文;李文武:整理文献、修订论文;姚明哲:选题、修订论文;唐乾利:选题、修订论文、终审论文、提供项目基金支持、指导性支持。
所有作者声明不存在利益冲突关系。

