AMP依赖的蛋白激酶调节脂质积累治疗非酒精性脂肪肝病的治疗研究进展
孙鹏帅 朱峰 郑丽红 王海强
1黑龙江中医药大学第一临床医学院(哈尔滨 150040);2黑龙江中医药大学(哈尔滨 150040);3黑龙江中医药大学附属第四医院消化内科(哈尔滨 150001);4黑龙江中医药大学附属第一医院消化二科(哈尔滨 150040)
非酒精性脂肪肝病(NAFLD)作为连续进展的代谢相关性肝病,也是慢性肝病最主要的患病原因[1]。世界上约有25%成年人患有NAFLD,且接近10%患者会出现相关肝病进展。非酒精性脂肪肝病已经对全球的公共健康卫生与医疗带来了巨大挑战[2]。目前对于非酒精性肝病的发病机制尚不明确,这些机制包括脂代谢异常、胰岛素抵抗、线粒体应激、炎症因子、肠道菌群等“多重打击”。其中脂代谢异常在NAFLD中扮演重要角色,肝脏作为脂质稳态的主要调节者,负责协调脂肪酸摄取、合成和氧化分解、脂质输出和再分配[3]。当肝脏发生损害后,首先会出现脂代谢紊乱诱发脂质积累,随后会继发胰岛素抵抗、线粒体应激以及炎症分子的释放等相关反应[4]。由于非酒精性脂肪肝病疾病的复杂性,目前FDA 批准有效药物作为NAFLD 的治疗药物较少,NAFLD 的治疗手段需要完善[2,5]。
1 NAFLD中的脂质积累异常相关作用机制
脂质积累是NAFLD 发病与进展的最主要病因之一[5]。脂质积累导致脂肪变性过程的发生,同时产生脂毒性物质造成了肝细胞的损伤[6-7]。在脂质代谢紊乱的背景下,脂肪积累导致相应信号分子的激活,随后发展为胰岛素抵抗和肝脂肪变性[8]。动物实验表明[9],由于脂肪积累,肝脏炎症标志物与内脏脂肪在一定程度上存在相关性,且肝炎的发生是由内脏脂肪积累所介导。由于脂质积累与NAFLD 中的其他机制,氧化应激,炎症反应,胰岛素抵抗相互作用,导致脂毒性物质合成加剧,脂毒性物质积累后会通过其他途径会进一步加剧NAFLD 疾病发生与进展[10-11]。脂毒性物质对NAFLD 疾病影响主要集中于肝内及肝肠轴两部分。根据脂毒性物质的不同进而通过炎症,肝星状细胞等加重肝脏损害形成恶性循环[12]。脂毒性物质使肠道通透性发生改变,引起肠道内菌群移位最终导致肠道细菌进入肝细胞中引起损伤,加速了疾病的发展过程[13]。
所以寻找相关信号通路的靶向药物改善NAFLD脂质积累对治疗NAFLD 有着重大意义,单磷酸腺苷激活的原蛋白激酶(AMPK)相关信号通路能够从多途径影响脂质积累,减轻脂质积累负担,为治疗NAFLD 提供了可能。
2 AMPK 通过改善脂质积累治疗NAFLD的相关机制
2.1 AMPK 结构 AMPK 作为蛋白激酶家族中的一种,其分子结构是由3 个亚基构成的复合体结构,即α亚基,β亚基与γ亚基。其中,α亚基由α1、α2 构成,β 亚基由β1、β2 构成,γ 亚基由γ1、γ2 和γ3 构成[14]。根据亚基的编码基因不同,AMPK 分子的启动方式、活化程度与异构体的结构具有相关性。在AMPK 分子中α 亚基主要为催化基因,作为上游启动分子的结合位点调控AMPK 激活方式。β 亚基和为γ 亚基为调节亚基,此外β 亚基还具有连接功能。β-亚基C 端结构域(β-CTD)与α-CTD 和γ 亚基相互作用,构成复合物的核心。γ 亚基可以通过与ATP16 竞争AMP/ADP 的相应位点来感知能量变化,并与上游分子对α 亚基的激酶结构域进行调节,使其变为磷酸化状态[15-16]。γ 亚基中包含的四个重复基因序列,其配体突变多与代谢性相关疾病存在相关性。
2.2 AMPK 及其相关信号通路对NAFLD 脂质积累的调控作用
2.2.1 AMPK 对NAFLD 脂质代谢的调控作用 AMPK 与其信号通路对细胞正常的生理功能发挥着重要调控作用,作为维持能量稳态和营养代谢的稳态传感器,其发挥作用以及激活途径主要依赖与对AMP 与ADP 的比值感知[17-18]。当AMPK 激活后,其可通过上下游信号通路调节基础物质代谢、自噬、线粒体发生与细胞生长。AMPK 对NAFLD 患者的脂质代谢调节包括对脂肪积累的改善和脂毒性物质的清除两大方面。首先AMPK 能够通过限速酶和脂肪合成酶减轻脂肪积累,抑制脂肪合成,加强脂肪分解改善脂肪积累,从而调控NAFLD 脂质代谢的稳态[19]。另外AMPK 也可通过调节其下游基因表达,调控脂肪合成相关基因表达,减少对脂质的合成。AMPK 通过直接间接保护线粒体稳态和调节氧化还原反应增强对脂质的氧化分解,促进β-氧化(FAO)的发生。AMPK 在激活后可通过自噬予以清除,恢复NAFLD 患者的脂质代谢稳态,防止疾病相关进展的发生。
2.2.2 AMPK改善脂肪的合成与分解机制 AMPK激活后抑制头部脂肪(DNL)的合成减少脂肪积累,改善NAFLD 的脂代谢情况。DNL 信号通路在储存脂肪分子过程中还经乙酰辅酶A 羧化酶(ACC)催化,且受到固醇调节元件结合蛋白1c(SREBP1c)表达的影响[3,20]。AMPK 对DNL 的合成的抑制作用,主要调控ACC 酶来抑制DNL 的生成。当AMPK 相关酶激活后可以通过AMPK—乙酰辅酶A 羧化酶1 (ACC1)通路通过抑制乙酰辅酶A 转化为丙二酰辅酶抑制DNL 的生成,调节脂肪堆积。当AMPK 激活后可直接影响AMPK-SREBP1c 信号通路,影响SREBP-1c 的活性,SREBP-1c 与多种脂肪酶的合成直接相关,包括ACC1。AMPK激活后可抑制SREBP1c活性,从而恢复对ACC1的磷酸化,从而抑制肝脏对TG 和胆固醇的转化与生成[18,21]。CHEN 等[22]实验表明,通过抑制AMPK-ACC 通路活性,会增加脂肪积累导致NAFLD 疾病进展。
AMPK 激活后能够促进β-氧化和脂肪分解。线粒体β-氧化[23]作为脂质代谢氧化的一部分,其中部分脂肪酸分子需要借助CPT1 相关酶在线粒体膜上完成。而CPT1 的活性直接影响了线粒体β-氧化的进程。当AMPK 被激活后,可作用于ACC2 蛋白上,通过AMPK-ACC2 途径抑制ACC2 的表达,而CPTA1 作为ACC2 的下游分子,当ACC2受抑制后,同样可以使丙二酰辅酶ɑ(MCD)减少。MCD 既是脂肪酸合成的前体,也是CPT1 的变构抑制剂[24],MCD 减少后CPT1 活性上升,从而增加对脂肪的氧化分解,减少脂肪积累对NAFLD 造成的损害,起到防治作用(图1)。
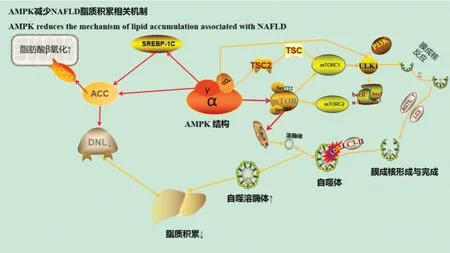
图1 AMPK 减少NAFLD 脂质积累相关机制Fig.1 Mechanisms of AMPK reducing lipid accumulation in NAFLD
2.2.3 AMPK 清除脂毒性物质改善脂质积累机制 研究[25]证明肝脏自噬在脂质代谢中起着关键作用,自噬缺乏会引起肝脏脂肪变性的加重。雷帕霉素靶蛋白(mTOR)作为磷酸肌醇3-激酶(PI3K)相关激酶家族成员,与多种蛋白相互作用形成两个功能和生化成分不同的复合物,即mTOR复合物1(mTORC1)和mTOR 复合物2 (mTORC2),它们在控制细胞生长、代谢、自噬方面有着重要作用。SHI等[26]证实AMPK-mTOR信号通路通过影响自噬在非酒精性脂肪病发挥了积极作用,当应用AMPK-mTOR 受体抑制时,观察到肝脏脂肪积累和脂肪变性加剧。AMPK 激活后通过AMPK-mTOR受体增加自噬小体与溶酶体的产生增加自噬发生,选择性对脂毒性物质进行清除。当AMPK 激活后可直接作用在mTOR 受体Ser722 和Ser792 膜蛋白中抑制mTOR 受体活性,也可通过蛋白复合体(TSC2)间接抑制mTORC1 的活性,使其自噬底物ULK1(丝氨酸/苏氨酸蛋白激酶 )升高,当ULK1酶活性升高后,其会招募beclin-1与3类和相应激酶(PI3KC3)相互作用,生成PI3,4,5-磷酸来实现自噬体的激活。此外AMPK可诱导自噬体相关蛋白ATG表达升高,促进自噬小体生成。另一方面TFEB(调控溶酶体的关键转录因子)受到mTOR受体的调控,当mTOR 受体被抑制后使得TFEB 表达升高,促进溶酶体的形成。两者融合形成自噬溶酶体,完成对脂毒性物质(LDS)的清除[27-28]。通过激活AMPK 相关信号通路增加自噬,减少脂毒性物质积累对NAFLD 造成的损伤,控制继发的炎症反应和胰岛素抵抗的加重,阻碍疾病的后续发展(图1)。
3 AMPK 通过调节脂质积累治疗NAFLD的相关药物研究进展
3.1 AMPK 改善脂肪的合成与分解治疗研究进展 AMPK 在改善脂肪积累,可通过抑制乙酰辅酶A 羧化酶(ACC)家族相关酶活性控制脂肪合成速率,加速脂肪氧化分解来改善机体的脂肪积累。经实验[29]证实由HFD 诱导的NAFLD 大鼠模型中,维生素E 联合有氧运动可以激活AMPK-ACC、AMPK-SREBP-1C-ACC、AMPK-ACC-CPT1 通路减少甘油三酯合成,减轻脂肪堆积,减少氧化应激反应治疗NAFLD。通过小鼠实验及细胞实验[30]表明CoQ10 可以通过AMPK-ACC1 通路减少脂肪合成,并通过AMPK-ACC2-CPT1 通路增加脂肪氧化分解调节脂质代谢。另外基因治疗也可能成为AMPK 相关治疗潜在的治疗方式,据报道,嘌呤能受体(P2Y2R)的激活可促进肥胖小鼠脂肪组织的脂肪形成和血脂异常,当敲除P2Y2R 后可激活AMPK 相关信号通路使CPT1 表达上升,促进脂肪的氧化分解[31]。负责烟酰胺腺嘌呤二核苷酸(NAD)生物合成的烟酰胺磷酸核糖基转移酶(NAMPT)在细胞代谢中具有调节作用,当敲除(NAMPT)相关基因后,发现HePG2 细胞脂质积累升高,而AMPK 表达降低,SREBP-1c 和ACC 表达升高,提示NAMPT 在保护NAFLD 中可能通过参与AMPK-ACC 相关通路实现抑制DNL 合成减少脂质积累的作用,即NAMPT 可作为AMPK-ACC 通路的激活剂治疗NAFLD[32]。
中药活性成分提取[33]中发现黄连提取成分小檗碱能够激活AMPK-ACC、AMPK-SREBP-1C-ACC、AMPK-ACC-CPT1 通路,增加p-AMPK、CTP1、p-ACC的表达,减少脂肪合成,促进脂肪分解。另有黄酮类提取物、异槲皮素、淫羊藿素等天然中药成分,都可通过AMPK-ACC 相关信号通路改善脂质积累[34-35]。值得注意的是目前大量用于我国临床中的保肝药物异水飞蓟宾,也被证实在TO901317 诱导的HepG2 脂肪变性的细胞中能够通过AMPKSREBP-1C-ACC相关通路,降低FFAs诱导的HepG2细胞中的TG 水平,改善脂肪变性和脂质积累[36]。中药方剂可以改善脂质代谢积累,高脂饮食诱导的小鼠体内实验和HepG2 细胞中实验已证实柴胡理中汤、苓桂术甘汤等可以通过AMPK-ACC 途径减少脂质的合成[37-38]。且四妙散,参苓白术散也存在类似的作用机制。
3.2 AMPK 清除脂毒性物质改善脂质积累治疗NAFLD 相关药物研究进展 AMPK 通过激活AMPK-mTOR 细胞通路、提高ULK1 相关自噬底物清除脂毒性物质。SGLT2 抑制剂目前被广泛应用于临床治疗糖尿病以及NAFLD 的治疗中[1],SGLT2 抑制剂被认为能够减轻肝细胞损伤改善NAFLD。Empagliflozin 是一种SGLT2 抑制剂,经小鼠实验证实[39]其可增加通过AMPK-mTOR 信号通路显著增强肝巨噬细胞的自噬,小鼠AMPK-mTOR自噬通路被阻断后,发现Empagliflozin 对肝损伤无帮助,提示Empagliflozn 通过AMPK-mTOR 增加自噬,减少肝损伤。经Ajay Krishnan U等实验证实[40],AMPK激活剂5-aminoimidazole-4-carboxamide-1-β-D呋喃核糖苷(AICAR)对NAFLD 治疗作用是通过AMPK-mTOR串扰而实现。最新研究指出[41]运用镁补充剂治疗NAFLD 的作用机制也与AMPK-mTOR相关信号分子有关,研究结果表明补充镁通过激活AMPK-mTOR 通路激活自噬来减少肝细胞中的脂质沉积。GLP-1 受体激动剂,目前广泛用于对于糖尿病患者的治疗中,其也在治疗NAFLD 中显示了重要的作用[3]。利拉鲁肽作为GLP-1 受体激动剂,可通过AMPK-mTOR 途径上调自噬以减少脂质过度积聚达到治疗目的[42]。
中药活性物质五味子乙素(SCH-B)经实验[43]证实可通过刺激AMPK-mTOR-ULK1 通路增加自噬通量,清除脂毒性物质,保护肝细胞。此外SCH-B 还可以通过激活AMPK-CTP1 相关通路激活对FAO 速率关键影响相关酶类,促进FAO 发生。中药复方康止泰颗粒已在临床中证明其可有效治疗NAFLD 疾病,但其作用机制目前不清。经体内体外实验证实[44]复方康止泰胶囊治疗NAFLD 一种途径为通过AMPK-mTOR 减轻脂毒性物质聚集,改善脂肪变性和脂肪积累。
4 展望与挑战
NAFLD 因其疾病的复杂性目前在临床治疗药物手段较少,而造成NAFLD 的“多重打击”、致使疾病发展的主要原因就是脂质代谢异常而造成的脂质堆积。经多种细胞与动物实验中证实,激活AMPK 相关通路可以改善NAFLD 的肝脏损伤,减少疾病后续进展。这使得AMPK成为了对于NAFLD的潜在的治疗靶点。除了对脂质代谢的调控影响外,AMPK 也可通过抗炎及胰岛素抵抗对NAFLD起到治疗作用。最后对于AMPK 的研究应当在准备充分后进入临床实验,观察其对于NAFLD 患者的治疗效果差异,以此更好的为NAFLD 的治疗提供指导作用。
【Author contributions】The following statements specify the contributions made by each author of this review article.SUN Pengshuai was responsible for conceptualizing and drafting the initial manuscript.ZHU Feng conducted the comprehensive literature search.ZHENG Lihong contributed to the analysis and interpretation of the collected literature.WANG Haiqiang played a significant role in revising the manuscript critically for important intellectual content.All authors read and approved the final manuscript as submitted.
【Conflict of interest】The authors declare no conflict of interest.

