调控丝素蛋白膜的力学性能研究进展
刘海宇 梁文安 王叶元 胡豆豆 孙京臣

Research progress in regulating the mechanical properties of silk fibroin films
摘要:作为一种潜在的生物材料,以丝素蛋白制备的膜材料越来越多地应用到生物医学领域。丝素蛋白膜的力学性能是一个重要的表征参数,对其后续的体外体内应用有较大的影响。本文先简述丝素蛋白的多级结构与力学性能的关系;然后总结制备工艺对丝素蛋白膜力学性能的影响,阐述不同的处理方式对丝素蛋白膜微观结构的影响及由此所致的力学性能的变化。丝素蛋白膜的制备工艺包括丝素蛋白溶液的制备(先脱胶再溶解丝素)、成膜工艺(按结构形式分为致密膜、多孔膜和多层膜),以及成膜后处理(有机溶剂浸泡、水蒸气退火和外力作用)等。此外,讨论复合丝素蛋白膜中不同改性方法导致的结构变化与力学性能的关系。最后,展望丝素蛋白膜材料的发展趋势,为不同需求下的丝素蛋白膜的发展提供借鉴和参考。
关键词:丝素蛋白;薄膜;力学性能;调控方法;复合材料;“结构性能”关系
中图分类号:TS102.54;TB324
文献标志码:A
文章编号:10017003(2024)04005012
DOI:10.3969j.issn.1001-7003.2024.04.007
收稿日期:20230706;
修回日期:20240309
基金项目:广州市基础研究计划基础与应用基础研究项目(SL2023A04J00039)
作者简介:刘海宇(2001),女,硕士研究生,研究方向为蚕丝仿生材料。通信作者:胡豆豆,副教授, ddhu@scau.edu.cn。
早在五千多年前,桑蚕丝就已被人们用于制成织品。19世纪20年代,研究人员使用ZnCl2、Mg(NO3)2和磷酸成功将丝素纤维溶解,至19世纪30年代出现Na2CO3脱胶法及LiBr溶解法[1]。丝素蛋白溶液的出现打破了蚕丝只能以纤维形式应用的限制,拓宽了蚕丝的应用范围。丝素蛋白凭借其良好的生物相容性、可控降解性等特性已成为生物医用材料中的有力竞争者,在药物递送[2]、组织工程[3]、柔性材料[4]等应用中极富发展潜力。
丝素蛋白材料的形式多样,相较于其他形式,丝素蛋白膜制备与表征简单、研究广泛。其中,丝素蛋白膜主要通过溶液浇铸法或旋转涂布法制得[5-6]。然而,与天然桑蚕丝相比,丝素蛋白材料的力学性能往往较差。通过溶液浇铸法制备的纯丝素蛋白膜拉伸强度和断裂伸长率都较小,因其脆性而缺乏实际应用的可能[5]。通过旋转涂布法或逐步沉积法制备的纳米级超薄膜极限拉伸强度优异,但是其弹性较差[7]。这样的力学性能无论是要求柔而韧的创伤敷料或是要求具备一定支撑能力的人工耳膜中都不适用。
丝素蛋白材料的力学性能具有结构依赖性。改变加工方法能调控丝素蛋白的结构[8]。因此,通过改变加工方法调控丝素蛋白材料的结构,使其力学性能得到改善具有现实可能性。力学性能的可调控性使丝素蛋白材料灵活多变,可适于不同应用场景。
本文首先介绍丝素蛋白的结构及影响力学性能的结构参数,然后总结丝素蛋白膜制备条件对力学性能的影响及其作用机制。在膜制备工艺的部分,讨论了从溶液制备到成膜后处理中各种方法对力学性能的影响;在复合丝素蛋白膜制备的部分,讨论了混合、增塑或交联处理对其力学性能的变化及变化机理。最后,对丝素蛋白膜的力学性能改善方法和应用进行了展望。
1 丝素蛋白的结构及其与力学性能的关系
1.1 丝素蛋白的结构
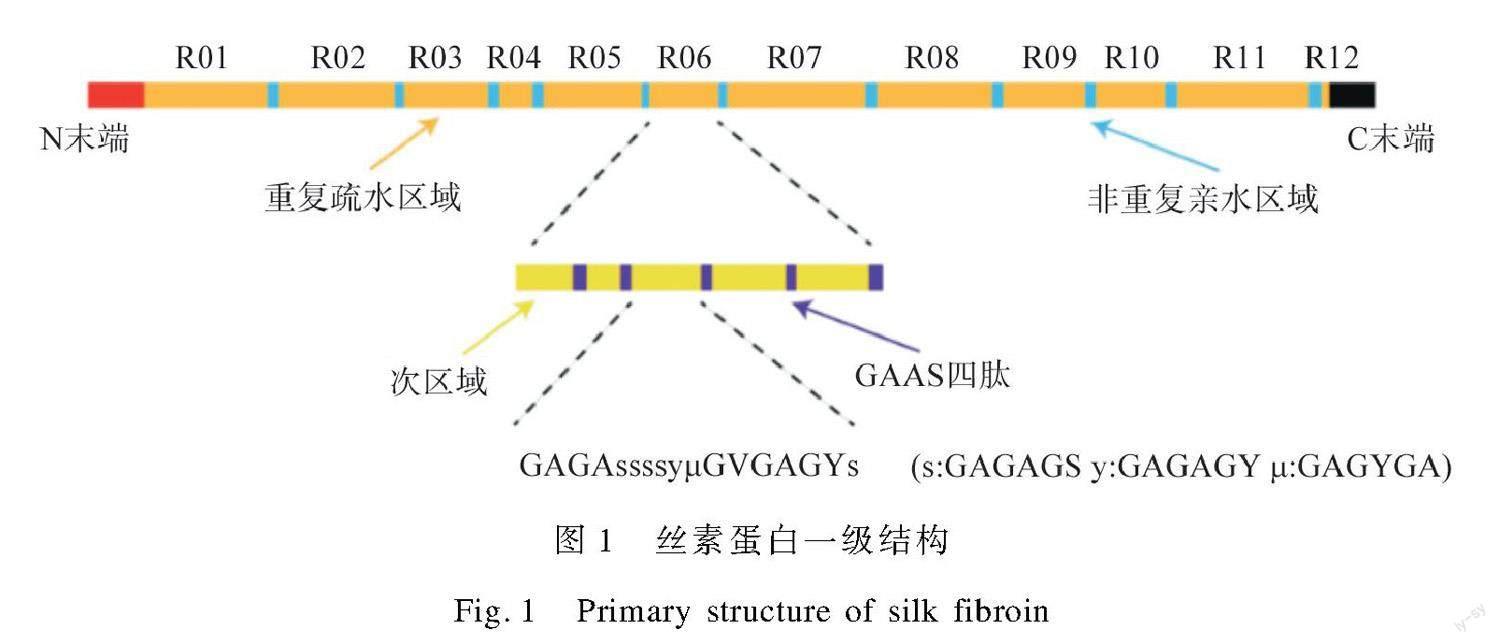
丝素纤维由蚕茧脱胶而得,约占蚕丝蛋白总量70%。丝素纤维被溶解后,丝素蛋白的氨基酸组成和序列不会改变。丝素蛋白的重链基因编码5 263个氨基酸残基,其中包括甘氨酸(45.9%)、丙氨酸(30.3%)、丝氨酸(12.1%)、酪氨酸(5.3%)、缬氨酸(1.8%)及15种其他氨基酸(4.7%)[9]。重链的氨基酸序列可分为N端头部和C端尾部,相间排列的12个疏水的重复序列和11个亲水的非重复序列,如图1[8]所示。
丝素蛋白重链的氨基酸序列为形成规整的二级结构和聚集态结构奠定基础。丝素蛋白二级结构的构象主要有四种:无规卷曲、α螺旋、β折叠和β转角。重复序列中,甘氨酸与某些氨基酸逐个交替连接成六肽,通过分子间或分子内的相互作用力形成反平行β折疊。其中,丙氨酸在β折叠的一侧形成疏水面。丝氨酸的存在可使相邻β折叠间的结合更紧密,增加结晶区的硬度和强度[10]。重复序列中的甘氨酸-丙氨酸-丙氨酸-丝氨酸四肽形成β转角,打断结晶性。亲水的非重复序列中含有带电荷基团或带大侧链基团的氨基酸残基,不能形成β折叠,但其中的脯氨酸可形成环状结构,促进反平行β折叠形成。
丝素蛋白的聚集态结构主要分为Silk I和Silk II。Silk I中包括α螺旋及其他非β折叠结构,不稳定且易溶于水。在固态核磁共振法研究中,Silk I被认为是II型β转角结构[11]。β转角中央的两个氨基酸残基能与水形成氢键,因此Silk I的亲水性好。Silk II主要为反平行β折叠结构,反平行β折叠能量上处于最低状态,稳定且不溶于水。
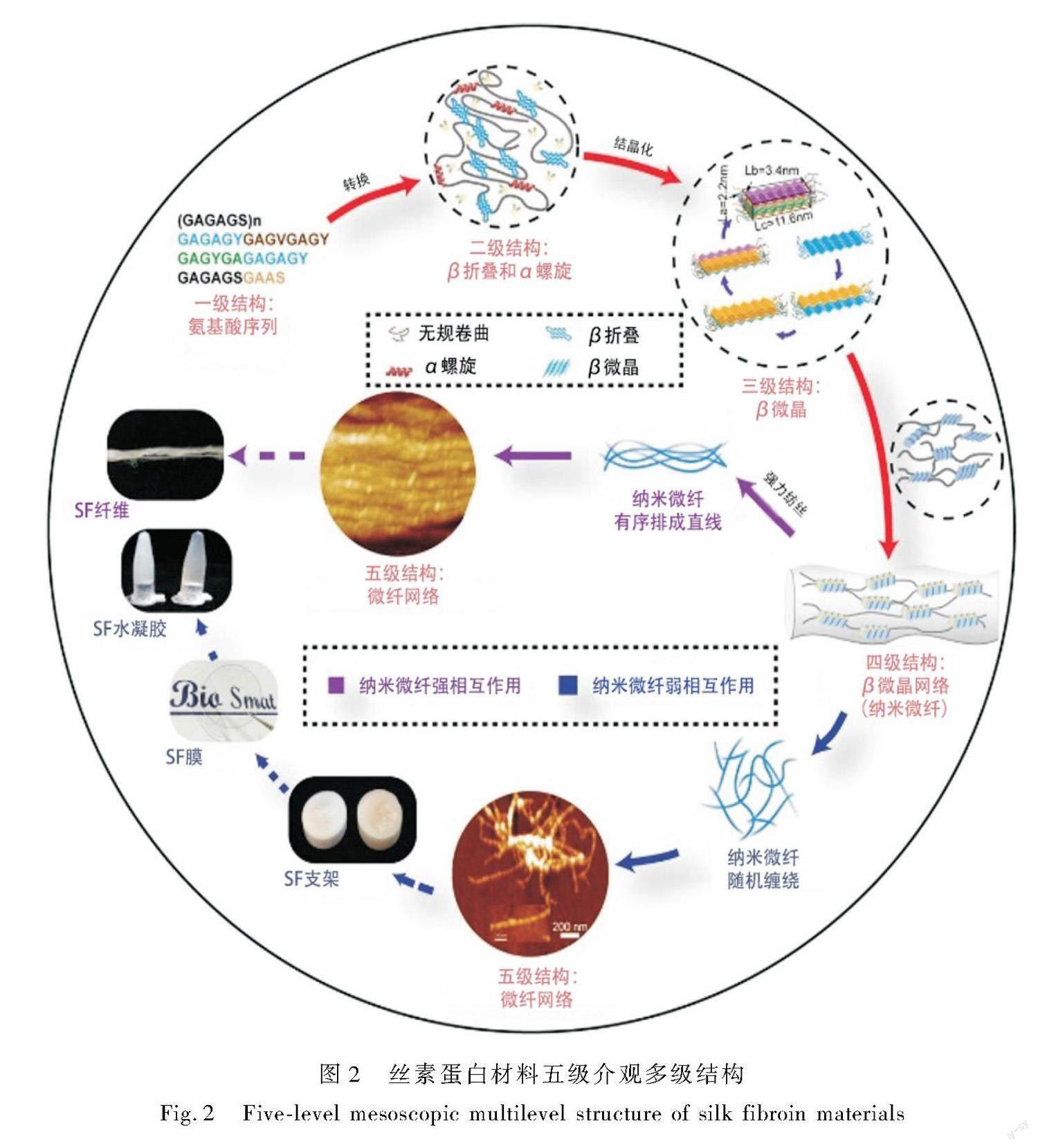
Qiu等[8]提出的丝蛋白材料五级介观多级结构认为丝素蛋白各级形成关系为:在重复序列中每6个氨基酸为一个β股(一级结构);β股间以氢键相互作用维持稳定的β折叠(二级结构);β折叠间以疏水相互作用和范德华力连接,形成β微晶(三级结构);β微晶通过无定形链连接形成纳米微纤(四级结构);纳米微纤间相互作用缠结形成纳米微纤网络(五级结构),如图2所示。
纳米微纤实际上由交叉-β构象构成,是广义上的Silk II。通常认为丝素蛋白材料的强度和刚度由Silk II决定,而延展性和柔韧性由Silk I控制。在纳米微纤中,β微晶作为物理交联点在拉伸过程中承担主要拉力,而无定形链的存在又赋予其柔性。这种无定形链连接β微晶节点形成的拓朴网络结构,使得纳米微纤拥有比自然界其他物质更柔韧、坚固的力学性能。
1.2 影响丝素蛋白材料力学性能的结构参数
丝素蛋白材料宏观上优异的力学性能归因于其特定的结构。从二级结构中β折叠的含量,三级结构中β微晶的尺寸和含量,到四级结构中β微晶的密度和取向度,都是对力学性能至关重要的结构参数。
丝素蛋白各级结构间相互关联,上一级结构是下一级结构形成的基础,逐层递进对宏观力学性能产生影响。具体来说,高含量分子间反平行β折叠有利于形成β微晶。β微晶尺寸仅介于几纳米时比更大尺寸时有更高的强度、刚度和韧性[12]。β微晶含量越高,密度越大,取向性越一致,纳米微纤网络的力学稳定性越强。
各级结构对力学性能变化有协同关系。通常认为,二级结构中β折叠含量越高,丝素蛋白材料脆性越大。然而,水退火处理的丝素蛋白膜和甲醇处理的丝素蛋白膜中β折叠含量差异较大,但在水的作用下二者力学性能趋同[13]。有研究认为水能使β股间的氢键作用变弱(二级结构),又在无定形链间起增塑作用(聚集态结构),这使材料柔韧性增强[14]。
丝素蛋白材料制备的过程,归根到底是丝素蛋白自组装的过程。因此,丝素蛋白自身与自组装过程相关的属性对力学性能均有影响,如质量浓度[15]和相对分子质量[16]的增加伴随着拉伸强度的增加。在丝素蛋白材料制备过程中,改变制备条件能改变自组装路径,从而影响丝素蛋白的结构,赋予丝素蛋白材料广泛适应于多种功能的力学性能。
2 制备工艺对丝素蛋白膜力学性能的影响
丝素蛋白膜的制备通常可分为以下三步:1)溶液制备:先脱胶再溶解丝素纤维,获得丝素蛋白溶液;2)成膜工艺:按结构形式分为致密膜、多孔膜和多层膜;3)成膜后处理:有机溶剂浸泡、水蒸气退火和外力作用等。
2.1 溶液制备
制备丝素蛋白膜的第一步是获得丝素蛋白溶液,即先去除茧壳的丝胶蛋白,再溶解丝素纤维。丝素蛋白材料与天然蚕丝在力学性能上的差异,通常归因于脱胶和溶解过程中丝素蛋白相对分子质量减小和天然蚕丝中多级结构的缺失。相对分子质量的降低使丝素蛋白无法形成连续的原纤维[17]。
2.1.1 脱 胶
脱胶是指去除茧壳中丝胶蛋白的过程。在脱胶时既完全去除丝胶蛋白,又不破坏丝素蛋白的结构是制备出符合应用要求的丝素蛋白的关键。脱胶时可以控制脱胶溶剂的种类及质量浓度、脱胶的温度、时间及次数。脱胶主要通过改变丝素蛋白分子量影响膜的力学性能[18-19]。具有高相对分子质量的丝素蛋白溶液制备的丝素蛋白膜拉伸强度更高,而彻底的脱胶往往导致丝素蛋白降解[18,20]。例如,Allardyce等[18]通过控制脱胶温度、时间和次数及脱胶溶液的种类和质量浓度,改变脱胶过程中的降解程度。轻柔的脱胶条件下,如较低的温度、较短的时间、较少的重复次数、较温和的脱胶试剂,制得的丝素蛋白膜强度为8.9 MPa,比强烈的脱胶条件下的丝素蛋白膜大4.6 MPa。不完全脱胶时,残留的丝胶蛋白(0.6%)有助于形成β微晶,且轻柔的脱胶使分子量的降低稍小,从而使拉伸强度和模量增加[19]。在脱胶率相近的条件下,使用沸水长时间脱胶所制膜的断裂伸长率和强度仍比使用Na2CO3溶液脱胶所制膜显著提高,说明烈性脱胶试剂如Na2CO3的使用会加剧分子量降低,导致力学性能减弱[20]。
2.1.2 溶解丝素
溶解丝素纤维需要破坏其氢键和疏水相互作用。目前用于溶解丝素纤维的溶剂有无机盐体系、有机盐体系、有机溶剂体系及离子液体等。溶解过程中可控的条件有溶剂种类及摩尔浓度、溶解的时间和温度,它们可通过改变丝素蛋白分子量及分子的稳定性[21]等影响膜的力学性能。
不同溶剂体系对丝素纤维溶解能力不同,丝素蛋白的水解程度也不同,从而导致丝素蛋白膜结构和力学性能的差异[22]。用水、甲酸和三氟乙酸分别作溶剂发现,使用三氟乙酸溶解会促进丝素蛋白降解,使丝素蛋白膜力学性能较水和甲酸溶解体系要差[23]。使用离子液体[Bmim]OAc溶解获得的丝素蛋白膜拉伸强度约是LiBr溶液溶解的两倍,但断裂伸长率略低[24]。
2.2 成膜工艺
丝素蛋白膜按结构形式可以分为致密膜、多孔膜和层状膜。多孔膜经去除分散在丝素蛋白中的成孔剂后形成。致密膜相较于多孔膜而言,几乎不存在人为微孔。层状膜由两种或两种以上不同材料相互交叠而成。结构形式不同,制作方法也有差异,可控条件也不同。
2.2.1 致密膜
致密膜的主要制备方法有溶液浇铸法和旋转涂布法。致密膜的制备是多孔膜和层状膜制备的基础,例如,通过在溶液中加入成孔剂,经过溶液浇铸后制成多孔膜;通过旋转涂布法将多层致密膜堆叠结合制成层状膜。
溶液浇铸法是最常用且最简易的成膜方法,只需将制备好的溶液浇铸在基材上,溶剂完全挥发后即得到透明的薄膜。在这一过程中干燥速率可通过影响丝素蛋白分子微观结构从而调控膜的力学性能[25]。缓慢的干燥速率使丝素蛋白分子有足够的时间与水分子相互作用,β折叠含量降低。缓慢干燥制备的丝素蛋白膜与水蒸气退火处理的膜相比,模量和强度分别降低了5.9 MPa和1.7 MPa,但断裂伸长率增加了60%[25]。垂直沉積法制得的丝素蛋白膜与缓慢干燥的相比含有更高的β折叠结构,表现出更高的拉伸模量[26]。
旋转涂布法指将要涂布的稀溶液加到平面底板上,底板旋转产生的离心力使底板上的稀溶液涂布成薄膜。Jiang等[7]首次使用旋转涂布法和自旋辅助层层组装法制作多层丝素蛋白超薄膜,并用胀形实验测量超薄膜的力学性能。在超薄膜中,Silk II晶体能形成物理交联网络,使丝素蛋白膜的模量增加到6~8 GPa,韧性增加到328 kJm3。然而超薄膜厚度小,丝素蛋白链受空间限制,无法通过滑移对自身再取向,无法全面地延展变形,导致断裂伸长率下降至0.5%。
2.2.2 多孔膜
丝素蛋白膜孔结构的形成方法很多,常见的有冻干法[27]和盐浸法[28]。适当的孔结构可以增强透气透水性,促进细胞迁移和黏附,为膜提供形变能力,但是过多过大的孔会使应力集中,导致强度和断裂伸长率降低[15]。因此,适当的孔径大小、孔密度及孔分布对形成优良的力学性能十分重要。
Liu等[29]对丝素蛋白溶液进行高压灭菌诱导丝素纳米颗粒的形成,经溶液浇铸、甲醇处理及水洗后,纳米颗粒溢出使膜中成孔。制得的多孔膜不仅保留了传统致密膜的拉伸模量(13.10±1.65 MPa vs. 16.27±3.81 MPa,p>0.05),且获得了远高于致密膜的渗透性(34.85%±2.12% vs. 6.14%±1.87%, p<0.05)。不同于Liu等从去除溶质的角度来制孔,Zhang等[30]从去除溶剂的角度出发制孔。相较于溶液浇铸法中水无序蒸发的脱水方法,单向纳米孔脱水的方法能引导水分子有序去除,使丝素蛋白能定向積累,形成稳定的Silk I结构,丝素蛋白膜获得了更强的延伸能力,断裂伸长率达665.23%。Sun等[15]使用磷酸溶液溶解纤维,硫酸铵溶液作凝固浴,制作出孔径可调节的丝素蛋白膜。高质量浓度凝固浴意味着更快的凝胶化,从而形成大孔。因此,随硫酸铵溶液质量浓度增加,丝素蛋白膜的拉伸强度和断裂伸长率先增加,后降低。
2.2.3 多层膜
多层膜的力学性能除前述的相关因素,还与层间结合紧密程度有关。这主要通过测试膜的抗弯性能来评价。在旋转涂布法中,使用适当的方法或引入合适的材料能有效增强层间相互作用,从而改善力学性能。层层自组装法可通过交替堆叠丝素蛋白溶液和其他材料来实现丝素蛋白膜力学性能的增强。例如,Hu等[31]用自旋辅助层层组装法引入氧化石墨烯,使丝素蛋白与氧化石墨烯层间形成致密网络,丝素蛋白膜的弹性模量由10 GPa增加到145 GPa。Yin等[32]用动态自旋辅助层层组装法拉伸丝素蛋白分子,增强其与氧化石墨烯的相互作用,从而制出极限强度(300 MPa)、模量(170 GPa)和韧性(3.4 MJm3)相平衡的薄膜。另外,水蒸气退火[33-34]和交联剂[35]的加入也常被用于增强层间相互作用。
2.3 成膜后处理
相较于从丝腺中直接提取的丝素蛋白溶液,由丝素纤维溶解的丝素蛋白溶液在制成材料后通常易溶于水。因此,为了实现水不溶性和力学性能的平衡,调控结晶度在成膜后处理过程中就格外重要。
成膜后处理中,最简易常用的是有机溶剂浸泡。早在20世纪末甲醇就被用于浸泡丝素蛋白膜,但所得丝素蛋白膜脆性大[36]。丁醇分子较大,诱导结晶的能力较甲醇弱。丁醇处理的丝素蛋白膜中无规卷曲结构较甲醇处理多,膜的断裂伸长率由甲醇诱导得到的1.1%提高到2.7%[37]。有机溶剂浸泡虽然能使无规卷曲结构转变为β折叠结构,但可调整空间小[38]。
水蒸气退火通过调整温度能更精细地调控β折叠结构含量。在60℃、95℃下形成的丝素蛋白膜β折叠含量较高,使膜的弹性模量、拉伸强度和屈服强度显著的提高[39]。进一步研究水蒸气退火时湿度的影响发现,在相同温度下,湿度对丝素蛋白膜的拉伸强度有显著影响,但对延展性影响不大。湿度越高,改变丝素蛋白膜二级结构所需的温度越低[40]。就多层膜的制备而言,水蒸气退火能有效增强层间相互作用。对于旋转涂布法制备层层组装的超薄膜,水蒸气退火处理可以使丝素蛋白膜填充密度增加,丝素蛋白分子取向更一致,从而使氧化石墨烯-丝素蛋白纳米膜的模量和硬度分别由22.1±7.1 GPa和0.8±0.2 GPa提高到45.5±4.8 GPa和2.3±0.6 GPa[33]。Xu等[34]利用水蒸气退火塑化制出“砖泥结构”中的“泥”,有效加强了薄层间相互作用,不进行水蒸气退火强度只有20%。
外力作用对丝素蛋白膜力学性能的影响也不可忽略。外力作用的方式有拉伸[41-43]、机械训练[44-45]及压力[46],使丝素蛋白膜的强度和模量增大。图3(b)是仿生介观自组装薄膜(Biomimetic Meso-assembling Films, BMAFs)中丝素蛋白在机械训练前后的结构示意,在4 h的机械训练中,丝素蛋白中的无规卷曲经过交联网络的形成与重塑,无规卷曲转变为β折叠,分子链高度取向,增加了结晶度和取向度。由图3(a)可见,与重组丝蛋白(Reconstituted Silkworm Silk Fibroin, RSSFs)相比,随着机械训练时间的增加(0~4 h),BMAFs的强度和模量增加,表现出延展性。经4 h训练后,膜的强度、刚度、延展性和韧性平衡完美,模量相比未训练膜提高60倍[45]。
表1总结了丝素蛋白膜制备过程中涉及的改性方法及其力学改性机制。
3 添加物改性丝素蛋白膜
添加物改性丝素蛋白膜有利于满足实际应用中苛刻的力学性能要求。多数情况下,丝素蛋白与添加物间形成特定的分子间相互作用使力学性能改变。分子间相互作用是丝素蛋白形成β折叠和β微晶的主要物理驱动力。部分添加物可降低成核壁垒,增强分子间相互作用,从而使膜中更易产生物理交联点(添加交联剂产生化学交联)[8]。因此,在复合丝素蛋白膜中,添加物通过增强分子间相互作用改变结构,达到改善力学性能的效果。共混、增塑和交联是常见的添加物改性方法。
添加混合物、增塑剂或交联剂对丝素蛋白膜改性是常用的改善丝素蛋白膜力学性能的方法。
3.1 共 混
天然高分子、合成高分子和无机材料等都可用于与丝素蛋白共混。共混可实现力学性能的增强,同时还可实现丝素蛋白膜的不溶性并保留其生物相容性和生物可降解性。共混物或先制成溶液再与丝素蛋白溶液混合,或与丝素纤维共同溶解于溶剂中[47]。根据共混物与丝素蛋白的相互作用强度,互作类型大致分为相分离、强相互作用和形成网络结构。
相分离的情况下,两种材料的相互作用弱,使拉伸模量和强度降低,断裂伸长率增加[48-49]。适当的混合方法对复合膜分散度、均匀性至关重要。为了避免相分离导致的力学性能减弱,混合物间须存在一定的相互作用[50]。增塑剂[51]或交联剂[52]的添加能通过增强界面相互作用,实现丝素共混膜力学性能的提高。
强相互作用的情况较为常见。纳米纤维作增强相时往往相互作用较强,能增加丝素蛋白膜的拉伸模量和强度[53-55]。丝素蛋白和纤维素在分子水平上有很强的氢键相互作用。随纤维素百分比增加,丝素蛋白和纤维素间形成的氢键比例增加,使分子取向更佳[54]。
形成网络结构时,力学性能往往最优[56-57]。适当的混合比例能使复合材料间形成独特的网络结构,有效增强力学性能。在添加氧化石墨烯的研究中发现,微量的添加可使石墨烯均匀分布,而大量的添加使石墨烯堆叠成团,介于中间的最适比例可以使石墨烯在丝素蛋白间形成均匀的插层,从而使其相互作用达到最大,实现模量的显著提升[58]。其他纳米复合物的添加也呈现类似的效果[59]。
3.2 增 塑
增塑剂广泛用于提高聚合物的加工性能、柔韧性和延展性。纯丝素蛋白膜在干态下硬且脆,断裂伸长率低,添
加增塑剂能有效改善这种情况。增塑剂通常与其他处理配合起效,表2总结了与增塑剂相关的处理对力学性能改善的研究。
3.2.1 甘 油
甘油(Glycerin,Gly)是最常用的增塑剂。无论在干态或湿态下,添加甘油的丝素蛋白膜比水蒸气退火处理或甲醇浸
泡的丝素蛋白膜延展性高。图4(a)是甘油分子与丝素蛋白作用的示意,甘油分子的氢键与丝素蛋白的羟基相互作用能破坏丝素蛋白链间的相互作用。当甘油含量增加到12%时,丝素蛋白链间的相互作用变弱,无定形结构域中丝素蛋白链移动,促使丝素蛋白膜形成β折叠结构,使结晶度增加[65]。当甘油含量增加到22%时,结晶度变化不显著。結构的变化在力学性能上体现为:随甘油含量的增加,丝素蛋白膜的断裂伸长率和韧性分别由1.80%和0.65 MJm3增加到364.42%和32.19 MJm 杨氏模量由2.85 GPa下降至0.07 GPa;当甘油含量大于16%时,结晶度增加到达极限,极限强度稳定在13 MPa左右(图4(b))[65]。
3.2.2 水
水在丝素蛋白膜中通常也起增塑作用。丝素蛋白膜存放的湿度环境对其力学性能有不可忽略的影响。在97%的相对湿度环境下丝素蛋白膜的断裂伸长率和韧性大大提高(图5(a)(b))。与甘油类似,在相对湿度较高的环境下,水分子以结合水存在,会破坏丝素蛋白链间的分子内聚力,降低空间位阻,促进非结晶区的链运动,诱导β折叠结晶(图5(c))。但是,高湿下(97%)水诱导的结晶度增大中形成的微晶较大,这使丝素蛋白膜保留了弹性[66]。
3.2.3 Ca2+
除了甘油和水分子,Ca2+也是一种常见的增塑剂。溶解丝素蛋白时使用含Ca2+的试剂或溶解后额外添加CaCl2都可引入Ca2+。Ca2+的添加还涉及电导率、黏弹性的变化,在电子皮肤、传感器中应用较多。Ca2+一方面与丝素蛋白相互
作用,另一方面能配位捕获空气中的水分子,从而发挥增塑作用,影响丝素蛋白膜的力学性能。
Ca2+通过螯合作用和电荷相互作用与丝素蛋白结合。在使用CaCl2甲酸溶解丝素蛋白时,Ca2+作为增塑剂使丝素蛋白形成以分子内β折叠为主,而非以分子间β折叠晶体为主的结构,得到的丝素蛋白膜弹性模量为2.573 GPa、断裂伸长率为79.72%[67]。随丝素蛋白与Ca2+的质量比从90∶10改变到70∶3 丝素蛋白膜的断裂伸长率从约1%增加到约200%[68]。Ca2+捕获水的能力很强,通常1个Ca2+能配位6~8个水分子。湿度对含Ca2+的丝素蛋白膜影响极大。Chen等[62]通过分子动力学模拟分析Ca2+的塑化机理,认为Ca2+与环境的相对湿度共同作用影响水含量(图6(c))。Ca2+含量越高,相对湿度越高,丝素蛋白膜的水含量越高,模量越低(图6(a)(b))[62]。
3.3 交 联
交联常用于突破生物材料的局限性。化学交联和酶促交联能在分子间形成共价连接,增大相对分子质量,提供更优的力学性能和水稳定性。酶促交联具有更好的生物相容性和更温和的反应条件,辣根过氧化物酶和酪氨酸酶都利用丝素蛋白中的酪氨酸进行交联,从而提高膜的强度[69-70]。紫外线照射[71]及超声波处理[72]等方法也可形成物理交联。
丝素蛋白膜改性常用的是化学交联,常用的交联剂有环氧树脂、戊二醛、京尼平、二醛淀粉、乙二醛和1-乙基-3(3-二甲基氨丙基)碳化二亚胺N-羟基丁二酰亚胺(EDCNHS)等。化学交联一方面破坏丝素蛋白链间原有的相互作用,使链段间可以相互滑移,从而使丝素蛋白膜表现出较高的断裂伸长率;另一方面又使丝素蛋白形成网络结构,增强链段滑移后的可恢复性,从而使膜表现出较好的弹性并增加强度,如环氧树
脂[73-74]。图7(a)为丝素蛋白与环氧树脂交联结构示意,随着丝素蛋白占比增大,环氧树脂与丝素蛋白的化学交联点增多。这种化学交联点的增多会限制丝素蛋白链的运动,阻碍丝素蛋白中物理交联点β微晶的形成。丝素蛋白与环氧树脂以7∶3混合加热产生的膜物理交联与化学交联相平衡,具有强网络结构,有效提高膜的强度和断裂伸长率(图7(b))[74]。
3.4 其 他
除上述三种改性方法外,其他改性方法如接枝也可能会对力学性能产生影响。丙氨酸接枝使膜的强度和模量降低,断裂伸长率增大。这是由于侧基接枝后阻碍相邻分子链间的连接,使结晶结构减少,链间作用力减小,强度下降;使分子链疏松卷曲,受外力拉伸易于伸长,去除外力易于回弹,使断裂伸长率增大[75-76]。因此,在对丝素蛋白膜接枝改性附加其他性能时要注意控制其对力学性能的影响。
4 結 语
天然丝素蛋白中“晶区非晶区”的嵌段分子结构赋予蚕丝纤维优异的强度和韧性。在再生重塑过程中,丝素蛋白的多级结构使其在材料制备过程中能对各级结构进行调控。除了丝素提取过程对丝素蛋白分子结构的影响外,成膜工艺、成膜后处理、复合其他材料及物理化学修饰均会影响丝素蛋白膜的力学性能。因此,利用丝素蛋白的结构特性有望制备出力学性能优异的丝素蛋白膜,以期满足不同领域的需求,如组织修复与再生、柔性电子器件等。
尽管已有很多方法用于调控丝素蛋白材料的力学性能,但进一步提高和精确调控力学性能的方法还需要继续创新。首先,从丝素蛋白分子链的角度,高相对分子质量丝素蛋白的获取对于提高膜的力学性能至关重要。然后,对丝素蛋白膜结构与力学性能间关系的厘清能为改性方法的创新提供理论指导。对于非纤维状的丝素蛋白材料,纳米微纤以近乎随机的方式排布,这种无序排布不利于增强丝素蛋白膜的力学性能。若能从微观角度更精确地控制纳米微纤的排列,使纳米微纤解缠结并规整排列,非纤维状的丝素蛋白材料也能在某个方向上获得纤维状般的力学性能。最后,精准调控丝素蛋白膜的力学性能,有利于研究不同力学性能的丝素蛋白膜对细胞、组织生命活动的影响。尽管目前能够制备出不同力学性能的材料,但是材料的其他性能如润湿性、拓扑结构和表面特性等可能也随力学性能的改变而变化。因此,制备出单一力学属性梯度的丝素蛋白膜是研究力学性能对细胞命运调控的关键。随着对丝素蛋白结构和性能的深入了解,具有优异力学性能的丝素蛋白膜将会在多种领域发挥重要作用。
参考文献:
[1]HOLLAND C, NUMATA K, RNJAK-KOVACINA J, et al. The biomedical use of silk: Past, present, future[J]. Advanced Healthcare Materials, 2019, 8(1): 1800465.
[2]CHEN Y P, LYU R, WANG J, et al. Metal-organic frameworks nucleated by silk fibroin and modified with tumor-targeting peptides for targeted multimodal cancer therapy[J]. Advance Science, 2023, 10: 2302700.
[3]WANG J, WU Y, WANG Y C, et al. Graphene oxide-coated patterned silk fibroin films promote cell adhesion and induce cardiomyogenic differentiation of human mesenchymal stem cells[J]. Biomolecules, 2023, 13(6): 1-11.
[4]LI J, YANG F, LIU D Y, et al. Graphene composite paper synergized with micronanocellulose-fiber and silk fibroin for flexible strain sensor[J]. International Journal of Biological Macromolecules, 2023, 240: 124439.
[5]DURN-REY D, BRITO-PEREIRA R, RIBEIRO C, et al. Development of silk fibroin scaffolds for vascular repair[J]. Biomacromolecules, 2023, 24(3): 1121-1130.
[6]SARKAR L, SUSHMA M V, YALAGALA B P, et al. ZnO nanoparticles embedded silk fibroin: A piezoelectric composite for nanogenerator applications[J]. Nanotechnology, 2022,33: 265403.
[7]JIANG C, WANG X, GUNAWIDJAJA R, et al. Mechanical properties of robust ultrathin silk fibroin films[J]. Advanced Functional Materials, 2007, 17(13): 2229-2237.
[8]QIU W, PATIL A, HU F, et al. Hierarchical structure of silk materials versus mechanical performance and mesoscopic engineering principles[J]. Small, 2019, 15(51): 1903948.
[9]ZHOU C Z, CONFALONIERI F, JACQUET M, et al. Silk fibroin: Structural implications of a remarkable amino acid sequence[J]. Proteins, 2001, 44(2): 119-122.
[10]ASAKURA T, OGAWA T, NAITO A, et al. Chain-folded lamellar structure and dynamics of the crystalline fraction of Bombyx mori silk fibroin and of Ala-Gly-Ser-Gly-Ala-Gly)n model peptides[J]. International Journal of Biological Macromolecules, 2020, 164: 3974-3983.
[11]ASAKURA T. Structure of silk I (Bombyx mori silk fibroin before spinning)-type II β-turn, not α-helix-[J]. Molecules, 2021, 26(12): 3706.
[12]KETEN S, XU Z P, IHLE B, et al. Nanoconfinement controls stiffness, strength and mechanical toughness of β-sheet crystals in silk[J]. Nature Materials, 2010, 9(4): 359-367.
[13]LAWRENCE B D, WHARRAM S, KLUGE J A, et al. Effect of hydration on silk film material properties[J]. Macromolecular Bioscience, 2010, 10(4): 393-403.
[14]CHENG Y, KOH L D, LI D C, et al. On the strength of β-sheet crystallites of Bombyx mori silk fibroin[J]. Journal of the Royal Society Interface, 2014, 11(96): 20140305.
[15]SUN F C, XIAO D D, SU H, et al. Highly stretchable porous regenerated silk fibroin film for enhanced wound healing[J]. Journal of Materials Chemistry B, 2023, 11(7): 1486-1494.
[16]WANG L P, LUO Z W, ZHANG Q, et al. Effect of degumming methods on the degradation behavior of silk fibroin biomaterials[J]. Fibers and Polymers, 2019, 20(1): 45-50.
[17]KOEBLEY S R, THORPE D, PANG P, et al. Silk reconstitution disrupts fibroin self-assembly[J]. Biomacromolecules, 2015, 16(9): 2796-2804.
[18]ALLARDYCE B J, RAJKHOWA R, DILLEY R J, et al. The impact of degumming conditions on the properties of silk films for biomedical applications[J]. Textile Research Journal, 2016, 86(3): 275-287.
[19]LEE J H, SONG D W, PARK Y H, et al. Effect of residual sericin on the structural characteristics and properties of regenerated silk films[J]. International Journal of Biological Macromolecules, 2016, 89: 273-278.
[20]LI M, TIAN W, YU Y X, et al. Effect of degumming degree on the structure and tensile properties of RSFRSS composite films prepared by one-step extraction[J]. Scientific Reports, 2023, 13(1): 6689.
[21]ZHENG Z Z, GUO S Z, LIU Y W, et al. Lithium-free processing of silk fibroin[J]. Journal of Biomaterials Applications, 2016, 31(3): 450-463.
[22]CHENG G T, WANG X, TAO S J, et al. Differences in regenerated silk fibroin prepared with different solvent systems: From structures to conformational changes[J]. Journal of Applied Polymer Science, 2015, 132(22): 41959.
[23]RAJKHOWA R, LEVIN B, REDMOND S L, et al. Structure and properties of biomedical films prepared from aqueous and acidic silk fibroin solutions[J]. Journal of Biomedical Materials Research Part A, 2011, 97(1): 37-45.
[24]LI L, XIONG Y N, YU S T, et al. Facile preparation for robust and freestanding silk fibroin films in a 1-butyl-3-methyl imidazolium acetate ionic liquid system[J]. Journal of Applied Polymer Science, 2015, 132(47): 42822.
[25]LU Q, HU X, WANG X Q, et al. Water-insoluble silk films with silk I structure[J]. Acta Biomaterialia, 2010, 6(4): 1380-1387.
[26]SAGNELLA A, PISTONE A, BONETTI S, et al. Effect of different fabrication methods on the chemo-physical properties of silk fibroin films and on their interaction with neural cells[J]. RSC Advances, 2016, 6(11): 9304-9314.
[27]WANG Y Y, SU L, HOU Y J, et al. A biomimetic composite bilayer dressing composed of alginate and fibroin for enhancing full-thickness wound healing[J]. Macromolecular Bioscience, 2022, 22(4): 2100352.
[28]HIGA K, TAKESHIMA N, MORO F, et al. Porous silk fibroin film as a transparent carrier for cultivated corneal epithelial sheets[J]. Journal of Biomaterials Science, Polymer Edition, 2011, 22(17): 2261-2276.
[29]LIU J, HUANG R, LI G, et al. Generation of nano-pores in silk fibroin films using silk nanoparticles for full-thickness wound healing[J]. Biomacromolecules, 2021, 22(2): 546-556.
[30]ZHANG M, WANG H Y, ZHANG Y Q. Unidirectional nanopore dehydration induces a highly stretchable and mechanically robust silk fibroin membrane dominated by type II β-turns[J]. ACS Biomaterials Science & Engineering, 2023, 9(5): 2741-2754.
[31]HU K, GUPTA M K, KULKARNI D D, et al. Ultra-robust graphene oxide-silk fibroin nanocomposite membranes[J]. Advanced Materials, 2013, 25(16): 2301-2307.
[32]YIN Y, HU K S, GRANT A M, et al. Biopolymeric nanocomposites with enhanced interphases[J]. Langmuir, 2015, 31(39): 10859-10870.
[33]CHO H, LEE J, HWANG H, et al. Mechanical properties of graphene oxide-silk fibroin bionanofilms via nanoindentation experiments and finite element analysis[J]. Friction, 2022, 10(2): 282-295.
[34]XU Z P, WU M R, GAO W W, et al. A sustainable single-component “silk nacre”[J]. Science Advances, 2022, 8(19): 1-7.
[35]KHARLAMPIEVA E, KOZLOVSKAYA V, WALLET B, et al. Co-cross-linking silk matrices with silica nanostructures for robust ultrathin nanocomposites[J]. ACS Nano, 2010, 4(12): 7053-7063.
[36]MINOURAN, TSUKADA M, NAGURA M, et al. Physico-chemical properties of silk fibroin membrane as a biomaterial[J]. Biomaterials, 1990, 11(6): 430-434.
[37]CHIAO Y H, HUNG W S. Separation performance of alcohol-induced silk fibroin membranes with homogeneous and heterogeneous microstructures[J]. Separation and Purification Technology, 2022, 293: 121004.
[38]ZHAO M H, QI Z Z, TAO X S, et al. Chemical, thermal, time, and enzymatic stability of silk materials with silk I structure[J]. International Journal of Molecular Sciences, 2021, 22(8): 4136.
[39]HU X, SHMELEV K, SUN L, et al. Regulation of silk material structure by temperature-controlled water vapor annealing[J]. Biomacromolecules, 2011, 12(5): 1686-1696.
[40]WANG H Y, ZHOU S F, ZHANG M, et al. The post-processing temperature or humidity can importantly control the secondary structure and characteristics of silk fibroin films[J]. Journal of Biomedical Materials Research Part A, 2021, 110(4): 827-837.
[41]YIN J W, CHEN E Q, PORTER D, et al. Enhancing the toughness of regenerated silk fibroin film through uniaxial extension[J]. Biomacromolecules, 2010, 11(11): 2890-2895.
[42]ZHANG C C, SONG D W, LU Q, et al. Flexibility regeneration of silk fibroin in vitro[J]. Biomacromolecules, 2012, 13(7): 2148-2153.
[43]YOSHIOKA T, TASHIRO K, OHTA N. Molecular orientation enhancement of silk by the hot-stretching-induced transition from α-helix-HFIP complex to β-sheet[J]. Biomacromolecules, 2016, 17(4): 1437-1448.
[44]SHU T, L Z C, CHEN C T, et al. Mechanical training-driven structural remodeling: A rational route for outstanding highly hydrated silk materials[J]. Small, 2021, 17(33): 2102660.
[45]ZHANG Y H, YE S S, CAO L T, et al. Natural silk spinning-inspired meso-assembly-processing engineering strategy for fabricating soft tissue-mimicking biomaterials[J]. Advanced Functional Materials, 2022, 32(27): 2200267.
[46]YAZAWA K, HIDAKA K. Pressure-and humidity-induced structural transition of silk fibroin[J]. Polymer, 2020, 211: 123082.
[47]YUE W, ZHANG L H, DENG L L, et al. Co-dissolution of cellulose and silk fibroin in levulinic acid-derived protic ionic liquids for composited membrane and fiber preparation[J]. Green Chemistry, 2021, 23(23): 9669-9682.
[48]CHEN W H, LI F, CHEN L, et al. Fast self-assembly of microporous silk fibroin membranes on liquid surface[J]. International Journal of Biological Macromolecules, 2020, 156: 633-639.
[49]JIN H J, PARK J, VALLUZZI R, et al. Biomaterial films of Bombyx mori silk fibroin with poly(ethylene oxide)[J]. Biomacromolecules, 2004, 5(3): 711-717.
[50]MORAES M A D, SILVA M F, WESKA R F, et al. Silk fibroin and sodium alginate blend: Miscibility and physical characteristics[J]. Biomaterials Advances, 2014, 40: 85-91.
[51]LI X F, ZHANG H J, HE L, et al. Flexible nanofibers-reinforced silk fibroin films plasticized by glycerol[J]. Composites Part B: Engineering, 2018, 152: 305-310.
[52]SERBAN M A, KLUGE J A, LAHA M M, et al. Modular elastic patches: Mechanical and biological effects[J]. Biomacromolecules, 2010, 11(9): 2230-2237.
[53]HUANG J W, QIN J Z, ZHANG P, et al. Facile preparation of a strong chitosan-silk biocomposite film[J]. Carbohydrate Polymers, 2020, 229: 115515.
[54]LUO Z W, LI M Z, ZHANG Q, et al. Green preparation of silk fibroinbamboo-derived cellulose nanofibril nanocomposite films with high mechanical strength[J]. Journal of Materials Science, 2022, 57(20): 9265-9276.
[55]LV L L, HAN X S, ZONG L, et al. Biomimetic hybridization of kevlar into silk fibroin:Nanofibrous strategy for improved mechanic properties of flexible composites and filtration membranes[J]. ACS Nano, 2017, 11(8): 8178-8184.
[56]MA M B, DONG S Z, HUSSAIN M, et al. Effects of addition of condensed tannin on the structure and properties of silk fibroin film[J]. Polymer International, 2017, 66(1): 151-159.
[57]WANG F, WU H, VENKATARAMAN V, et al. Silk fibroin-poly(lactic acid) biocomposites:Effect of protein-synthetic polymer interactions and miscibility on material properties and biological responses[J]. Biomaterials Advances, 2019, 104: 109890.
[58]WANG F, ARAVIND S S J, WU H, et al. Tunable green graphene-silk biomaterials: Mechanism of protein-based nanocom-posites[J]. Biomaterials Advances, 2017, 79: 728-739.
[59]REIZABAL A, CASTRO N, PEREIRA N, et al. Silk fibroin nanocomposites with indium tin oxide toward sustainable capacitive touch sensing applications[J]. ACS Applied Electronic Materials, 2022, 4(4): 1901-1909.
[60]WANG Y Y, WANG X Y, SHI J, et al. Flexible silk fibroin films modified by genipin and glycerol[J]. RSC Advances, 2015, 5(123): 101362-101369.
[61]LYU H, LI J H, YUAN Z C, et al. Supertough and highly stretchable silk protein-based films with controlled biodegradability[J]. Acta Biomaterialia, 2022, 153: 149-158.
[62]CHEN G, MATSUHISA N, LIU Z Y, et al. Plasticizing silk protein for on-skin stretchable electrodes[J]. Advanced Materials, 2018, 30(21): 1800129.
[63]SRIVASTAVA C M, PURWAR R, KANNAUJIA R, et al. Flexible silk fibroin films for wound dressing[J]. Fibers and Polymers, 2015, 16(5): 1020-1030.
[64]羅敏清. 小分子多元醇对丝素蛋白结构和性能的影响[D]. 苏州: 苏州大学, 2011.
LUO M Q. The Effects of Polyalcohol on the Structure and Properties of Silk Fibroin[D]. Suzhou: Soochow University, 2011.
[65]L H, SUN Z Y, LIU Y, et al. Processing-structure-properties relationships of glycerol-plasticized silk films[J]. Molecules, 2022, 27(4): 1339.
[66]YAZAWA K, ISHIDA K, MASUNAGA H, et al. Influence of water content on the β-sheet formation, thermal stability, water removal, and mechanical properties of silk materials[J]. Biomacromolecules, 2016, 17(3): 1057-1066.
[67]XUE Y, WANG F, TORCULAS M, et al. Formic acid regenerated mori, tussah, eri, thai, and muga silk materials: Mechanism of self-assembly[J]. ACS Biomaterials Science & Engineering, 2019, 5(12): 6361-6373.
[68]BON S B, RAPI M, COLETTA R, et al. Plasticised regenerated silkgold nanorods hybrids as sealant and bio-piezoelectric materials[J]. Nanomaterials, 2020, 10(1): 179.
[69]ZHOU B G, WANG P, CUI L, et al. Self-crosslinking of silk fibroin using H2O2-horseradish peroxidase system and the characteristics of the resulting fibroin membranes[J]. Applied Biochemistry and Biotechnology, 2017, 182(4): 1548-1563.
[70]李新玥, 邢鐵玲. 基于酪氨酸酶的丝素蛋白膜的制备及其性能[J]. 丝绸, 2013, 50(10): 24-29.
LI X Y, XING T L. Study on the preparation and performance of the tyrosinase based silk fibroin membrane[J]. Journal of Silk, 2013, 50(10): 24-29.
[71]XIE C X, LI W J, LIANG Q Q, et al. Fabrication of robust silk fibroin film by controlling the content of β-sheet via the synergism of UV-light and ionic liquids[J]. Applied Surface Science, 2019, 492: 55-65.
[72]CAI B W, GU H L, WANG F, et al. Ultrasound regulated flexible protein materials: Fabrication, structure and physical-biological properties[J]. Ultrasonics Sonochemistry, 2021, 79: 105800.
[73]杨华. 丝素膜的共混改性研究[D]. 苏州: 苏州大学, 2004.
YANG H. Modification of Silk Fibroin Film by Blending[D]. Suzhou: Soochow University, 2004.
[74]YANG K, YAZAWA K, TSUCHIYA K, et al. Molecular interactions and toughening mechanisms in silk fibroin-epoxy resin blend films[J]. Biomacromolecules, 2019, 20(6): 2295-2304.
[75]ZHOU B G, ZHOU Q, WANG P, et al. HRP-mediated graft polymerization of acrylic acid onto silk fibroins and in situ biomimetic mineralization[J]. Journal of Materials Science: Materials in Medicine, 2018, 29(6): 1-14.
[76]张幼珠, 王朝霞, 吴徵宇, 等. 丙烯酸接枝丝素膜的结构及其性能研究[J]. 纺织学报, 2003(2): 17-20.
ZHANG Y Z, WANG Z X, WU Z Y, et al. Study of the structure and properties of acrylic acid grafted silk fibroin films[J]. Journal of Textile Research, 2003(2): 17-20.
Research progress in regulating the mechanical properties of silk fibroin films
LIU Haiyu, LIANG Wenan, WANG Yeyuan, HU Doudou, SUN Jingchen
(College of Animal Science, South China Agricultural University, Guangzhou 510642, China)
Abstract:Silk fibroin shows biocompatibility, biodegradability, and a lack of immunogenicity and allergenicity, possessing great potential in biomedical applications. In various forms of silk fibroin biomaterials, silk fibroin films are attracting increasing attention due to their easy processing. Among the physic-chemical properties of silk fibroin films, mechanical properties have great impact on their subsequent applications in vitro and in vivo. First, this paper briefly discussed the relationship between the hierarchical structures and mechanical properties of silk fibroin. Then, it summarized the influence of preparation parameters on mechanical properties, and the influence of different treatments on microstructure of silk films and the resulting changes in mechanical properties. Moreover, it discussed the relationship between structural changes and mechanical properties of silk fibroin films. Finally, it looked to the future to provide reference for the development of silk fibroin films to meet a variety of needs.
The mechanical properties of silk fibroin materials are structure dependent. Silk fibroin materials have five levels of hierarchical structures, in which the content of β-sheet in the secondary structure, the size and content of β-crystallites in the tertiary structure, and the density and orientation of β-crystallites in the quaternary structure are all critical parameters to the mechanical properties. The multi-level structure of silk fibroin can progressively influence the macroscopic mechanical properties step by step. In the aggregated state, it is generally accepted that the strength and stiffness of the silk fibroin material are determined by Silk II while ductility and flexibility are controlled by Silk I.
The rational design and reconstruction of silk fibroin structure can be implemented by controlling the preparation process. Pure silk fibroin films can be prepared in three steps: solution fabrication, film formation and post-treatment. Solution fabrication consists of degumming and silk fibroin dissolution, which will reduce the molecular weight of silk fibroin and therefore weaken the mechanical properties. As for film formation, solution casting or spin coating is often used to produce dense, porous, and lamellar films. The mechanical property of silk fibroin films fabricated via solution casting is controlled by controlling the drying rate, while films fabricated via spin-on method are limited by thickness. The pore size, pore density and pore distribution are important to mechanical properties for porous films, while the mechanical properties of lamellar films are related to the interlayer bond compactness. Post-treatments, such as organic solution immersion, water vapor annealing, external forces, and relative humidity in storage, can improve mechanical properties by changing crystallinity and orientation.
Additive modification is an effective way to improve the mechanical properties of silk fibroin films. Blending, plasticizing, and crosslinking are common additive modification methods. Mechanical properties are changed by forming specific intermolecular interactions between silk fibroin and additives. The interactions between blends and silk fibroin can be roughly divided into phase separation, strong interaction, and network formation. Among them, network formation needs an appropriate mixing ratio to form an excellent balance interaction. Crosslinkers form covalent links between molecules and increase the molecular weight. In this way, physical crosslinking and chemical crosslinking need to be balanced. Plasticizing can improve the flexibility and ductility of silk fibroin films. The commonly used plasticizers are glycerin, water, and Ca2+, and the combination of other additives gives silk fibroin films excellent comprehensive mechanical properties.
All in all, the hierarchical structures and the mechanic-structure dependence of silk fibroin materials make silk fibroin films adaptive to meet the applications requiring different mechanical properties. In the future, it is necessary to continue to expand the preparation methods of silk fibroin, and have an in-depth knowledge of the relationship between the structure and properties of silk fibroin, so as to accurately regulate the mechanical properties of silk fibroin films and further study the relationship between mechanical properties and other relevant properties. Mechanical property modification, functionalization and biocompatibility need to be considered together in the application studies of silk fibroin materials, so as to further expand the application range of silk fibroin materials.
Key words:
silk fibroin; film; mechanical properties; regulation method; composite materials; structure-property relationship

