不同光照强度对一种新紫菜孢子体的光合色素和叶绿素荧光参数的影响
王楠 苏妮 顾全 李信书 刘建羽
摘要 将新紫菜孢子體放置在5种不同的光照强度下[10、20、40、80、160 μmol/(m2 ·s)]培养,测量叶绿素a(Chl a)、类胡萝卜素(Car)、藻红蛋白(PE)、最大光合效率(Fv/Fm)和最大相对电子传递速率(rETRmax),探讨光照强度对新紫菜孢子体的光合色素含量和叶绿素荧光参数的影响。结果表明,20 μmol/(m2 ·s)培养下的新紫菜光合色素(Chl a、Car和PE)含量在培养期间都呈现出一个较高的数值,培养30 d后的新紫菜孢子体的Fv/Fm呈现出较高值。80和160 μmol/(m2 ·s)处理下培养至15 d 时其叶绿素荧光参数(Fv/Fm和rETRmax)呈现出较高的数值,培养至30 d时其光合色素含量和叶绿素荧光参数均呈现出一个低值。20 μmol/(m2 ·s)条件培养下的新紫菜孢子体色泽呈现健康的紫红色,高光[80、160 μmol/(m2 ·s)]培养下的新紫菜孢子体色泽变淡,发黄。根据其光合色素含量和叶绿素荧光参数来看,新紫菜孢子体最适培养光照强度应该在20 μmol/(m2 ·s)。
关键词 新紫菜;光照强度;光合色素;叶绿素荧光参数
中图分类号 S968.3+1 文献标识码 A 文章编号 0517-6611(2024)07-0001-04
doi: 10.3969/j.issn.0517-6611.2024.07.001
Effects of Different Light Intensity on Photosynthetic Pigment and Chlorophyll Fluorescence Parameters of Neoporphyra sp.Sporophyte
WANG Nan,SU Ni,GU Quan et al
(Key Laboratory of Marine Biotechnology,College of Marine Science and Fisheries,Jiangsu Ocean University,Lianyungang,Jiangsu 222005)
Abstract The sporophytes of Neoporphyra sp. were placed in 5 different light intensities,respectively 10,20,40,80 and 160 μmol/(m2 ·s),respectively.Chlorophyll a (Chl a),carotenoids (Car),phycoerythrin (PE),maximum photosynthetic efficiency (Fv/Fm) and maximum relative electron transfer rate (rETRmax) were measured,the effects of light intensity on photosynthetic pigment content and chlorophyll fluorescence parameters of Neoporphyra sp.sporophyte were explored.The result showed that the photosynthetic pigment contents (Chl a,Car,and PE) of N.sp.sporophyte by 20 μmol/(m2 ·s) were relatively high during the cultivation period,and the Fv/Fm of Neoporphyra sp.sporophyte after 30 days of cultivation showed a high value.The chlorophyll fluorescence parameters (Fv/Fm and rETRmax) showed high values after cultured at 80 and 160 μmol/(m2 ·s) for 15 days,while the photosynthetic pigment content and chlorophyll fluorescence parameters showed low values after 30 days of culture.The sporophytes of Neoporphyra sp.were healthy purplish red in 20 μmol/(m2 ·s) cultures,while the sporophytes of Neoporphyra sp.were light and yellow in high light cultures[80 and 160 μmol/(m2 ·s)].According to the photosynthetic pigment content and chlorophyll fluorescence parameters,the optimal light intensity of Neoporphyra sp.spores was 20 μmol/(m2 ·s).
Key words Neoporphyra sp.;Light intensity;Photosynthetic pigment;Chlorophyll fluorescence parameter
我国作为农业大国,紫菜是我国出口的重要海洋农作品中不可或缺的一部分,是食物的来源之一,同时也是我国沿海城市重要的经济来源[1-2]。紫菜蕴含的营养物质的含量相对也比较高,物美价廉[3]。紫菜还能有效改善海洋环境的富营养化问题,增加溶解氧含量,调控海水环境,防治海洋酸化问题以及海洋低溶氧问题等[4]。紫菜富含人体所需的多种物质,长期食用能够促进人体健康、提高人体防御抵抗能力等功效[5]。在连云港的海域地区调查中发现了一种紫菜,经过初步研究,这种紫菜只在Genebank有少量记录,没有正式命名。该种紫菜的孢子体具有形态细长、藻体较薄、耐干出等特点,具有潜在的栽培价值和生态价值。
光是植物生长发育的一部分,也是光合作用过程中不可缺乏的一部分,能够促进植物体的新陈代谢,促进植物体细胞分化以及细胞分裂,是植物体不可缺少的外界条件[6]。生长在潮间带的大型藻类紫菜在其培养过程中必须应对潮间带环境因素的巨大变化,其中包括光照强度这一重要环境因 素。关于其他大型藻类的研究中,很多藻类的生长与其光合活性密切相关,例如螺旋藻。由于相对较高的光合生理活性可以加速藻体的生长,因此研究藻体的光合生理特性对藻种的选育具有重要意义[7]。从育种的角度来看,培育具有高光利用效率的品种也是至关重要的。在光照试验中,试验人员更多是使用人工光源培育植物体的生长发育,该试验采用LED光源为紫菜生长提供培养光强[8]。为了更好地培育该种新紫菜,笔者研究新紫菜在不同时期下不同光照强度下叶绿素荧光特性、光合色素含量,探讨其对不同光照强度的响应,找到其最适合的培养光照强度。
1 材料与方法
1.1 试验材料 试验材料为实验室培养的新紫菜孢子体,在实验室将孢子体在无菌海水内通空气培养3 d即开始试验,采用VSE灭菌天然海水培养基。
1.2 试验条件设置
HP1000G-D型植物培养箱内设置5种不同的光照强度,分别为10、20、40、80和160 μmol/(m2 ·s)。 将新紫菜的孢子体放入500 mL培养瓶中,每个光照强度条件下设置3个平行试验,温度20 ℃,光周期为12 h/12 h。
1.3 试验方法
1.3.1 叶绿素a(Chl a)和类胡萝卜素(Car)的测定。
新紫菜孢子体培养至15和30 d后,称取0.1 g左右的孢子体放入含有5 mL甲醇的离心管中,避光处理。放置4 ℃的冰箱冷藏24 h后,4 ℃、5 000 r/min离心10 min。吸取上清液3 mL,测量其在470、653、666 nm波长处的吸光度。Car和Chl a的计算公式如下:
Car=(1 000×A470+1 403.57×A666-3 473.87×A653)/221
Chl a=15.65×A666-7.53×A653
其中,A470、A653和A666代表在对应波长下的吸光度。
1.3.2 藻红蛋白(PE)的测定。
新紫菜孢子体培养至15和30 d后,称取0.1 g左右的孢子体与石英砂、磷酸缓冲液(pH=6.8)研磨碎。用磷酸缓冲液将其定容至15 mL,4 ℃、5 000 r/min离心15 min。吸取3 mL上清液,测量其在455、564、592、618、645 nm波长处的吸光度。PE和PC的计算公式如下:
PE=[(A564-A592)-(A455-A592)×0.2]×0.12
其中,A455、A564、A592代表对应波长下的吸光度。
1.3.3 叶绿素荧光参数的测定。
新紫菜孢子体培养至15和30 d后,取5种不同光照强度下等量新紫菜的孢子体放置于比色皿中,暗处理15 min,然后用手持便携式叶绿素荧光测定仪测量最大光合效率(Fv/Fm)、相对电子传递速率(rETR)。
2 结果与分析
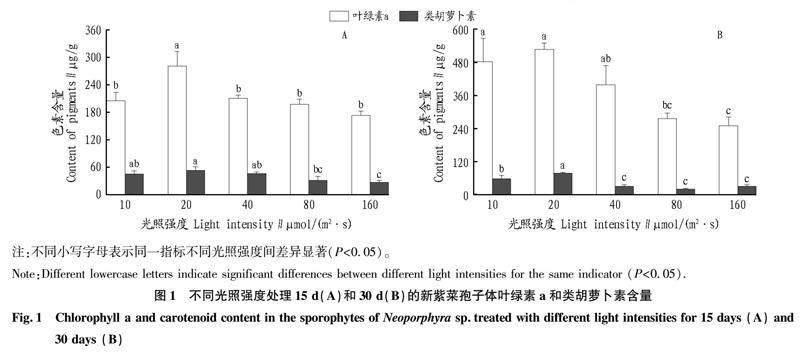
2.1 不同光照强度处理下新紫菜孢子体叶绿素a和类胡萝卜素含量
从图1A可以看出,不同光照强度下培养15 d的新紫菜孢子体的叶绿素a含量在20 μmol/(m2 ·s)条件下达到了最大值(281.35 μg/g),之后开始随着光照强度的增加逐渐降低。20 μmol/(m2 ·s)条件下的叶绿素a显著高于其他光照强度处理组, 在160 μmol/(m2 ·s)条件下达到了最低值(173.11 μg/g)。在20 μmol/(m2 ·s)条件下,类胡萝卜素含量达到了最大值(53.36 μg/g),之后开始随着光照强度的增加逐渐降低 ,在160 μmol/(m2 ·s)条件下达到了最低值(27.07 μg/g)。
从图1B可以看出,不同光照强度下培养30 d的新紫菜孢子体的叶绿素a含量在10和20 μmol/(m2 ·s)光照强度条件下无显著差异(P>0.05);在20 μmol/(m2 ·s)光照強度条件下达到了最大值(527.09 μg/g),之后开始随着光照强度的增加逐渐降低,在160 μmol/(m2 ·s)条件下达到了最低值(249.95 μg/g)。新紫菜孢子体的类胡萝卜素含量变化的趋势与新紫菜孢子体的叶绿素a含量趋势相同。在20 μmol/(m2 ·s)条件下含量达到了最大值(77.74 μg/g),之后随着光照强度的增加而降低,在80 μmol/(m2 ·s)条件下达到了最低值(30.00 μg/g)。
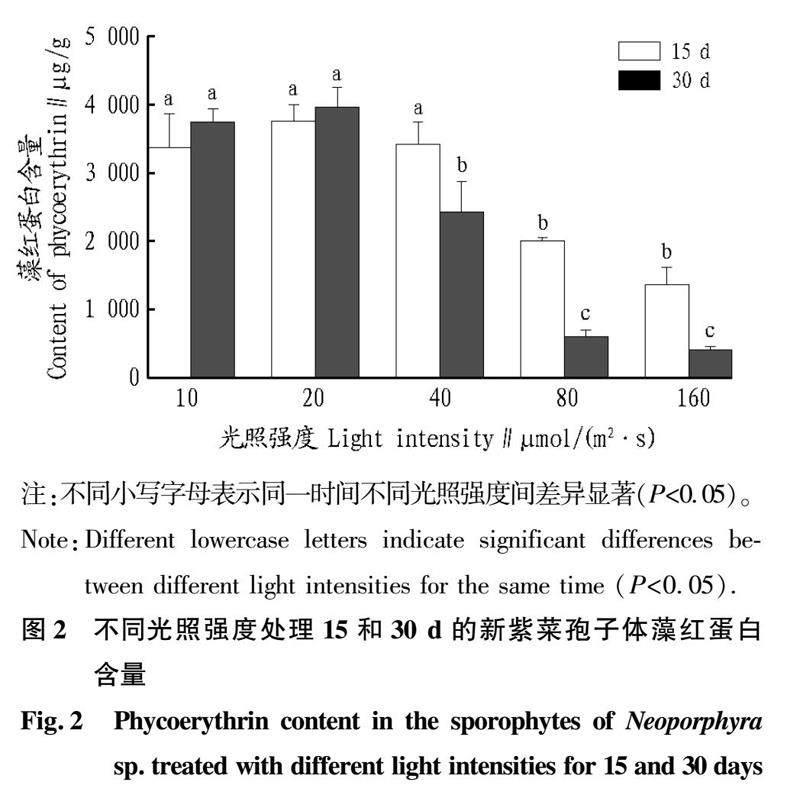
2.2 不同光照强度处理下新紫菜孢子体藻红蛋白含量
从图2可以看出,不同光照强度下培养15 d的新紫菜孢子体藻红蛋白含量随着光照强度的增加而升高并在20 μmol/(m2 ·s)条件下达到了最大值(3 754.48 μg/g),之后随着光照强度的增加逐渐降低。10、20和40 μmol/(m2 ·s)条件下的藻红蛋白含量显著高于80和160 μmol/(m2 ·s)条件下的藻红蛋白含量,在160 μmol/(m2 ·s)条件下达到了最低值(1 363.12 μg/g)。
不同光照强度下培养30 d的新紫菜孢子体藻红蛋白含量随着光照强度的增加而升高并在20 μmol/(m2 ·s)条件下达到了最大值(3 965.68 μg/g),之后开始随着光照强度的增加逐渐降低。10、20和40 μmol/(m2 ·s)条件下的藻红蛋白含量显著高于80和160 μmol/(m2 ·s)条件下的藻红蛋白含量,在160 μmol/(m2 ·s)条件下达到了最低值(405.76 μg/g)。
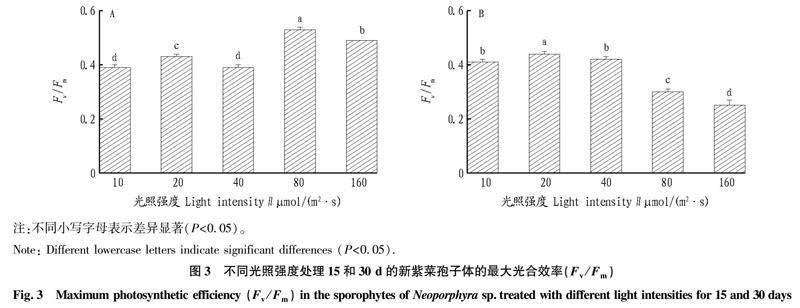
2.3 不同光照强度处理下新紫菜孢子体的最大光合效率(Fv/Fm)
从图3A可以看出,不同光照强度下培养15 d的新紫菜孢子体Fv/Fm在80 μmol/(m2 ·s)条件下达到了最大值(0.53)。高光照强度[80和160 μmol/(m2 ·s)]条件下的Fv/Fm显著高于低光照强度[10、20和40 μmol/(m2 ·s)]条件下的Fv/Fm,在10和40 μmol/(m2 ·s)条件下达到了最低值(0.39)。
从图3B可以看出,不同光照强度下培养的新紫菜孢子体Fv/Fm随着光照强度的增加而升高,并在20 μmol/(m2 ·s)条件下达到了最大值(0.44),之后随着光照强度的增加逐渐降低。20 μmol/(m2 ·s)条件下的Fv/Fm显著高于其他光照强度条件下的Fv/Fm,在160 μmol/(m2 ·s)条件下达到了最低值(0.25)。
2.4 不同光照强度处理下新紫菜孢子体的相对电子传递速率(rETR)
从图4可以看出,不同光照强度下培养15和30 d的新紫菜孢子体的快速光响应曲线达到峰值时的光照强度不同,且峰值也不同。不同光照强度条件下快速光响应曲线趋势相似,15 d处理下的80和160 μmol/(m2 ·s)条件下峰值最高,显著高于其他光照强度条件下的峰值。30 d处理下的20 μmol/(m2 ·s)条件下峰值最高,160 μmol/(m2 ·s)条件下峰值最低。
根据图4,计算得出新紫菜孢子体在15和30 d的最大相对电子传递速率(rETRmax)、饱和光照强度(Ik)和低光利用率(α),如表1~2所示。15 d的新紫菜孢子体的rETRmax在80 μmol/(m2 ·s)条件下达到了最大值,为41.74 μmol/(e·m2 ·s), 在40 μmol/(m2 ·s)条件下达到了最小值,为25.26 μmol/(e·m2 ·s);15 d的新紫菜孢子体的Ik在20 μmol/(m2 ·s)条件下达到了最大值,为415.13 μmol/(m2 ·s),在10 μmol/(m2 ·s)条件下达到了最小值,为320.88 μmol/(m2 ·s);15 d的新紫菜孢子体的α在10和40 μmol/(m2 ·s)条件下达到了最小值(0.14),在80和160 μmol/(m2 ·s)条件下达到了最大值(0.19)。30 d的新紫菜孢子体的rETRmax在40 μmol/(m2 ·s)条件下达到了最大值,为39.88 μmol/(e·m2 ·s),在160 μmol/(m2 ·s)条件下达到了最小值,为25.85 μmol/(e·m2 ·s);30 d的新紫菜孢子体的Ik在20 μmol/(m2 ·s)条件下达到了最大值,为814.96 μmol/(m2 ·s),在160 μmol/(m2 ·s)条件下达到了最小值,为459.15 μmol/(m2 ·s);30 d的新紫菜孢子体的α在20 μmol/(m2 ·s)条件下达到了最大值(0.21),在80和160 μmol/(m2 ·s)条件下达到了最小值(0.12)。
3 讨论
3.1 不同光照强度处理对新紫菜孢子体光合色素的影响
在对紫菜的研究试验中,光照强度作为重要的外界因素之一,对其的研究是不可分割的一部分。光合色素含量是紫
菜的重要组成部分,因为这些组成部分与紫菜本身色泽和生理组分组成密切相关[9]。该研究使用的实验室培养的新紫
菜孢子体,不同光照强度处理下其光合色素含量发生了明显的变化,这种变化可能会影响其光合特性和光适应能力。有研究表明坛紫菜的颜色基于主要光合色素如叶绿素a(Chl a)、藻红蛋白(PE)和藻蓝蛋白(PC)的相对含量,因此主要光合色素含量的测定可以在一定程度上反映光合色素产品的质量[10]。作为主要的捕光色素之一,PE含量的增加可以提高光吸收能力。叶绿素主要作为光合反应中心色素,Chl a和PE的增加可以将更多的能量转移到反应中心,提高其光合利用效率[11-13]。因此,在短暂的高光照强度下生长时,新紫菜孢子体中PE可以通过状态转换将能量转移给光系统 Ⅱ(PSⅡ) ,还可以通过状态转换将能量转移给光系统 Ⅰ(PSⅠ),从而新紫菜孢子体在高光照强度下表现出更高的光能利用率,但是长时间处于高光照强度培养下会显著降低新紫菜孢子体光合色素含量。
在目前的研究中,随着培养时间的变化,培养至30 d的新紫菜孢子体在20 μmol/(m2 ·s)条件下的叶绿素a(Chl a)、类胡萝卜素(Car)和藻红蛋白(PE)的含量高于其他光照强度条件下的含量。这也说明在适宜的光照强度下有利于新紫菜孢子体的光合色素累积。
3.2 不同光照强度处理对新紫菜孢子体的叶绿素荧光参数的影响
生活在潮间带养的紫菜孢子体,一定程度上必须应对高光照强度和脱水等胁迫环境[14]。实际上,光胁迫现象可能在紫菜的生长期间频繁发生,这也降低了紫菜的数量和质量[15]。有相关研究表明为了在高光胁迫环境下生存,红藻进化出了一种状态转换机制,以调节PSⅠ和PSⅡ间吸收的光能[16]。相关研究表明,叶绿素荧光和光合色素含量等光合参数的测定有助于分析在胁迫环境下生长的不同藻体的光合特性,因为这些特性与生长活性密切相关。因此,光合作用参数的测量可能有助于提高繁殖效率[17]。叶绿素荧光通常用于光合作用的研究,特别是PSⅡ参数,叶绿素荧光已被广泛用于研究陆地植物和藻类的光合特性和胁迫耐受能力[18]。有相关研究表明藻体的PSⅡ在过度光照下受到抑制[19]。该研究中培养至30 d的新紫菜孢子体在160 μmol/(m2 ·s)处理下Fv/Fm显著低于其他光照强度处理下,说明过高的光照强度抑制了其光合作用。长期的高强度光照会对紫菜的生长产生抑制作用。高光照强度下,紫菜的Fv/Fm会随着光照强度的增加而增加,但同时也会增加光抑制作用,导致紫菜的光合作用达到饱和后, 继续增加光照强度对光合作用并没有促进作用。而低光照強度下,光照不足导致紫菜的光合作用速率下降,但同时也减少了光抑制作用,使得紫菜能够更有效地利用有限的光能进行光合作用[20-21]。
4 結结
该研究将新紫菜孢子体放置在5种不同的光照强度下[10、20、40、80、160 μmol/(m2 ·s)]培养,测量叶绿素a(Chl a)、类胡萝卜素(Car)、藻红蛋白(PE)、最大光合效率(Fv/Fm)和最大相对电子传递速率(rETRmax),探讨不同时期下不同光照强度对新紫菜孢子体的光合色素含量和叶绿素荧光参数的影响, 找到其最适合的培养光照强度。结果表明,20 μmol/(m2 ·s)培养下的新紫菜光合色素(Chl a、Car和PE)含量在培养期间都呈现出一个较高的数值,培养30 d后的新紫菜孢子体的Fv/Fm呈现出较高的值;80和160 μmol/(m2 ·s) 处理下培养至15 d 时其叶绿素荧光参数(Fv/Fm和rETRmax)呈现出较高的数值,培养至30 d时其光合色素含量和叶绿素荧光参数均呈现出一个低值。20 μmol/(m2 ·s)条件培养下的新紫菜孢子体色泽呈现健康的紫红色,高光[80、160 μmol/(m2 ·s)]培养下的新紫菜孢子体色泽变淡,发黄。由此可见,光照强度在20 μmol/(m2 ·s)条件下有利于新紫菜孢子体的光合色素(Chl a、Car、PE)累积,从而增强其光合作用效率和抗氧化能力,提高其色泽强度,促进其进行有效的光合作用。长期处于过高的光照强度会使新紫菜孢子体叶绿素a、类胡萝卜素、藻红蛋白含量下降,从而抑制其光合作用。根据其光合色素含量和叶绿素荧光参数来看,新紫菜孢子体最适培养光照强度在20 μmol/(m2 ·s)。
参考文献
[1] XIE C T,LI B,XU Y,et al.Characterization of the global transcriptome for Pyropia haitanensis (Bangiales,Rhodophyta)and development of cSSR markers[J].BMC Genomics,2013,14:1-13.
[2] WANG D M,YU X Z,XU K P,et al.Pyropia yezoensis genome reveals diverse mechanisms of carbon acquisition in the intertidal environment[J].Nat Commun,2020,11(1):1-11.
[3] 于娇,陈胜军,胡晓,等.不同采收期坛紫菜营养成分分析与品质评价[C]//中国食品科学技术学会第十五届年会论文摘要集.北京:中国食品科学技术学会,2018:255-256.
[4] XIAO X,AGUSTI S,LIN F,et al.Nutrient removal from Chinese coastal waters by largescale seaweed aquaculture[J].Scientific Rep,2017,7:1-6.
[5] CAO J,WANG J P,WANG S C,et al.Porphyra species:A minireview of its pharmacological and nutritional properties[J].J Med Food,2016,19(2):111-119.
[6] DARKO E,HEYDARIZADEH P,SCHOEFS B,et al.Photosynthesis under artificial light:The shift in primary and secondary metabolism[J].Philos Trans R Soc Lond B Biol Sci,2014,369(1640):1-7.
[7] ZHANG T,SHEN Z G,XU P,et al.Analysis of photosynthetic pigments and chlorophyll fluorescence characteristics of different strains of Porphyra yezoensis[J].Appl Phycol,2012,24(4):881-886.
[8] ECONOMOU A S,READ P E,SPANOUDAKI M J.Azalea regeneration from callus cullture[J].Acta Hortic,1988,226:209-216.
[9] YAN X H,FUJITA Y,ARUGA Y.Induction and characterization of pigmentation mutants in Porphyra yezoensis(Bangiales,Rhodophyta)[J].J Appl Phycol,2000,12(1):69-81.
[10] NIWA K,MIZUTA A,ARUGA Y.Genetic characterization of a spontaneous greentype pigmentation mutant of Porphyra yezoensis and the significance of using heterozygous conchocelis in nori far ming[J].Fisheries Sci,2002,68(4):729-735.
[11] NIWA K,FURUITA H,ARUGA Y.Free a mino acid contents of the gametophytic blades from the green mutant conchocelis and the heterozygous conchocelis in Porphyra yezoensis Ueda (Bangiales,Rhodophyta)[J].J Appl Phycol,2003,15(5):407-413.
[12] NIWA K,FURUITA H,YAMAMOTO T,et al.Identification and characterization of a greentype mutant of Porphyra tenera Kjellman var.tamatsuensis Miura (Bangiales,Rhodophyta)[J].Aquaculture,2008,274(1):126-131.
[13] NIWA K,YAMAMOTO T,FURUITA H,et al.Mutation breeding in the marine crop Porphyra yezoensis(Bangiales,Rhodophyta):Cultivation experiment of the artificial red mutant isolated by heavyion beam mutagenesis[J].Aquaculture,2011,314(1/2/3/4):182-187.
[14] KATZ S,KIZNER Z,DUBINSKY Z,et al.Responses of Porphyra linearis(Rhodophyta) to environmental factors under controlled culture conditions[J].J Appl Phycol,2000,12(3):535-542.
[15] HERBERT S K.Photoinhibition resistance in the red alga Porphyra perforata:The role of photoinhibition repair[J].Plant Physiol,1990,92(2):514-519.
[16] YOKONO M,MURAKAMI A,AKIMOTO S.Excitation energy transfer between photosystem II and photosystem I in red algae:Larger amounts of phycobilisome enhance spillover[J].Biochim Biophys Acta,2011,1807(7):847-853.
[17] CRAWFORD M H.LEDs for solidstate lighting:Performance challenges and recent advances[J].IEEE J Sel Top Quantum Electron,2009,15(4):1028-1040.
[18] BAKER N R,ROSENQVIST E.Applications of chlorophyll fluorescence can improve crop production strategies:An examination of future possibilities[J].J Exp Bot,2004,55(403):1607-1621.
[19] SCHREIBER U,BILGER W,NEUBAUER C.Chlorophyll fluorescence as a nonintrusive indicator for rapid assessment of in vivo photosynthesis[M]//SCHULZE E D,CALDWELL M M.Ecophysiology of photosynthesis.Berlin:SpringerVerlag,1995:49-70.
[20] DUTTA GUPTA S,JATOTHU B.Fundamentals and applications of lightemitting diodes(LEDs)in in vitro plant growth and morphogenesis[J].Plant Biotechnol Rep,2013,7:211-220.
[21] STARR C.Biology:Concepts and applications without physiology[M].Belmont,CA:Thomson Brooks/Cole,2008.
基金項目 江苏省科技厅苏北科技专项(LYG-SZ201817);江苏省现代农业重点项目(BE2018335)。
作者简介 王楠(1999—),女,江苏连云港人,硕士研究生,研究方向:海藻生物学。*通信作者,教授,硕士生导师,从事紫菜生物学研究。

