基于广泛靶向代谢组的桃果实衰老软化过程差异代谢物筛选与鉴定
郭绍雷 许建兰 张斌斌 张妤艳 沈志军 马瑞娟 俞明亮


摘要:筛选与鉴定参与调控桃果实采后贮藏过程衰老软化相关代谢物质,以深入了解桃果实采后衰老软化相关生理生化机制。常温贮藏条件下,萘乙酸处理可加速霞晖8号七成熟桃果实衰老软化,采用超高液相色谱串联质谱技术,检测桃果实贮藏0、3、6 d代谢物质的变化,选取差异倍数值(≥2或≤0.5),采用正交偏最小二乘判别分析模型所获得的变量重要性投影值(≥1)的代谢物为差异代谢物。结果表明,在霞晖8號桃果实5组样品中共检测到816种代谢物,可被分为11类,其中检测到酚酸类物质160种,占比最高。通过比较在各分组中代谢物定量信息的差异倍数变化前10的代谢物,结合KEGG信号通路的差异代谢物聚类分析,筛选并鉴定到可能参与桃果实软化的各种代谢物29种,其中脂质与酚酸类物质鉴定到最多,各有7种。
关键词:桃果实;衰老软化;代谢组;差异代谢物
中图分类号:S662.101 文献标志码:A
文章编号:1002-1302(2024)06-0198-08
收稿日期:2023-10-23
基金项目:现代农业产业技术体系建设专项(编号:CARS-30);江苏省种业振兴“揭榜挂帅”项目(编号:JBGS[2021]082)。
作者简介:郭绍雷(1988—),男,山东郯城人,博士,助理研究员,主要从事桃种质资源与新品种选育工作。E-mail:guoshaolei0305@126.com。
通信作者:俞明亮,博士,研究员,主要从事桃种质资源与新品种选育工作。E-mail:mly@jaas.ac.cn。
桃[(Prunus persica L.) Batsch]原产于中国,在世界多地广泛栽种,依据联合国粮食及农业组织统计(https://www.fao.org/faostat/zh/#data/QCL),2021年我国桃栽培面积和产量占全球比重超过50%,均位列世界第一。然而,桃是典型的呼吸跃变型水果。常温下,成熟桃果实软化迅速,不方便采运,货架期较短,果实易损耗[1],造成重大经济损失,是制约我国桃产业进一步发展的因素之一。桃果实衰老软化相关机理的探究,将为桃果实采后保鲜技术的进步及耐贮新品种的选育提供理论依据。
乙烯的生物合成和信号转导,以及下游的细胞壁降解,是存在于果实衰老软化中的复杂生理生化过程[2-4]。研究表明,乙烯可通过调控木葡聚糖内糖基转移酶/水解酶、β-半乳糖苷酶、果胶甲酯酶以及多聚半乳糖醛酸酶等细胞壁降解相关酶活性,参与调控果实衰老软化[5-7]。还有研究表明,包括MADS-box、NAC、ERF等在内的转录因子,可通过调控乙烯生物合成或信号转导,影响果实衰老软化进程[8-9]。在桃果实中,多聚半乳糖醛酸酶是决定果实衰老软化进程的主要因素之一,通过外源乙烯处理桃果实,使多个多聚半乳糖醛酸酶家族基因成员的表达量,伴随果实衰老软化而显著升高[10]。乙烯响应因子PpeERF2可与PpePG1启动子结合,负调控PpePG1的表达,进而影响桃果实成熟软化[11]。β-半乳糖苷酶与果实衰老软化密切相关[12],桃β-半乳糖苷酶基因家族成员中PpBGAL2和PpBGAL16在不同肉质桃常温贮藏过程中差异表达[13],且PpBGAL16可能受乙烯诱导参与桃果实衰老软化[14]。Gu等的研究表明,桃PpHB.G7转录因子可调控PpACS1和PpACO1编码酶ACS与ACO活性,影响乙烯生物合成,对桃果实的成熟软化起作用[15]。生长素与乙烯相互作用调控果实衰老软化成为当前研究的热点。喷施萘乙酸(1-naphthaleneacetic acid,简称NAA)可使硬质桃迅速变软,并提高乙烯生物合成中ACS1、ACS7与ACO3等基因的转录水平,增加乙烯释放量[16]。最近的研究表明,桃生长素响应因子PpIAA1可调控PpACS1的表达,影响乙烯释放量,而乙烯响应因子PpERF4还可通过与PpACO1和PpIAA1启动子结合,影响乙烯合成[17]。桃生长素响应因子PpARF6可结合PpACS1和PpACO1的启动子,激活其转录,促进乙烯的生物合成。蛋白水平上,PpARF6抑制PpEBF1/PpEBF2和PpEIL2/PpEIL3之间的相互作用,增强PpEIL2/PpEIL3蛋白稳定性,对PpACS1和PpACO1的转录激活作用增强,进一步促进乙烯合成[18]。桃果实衰老软化机制受多种因子调控,是一个复杂的调控网络。目前,相关生理生化机制的研究大多集中在相关酶活的变化和关键基因调控研究。
广泛靶向代谢组学通过建库、检测、分析等流程,完成对代谢物组分的鉴定和相对含量的分析,具有通量高、覆盖广、灵敏度与精度高的特点[19-20]。目前该技术已广泛应用于桃[21-22]、葡萄[23]、冬枣[24]、茶[25]等园艺作物上。桃果实常温贮藏过程代谢组学的研究还鲜有报道,缺乏相关系统的研究,相关代谢机理仍需探究。本研究选取七成熟桃果实常温贮藏6 d,通过NAA处理加快果实软化,采用基于液质联用的广泛靶向代谢组学技术,鉴定和比较分析常温贮藏过程中代谢物组分和相对含量,为桃果实采后保鲜技术的发展及耐贮藏新品种的选育提供理论依据。
1 材料与方法
1.1 试验材料
本研究以桃品种霞晖8号果实为试验材料,霞晖8号桃果实样品取自江苏省农业科学院果树研究所桃试验园,常规栽培管理。试验于2021年进行,选取七成熟标准(果实完成膨大,底色未转变)桃果实进行采收,采收后立即运回江苏省农业科学院实验室进行贮藏试验。选取大小均一、无病虫伤害的完好桃果实用于常温贮藏试验。根据Tatsuki等的方法[26],对桃果实进行NAA喷施处理,NAA喷施浓度为1 mmol/L(含0.01% Tween 20),对照组喷施0.01% Tween 20水溶液,喷施频次间隔1 d。常温贮藏试验,温度设为(25±1) ℃,相对湿度为75%~85%,贮藏0、3、6 d各取样1次,对照组(CK,0、3、6 d),NAA处理组(NT,0、3、6 d),5个桃果实为1次重复,所有试验进行3次生物学重复。桃果实样品先去皮,后切成大小均匀块状,经液氮快速冷冻处理后,置于-80 ℃冰箱。
1.2 硬度检测
桃果实硬度检测使用TA-XT Plus质构仪,使用直径为8 mm的探头在桃果实样品腹缝线两侧中间部位进行检测,检测深度是5 mm,速率是 1 mm/s。
1.3 代谢物提取
桃果实样品先通过冻干机真空冷冻干燥,后将桃果实样品磨成粉末。称量0.100 g桃果实粉末,置于1.2 mL含70%甲醇的提取液中进行溶解。对提取液进行涡旋处理6次,频次按照每30 min涡旋 0.5 min 进行。涡旋处理后的提取液放于4 ℃冰箱过夜。离心后,吸取上清液,吸取的上清液使用0.22 μm微孔膜过滤,用于检测。
1.4 色谱质谱方法
使用超高效液相色谱和串联质谱(色谱仪,SHIMADZU Nexera X2;串联质谱,Applied Biosystems 4500 QTRAP)进行数据采集。超高液相色谱使用的色谱柱为安捷伦SB-C18,色谱柱的参数(1.8 μm,2.1 mm,100 mm)。其他液相色谱采集条件:分为A和B两相,使用超纯水(加入0.1%的甲酸)作为A相,使用乙腈(加入0.1%的甲酸)作为B相。洗脱梯度设置:开始后,B相占比5%,然后设置B相于 9 min 内占比匀速增至95%,保持1 min,设置B相11.10 min内占比减少至5%,并维持至14 min。液相色谱采集条件中,进样量4 μL,流速保持在 0.35 mL/min,柱温保持在40 ℃。主要的质谱条件:使用AB4500 Q TRAP UPLC/MS/MS质谱系统,配置电喷雾离子源。设定电压5 500 V(正离子模式)/-4 500 V(负离子模式),源温度设定为 550 ℃,帘气参数设定为0.172 4 MPa,碰撞诱导电离参数条件设定为高。
1.5 代谢物定性定量分析
代谢物定性分析,以MWDB(Metware database)为数据库,数据分析前需删除包括含NH+4、Na+、K+,与其他碎片离子在内的各种重复信号,以及产生的同位素信号。然后依据获得的二级谱信息,完成物质的定性解析。通过三重四级杆质谱仪中的多反应监测模式,进行代谢物定量:目标物质的前体离子(母离子)最初利用四级杆获得筛查,后使其经碰撞室诱导电离后形成碎片离子,然后,利用三重四级杆继续筛查,获取1个特征碎片离子。数据分析,首先获取桃样品检测到的物质质谱峰,后对其峰面积进行积分。针对试验中不同桃果实样品中的同一个代谢物的质谱出峰,进行积分校正[27]。
1.6 数据处理与分析
确定差异代谢物的标准:代谢物的差异倍数值(Fold change,FC)≥2或≤0.5,采用正交偏最小二乘判别分析模型所获得的变量重要性投影值(variable importance in projection,简称VIP)≥1[28]。使用KEGG数据库注释和显示差异代谢物[29]。
2 结果与分析
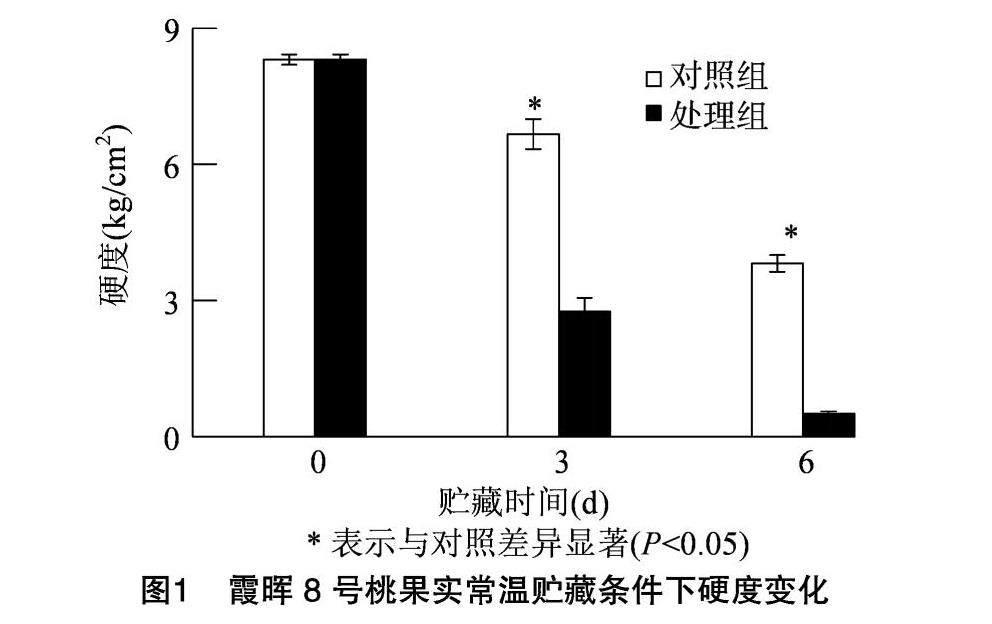
2.1 桃果实常温贮藏过程中硬度变化
霞晖8号七成熟桃果实随常温贮藏过程延长,对照组与NAA处理组硬度均下降。NAA处理后使霞晖8号七成熟果实硬度迅速下降,下降速度快于对照组(图1)。
2.2 桃果实常温贮藏过程中代谢物种类鉴定
将七成熟桃果实喷施NAA常温贮藏0、3、6 d,对照分别命名CK 0 d、CK 3 d、CK 6 d,处理组命名為NT 3 d、NT 6 d。经与数据库比对分析发现,在霞晖8号桃果实5组样品中共检测到816种代谢物,可被分为11类(表1)。其中检测到酚酸类物质160种,占比最高。脂质、黄酮类、氨基酸及其衍生物、有机酸占比较高。
2.3 桃果实常温贮藏过程各分组相对含量变化趋势
为研究桃果实差异代谢物不同分组中的相对含量变化趋势,将分组比较中的差异代谢物的相对含量进行标准化,随后进行K均值聚类分析。如图2所示,桃果实常温贮藏过程中的代谢物相对含量变化趋势共分为7组。第3组代谢物相对含量变化趋势包含的差异代谢物有64种,该组中差异代谢物在对照组与处理组中均有上升趋势,第5组中差异代谢物相对含量变化在对照组与处理组中均有下降趋势,包含的差异代谢物有44种。各组所含代谢物数量有异同,其中第6组所含的差异代谢物也有64种,与第3组相同,第4组所含差异代谢物最少,只有8种。
2.4 桃果实常温贮藏过程中差异代谢物鉴定
比较在各分组中代谢物定量信息的差异倍数变化,鉴定对照组中的CK 0 d vs. CK 3 d、CK 3 d vs. CK 6 d,处理组中的CK 0 d vs. NT 3 d、NT 3 d vs. NT 6 d的差异代谢物,对上调前10位差异代谢物和下调前10位差异代谢物进行分析。由图3可见,在对照组2分组CK 0 d vs. CK 3 d与CK 3 d vs. CK 6 d上调前10位差异代谢物中共鉴定到19种代谢物,其中溶血磷脂酰胆碱18∶4在对照组2分组中均是上调前10位差异代谢物。对照组2分组中下调前10位差异代谢物中共鉴定到18种,其中松柏醇、1-甲基腺嘌呤在CK 0 d vs. CK 3 d与CK 3 d vs. CK 6 d 2分组中均是下调前10位差异
代谢物。处理组2分组中共鉴定到上调代谢物20种,2分组中上调前10位的差异代谢物均不相同。处理组2分组中下调前10位差异代谢物中共鉴定到18种,其中松柏醇、溶血磷脂酰胆碱16∶1(2n异构)在处理组CK 0 d vs. NT 3 d与NT 3 d vs. NT 6 d 中均是下调前10位的差异代谢物。
对照组2分组鉴定到的19种与处理组2分组鉴定到的20种上调前10位差异代谢物取交集,共鉴定到10种代谢物:香兰素乙酸酯、溶血磷脂酰胆碱16∶2(2n异构)、溶血磷脂酰胆碱16∶2、溶血磷脂酰胆碱18∶4、水飞蓟素、溶血磷脂酰胆碱19∶1、4-乙基苯甲醛、7-羟基-4-甲基-8-硝基香豆素、10-羟基癸酸、5-甲氧基水杨酸。对照组2分组(18种)与处理组2分组(18种)下调前10位差异代谢物取交集,共鉴定到7种代谢物:松柏醇、溶血磷脂酰胆碱16∶1(2n异构)、溶血磷脂酰胆碱 18∶1 (2n异构)、2-羟基肉桂酸、丁香酸、L-甲硫氨酸、1-甲基腺嘌呤。鉴定到的代谢物信息见表2。
2.5 KEGG信号通路的差异代谢物聚类热图分析
KEGG信号通路的差异代谢物聚类分析是根据差异代谢物的KEGG注释信息,选择至少含有5个差异代谢物的KEGG代谢通路,对所选的KEGG代谢通路中的差异代谢物的相对含量进行聚类分析,挖掘重要代谢通路中的代谢物在不同分组中的特性。由KEGG信号通路的差异代谢物聚类分析(图4),发现在对照组2分组CK 0 d vs. CK 3 d与CK 3 d vs. CK 6 d中共有上调代谢物7种,其中吲哚-3-乙酸同时在对照组2分组中上调。在对照组2分组中下调的代谢物共鉴定到9种,其中松柏醇在CK 0 d vs. CK 3 d与CK 3 d vs. CK 6 d中均为下调。在处理组2分组中CK 0 d vs. NT 3 d与NT 3 d vs. NT 6 d的KEGG信号通路的差异代谢物聚类分析中上调代谢物共鉴定到22种,其中迷迭香酸、腺苷在处理组2个分组中均有上调趋势。处理组2分组中下调代谢物共鉴定到21种,其中松柏醇、2-羟基肉桂酸在处理组2分组CK 0 d vs. NT 3 d与NT 3 d vs. NT 6 d中均下调。
对照组2分组中的7种与处理组2分组中的22种有上调趋势代谢物取交集,共鉴定到5种代谢物:脱落酸、对香豆醇、迷迭香酸、腺苷-5′-单磷酸、尿嘧啶核苷。对照组2分组(9种)与处理组2分组(21种)有下调趋势代谢物取交集,共鉴定到8种代
谢物:腐胺、松柏醇、磷酸烯醇式丙酮酸、黄苷、2-羟基肉桂酸、阿魏酸、L-甲硫氨酸、2-(甲酰氨基)苯甲酸。在KEGG信号通路的差异代谢物聚类分析中筛选得到的代谢物信息见表2。
本研究通过代谢物定量信息的差异倍数变化和KEGG信号通路的差异代谢物聚类分析共鉴定到可能参与桃果实软化的各种代谢物29种,其中脂质类和酚酸类各有7种,核苷酸及其衍生物有5种,有机酸类3种,生物碱2种,黄酮、木脂素和香豆素、氨基酸及其衍生物各1种,其他类2种(表2)。
3 讨论与结论
桃是世界上栽培最为广泛的落叶果树之一,我国桃产业在世界占有重要地位,近年来在栽培面积和产量上一直占比超过全球50%。然而,桃作为典型的呼吸跃变型水果,成熟后极易软化,货架期较短,运输成本较高,损耗高[1],给种植者和销售者带来较大的经济损失。桃果实衰老软化的调控仍是桃产业发展需要应对的问题,与种植者、生产者营收与产业发展都息息相关。开展桃果实衰老软化相关理论的研究能为降低桃果实采后损耗提供理论基础,对桃产业的持续健康发展有重要意义。
在所有的脂质中,磷脂的种类丰富,也是构成细胞膜最主要的脂类物质。本研究7种脂质相对含量的变化,可能与桃果实衰老软化过程中细胞膜的分解有关。酚酸类物质是主要的多酚类物质之一。植物中的酚类物质被认为是重要的次生代谢物质之一。研究发现,酚类物质在植物抗病虫害、抗逆等多方面发挥作用[30],同时在果实中也具有重要的抗氧化能力[31-32]。本研究筛选鉴定的7种酚酸类代谢物种,迷迭香酸随着桃果实贮藏软化过程有上调趋势,多数酚酸类物质[松柏醇、2-羟基肉桂酸、丁香酸、阿魏酸、2-(甲酰氨基)苯甲酸]在桃果实贮藏软化过程中有下调趋势,对香豆醇则无明显规律。朱辰晖等的研究表明,酚酸类物质能激活桃果实中多种抗氧化酶,能增强桃果实的抗氧化能力;使用对羟基肉桂酸,桃果实多酚对DPPH·和羟自由基清除能力得到加强,桃果实的成熟衰老得到延缓[33]。阿魏酸在柑橘抗氧化活性中被鉴定为主要作用物质之一[34]。因而这些酚酸类物质含量可能随着桃果实衰老软化进程逐渐减少,抗氧化活性减弱。吲哚-3-乙酸是常见的生长素类物质,在植物体内发挥着重要作用。Tatsuki等研究发现,硬质桃在成熟后几乎不释放乙烯,且吲哚-3-乙酸含量极低,而普通桃有大量乙烯释放,吲哚-3-乙酸含量较高,表明乙烯的生物合成可能需要生长素介导[26]。硬质桃中PpACS1的表达量和乙烯释放量同时受NAA诱导增加,暗示吲哚-3-乙酸可介导乙烯合成[35]。腐胺是植物体内多胺的主要种类之一。研究表明,外源多胺处理可下调桃果实乙烯合成相关基因表达,上调多胺合成相关基因的表达,促进果实多胺合成并降低乙烯释放量和呼吸速率,延缓桃果实成熟衰老[36]。张海燕等使用外源腐胺处理油桃,促使油桃超氧化物歧化酶、过氧化氢酶、过氧化物酶的活性提高,同时乙烯释放量和呼吸释放速率下降,果实硬度下降延缓[37]。說明生物碱类物质吲哚-3-乙酸与腐胺在桃果实衰老软化过程中起到重要调控作用。研究表明,桃果实成熟过程中,内源脱落酸的积累构成了果实成熟的启动信号,而脱落酸高峰的出现启动了果实的后熟衰老进程[38],本研究中脱落酸的相对含量变化趋势符合上述结果。有研究表明,在桃果实成熟软化过程中脱落酸可能也受到乙烯的调控,如乙烯可通过PpERF3调节脱落酸生物合成基因PpNCED2/3的表达从而促进其生物合成[39]。其他代谢物质在桃果实衰老软化进程中如何发挥作用还需要更深入的研究。本研究使用广泛靶向代谢组学方法分析鉴定了29种代谢物质,可能参与桃果实软化的进程,将为桃果实衰老软化过程中的代谢物质研究提供参考。
參考文献:
[1]Yoshioka H,Hayama H,Tatsuki M,et al. Cell wall modification during development of mealy texture in the stony-hard peach “Odoroki” treated with propylene[J]. Postharvest Biology and Technology,2010,55(1):1-7.
[2]Brummell D A,Dal Cin V,Crisosto C H,et al. Cell wall metabolism during maturation,ripening and senescence of peach fruit[J]. Journal of Experimental Botany,2004,55(405):2029-2039.
[3]Hayama H,Shimada T,Fujii H,et al. Ethylene-regulation of fruit softening and softening-related genes in peach[J]. Journal of Experimental Botany,2006,57(15):4071-4077.
[4]Tucker G,Yin X R,Zhang A D,et al. Ethyleneand fruit softening[J]. Food Quality and Safety,2017,1(4):253-267.
[5]Zhang Z Y,Wang N,Jiang S H,et al. Analysis of the xyloglucan endotransglucosylase/hydrolase gene family during apple fruit ripening and softening[J]. Journal of Agricultural and Food Chemistry,2017,65(2):429-434.
[6]Iqbal N,Khan N A,Ferrante A,et al. Ethylene role in plant growth,development and senescence:interaction with other phytohormones[J]. Frontiers in Plant Science,2017,8:475.
[7]阚娟,刘俊,金昌海. 桃果实成熟软化与细胞壁降解相关糖苷酶及乙烯生物合成的关系[J]. 中国农业科学,2012,45(14):2931-2938.
[8]徐小迪,李博强,秦国政,等. 果实采后品质维持的分子基础与调控技术研究进展[J]. 园艺学报,2020,47(8):1595-1609.
[9]Xu H Y,Chen Y Y,Wang L B,et al. Transcriptome analysis reveals a regulation of ethylene-induced post-harvest senescence in pear fruit[J]. Scientia Horticulturae,2018,240:585-591.
[10]Qian M,Zhang Y K,Yan X Y,et al. Identification and expression analysis of polygalacturonase family members during peach fruit softening[J]. International Journal of Molecular Sciences,2016,17(11):1933.
[11]Wang X B,Zeng W F,Ding Y F,et al. Peach ethylene response factor PpeERF2 represses the expression of ABA biosynthesis and cell wall degradation genes during fruit ripening[J]. Plant Science,2019,283:116-126.
[12]Smith D L,Abbott J A,Gross K C. Down-regulation of tomato beta-galactosidase 4 results in decreased fruit softening[J]. Plant Physiology,2002,129(4):1755-1762.
[13]Guo S L,Song J,Zhang B B,et al. Genome-wide identification and expression analysis of beta-galactosidase family members during fruit softening of peach[Prunus persica (L.) Batsch][J]. Postharvest Biology and Technology,2018,136:111-123.
[14]Liu H K,Qian M,Song C H,et al. Down-regulation of PpBGAL10 and PpBGAL16 delays fruit softening in peach by reducing polygalacturonase and pectin methylesterase activity[J]. Frontiers in Plant Science,2018,9:1015.
[15]Gu C,Guo Z H,Cheng H Y,et al. A HD-ZIP Ⅱ HOMEBOX transcription factor,PpHB.G7,mediates ethylene biosynthesis during fruit ripening in peach[J]. Plant Science,2019,278:12-19.
[16]Tadiello A,Ziosi V,Negri A S,et al. On the role of ethylene,auxin and a GOLVEN-like peptide hormone in the regulation of peach ripening[J]. BMC Plant Biology,2016,16:44.
[17]Wang X B,Pan L,Wang Y,et al. PpIAA1 and PpERF4 form a positive feedback loop to regulate peach fruit ripening by integrating auxin and ethylene signals[J]. Plant Science,2021,313:111084.
[18]Chen X M,Liu Y D,Zhang X,et al. PpARF6 acts as an integrator of auxin and ethylene signaling to promote fruit ripening in peach[J]. Horticulture Research,2023,10(9):uhad158.
[19]Sawada Y,Akiyama K,Sakata A,et al. Widely targeted metabolomics based on large-scale MS/MS data for elucidating metabolite accumulation patterns in plants[J]. Plant & Cell Physiology,2009,50(1):37-47.
[20]Chen W,Gong L,Guo Z L,et al. A novel integrated method for large-scale detection,identification,and quantification of widely targeted metabolites:application in the study of rice metabolomics[J]. Molecular Plant,2013,6(6):1769-1780.
[21]闫乐乐,卜璐璐,牛良,等. 广泛靶向代谢组学解析桃蚜危害对桃树次生代谢产物的影响[J]. 中国农业科学,2022,55(6):1149-1158.
[22]刘苏寧,王力荣,方伟超,等. 基于广泛靶向代谢组学的桃芽抗寒代谢物的筛选与鉴定[J]. 果树学报,2023,40(1):1-12.
[23]生弘杰,卢素文,郑暄昂,等. 基于广泛靶向代谢组学的葡萄种子代谢物鉴定与比较分析[J]. 中国农业科学,2023,56(7):1359-1376.
[24]石飞,邢玉青,李志刚,等. 基于广泛靶向代谢组学的冷藏冬枣成分分析[J]. 中国食品学报,2023,23(4):324-333.
[25]Fan F Y,Huang C S,Tong Y L,et al. Widely targeted metabolomics analysis of white peony teas with different storage time and association with sensory attributes[J]. Food Chemistry,2021,362:130257.
[26]Tatsuki M,Nakajima N,Fujii H,et al. Increased levels of IAA are required for system 2 ethylene synthesis causing fruit softening in peach (Prunus persica L.Batsch)[J]. Journal of Experimental Botany,2013,64(4):1049-1059.
[27]Fraga C G,Clowers B H,Moore R J,et al. Signature-discovery approach for sample matching of a nerve-agent precursor using liquid chromatography-mass spectrometry,XCMS,and chemometrics[J]. Analytical Chemistry,2010,82(10):4165-4173.
[28]Thévenot E A,Roux A,Xu Y,et al. Analysis of the human adult urinary metabolome variations with age,body mass index,and gender by implementing a comprehensive workflow for univariate and OPLS statistical analyses[J]. Journal of Proteome Research,2015,14(8):3322-3335.
[29]Ogata H,Goto S,Sato K,et al. KEGG:Kyoto encyclopedia of genes and genomes[J]. Nucleic Acids Research,1999,27(1):29-34.
[30]蔡志翔,严娟,宿子文,等. 不同类型桃种质资源主要酚类物质含量评价[J]. 园艺学报,2022,49(5):1008-1022.
[31]Liu H,Jiang W B,Cao J K,et al. Evaluation of antioxidant properties of extractable and nonextractable polyphenols in peel and flesh tissue of different peach varieties[J]. Journal of Food Processing and Preservation,2018,42(6):e13624.
[32]盧娟芳,刘盛雨,芦旺,等. 不同类型桃果肉酚类物质及抗氧化活性分析[J]. 中国农业科学,2017,50(16):3205-3214.
[33]朱辰晖,吴昊,施文卫,等. 对羟基肉桂酸(P-CA)处理对桃果实采后保鲜效果研究[J]. 食品科技,2022,47(5):62-68.
[34]Xi W P,Zhang Y M,Sun Y J,et al. Phenolic composition of Chinese wild mandarin (Citrus reticulata Balnco.) pulps and their antioxidant properties[J]. Industrial Crops and Products,2014,52:466-474.
[35]Pan L,Zeng W F,Niu L,et al. PpYUC11,a strong candidate gene for the stony hard phenotype in peach (Prunus persica L.Batsch),participates in IAA biosynthesis during fruit ripening[J]. Journal of Experimental Botany,2015,66(22):7031-7044.
[36]汪开拓,雷长毅,韦盼盼,等. 亚精胺处理对桃果实贮藏品质及内源乙烯和多胺代谢的影响[J]. 食品与发酵工业,2020,46(10):92-99,117.
[37]张海燕,饶景萍,戴斯琴,等. 外源腐胺对油桃采后生理及与其相关酶活性的影响[J]. 植物生理学通讯,2007,43(6):1061-1064.
[38]曹永庆,冷平,潘烜,等. 脱落酸在桃果实成熟过程中的作用[J]. 园艺学报,2009,36(7):1037-1042.
[39]Wang X B,Zeng W F,Ding Y F,et al. PpERF3 positively regulates ABA biosynthesis by activating PpNCED2/3 transcription during fruit ripening in peach[J]. Horticulture Research,2019,6:19.

