南方根结线虫对7种瓜菜作物根系分泌物的趋性
周媛媛 彭欣怡 马建庆 杨学瑾 张爱民 赵钢勇 曹丹丹

DOI: 10.16861/j.cnki.zggc.202423.0610
摘 要:為探究植物根系分泌物组分与南方根结线虫趋化性的关系,盆栽种植7种不同瓜菜作物(番茄、甜椒、苦瓜、蕹菜、芹菜、黄瓜、甜瓜),收集并测定根系分泌物中初级代谢物和次生代谢物的含量,观察南方根结线虫J2s对不同瓜菜作物根系分泌物的行为趋性,并对根系分泌物各组分含量进行相关性分析。结果表明,南方根结线虫J2s对7种瓜菜作物的根系分泌物均表现出正趋向行为,其中J2s对蕹菜根系分泌物的趋化指数最高,为0.52;且趋化指数与根系分泌物中可溶性糖和蛋白质含量没有显著相关性,但与单宁、丁二酸、丙氨酸含量呈显著负相关,相关系数分别为-0.444、-0.527、-0.522,与生物碱、甘氨酸含量呈极显著负相关,相关系数分别为-0.601、-0.550。研究结果可为利用趋性技术防控南方根结线虫提供理论基础。
关键词:南方根结线虫;根系分泌物;趋化性;相关性
中图分类号:S636+S641+S642 文献标志码:A 文章编号:1673-2871(2024)04-146-08
Relationship between root exudates of cucurbits and vegetables plants and chemotaxis behavior of Meloidogyne incognita
ZHOU Yuanyuan1,2, PENG Xinyi1,2, MA Jianqing1,2, YANG Xuejin1,2, ZHANG Aimin2, ZHAO Gangyong2, CAO Dandan2
(1. School of Life Sciences, Hebei University, Baoding 071002, Hebei, China; 2. Hebei Innovation Center for Bioengineering and Biotechnology, Baoding 071002, Hebei, China)
Abstract: To investigate the relationship between the components of root exudates and the chemotaxis of Meloidogyne incognita J2s, this study potted 7 different cucurbits and vegetables plants(tomato, sweet pepper, bitter gourd, water spinach, celery, cucumber, melon) and measured the primary metabolites and secondary metabolites extent of root exudates. Then, the tendency of M. incognita J2s towards different cucurbits and vegetables plants root exudates were observed. And the correlation analysis was also conducted between the chemotaxis of M. incognita J2s and the content of various components in plant root exudates. The results showed that M. incognita J2s exhibited a positive trend towards the root exudates of 7 cucurbits and vegetables plants, with J2s towards root exudates of Ipomoea aquatica having the highest chemotaxis index of 0.52. There was no significant correlation between chemotaxis and soluble sugars, proteins content, but significantly negatively correlated with tannin, succinic acid, alanine content in root exudates, with the correlation coefficients values of -0.444, -0.527, and -0.522, respectively, and extremely significantly negatively correlated with glycine and alkaloid content, with the correlation coefficients values of -0.601 and -0.550, respectively. The research results could provide a theoretical basis for using taxis technology to prevent and control M. incognita.
Key words: Meloidogyne incognita; Root exudates; Chemotaxis; Correlation
收稿日期:2023-09-18;修回日期:2023-12-05
基金项目:河北大学校长基金(XZJJ201924);宁夏回族自治区重点研发计划(2021BBF02013);河北省生物技术创新中心绩效补助经费项目(225676109H)
作者简介:周媛媛,女,在读硕士研究生,研究方向为农业微生物与害虫防治。E-mail:zhouyy1851@163.com
通信作者:曹丹丹,女,讲师,研究方向为植物与昆虫互作。E-mail:caodandan666@163.com
根结线虫(Meloidogyne spp.)是造成农业生产严重损失的主要植物内寄生线虫,几乎可以危害所有的植物,其中尤以茄科、豆科、葫芦科、十字花科等作物受害最为严重[1]。南方根结线虫(Meloidogyne incognita)是我国设施农业中的优势根结线虫[2],其有1700多种寄主植物[3],每年因根结线虫侵染造成蔬菜减产30%,导致经济损失超过30亿元[4],受侵害的植株,会在地下根系部分形成根结,而地上部分生长矮小缓慢,影响产量,甚至植株出现提早死亡现象[5]。
根际作为植物根系与土壤间能量流动和物质交换的直接界面,被认为是地球上最活跃的界面之一[6]。植物根系在生长过程中会向外部释放一些无机离子和有机化合物来调节植株自身生长并影响土壤及土壤微生物,这类物质统称为根系分泌物[7]。南方根结线虫二龄幼虫(the second-stage juveniles,J2s)可通过识别植物根系分泌物来搜索定位寄主并向寄主迁移,最终成功侵染[8]。根结线虫J2s随根系分泌物种类和浓度变化而移动的现象即为趋化性。趋化性在J2s寻找寄主、配偶、躲避危险及个体间互作等方面都发挥着十分重要的作用[9-11]。
已有研究表明,大豆、番茄、紫花苜蓿、豌豆等植物根系分泌物中的激素、氨基酸(天冬氨酸、精氨酸、谷氨酸)、有机酸(苹果酸、草酸和乳酸)等均可吸引南方根结线虫[12-16];除此之外,植物根系分泌物中的酚类、皂苷、生物碱、泰诺芬宁、硫代葡萄糖苷等成分对南方根结线虫J2s具有一定的致死作用[17-18]。充分了解植物根系分泌物对南方根结线虫趋化行为的调控作用对指导农业生产中作物轮作和倒茬具有重要的实践意义。笔者在分析不同瓜菜作物根系分泌物初级代谢物和次生代谢物含量的基础上,比较南方根结线虫J2s对不同瓜菜作物根系分泌物的趋向性选择,并通过分析二者的相关性,定位瓜菜作物根系分泌物中可能影响南方根结线虫趋化性的信息化学物质,以期为南方根结线虫的安全绿色生物防控提供新的方向。
1 材料与方法
1.1 材料
试验于2021年9月至2022年9月在河北省保定市河北省(河北大学)生物工程技术创新中心进行。
供试瓜菜作物材料:新旺斯番茄、农发甜椒、丰绿苦瓜、柳叶空心菜、大叶芹菜、琳达961黄瓜、日本甜宝甜瓜,上述材料均采购自保定市利民农资科技市场。
供试南方根结线虫:试验室内使用番茄活体植株扩繁获得试验南方根结线虫种群。
1.2 方法
1.2.1 盆栽瓜菜作物的培育与管理 盆栽基质为灭菌的营养土和蛭石(1∶1,V/V),每种瓜菜作物6盆(花盆高度和直径为11 cm),每盆250 g灭菌土壤,每盆3株,置于光照培养箱中培养,培养条件为白天16 h,温度28 ℃,相对湿度60%,光照度350 μmol·m-2·s-1;黑暗8 h,温度20 ℃,相对湿度75%,光照度0 μmol·m-2·s-1。其间定期等量给作物浇水,使其生长良好。上述瓜菜作物生长20 d后,随机选取长势相同的盆栽用于收集根系分泌物。
1.2.2 瓜菜作物根系分泌物的收集及测定 根系分泌物的收集:采用土培法对根系分泌物进行收集[19],将试验植株连根取出,在尽量不破坏根部完整性的前提下保留根系表面一薄层土,取20~100 mL蒸馏水(视不同根系体积而定,以能充分浸过完整根系为宜)于烧杯中涮洗,将水样静置,取上清液,用0.45 μm尼龙布过滤后得到根系分泌物的水溶液。采用蒽酮比色法测定可溶性糖含量[20-21]。采用考马斯亮蓝法测定蛋白质含量[22]。采用茚三酮显色法测定总氨基酸含量[23]。
有机酸和氨基酸各组分含量的测定(液相色谱法):将根系分泌物的收集液用0.22 μm尼龙膜过后,取1~2 mL装入样品瓶,加入50 μL磷酸后,用于下一步检测[24]。
液相色谱分析条件—色谱仪:RIGOL L3000高效液相色谱仪,紫外检测器波长254 nm;色谱柱:赛分Amethyst C18-H(250 mm×4.6 mm,5 μm);柱温:40 ℃;流速:1 mL·min-1,进样体积:10 μL;流动相A:称取7.6 g无水乙酸钠,加水925 mL,溶解后用冰醋酸调节pH至6.5,然后加入乙腈70 mL,混匀。用0.45 μm滤膜过滤;流动相B:80%乙腈水溶液。
次生代谢物质含量测定:木质素、单寧、类黄酮、总酚、生物碱含量采用Solarbio公司生产的试剂盒检测。
pH值的测定:采用pH计测定。
1.2.3 南方根结线虫对根系分泌物的趋向选择行为测定 23%Pluronic F-127胶的配制:取80 mL冷的无菌水加入到含有磁力搅拌棒的玻璃杯中,再向其中加入23 g PF-127粉末,4 ℃下缓慢搅拌至溶解。
琼脂糖平板:将0.4 g琼脂糖粉溶于200 mL无菌蒸馏水中,加热溶解后,制备0.2%的琼脂糖凝胶。将15 mL琼脂糖凝胶倒入90 mm×15 mm的培养皿,凝固后备用。
趋向行为观测:于琼脂糖平板上画2条平行线,每条线距培养皿中心等距1.5 cm。用消毒镊子从这两条线之间的区域舀出琼脂,填充3 mL 23%的PF-127凝胶,在室温下凝固。在两条平行线上分别设置直径5 mm的孔A和孔B距離培养皿最近的边缘约1 cm,线虫接种点距琼脂-PF-127凝胶结点等距1.5 cm。在A孔中置入10 ?L的根系分泌物。B孔以等量的蒸馏水作为对照。之后,将约100条J2s混于PF-127凝胶中,10 h后,在体式显微镜下计数[25]。
趋近率=(试验做出选择J2s数/供试J2s总数)×100%;
趋化指数=(试验组J2s数-对照组J2s数)/(试验组J2s数+对照组J2s数)。
1.3 数据处理
在Microsoft Excel 2016中整理数据;利用SPSS 25.0软件进行单因素方差分析(One way ANOVA)、比较各处理间的差异显著性,选用Spearman系数分别分析根系分泌物中初级代谢产物、次生代谢物质与根结线虫趋化反应的相关关系。并采用Tukeys HSD 法在显著性水平为0.05条件下进行显著性检验。趋化性采用单样本t检验进行显著性检验。
2 结果与分析
2.1 不同瓜菜作物根系分泌物中各组分含量
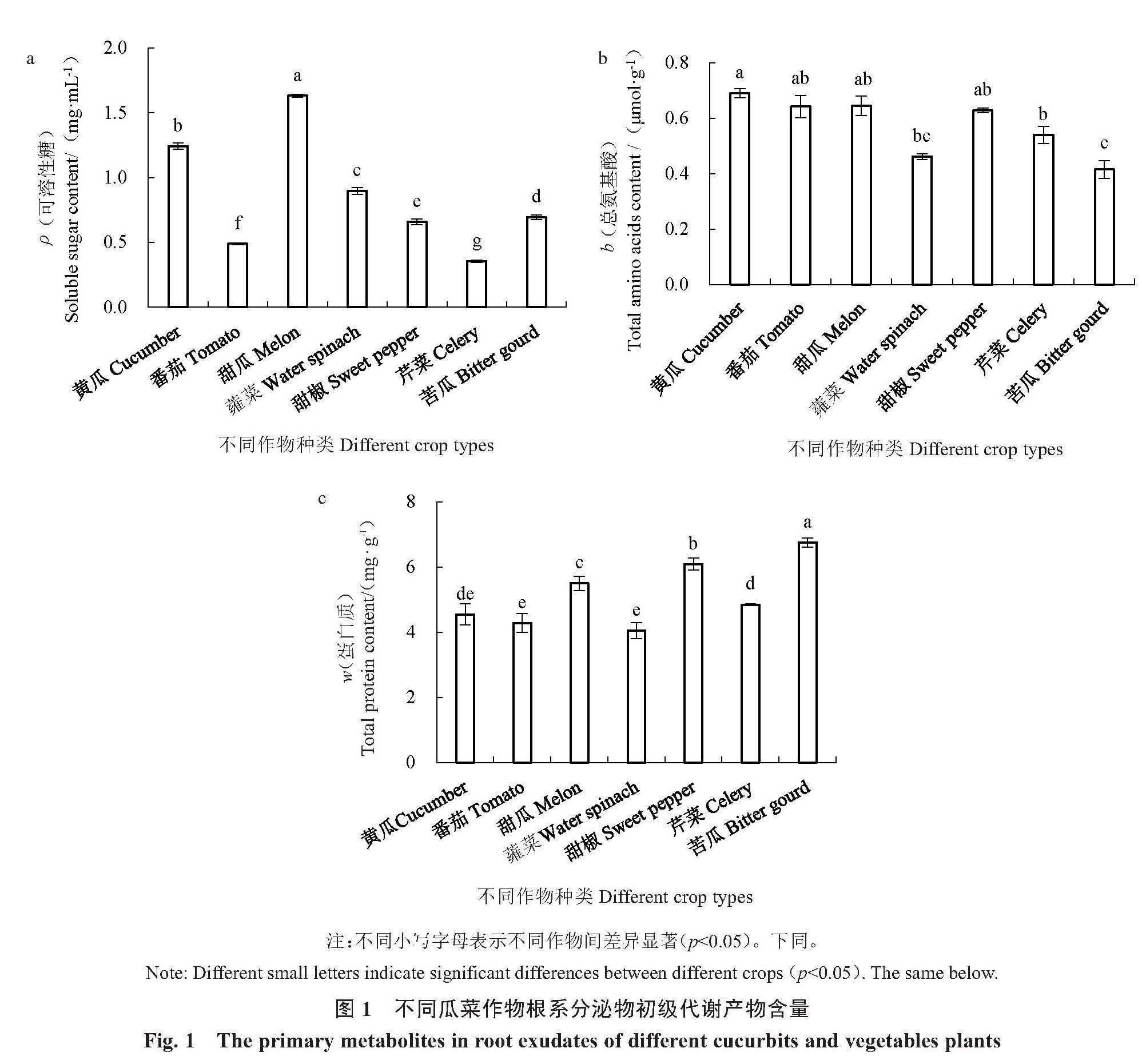
2.1.1 不同瓜菜作物根系分泌物中初级代谢产物含量 7种瓜菜作物根系分泌物的测定结果表明,相较于其他6种瓜菜作物,甜瓜根系分泌物的可溶性糖含量(ρ)最高,为1.63 mg·mL-1;然后依次为黄瓜、蕹菜、苦瓜、甜椒、番茄,其含量分别为1.24、0.90、0.69、0.66、0.49 mg·mL-1;芹菜最低,为0.36 mg·mL-1,且各瓜菜作物根系分泌物中可溶性糖含量均达到显著差异水平(图1-a)。
黄瓜、番茄、甜瓜、甜椒根系分泌物中总氨基酸含量(b)较高,均在0.62~0.69 μmol·g-1,分别为0.69、0.64、0.64、0.63 μmol·g-1,且四者之间无显著差异;芹菜、蕹菜次之,其含量分别为0.54、0.46 μmol·g-1;苦瓜最低,为0.45 μmol·g-1,蕹菜与芹菜、苦瓜根系分泌物中总氨基酸含量差异不显著(图1-b)。
苦瓜根系分泌物中蛋白质含量(w)最高,达6.75 mg·g-1,与其他6种瓜菜作物达到显著差异水平;然后依次为甜椒、甜瓜、芹菜、黄瓜、番茄,其含量分别为6.09、5.50、4.85、4.55、4.28 mg·g-1;蕹菜根系分泌物中蛋白质含量最少,为4.05 mg·g-1,芹菜与黄瓜未达到显著差异水平,黄瓜、番茄、蕹菜之间根系分泌物中蛋白质含量未达到显著差异水平(图1-c)。
7种瓜菜作物根系分泌物中17种氨基酸含量测定结果(表1)显示,相较于其他几种瓜菜作物,番茄根系分泌物中天冬氨酸、谷氨酸、精氨酸、苏氨酸、脯氨酸、酪氨酸、缬氨酸、蛋氨酸、胱氨酸、亮氨酸、苯丙氨酸、赖氨酸含量(w)最高,分别为38.275、17.400、29.873、4.595、4.352、1.255、2.882、0.304、0.106、3.157、0.995、0.153 μg·g-1;芹菜根系分泌物中丝氨酸、甘氨酸、组氨酸含量高于其他几种瓜菜作物,分别为9.654、3.129、5.665 μg·g-1;苦瓜根系分泌物中丙氨酸和异亮氨酸含量最高,分别为5.311、13.906 μg·g-1。
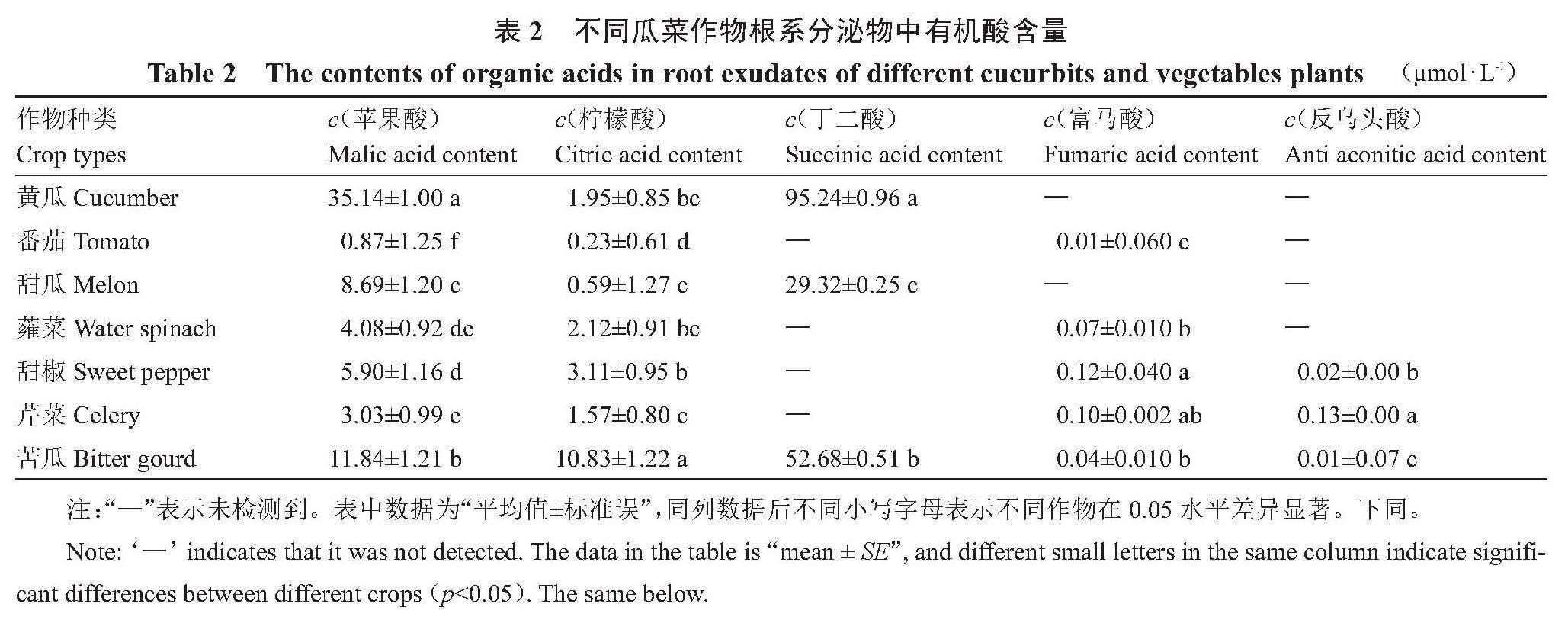
在测试的7种瓜菜作物根系分泌物中均检测到了苹果酸和柠檬酸,其中黄瓜中苹果酸含量最高,达35.14 μmol·L-1,与其他瓜菜作物之间达到显著差异水平;番茄中苹果酸含量最低,为0.87 μmol·L-1。丁二酸只在苦瓜、黄瓜和甜瓜根系分泌物中检测到,含量由高到低依次为黄瓜>苦瓜>甜瓜。除黄瓜和甜瓜以外,其他几种瓜菜作物根系分泌物中都检测到了富马酸,但含量很低。反乌头酸只在甜椒、芹菜和苦瓜根系分泌物中检测到,含量较低(表2)。
2.1.2 不同瓜菜作物根系分泌物中次生代谢物质含量 次生代谢物质含量的测定结果详见表3,7种瓜菜作物中,蕹菜根系分泌物的木质素含量(w)最高,为4.55 mg·g-1,番茄中木质素含量最低,为1.08 mg·g-1,蕹菜、甜瓜中木质素含量与其他几种瓜菜作物达到显著差异水平,但蕹菜与甜瓜差异不显著;番茄根系分泌物的类黄酮含量最高,为11.16 mg·g-1,蕹菜中含量最低,为2.85 mg·g-1,番茄与其他几种瓜菜作物类黄酮含量均达到显著差异水平,苦瓜与黄瓜、甜椒和甜瓜间类黄酮含量差异不显著;苦瓜根系分泌物的单宁含量最高,为63.03 nmol·g-1,蕹菜中含量最低,为17.06 nmol·g-1,苦瓜、甜瓜和其他几种瓜菜作物达到显著差异水平;甜瓜根系分泌物的总酚含量最高,为5.27 mg·g-1,与其他几种瓜菜作物达到显著差异水平,黄瓜、番茄和苦瓜根系分泌物中总酚含量分别为3.60、3.39、3.18 mg·g-1,黄瓜与番茄、苦瓜之间未达到显著差异水平,甜椒、蕹菜、芹菜根系分泌物中总酚含量分别为2.70、2.61、2.24 mg·g-1,甜椒与蕹菜、芹菜之间未达到显著差异水平;甜瓜根系分泌物的生物碱含量最高,为24.02 ng·mL-1,甜椒中含量最低,为13.37 ng·mL-1,甜瓜和其他几种瓜菜作物差异达到显著水平。
2.1.3 不同瓜菜作物根系分泌物pH值 经检测,7种瓜菜作物中甜椒的根系分泌物呈弱碱性,为7.21;芹菜和苦瓜的根系分泌物呈中性,分别为7.06、7.05,两者之间差异不显著,黄瓜、番茄、甜瓜和蕹菜的根系分泌物呈弱酸性,分别为6.16、6.80、6.60、6.72,甜瓜与蕹菜之间差异不显著,番茄与黄瓜、甜瓜三者之间达到差异显著水平(表4)。
2.2 南方根结线虫J2s与不同瓜菜作物根系分泌物间的趋化性
通过预试验观察,发现南方根结线虫J2s对7种瓜菜作物根系分泌物的选择在10 h时达到高峰期,如图2-a所示,南方根结线虫J2s对7种不同瓜菜作物根系分泌物均表现出一定的正趋向性,图2-b表明,J2s对蕹菜根系分泌物的趋化指数最高,为0.52,蕹菜与甜椒趋化指数差异不显著,苦瓜与芹菜趋化指数差异不显著,芹菜与黄瓜、甜瓜趋化指数差异不显著,J2s对7种瓜菜作物根系分泌物趋化指数为:蕹菜>甜椒>番茄>苦瓜>芹菜>甜瓜>黄瓜。
2.3 瓜菜作物根系分泌物组分与南方根结线虫趋化性的相关性分析
如表5所示,南方根结线虫J2s趋化性与有机酸中丁二酸呈显著负相关,相关系数为-0.527,与氨基酸中的丙氨酸呈显著负相关,相关系数为-0.522,与甘氨酸呈极显著负相关,相关系数为-0.550,与其他氨基酸、有机酸无显著相关关系。南方根结线虫J2s趋化性与不同瓜菜作物根系分泌物的pH、类黄酮含量、总酚含量等具有一定相关性,但未达到显著差异水平,与单宁呈显著负相关,相关系数为-0.444,与生物碱呈极显著负相关,相关系数为-0.601。
3 讨论与结论
本研究结果表明,南方根结线虫J2s对7种瓜菜作物根系分泌物均表现出正趋向选择行为,这与已有报道中它们是南方根结线虫的易感寄主结果一致[26]。同时,笔者的研究得出的南方根结线虫J2s对不同瓜菜作物根系分泌物的选择率顺序为蕹菜>甜椒>番茄>苦瓜>芹菜>甜瓜>黄瓜,与丁正蛟[27]的研究结果一致,且随着处理时间的增加,黄瓜根尖对J2s的吸引力并没有明显增强。但在实际生产中,黄瓜受害比较严重,南方根结线虫对黄瓜的侵染能力一般强于其他蔬菜作物[28-29]。这可能是由于笔者研究的行为试验采用的是基质栽培的瓜菜作物根系分泌物,而大田中植物根尖周围的根际微生态环境相对复杂,根系的活性以及土壤微生物均会影响线虫的趋化性[30];除此之外,田间植物根际土壤中的化学和物理因素如CO2、温度等也会影响J2s的趋化性[31-33]。
单宁是存在于各种植物组织中的多酚类化合物,具有对抗草食性动物和调节植物生长的功能[34],也会降低根结线虫卵的孵化率和活性,从而减少二龄幼虫的数量[35-38]。葡萄渣对根结线虫属的杀线虫作用也与浆果表皮释放的多酚和单宁等化合物有关,其中单宁含量可在0.4%~3%之间变化[39-40]。
生物碱(alkaloids)是一类含氮有机化合物,其植物来源广泛且具有很强的杀虫活性。已有研究表明,源于 Nicotinia spp.的烟碱、源于无叶假木贼(Anabasis aphylla)的新烟碱、源于沙巴草(Schoenocaulon officinale)的藜芦碱、源于尼亚那(Ryania speciosa)的理阿诺碱[41],以及无花果、悬铃木根系分泌物中的生物碱可对根结线虫J2s和卵的孵化具有一定的抑杀作用[42]。其中,从博落回(Macleaya cordata)中分离得到的血根碱、白屈菜红碱和别隐品碱对南方根结线虫J2s具有杀虫活性,且LC50分别为67.52、61.00和76.56 μg·mL-1,均具有杀虫活性[43]。本研究结果显示,次生代谢物质中单宁与J2s的趋化呈显著负相关,生物碱与J2s的趋化呈极显著负相关,表明单宁和生物碱在南方根结线虫有效防控中具有一定的生防潜力。
已有研究表明,丁二酸对南方根结线虫J2s的毒杀作用及卵孵化的抑制生物活性较高,其LC50分别为6 260.294 5 μg·mL-1、2 268.393 3 μg·mL-1 [44]。笔者研究的7种供试瓜菜作物中,只在苦瓜、黄瓜和甜瓜中检测到了丁二酸,含量分别为52.68、95.24、29.32 μmol·L-1,且其与J2s的趋化呈显著负相关。说明J2s对丁二酸的趋化反应具有浓度依赖性[14]。
部分氨基酸能够抑制卵孵化、影响线虫致死率和线虫在植物上的繁殖,如谷氨酸、甘氨酸、丙氨酸、亮氨酸、苯丙氨酸和赖氨酸等在根系分泌物中的含量與品种的抗性呈一定的负相关[45]。丹参根部受到根结线虫侵害后,甘氨酸、谷氨酸、丙氨酸、亮氨酸含量升高[46],花生根部在受到花生根结线虫危害后,根结中苯丙氨酸、精氨酸、赖氨酸含量显著高于健康根系,苏氨酸和总氨基酸含量显著低于健康根系[47]。在笔者的研究中,丙氨酸含量与南方根结线虫J2s对根系分泌物的趋化选择率呈显著负相关,甘氨酸含量与J2s的趋化呈极显著负相关。
综上所述,在易感瓜菜作物范围内,影响南方根结线虫J2s趋化性的主要化学因子为植物次级代谢物单宁和生物碱,与初级代谢物中的丁二酸、丙氨酸和甘氨酸含量呈负相关关系,且具有一定浓度依赖性,与可溶性糖和蛋白质含量无相关性。未来,笔者将进一步测试和量化各目标因子对南方根结线虫的生物活性影响。研究结果将为经济作物套种、轮茬的可行性提供理论依据,也可为抗性品种选育及开发天然杀线虫剂产品奠定理论基础。
参考文献
[1] 谢晖.植物线虫分类学[M].北京:高等教育出版社,2005.
[2] 宫远福.东北地区根结线虫的种类分布及南方根结线虫氯离子通道基因分析[D].沈阳:沈阳农业大学,2020.
[3] JI X X,LI J J,DONG B,et al.Evaluation of fluopyram for southern root-knot nematode management in tomato production in China[J].Crop Protection,2019,122:84-89.
[4] 杨学瑾,周媛媛,彭欣怡,等.根结线虫危害与健康黄瓜根际土壤微生物群落结构差异分析[J].中国农业科技导报,2023,25(1):109-118.
[5] 杨学瑾.南方根结线虫侵染花生转录代谢关联分析及AhHPT基因功能研究[D].河北保定:河北大学,2023.
[6] 邵秋雨,董醇波,韩燕峰,等.植物根际微生物组的研究进展[J].植物营养与肥料学报,2021,27(1):144-152.
[7] 李争艳,徐智明,李岩,等.高粱根际微生物研究进展[J].草学,2021(2):7-14.
[8] 王帅,魏钰洋,张羲,等.根结线虫趋化性研究进展[J].农药学学报2022,24(5):982-996.
[9] 孟丽,漆永红,刘玉霞,等.南方根结线虫二龄幼虫对不同类型盐离子的趋化反应[J].植物保护,2014,40(2):85-89.
[10] TSAI A Y L,IWAMOTO Y,TSUMURAYA Y,et al.Root-knot nematode chemotaxis is positively regulated by l-galactose sidechains of mucilage carbohydrate rhamnogalacturonan-I[J].Science Advances,2021,7(27):eabh4182.
[11] TSAI A Y L,OOTA M,SAWA S.Chemotactic host-finding strategies of plant endoparasites and endophytes[J].Frontiers in Plant Science,2020,11:1167.
[12] OOTA M,TSAI A Y L,AOKI D Y,et al.Identification of naturally occurring polyamines as root-knot nematode attractants[J].Molecular Plant,2020,13(14):658-665.
[13] ?EPULYTE R,DANQUAH W B,BRUENING G,et al.Potent attractant for root-knot nematodes in exudates from seedling root tips of two host species[J].Scientific Reports,2018,8:10847.
[14] WANG J X,DING Z J,BIAN J,et al.Chemotaxis response of Meloidogyne incognita to volatiles and organic acids from root exudates[J].Rhizosphere,2021,17:100320.
[15] WANG C L,LOWER S,WILLIAMSON V M.Application of pluronic gel to the study of root-knot nematode behaviour[J].Nematology,2009,11:453-464.
[16] 姜野,李春杰,黄铭慧,等.根结线虫和大豆孢囊线虫对氨基酸的趋化性比较研究[C]//中国植物病理学会.植物病理科技创新与绿色防控:中国植物病理学会2021年学术年会论文集.北京:中国农业科学技术出版社,2021.
[17] MONFORT,W S,CSINOS A S,DESAEGER J,et al.Evaluating Brassica species as an alternative control measure for root-knot nematode (M.incognita) in Georgia vegetable plasticulture[J].Crop Protection,2007,26(9):1359-1368.
[18] JADA M Y.Effect of fig tree (Ficus sycomorus) root exudates on root-knot nematode (Meloidogyne javanica)[J].Journal of Agriculture and Veterinary Science,2013,3(5):24-28.
[19] 謝一琪.韭菜根系分泌物调控苦瓜枯萎病抗性的化感作用机理[D].海口:海南大学,2022.
[20] 张述伟,宗营杰,方春燕,等.蒽酮比色法快速测定大麦叶片中可溶性糖含量的优化[J].食品研究与开发,2020,41(7):196-200.
[21] 赵轶鹏,赵新勇.植物体可溶性糖测定方法的优化[J].安徽农业科学,2018,46(4):184-185.
[22] 徐亚,范会芬,赵玎玲,等.考马斯亮蓝法测定大豆水溶性蛋白提取方法的优化[J].大豆科学,2022,41(2):196-202.
[23] 罗丹,姜敏,李柯翱,等.虫草花总黄酮,总氨基酸含量测定及其抗氧化活性研究[J].化学工程师,2020,34(9):18-21.
[24] 唐宏亮,申建波,张福锁,等.磷和外源生长素对白羽扇豆(Lupinus albus L.)根形态和生理特性的影响[J].中国科学(生命科学),2013,43(3):201-212.
[25] SHIVAKUMARA T N,DUTTA T K,RAO U.A novel in vitro chemotaxis bioassay to assess the response of Meloidogyne incognita towards various test compounds[J].Journal of Nematology,2018,50(4):487-494.
[26] 刘维志.植物病原线虫学[M].北京:中国农业出版社,2000.
[27] 丁正蛟.七种植物根系分泌物对南方根结线虫趋化性的作用[D].昆明:云南大学,2018.
[28] 马艳粉,郝志云,肖春,等.南方根结线虫对不同寄主植物侵染能力的比较[J].安徽农业科学,2011,39(24):14658-14659.
[29] 沈镝,李锡香,冯兰香,等.葫芦科蔬菜种质资源对南方根结线虫的抗性评价[J].植物遗传资源学报,2007,8(3):340-342.
[30] PERRY R N.Chemoreception in plant parasitic nematodes[J].Annual Review of Phytopathology,1996,34:181-199.
[31] VIGLIERCHIO D R.Carbon dioxide sensing by Panagrellus silusiae and Ditylenchus dipsaci[J].Revue De Nematologie,1990,13(4):425-432.
[32] WANG C L,BRUENING G,WILLIAMSON V M.Determination of preferred pH for root-knot nematode aggregation using pluronic F-127 gel[J].Journal of Chemical Ecology,2009,35(10):1242-1251.
[33] WANG C L,LOWER S,THOMAS V P,et al.Root-knot nematodes exhibit strain-specific clumping behavior that is inherited as a simple genetic trait[J].Plos One,2010,5(12):e15148.
[34] COSTA S N D,SILVA M V T E,RIBEIRO J M,et al.Secondary metabolites related to the resistance of Psidium spp.against the nematode Meloidogyne enterolobii[J].Heliyon,2023,9(7):e17778.
[35] SILVA F DE J,RIBEIRO R C F,XAVIER A A,et al.Management of Meloidogyne javanica in okra using compost of pequi fruit waste[J].Journal of Agricultural Science,2018,10(7):258-265.
[36] FONSECA W L, DE ALMEIDA F A,LETTE M L T,et al.Bioactivity of aqueous extracts of Anadenanthera macrocarpa to Meloidogyne incognita in cotton crop[J].Australian Journal of Crop Science,2017,11(2):156-161.
[37] MAISTRELLO L,VACCARI G,SASANELLI N.Effect of chestnut tannins on the root-knot nematode Meloidogyne javanica[J].Helminthologia,2010,47(1):48-57.
[38] MISIHA P,ALY A.TOHAMY M,et al.Eco-friendly management of root-knot nematode and root rot disease infecting pepper plants by application compost and tea compost[J].Zagazig Journal of Agricultural Research,2019,46(4):1053-1065.
[39] DADDABBO T,SASANELLI N,LAMBERTI F,et al.Control of root-knot nematodes by olive and grape pomace soil amendments[J].Acta Horticulturae,2000,532:53-57.
[40] DERRICO G,WOO S L,MANGANIELLO N L G,et al.Activity of chestnut tannins against the Meloidogyne incognita[J].Journal of Zoology,2018,101:53-59.
[41] RATTAN R S.Mechanism of action of insecticidal secondary metabolites of plant origin[J].Crop Protection,2010,29(9):913-920.
[42] JADA M Y.Effect of fig tree (Ficus sycomorus) root exudates on root-knot nematode (Meloidogyne javanica)[J].Journal of Agriculture and Veterinary Science,2013,3(5):24-28.
[43] WANG K,LUO C,LIU H,et al.Nematicidal activity of the alkaloids from Macleaya cordata against certain nematodes[J].African Journal of Agricultural Research,2012,7(44):5925-5929.
[44] 劉丹丹,段玉玺,陈立杰,等.有机酸类化合物对南方根结线虫的生物活性[J].植物保护,2011,37(2):99-102.
[45] 王雪,段玉玺,陈立杰,等.大豆根系分泌物中氨基酸组分与抗大豆胞囊线虫的相关性研究[J].沈阳农业大学学报,2008,39(6):677-681.
[46] 张永清,王苓,孙晋璞.根结线虫侵害对丹参药材氨基酸与蛋白质含量的影响[J].中国中医药科技,1999(6):383-384.
[47] 宾淑英,冯志新.花生根结线虫对花生植株内源激素、氨基酸、核酸及糖的影响[J].华南农业大学学报,1999,20(4):15-19.

