microRNA-338-3p抑制HepG2肝癌细胞的迁移和侵袭
念家辉 韦卿 刘国满 黄梓华 黄理政 浦涧
基金项目:广西自然科学基金(2020GXNSFAA259019)
第一作者简介:念家辉,男,医学学士,在读硕士研究生,研究方向:肝脏疾病基础与临床。E-mail:123554419@qq.com
▲通信作者:浦涧。E-mail:pujianym@163.com
[本文引用格式]念家辉,韦卿,刘国满,等.microRNA-338-3p抑制HepG2肝癌细胞的迁移和侵袭[J].右江医学,2024,52(3):198-202.
【摘要】 目的 研究microRNA-338-3p对HepG2肝癌细胞迁移、侵袭和上皮间质转化的影响。
方法 取HepG2肝癌细胞,随机分为三组:control组(未转染)、vector组(转染空质粒)、OE组(转染microRNA-338-3p质粒),分别取生理盐水、空质粒、microRNA-338-3p转染,培养48小时。实时荧光定量PCR(qPCR)检测microRNA-338-3p的转染效率;划痕实验检测细胞的迁移指数;Transwell法检测细胞的侵袭能力;蛋白质印迹法(Western blot实验)检测细胞E-cadherin、N-cadherin的相对蛋白表达量。
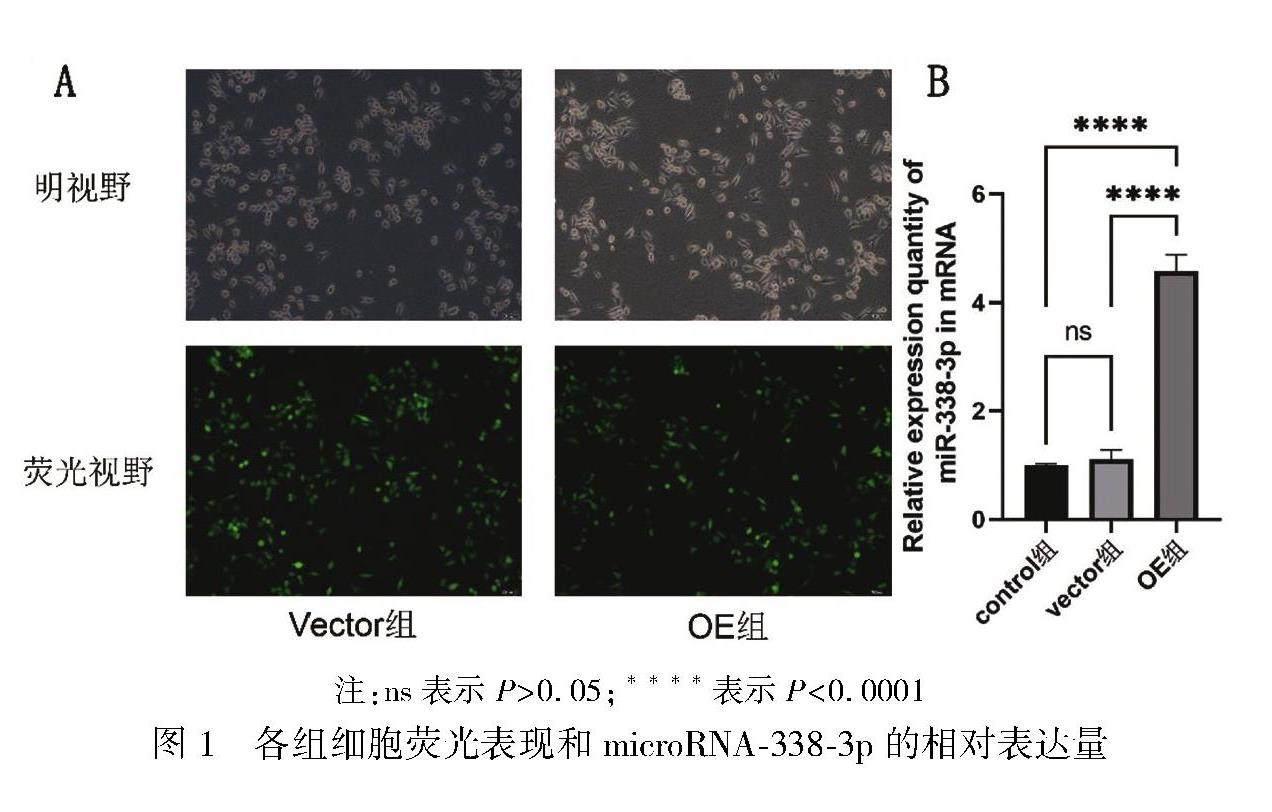
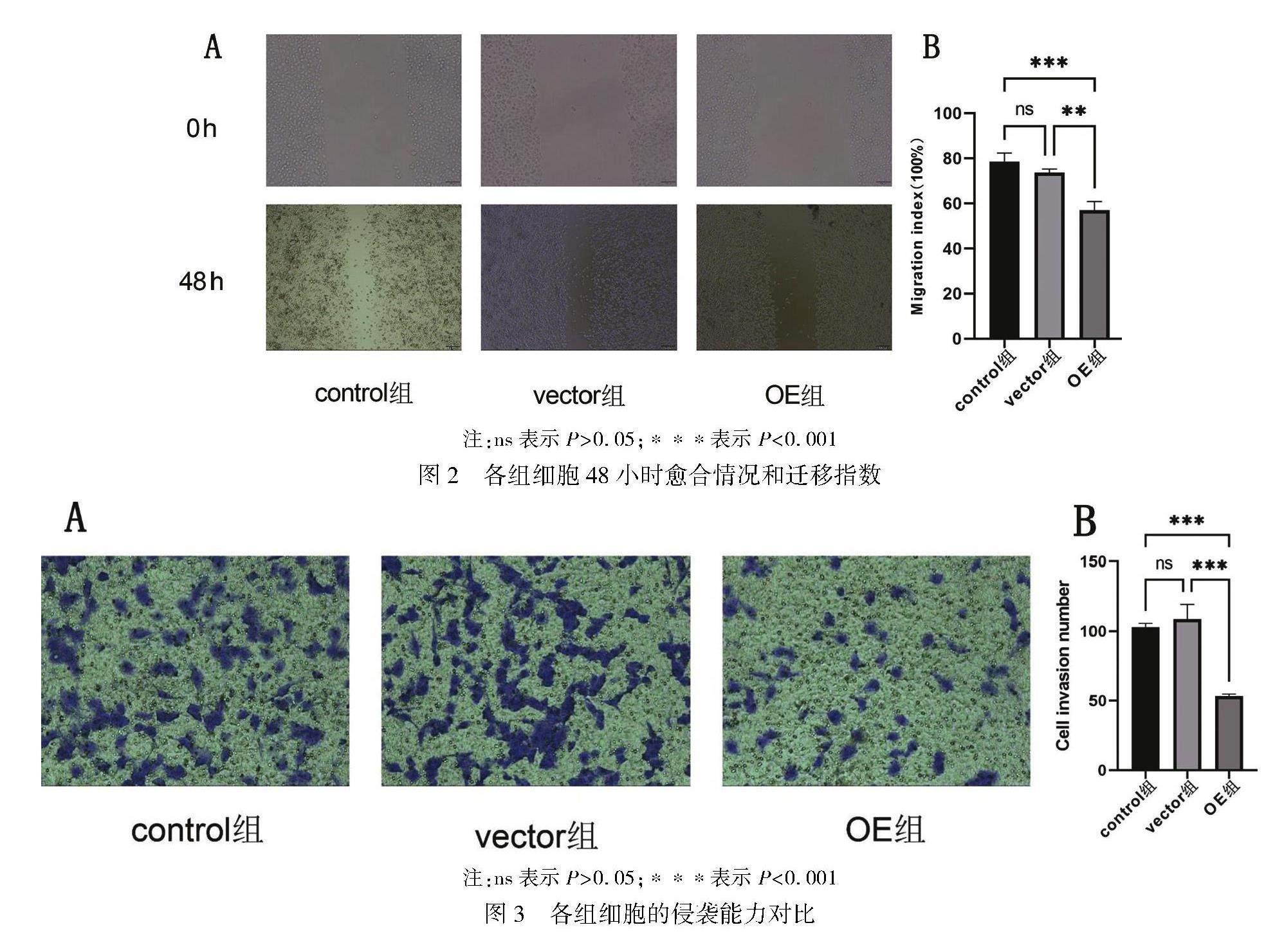
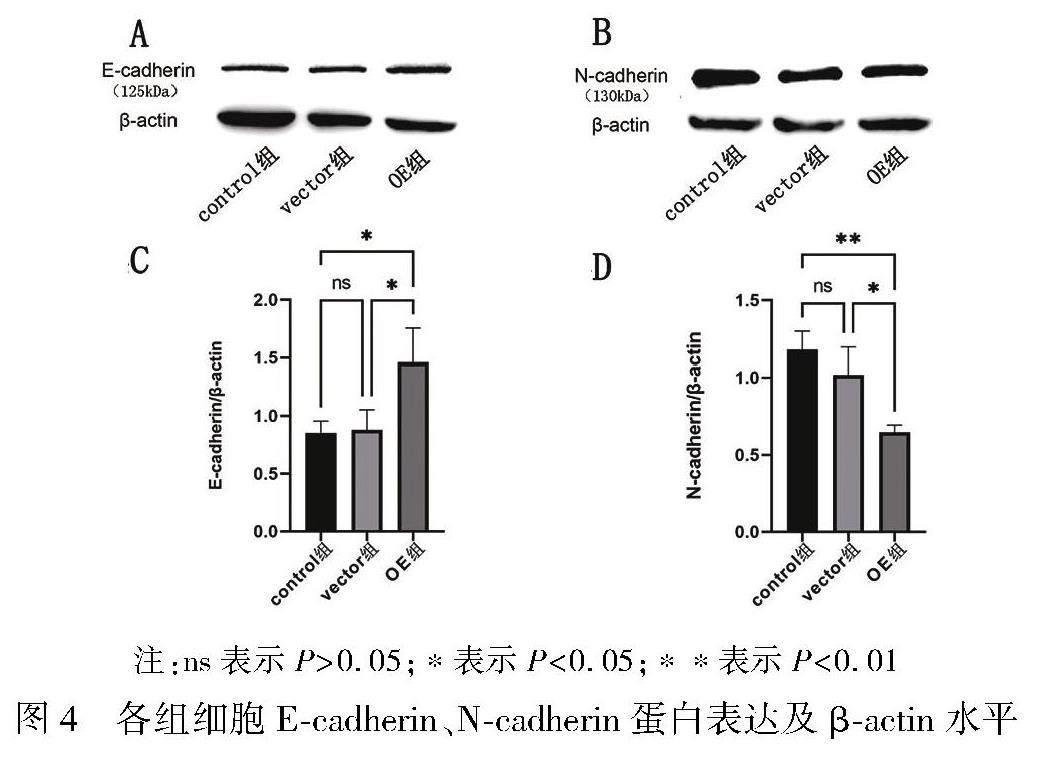
结果 (1)microRNA-338-3p的转染阳性率超过90%,符合实验标准。(2)HepG2肝癌细胞的迁移指数,control组与vector組相比较,差异无统计学意义(P>0.05);OE组与control组、vector组相比较,迁移指数明显降低,差异有统计学意义(P<0.01)。(3)HepG2肝癌细胞的侵袭能力,control组与vector组相比较,差异无统计学意义(P>0.05);OE组HepG2与control组、vector组相比较,侵袭能力显著下降,差异有统计学意义(P<0.001)。(4)E-cadherin相对蛋白表达量,control组与vector组相比较,差异无统计学意义(P>0.05);OE组与control组、vector组相比较,E-cadherin相对蛋白表达量均增高,差异有统计学意义(P<0.05)。(5)N-cadherin的相对蛋白表达量,control组与vector组相比较,差异无统计学意义(P>0.05);OE组与control组、vector组相比较,N-cadherin相对蛋白表达量减少,差异均有统计学意义(P<0.01)。
结论 (1)microRNA-338-3p可抑制HepG2肝癌细胞的迁移、侵袭能力;(2)microRNA-338-3p通过促进E-cadherin蛋白表达并抑制N-cadherin蛋白表达,从而抑制HepG2肝癌细胞的上皮间质转化。
【关键词】 微小RNA;肝细胞癌;迁移;侵袭
中图分类号:R735.7 文献标志码:A DOI:10.3969/j.issn.1003-1383.2024.03.002
Inhibition of microRNA-338-3p on migration and invasion of HepG2 hepatoma cells
NIAN Jiahui1, WEI Qing2, LIU Guoman2, HUANG Zihua2, HUANG Lizheng2, PU Jian1▲
(1. Department of Hepatobiliary Surgery, Affiliated Hospital of Youjiang Medical University for
Nationalities, Baise 533000, Guangxi, China; 2. Graduate School, Youjiang Medical
University for Nationalities, Baise 533000, Guangxi, China)
【Abstract】 Objective To investigate the effects of microRNA-338-3p on migration, invasion and epithelial mesenchymal transformation of HepG2 hepatoma cells.
Methods HepG2 hepatoma cells were extracted. They were randomly divided into three groups: control group (non-transfected), vector group (transfected with empty plasmid) and OE group (transfected with microRNA-338-3p plasmid). Normal saline, empty plasmid and microRNA-338-3p were transfected, respectively, and cultured for 48 hours. Real-time fluorescence quantitative PCR (qPCR) was used to detect the transfection efficiency of microRNA-338-3p. The migration index of cells was detected by scratch test. The invasive ability of cells was detected by Transwell method. The relative protein expression levels of E-cadherin and N-cadherin were detected by Western blot assay.
Results (1) The positive rate of microRNA-338-3p transfection in this study was over 90%, which met the experimental criteria. (2) The migration index of HepG2 liver cancer cells showed no statistically significant difference between the control group and the vector group (P>0.05). The migration index of the OE group was significantly lower than that of the control group and the vector group, and difference was statistically significant (P<0.01). (3) There was no statistically significant difference in the invasion ability of HepG2 hepatocellular carcinoma cells in the control group and the vector group (P>0.05); compared with the control group and the vector group, the invasion ability of HepG2 in the OE group significantly decreased, and the difference was statistically significant (P<0.001). (4) There was no statistically significant difference in the relative protein expression of E-cadherin between the control group and the vector group (P>0.05); the relative protein expression of E-cadherin in the OE group was higher than that in the control group and the vector group, and the difference was statistically significant (P<0.05). (5) There was no statistically significant difference in the relative protein expression of N-cadherin between the control group and the vector group (P>0.05); compared with the control group and the vector group, the relative protein expression of N-cadherin decreased in the OE group, and the difference was statistically significant (P<0.01).
Conclusion (1) microRNA-338-3p can inhibit the migration and invasion ability of HepG2 liver cancer cells; (2) microRNA-338-3p inhibits epithelial mesenchymal transition in HepG2 liver cancer cells by promoting E-cadherin protein expression and inhibiting N-cadherin protein expression.
【Keywords】 microRNA; hepatocellular carcinoma; migration; invasion
肝细胞癌(hepatocellular carcinoma,HCC)作为最常见的原发性肝癌类型,目前已成为世界上第六大常见的癌症种类和第三大癌症死因[1]。尽管治疗方案不断取得进步,但许多HCC患者的预后仍然无法令人满意。上皮间质转化(epithelial-mesenchymal transition,EMT)是一种由上皮表型向间质表型的形态转化过程,与肝癌患者的预后密切相关,也是肝癌晚期转移的重要环节。在发生EMT的癌细胞中,N-cadherin和Vimentin等间充质标志物的表达上调,E-cadherin和ZO-1等上皮标志物的表达下调[2]。微小RNA(microRNAs,miRNAs)是一种长度为18~22个核苷酸的非编码单链小RNA,可以通过与靶mRNA的3'-UTR结合抑制基因表达,miRNAs异常表达对HCC细胞的增殖、迁移、侵袭和耐药的调控作用已经广泛受到关注,其中也包括EMT相关的癌症转移[3]。因此,本研究旨在通过体外干扰microRNA-338-3p表达,探究其对HepG2肝癌细胞迁移、侵袭和EMT的影响。
1 材料与方法
1.1 材料和试剂
人肝癌细胞HepG2来自中科院干细胞库;DMEM高糖培养基(Gibco公司,货号:C11995500BT);青链霉素混合液(Solarbio公司,货号:P1400-100);结晶紫染色液(Solarbio公司,货号:G1063-100 mL)、胰蛋白酶-EDTA消化液(Solarbio公司,货号:T1320-100);胎牛血清(OriCell公司,货号:FBSST-01033-500);慢病毒合成(上海吉玛制药技术有限公司,货号:ZLDZ003);miRNA第一链cDNA合成试剂盒[生工生物工程(上海)股份有限公司,货号:B532451-0020];实时荧光定量PCR试剂盒SYBR Green Master (Roche公司,货号:4913914001-5 mL);TRIzol RNA提取試剂(赛默飞公司,货号:15596026CN);引物合成[生工生物工程(上海)股份有限公司,货号:H001];E-cadherin抗体(武汉三鹰生物技术有限公司,货号:20874-1-AP);N-cadherin抗体(武汉三鹰生物技术有限公司,货号:22018-1-AP)和内参β-actin抗体(武汉三鹰生物技术有限公司,货号:20536-1-AP);Transwell小室8 μm PC膜(corning公司,货号:3422);RIPA裂解液(上海雅酶生物医药科技有限公司,货号:PC102);BCA蛋白浓度测定试剂盒(上海碧云天生物技术股份有限公司,货号:P0010S);ECL化学发光试剂盒(上海碧云天生物技术股份有限公司,货号:P0018S)。
1.2 细胞培养和处理
HepG2肝癌细胞复苏后,培养于含有10%胎牛血清的DMEM培养基中,置于37 ℃、5%CO2恒温培养箱中。每天常规换液1次,当细胞融合度达到90%左右即可按1∶2或1∶3传代处理,取对数生长期细胞进行下一步实验。
1.3 细胞转染和验证
取情况良好、对数生长期的HepG2肝癌细胞进行实验,将HepG2肝癌细胞以2×105个/well接种于六孔板中,每孔加入2 mL完全培养基,在37 ℃、5%CO2恒温培养箱中过夜。次日按MOI=20稀释病毒原液,将原细胞培养液移去,加入含有病毒稀释液的DMEM完全培养基。24小时后移去六孔板中的旧病毒液,加入新鲜DMEM完全培养基继续常规培养72小时,使用嘌呤霉素连续筛选2周。根据转染具体情况建立对照,分为control组(未转染)、vector组(转染空质粒)、OE组(转染microRNA-338-3p质粒)。使用荧光倒置显微镜观察转染后细胞的荧光表达效率;使用TRIzol试剂从HepG2肝癌细胞中提取总RNA,通过miRNA第一链cDNA合成试剂盒将总RNA逆转录为cDNA,以该cDNA为模板进行实时荧光定量PCR,反应条件为95 ℃ 10分钟,40个循环的95 ℃ 10 s、60 ℃ 30 s。以U6为内参,结果用2-△△Ct测定相对表达量。microRNA-338-3p上游引物:5-AACAGTGTCCAGCATCAGTGA-3,U6上游引物及通用下游引物由生工生物工程(上海)股份有限公司设计合成。
1.4 细胞划痕实验
预先对六孔板做好标记,将各组细胞按照5×105个/well的浓度接种到六孔板上,每孔加入2 mL完全培养基,放置于37 ℃、5%CO2恒温箱过夜。等待细胞贴壁并均匀铺满单层进行操作,使用无菌黄色枪头垂直平滑地划出划痕,用PBS将飘起的细胞充分洗去,再加入含有1%血清的DMEM培养基2 mL继续在37 ℃、5%CO2恒温箱中培养48小时。分别记录镜下0小时和48小时同一划痕区域的图片,计算迁移指数,迁移指数=(0小时的面积-48小时后的面积)/0小时的面积×100%。
1.5 细胞侵袭实验
使用无血清DMEM培养基将各组细胞的浓度稀释至2×105个/mL,充分重悬后每组分别取出100 μL的细胞悬液接种到预制好基质胶的Transwell小室中,加入600 μL 10%血清DMEM完全培养基,放置于37 ℃、5%CO2恒温箱继续培养24小时。使用甲醇对培养结束后的细胞进行10分钟固定,PBS漂洗两次后用0.1%结晶紫染色15分钟,再用PBS漂洗去多余的染料,轻柔地擦去Transwell小室上表面的细胞,最后对穿过膜的细胞进行计数。
1.6 蛋白质印迹法实验
提取各组HepG2肝癌细胞的总蛋白,通过BCA法测定蛋白浓度。制作7.5%SDS-PAGE凝胶,在每个加样孔中加入30 μg蛋白样本,浓缩胶电泳80 V,分离胶电泳120 V。湿转法设定恒流300 mA 1.5小时将蛋白条带转至PVDF膜上,快速封闭液封闭15分钟。加入一抗(E-cadherin、N-cadherin)后在4 ℃冰箱中孵育过夜,PBS漂洗三次后再加入二抗室温孵育1小时,PBS漂洗三次,显影后使用Image J软件分析蛋白条带灰度值,以β-actin作为内参计算蛋白相对表达量。
1.7 统计学方法
使用SPSS 22.0版统计学软件对实验结果进行统计分析。计量资料以均值±标准差(±s)表示,两样本均数间的比较采用t检验;多个样本间的比较采用单因素方差分析。检验水准设定为α=0.05,双侧检验。
2 结 果
2.1 microRNA-338-3p mimics慢病毒过表达效率检测
荧光倒置显微镜下观察各组HepG2肝癌细胞,成功被感染的细胞能够发出绿色荧光。vector组和OE组的荧光效率均超过90%。如图1A所示。使用RT-qPCR检测各组细胞的microRNA-338-3p表达量,control组与vector组相比microRNA-338-3p的表达量未见明显差异(P>0.05);control组与OE组microRNA-338-3p的表达量比较差异有统计学意义(P<0.0001),OE组microRNA-338-3p的表达量显著上升;vector组与OE组microRNA-338-3p的表达量比较差异有统计学意义(P<0.0001),OE组microRNA-338-3p的表达量显著上升。如图1B所示。
2.2 划痕实验检测microRNA-338-3p对HepG2肝癌细胞迁移能力的影响
划痕实验结果显示,microRNA-338-3p可以抑制HepG2肝癌细胞的迁移能力,将control组细胞48小时的迁移指数与vector组对比,差异无统计学意义(P>0.05);将control组细胞48小时的迁移指数与OE组对比,差异有统计学意义(P<0.001),OE组的迁移能力显著小于control组;将vector组细胞48小时的迁移指数与OE组对比,差异有统计学意义(P<0.01),OE组的迁移能力显著小于vector组。如图2A、2B所示。
2.3 Transwell侵袭实验检测microRNA-338-3p對HepG2肝癌细胞侵袭能力的影响
Transwell侵袭实验结果显示,microRNA-338-3p可以抑制HepG2肝癌细胞的侵袭能力。将control组的穿膜细胞计数后与vector组对比,两组差异无统计学意义(P>0.05),而与OE组对比差异有统计学意义(P<0.001),OE组的穿膜细胞计数显著小于control组,可以认为OE组的侵袭能力显著小于control组;将vector组的穿膜细胞计数后与OE组对比,差异有统计学意义(P<0.001),OE组的穿膜细胞计数显著小于vector组,可以认为OE组的侵袭能力显著小于vector组。如图3A、3B所示。
2.4 蛋白质印迹法实验检测E-cadherin、N-cadherin蛋白表达
Western bolt实验结果显示,microRNA-338-3p可以促进上皮细胞标志物E-cadherin的表达,抑制间质细胞标志物N-cadherin的表达。control组和vector组的E-cadherin相比差异无统计学意义(P>0.05);control组和OE组的E-cadherin相比差异有统计学意义(P<0.05),OE组的E-cadherin表达量高于control组;而vector组和OE组的E-cadherin相比差异有统计学意义(P<0.05),OE组的E-cadherin表达量高于vector组。如图4A、4C所示。control组和vector组的N-cadherin相比差异无统计学意义(P>0.05);control组和OE组的N-cadherin相比差异有统计学意义(P<0.01),OE组的N-cadherin表达量显著低于control组;vector组和OE组的N-cadherin相比差异有统计学意义(P<0.05),OE组的N-cadherin表达量显著低于vector组。如图4B、4D所示。
3 讨 论
肝细胞癌是常见的恶性肿瘤之一,发病率和病死率都很高。近年有大量研究聚焦于肝细胞癌发生发展的机制,但是肝细胞癌进展的分子机制尚不明确,目前仍缺乏治疗晚期肝细胞癌的临床有效途径。目前一些研究表明microRNA-338-3p在抑制多种恶性肿瘤的特性中广泛发挥作用[4],然而其介导肝细胞癌发生发展的机制尚未完全明确。miRNA在肿瘤的发生、发展和转移过程中起着关键作用,不同miRNA的生物活性调控了HCC细胞的侵袭和转移,有的充当促癌基因发挥作用,有的充当抑癌基因发挥作用,如过表达miRNA-96-5p可以促进SMMC-7721和MHCC-97H肝癌细胞的增殖、迁移和侵袭[5];过表达miRNA-299-3p可以抑制HCC细胞的增殖、侵袭和抗凋亡,并限制EMT和细胞干性[6]。因此,明确特定miRNA的功能也许会为肝细胞癌的患者提供有效治疗方案。E-cadherin常被认为可以抑制肝癌细胞的生长和转移,它不仅和基因突变、染色体不稳定性、DNA甲基化、组蛋白修饰和非编码RNA有关[7],还有研究发现在其他肿瘤中E-cadherin的表达量与淋巴结累积情况、肿瘤分化程度显著相关[8],E-cadherin的缺失往往被认为是EMT的标志之一。N-cadherin对大脑、心脏、骨骼肌、血管的发育和功能调节起着重要作用,同时N-cadherin的异常表达也与肿瘤细胞的凋亡、血管生成、侵袭和转移密切相关[9]。本研究中,实验结果显示在HepG2肝癌细胞中过表达microRNA-338-3p后,HepG2肝癌细胞的细胞划痕愈合率降低,侵袭实验中穿膜细胞数减少,上皮细胞标志物E-cadherin蛋白表达量上升,间质细胞标志物N-cadherin蛋白表达量下降。
综上所述,microRNA-338-3p可以抑制HepG2肝癌细胞的迁移、侵袭能力;microRNA-338-3p通过促进E-cadherin蛋白表达并抑制N-cadherin蛋白表达,从而抑制HepG2肝癌细胞的上皮间质转化,有望为肝细胞癌的临床治疗提供新思路。
参 考 文 献
[1] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin,2021,71(3):209-249.
[2] HUANG Y H, HONG W Q, WEI X W. The molecular mechanisms and therapeutic strategies of EMT in tumor progression and metastasis[J]. J Hematol Oncol,2022,15(1):129.
[3] PAN G T, LIU Y H, SHANG L R, et al. EMT-associated microRNAs and their roles in cancer stemness and drug resistance[J]. Cancer Commun,2021,41(3):199-217.
[4] MIRZAEI S, ZARRABI A, ASNAF S E, et al. The role of microRNA-338-3p in cancer:growth,invasion,chemoresistance,and mediators[J]. Life Sci,2021,268:119005.
[5] LI Z R, XU G, ZHU L Y, et al. GPM6A expression is suppressed in hepatocellular carcinoma through miRNA-96 production[J]. Lab Invest,2022,102(11):1280-1291.
[6] WANG B L, WANG H H, ZHAO Q, et al. Matrine induces hepatocellular carcinoma apoptosis and represses EMT and stemness through microRNA-299-3p/PGAM1 axis[J]. Growth Factors, 2022, 40(5/6): 200-211.
[7] FAN X X, JIN S X, LI Y R, et al. Genetic and epigenetic regulation of E-cadherin signaling in human hepatocellular carcinoma[J]. Cancer Manag Res, 2019, 11: 8947-8963.
[8] RAJKUMAR S D, GUNABOOSHANAM B, JOSEPH L D, et al. Utility of immunohistochemical expression of E-cadherin in colorectal carcinoma[J]. Prz Gastroenterol, 2022, 17(1): 59-66.
[9] CAO Z Q, WANG Z, LENG P. Aberrant N-cadherin expression in cancer[J]. Biomedecine Pharmacother, 2019, 118: 109320.
(收稿日期:2023-03-11 修回日期:2023-10-22)
(編辑:潘明志)

