指向普通学生的高中化学扶放课堂研究
李湘瑜 连永琳

[摘 要]文章介绍并阐释了指向普通学生的高中化学扶放课堂,并以“化学反应的焓变”教学为例展示扶放课堂教学,主要教学环节包括理解概念、宏观辨识、巩固书写、总结提升,基于学生认知先扶后放、提质增效,进而提升学生化学学科核心素养。
[关键词]扶放课堂;普通学生;高中化学;焓变
[中图分类号] G633.8 [文献标识码] A [文章编号] 1674-6058(2024)05-0068-05
一、扶放课堂的提出
(一)课标文件的导向
2018年1月,教育部颁布了《普通高中化学课程标准(2017年版)》,提出要培养学生的创新精神和实践能力,倡导真实问题情境的创设,开展以化学实验为主的多种探究活动,重视教学内容的结构化设计,激发学生学习化学的兴趣,促进学生学习方式的转变[1]。2019年6月,国务院办公厅印发的《关于新时代推进普通高中育人方式改革的指导意见》明确提出,要深化课堂教学改革,要求积极探索基于情境、问题导向的互动式、启发式、探究式、体验式等课堂教学。2021年7月,中共中央办公厅、国务院办公廳印发《关于进一步减轻义务教育阶段学生作业负担和校外培训负担的意见》,明确提出要提升课堂教学质量,要求教师优化教学方式,强化教学管理,提升学生在校学习效率。因此,在新课标、新教材、新高考的背景下,教师应加强授课主题的结构化设计,在创设情境中提出问题,在解决问题中建构知识,在学以致用中落实质量评价。
(二)普通学生的学情
笔者所在的学校是一所二级达标校,生源水平一般。大部分学生接受形象事物的能力较强,理解抽象理论的能力较弱,整合情境信息和规范学科用语的能力较弱;习惯被动学习,自觉主动探究较少。在“双减”政策背景下,普通高中的化学教师在教学中如何根据学情提高教学质量?对此,我们采用问卷星对选科化学的高中生进行了网络问卷调查和个别访谈。调查结果显示:1.高中化学课时少而教学内容多,可让学生参与教学进度的安排,使学生有更强的学习化学的时间观念;2.教师要根据学生的具体情况,即学生的知识结构和接受知识的能力,设计课堂教学过程。对于基础比较扎实但是学习能力一般的学生,教师应创建情境,让学生经历知识获取过程并学会迁移应用知识。对于基础不扎实但是学习能力较强的学生,教师应积极引导,让学生明白扎实的基础知识对于学习的重要性,并采用对基础知识多扶而对需要理解和迁移应用的知识多放的教学策略,即采取该扶就扶、该放就放的教学模式进行教学,从不同的角度引导学生学习、理解、应用知识。
(三)扶放有度的启发
面对新课标、新教材、新高考,如何让学生全员参与课堂并专注于课堂?本着问题即课题、教学即研究的原则,笔者在教学中思考,在学习中借鉴。阅读《扶放有度实施优质教学》一书后,笔者深受美国教学实践专家道格拉斯·费希尔和南希·弗雷构建的“扶放有度”教学模式的启发。书中对“扶放有度”教学模式的阐释是教师示证、教师辅导、同伴协作、独立表现,具体实施可以根据教学需要重新排序。该教学模式把认知负荷从以教师为中心逐渐转移至教师与学生的学习共同体中,直到最后学生可以独立进行实践和应用新知。“扶放有度”教学模式启发我们,要提升高中普通学生的化学课堂学习效率,就应基于学生认知先扶后放、有序推进[2]。
二、扶放课堂的构建
(一)扶放课堂的设想
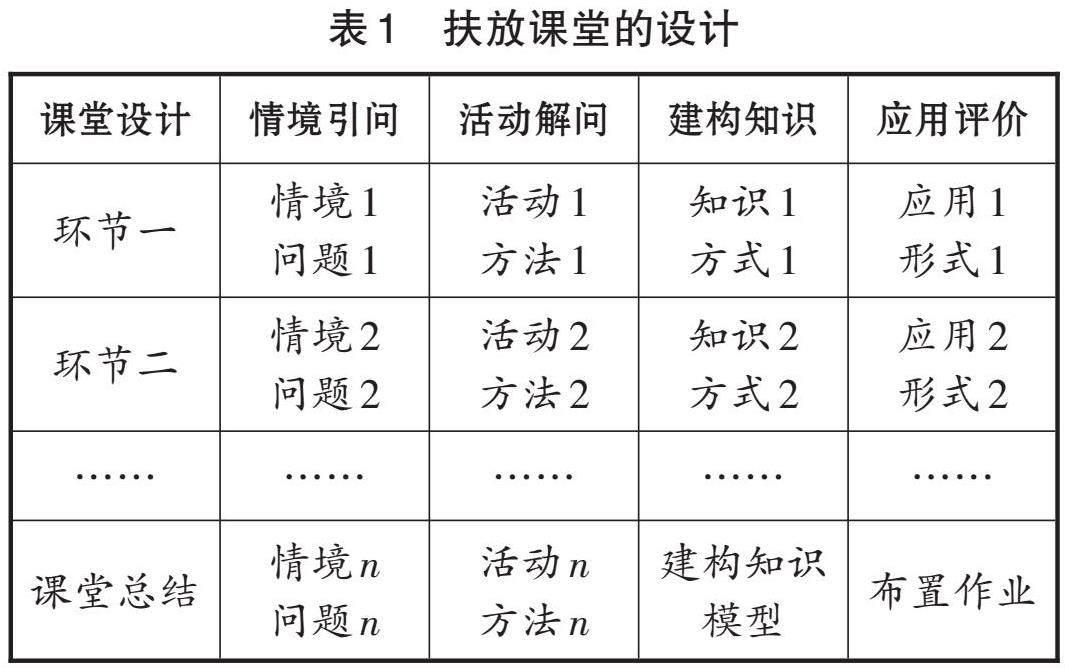
根据高中普通学生的认知水平和学习状态构建扶放课堂,可突出课堂教学结构化设计,通过优化教学方式先扶后放,使课堂教学提质增效。扶放课堂的每个教学环节都包含四个步骤:情境引问、活动解问、建构知识、应用评价。情境引问是通过创设情境,提出问题;活动解问是通过活动分析,解决问题;建构知识是通过师生互动,总结知识;应用评价是通过应用固学,评价成效。在教学方式上,情境引问和活动解问主要采用教师示证、教师辅导、同伴协作,适时结合独立表现的方式,即以扶为主;建构知识和应用评价主要采用同伴协作和独立表现的方式,即以放为主[3]。通过先扶后放,形成符合学生认知的教、学、评一体化模式。
(二)扶放课堂的设计
(三)扶放课堂的实施
笔者以苏教版高中化学选择性必修1专题1第一单元“化学反应的热效应”中的“化学反应的焓变(第一课时)”的教学为例,对扶放课堂的实施进行探究。本课是选择性必修1的第1节课,起着承上启下的作用,旨在促进学生在原有知识的基础上学习新知识,完善知识结构。经过对高一化学必修内容的学习,学生已认识吸热反应与放热反应,了解热化学方程式定量表示一个特定反应放出或吸收的热,但不清楚?H的含义;知道必须提高燃料的燃烧效率,开发高能清洁燃料,但不了解学习化学反应的焓变的意义。
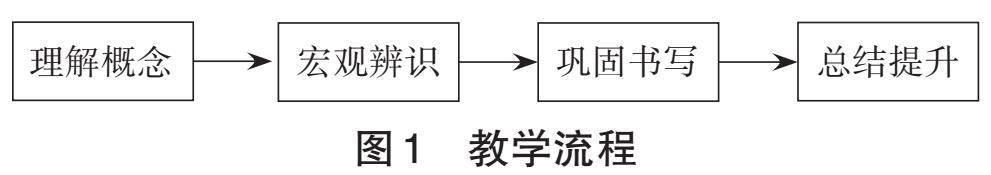
本节课的教学目标:1.通过实验辨识化学反应中的能量转化形式,认识体系与环境、内能与焓、反应热与焓变等概念。2.通过丙烷完全燃烧的能量变化图,建立由内能分析焓变的宏观认知模型。3.通过讨论对比,掌握热化学方程式的书写,了解学习化学反应的焓变的意义。本节课的教学流程如图1所示。
三、扶放课堂教学过程
环节一 理解概念
【情境引问】(教师辅导)
情境1:神舟伴月(视频)。
“长征”系列运载火箭技术的发展,为中国航天的发展提供了强有力的支撑。火箭一飞冲天需要动力源,火箭的燃料源叫推进剂,由氧化剂和燃烧剂组成,如液氧和液氢、常温推进剂四氧化二氮和偏二甲肼等。
化学反应过程中既有物质变化,又有能量变化,遵循质量守恒定律和能量守恒定律。化学反应与能量的关系应用广泛。本节课的主题是“化学反应的焓变”。
问题1:什么是化学反应的焓变?
【活动解问】(同伴协作)
实验目的:测定盐酸与碳酸钙反应生成CO2的速率。
实验试剂:3.0 g 大理石(如图2)、20 mL 1mol·L-1盐酸。
观测记录:每隔10 s记录注射器(如图3)中气体的体积。
数据分析(以一组学生记录和计算的数据为例):
1.同一个反应,在相同时间间隔收集到的CO2体积不同。
2.同一个反应,从开始至30 s,每10 s CO2的平均生成速率增大;从30 s至60 s,每10 s CO2的平均生成速率减小。
原因分析:本实验是放热反应,反应速率与溶液温度和H+浓度有关。从开始至30 s,虽然盐酸浓度变化不大,但是反应放热导致体系温度升高,反应速率增大;从30 s至60 s,随着反应的进行,已达到一定的温度,温度变化不会太大,但此时盐酸中的H+浓度降低,使反应速率减小。
【建构知识】(教师辅导)
1.体系与环境
体系:被研究的物质系统。
环境:体系以外的其他部分,也称为“外界”。
如图3中,锥形瓶中的盐酸、大理石及发生的反应属于体系;盛试剂的锥形瓶和玻璃注射器及空气等属于环境。因溫度不同,体系与环境之间传递着热量。
2.内能与焓
内能:体系内物质的各种能量的总和,用符号U表示。
影响因素:质量、温度、压强、聚集状态、组成等。
焓:与内能有关的物理量,用符号H表示。
3.反应热与焓变
反应热:在化学反应过程中,当反应物和生成物具有相同温度时,吸收或释放的热。
焓变:在恒压条件下,化学反应过程中吸收或释放的热,用符号?H表示,单位为kJ·mol-1。
恒压条件下的反应热等于焓变。
吸热反应:ΔH>0;放热反应:ΔH<0。
【应用评价】(独立表现)
1.正误判断。
()(1)同种物质不同状态,质量相同,焓就相同。
()(2)化学反应的反应热就是该反应的焓变。
()(3)化学反应的能量变化都是化学能与热能间的相互转化。
()(4)放热反应的ΔH<0,而吸热反应的ΔH>0。
设计意图:以火箭燃料引入教学主题,通过实验数据分析引发认知冲突,让学生体验放热反应对化学反应速率的影响,渗透批判性思维。教师及时引导学生理解三组概念,学会从宏观视角解决问题,形成化学反应存在物质和能量转化的变化观念,培养学生的合作探究能力。
环节二 宏观辨识
【情境引问】(教师辅导)
情境2:液化石油气含有丙烷。
问题2:图4是一定量丙烷完全燃烧生成CO2气体和1 mol 液态水的能量变化图,请在括号内填“+”或“-”。从内能角度分析一个化学反应是吸收能量还是释放能量取决于什么。
【活动解问】(同伴协作)
读图分析:反应物总能量大于生成物总能量,反应过程要释放能量,括号内填“-”。
讨论总结:从内能角度分析一个化学反应是吸收能量还是释放能量,取决于反应物总能量和生成物总能量之间的相对大小。
【建构知识】(同伴协作)
当反应物总能量小于生成物总能量时,反应过程吸收能量(如图5)。
当反应物总能量大于生成物总能量时,反应过程释放能量(如图6)。
在恒温、恒压条件下,化学反应中的能量变化以热的形式表现,即体系内能改变产生反应热,恒压条件下的反应热等于焓变。
ΔH=生成物总能量-反应物总能量
【应用评价】(独立表现)
2.已知 2A(g)?B(g) ?H1(ΔH1<0);2A(g)?B(l)ΔH2。图7中能量变化示意图正确的是()。
A B
C D
设计意图:通过完善丙烷完全燃烧的能量变化图,引导学生建构直观的反应过程能量变化的认知模型,学会通过图像表征化学反应的能量变化,并能应用模型解决具体反应问题。
环节三 巩固书写
【情境引问】(教师辅导)
情境3:北京冬奥会主火炬使用的是氢燃料,张家口赛区的火炬使用的是绿氢燃料,从生产到应用实现零碳排放。
问题3:热量的释放或吸收是化学反应能量变化的常见形式。如何用化学用语定量表示化学反应中放出或吸收的热?
【活动解问】(教师辅导)
请学生观察下列热化学方程式,分析其在书写上与化学方程式有何不同。
①2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1
③H2(g)+[12]O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
④2H2O(l)=2H2(g)+O2(g) ΔH=571.6 kJ·mol-1
【建构知识】(教师辅导,同伴协作)
热化学方程式
1.定义:能够表示反应热的化学方程式。
2.意义:不仅表示物质的变化,也表示能量的变化。
3.书写原则
(1)标注状态:固体(s)、液体(l)、气体(g)、水溶液(aq)。
(2)化学计量数表示物质的量,书写时可以用整数或简单分数表示。同一反应,化学计量数不同时,ΔH成比例变化。
(3)反应逆向进行,ΔH 绝对值相等,符号相反。
(4)若条件为25 ℃(298 K)、101 kPa可省略,其他温度和压强必须注明。
如:
100 ℃、101 kPa
H2(g)+I2(g)=2HI(g) ΔH=-14.9 kJ·mol-1
25 ℃、101 kPa
H2(g)+I2(g)=2HI(g) ΔH=-9.48 kJ·mol-1
[信息提示]
ΔH的单位中“mol-1”的含义:
对于一个化学反应:aA+bB=cC+dD,ΔH的单位中“mol-1”不是指“每摩尔A(或B、C、D)”,而是指“每摩尔反应”。
例如,对于反应:2H2(g)+ O2(g)= 2H2O(l) ΔH=-571.6 kJ·mol-1,2 mol H2(g)与1 mol O2(g)反应生成2 mol H2O(l)表示“每摩尔反应”,“每摩尔反应”放出571.6 kJ的热量。
而对于反应:[H2(g)+12O2(g)]=H2O(l) ΔH=-285.8 kJ·mol-1,1 mol H2(g)与0.5 mol O2(g)反应生成1 mol H2O(l)表示“每摩尔反应”,“每摩尔反应”放出285.8 kJ的热量。
[典例分析]
写出以下反应的热化学方程式。25 ℃、101 kPa 时,2.3 g乙醇液体完全燃烧生成二氧化碳气体和液态水,放出68.34 kJ的热量。
解:乙醇完全燃烧的化学方程式为:
C2H5OH+3O2[点燃] 2CO2+3H2O
设1 mol乙醇完全燃烧放出的热量为[x],则
[2.3 g68.34 kJ=1 mol×46 g·mol-1x]
解得[x=1366.8 kJ]
则该反应的热化学方程式为:
C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)
ΔH=-1366.8 kJ·mol-1
強调:一写方程式,二标状态,三写ΔH,四检查。
【应用评价】(独立表现)
3.Ⅰ.发射卫星时可用肼(N2H4)做燃料,已知在298 K、101 kPa时,1 g液态肼燃烧生成氮气和液态水,释放19.44 kJ热量。观察并分析下列肼燃烧反应的热化学方程式,判断这些热化学方程式是否正确。
()(1)N2H4+O2=N2+2H2O
ΔH=-622.08 kJ·mol-1
()(2)N2H4(l)+O2(g)=N2(g)+2H2O(l)
ΔH=622.08 kJ·mol-1
()(3)N2H4(l)+O2(g)=N2(g)+2H2O(l)
ΔH=-622.08 kJ·mol-1
()(4)N2H4(l)+O2(g)=N2(g)+2H2O(g)
ΔH=-622.08 kJ·mol-1
()(5)[12]N2H4(l)+[ 12]O2(g)=[12]N2(g)+ H2O(l) ΔH=-311.04 kJ·mol-1
Ⅱ.写出下列反应的热化学方程式。
(1)液氧和液氢可做火箭推进剂,已知1 g液氢在液氧中完全燃烧生成气态水,释放118.75 kJ热量。
(2)2022年10月9日,长征二号丁运载火箭将“夸父一号”卫星成功送入预定轨道,该火箭使用的推进剂是N2O4和偏二甲肼(C2H8N2)。已知0.5 mol液态C2H8N2在液态N2O4中完全燃烧生成无污染气体和液态水,释放1275 kJ热量。
设计意图:通过氢燃料火炬引出氢气燃烧热化学方程式的比较,提出问题,促进学生巩固热化学方程式的书写原则,进而能够熟练、规范地用符号表征化学反应,养成节约能源、绿色低碳的环境保护意识。
环节四 总结提升
【情境引问】(教师辅导)
情境4:氢气的制取与储存是氢能源利用领域的研究热点。
问题4:已知0.5 mol H2S(g)分解为S2(g)和H2(g),吸收42.45 kJ的热量,热化学方程式为 。该反应的反应物具有的总能量 (填“大于”“等于”或“小于”)生成物具有的总能量。H2S热分解制氢时,常向反应器中通入一定比例的空气,使部分H2S燃烧,其目的是 。
【活动解问】(独立表现)
2H2S(g)=2H2(g)+ S2(g) ΔH=169.8 kJ·mol-1;小于;使部分H2S燃烧,放出热量,为硫化氢热分解反应提供热量。
教师小结:
1.化学反应的热效应应用广泛,人们根据焓变的数据合理选择和利用化学反应。
2.倡导构建清洁低碳、安全高效的能源体系[4]。
【建构知识】(同伴协作)
从宏观角度认识化学反应的焓变。
理解三组概念→由内能分析焓变→巩固表示方法→合理应用焓变。
【应用评价】(独立表现)
课外作业。
设计意图:让学生综合应用知识回答问题,进而评价学生灵活运用知识独立解决问题的能力,让学生进一步了解运用焓变的数据合理选择和利用化学反应的学科价值。
四、教学反思
(一)课堂简约,结构清晰
扶放课堂践行简约。高效的课堂结构化设计,教学方向和教学环节明确,可有效避免复杂内容的烦琐教学,重在优化教学方式。
(二)情境引问,建构知识
真实、具体的问题情境是学生化学学科核心素养形成和发展的重要平台,为学生化学学科核心素养提供了真实的表现机会[5]。创设的情境应具有针对性,可有效发挥为教学服务的功能,主要目的是引发问题、解决问题、建构知识。教学中还应充分发挥化学实验的独特价值,让学生在实践中质疑,在实践中感悟,在实践中激发内驱力。
(三)生生參与,及时评价
高考命题理念从“知识立意”“能力立意”向“价值引领、素养导向、能力为重、知识为基”转变[6]。教师如何提升教学质量以适应新高考的要求?若教师只是一味地灌输知识,舍不得花时间让学生及时巩固,就会使学生觉得知识乏味、不易理解,从而丧失学习兴趣。对此,教师要积极改变教学方式,顺应新时代的需求。扶放课堂教学模式是基于普通学生的认知而设计的,强调学生全员参与。它根据学生的认知层次,先落实单一知识,再综合运用知识解决问题,尽可能发挥学生的主体作用,引导学生对所学内容进行有序梳理归纳,并及时在应用中评价学生的学习成效[7]。
[ 参 考 文 献 ]
[1][5] 中华人民共和国教育部.普通高中化学课程标准:2017年版[M].北京:人民教育出版社,2018.
[2][3] 费希尔,弗雷.扶放有度实施优质教学[M].徐佳燕,张强,译.福州:福建教育出版社,2019.
[4] 王祖浩.普通高中教科书 选择性必修1 化学反应原理[M].南京:江苏凤凰教育出版社,2021.
[6] 教育部考试中心.中国高考评价体系说明[M].北京:人民教育出版社,2019.
[7] 王云生.优化课程内容结构和组织形式的实践探索:智慧教育平台高中化学教学课例评析 [J].化学教学,2023(9):3-6,19.
(责任编辑 罗 艳)

