浅析化学药剂对氨氮废水处理
王 勇
摘要:近年来,随着城市人口的日益膨胀和工农业的不断发展,环境污染问题日益成为人们关注的焦点。目前我国的水体污染中氮、磷已逐渐上升为主要污染物,加强对氨氮废水处理的研究意义重大。本文详细阐述了化学实验中化学药剂处理氨氮废水的实验方法和测定方法,并对结果进行了分析。
关键词:化学实验;氨氮废水;处理
我国的海域污染也很严重。渤海、黄海、东海、南海、四大海域主要受无机氮、磷酸盐、高锰酸钾盐和石油类产品的污染,而且无机氮、磷的指数还在呈逐年增加的趋势。
目前我国的水体污染中氮、磷已逐渐上升为主要污染物。对氨氮废水的控制日益严格,对氨氮废水的处理愈来愈引起关注。为满足公众对环境质量要求的不断提高。本文就是对化学实验中化学药剂处理氨氮废水进行了研究。
一、实验内容
1.实验废水的配制
由于工业生产的氨氮废水来源广,浓度差异大,废水成分复杂。为了系统研究化学沉淀法处理高酸度高浓度氨氮废水的影响因素及处理效果,采用配制的模拟氨氮废水进行实验。
本实验采用硫酸按和蒸馏水配制l0L的实验废水,硫酸按投加量的计算方法如下:
(1)
式中m——硫酸氨投加量,g; ——初步给定氨氮的浓度,mol/L;14 g/mol——氮的摩尔质量;132.14 g/mol——硫酸按的摩尔质量;
99%——硫酸按的纯度。
通过计算硫酸按投加量配制模拟氨氮废水,最后采用纳氏比色法测定模拟废水中的氨氮浓度为1600mg/L,用试剂调节废水的酸碱度,使pH值达到2.0。
2.废水处理实验方法
实验在500mL的烧杯中进行,并将其放在可控温的磁力搅拌机上进行搅拌,实验步骤如下:
(1)量取200mL的实验废水于烧杯中,缓慢加入磷酸盐,充分搅拌,直到无晶体物质沉积于烧杯底部;
(2)加入镁盐,并充分搅拌,直到全部溶解;
(3)采用10mo1/L的NaOH溶液调节水样的pH达到反应所需值(水样达到设定的pH后,设为反应起始点);
(4)在设定的搅拌速度下,反应一定的时间,待反应结束后,将水样静置15min;
(5)水样静置后,取其上清液用孔径为2nm的定量滤纸进行固液分离;
(7)取滤液,分析N、Mg、P的浓度;
(8)所得沉淀物置于干燥皿中保存。
3.氨氮的测定
(1)预处理
样品中含有悬浮物、余氯、钙镁等金属离子时,对比色测定有干扰。处理方法如下:在100mL样品中加入1mL硫酸锌溶液和0.~ 0.2mL氢氧化钠溶液,调节pH值约为10.5,混匀,防止沉淀,必要时,用经过水冲洗的中速滤纸过滤,弃去初滤液20mL;加入适量的硫代硫酸钠溶液去除余氯,每0.5mL可去除0.25mg余氯,也可用淀粉一碘化钾试纸检验是否除尽余氯;加入酒石酸钾钠溶液络合掩蔽,可消除钙镁等金属离子的干扰;用凝聚沉淀和络合掩蔽后,如样品仍浑浊和带色,则应采用蒸馏法。并且推算氨氮回归曲线方程式并绘制标准曲线。
(2)水样的测定
取样品50mL于比色管中,加入1mL酒石酸钾钠溶液,摇匀,再加入纳氏试剂1.5mL摇匀。放置10min后进行比色。一般在波长420nm下,用光程长20mm比色皿,以蒸馏水作参比,测定吸光度。
(3)结果计算
根据吸光度(试样测定吸光度减去空白实验吸光度),就可以在氮氮标准回归直线上查出氨氮的浓度,再乘以稀释倍数,得出废水中氨氮的浓度。
4.镁的测定
在pH为5.5的醋酸——醋酸钱缓冲溶液中用铜试剂分离铁、铝和镍等干扰离子分离除去后,一份试液在pH> 12的情况下,以酸性铬蓝K-蔡酚绿B为指示剂,用EDTA标准溶液滴定钙,另外一份试液在pH值为10的氨性缓冲溶液中以酸性铬蓝K-蔡酚绿B或铬黑T为指示剂,用EDTA标准溶液滴定钙镁含量。
吸取试液两份,每份20毫升,分别置于两个100毫升烧杯中,用1:1的氨水中和至沉淀出现,再滴加1:1的盐酸使沉淀刚好溶解,加1毫升pH=5.5醋酸-醋酸钱缓冲溶液、0.3~0.5克铜试剂及少量纸浆,搅拌片刻,用中间夹有纸浆的脱脂棉漏斗过滤,滤液用250毫升锥形瓶承接,用少量含有铜试剂的水洗涤烧杯和沉淀各3-4次。
二、结果与讨论
1.沉淀剂的选择
实验中所用的药剂是镁盐和磷酸盐,其中Mg2+可以用MC12,MgO,Mg(NO3)2:和MgSO4;等,PO43-可用H3PO4, NaH2PO4-2H2O等。
按Mg:P:N的理论物质的量之比为1:1:1,投加不同种类的镁盐和磷酸盐,反应在pH值为9.0下进行,反应时间10min,搅拌速度150r/min,进行三次重复实验。
通过对比实验得出:
(1)采用MgO和H3PO;的组合,其氨氮去除率只有36.5%,其原因主要是MgO在水中是难溶的金属氧化物,同时H3PO4;是多元酸,两者之间反应缓慢且反应不彻底,氨氮去除效果差。
(2)采用药剂MgSO4;和Na2HPO412H2O的组合与采用MgCI:和Na2HPO412H2O的组合,其两者的氨氮去除率相近,但考虑到CI-会给后续生化处理带来影响,而工业纯MgSO4;价格低于M9Cl2,所以选择MgSO4。
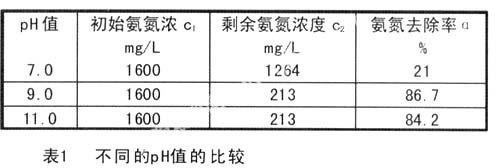
2.反应PH值对氨氮去除率的影响
固定n(Mg2+):n(NH4+):n(PO43-)=1:1:1,搅拌速度100转/分钟,反应时间为10min,在不同的pH值条件下反应,1:1,反应时所得的结果见表1.
3.反应时间对氨氮去除率的影响
固定n(Mg2+):n(NH4+):n(PO43-)=1:1:1, pH=9.0,搅拌速度100转/分钟,投加硫酸镁和磷酸氢二钠,调整反应时间,通过不同反应时间的比较可知,当反应时间在1 min和5min时,氨氮去除率较低,其主要原因是所投加的药剂还未充分混合:当反应时间大于l0min以后,氨氮去除率变化幅度不大,基本上没有影响,说明磷酸钱镁在一定的反应时间下,成核速度快,延长反应时间对反应结果的影响小。确定反应时间为t=10min。
参考文献:
[1] 张翠粉,戴建军.氨氮废水物化法处理技术探讨[J].污染防治技术,2006.3
[2] 何岩,赵由才,周恭明等.高浓度氨氮废水脱氮技术研究进展[J].工业水处理,2008.1

