缺血后处理对大鼠肠缺血再灌注致肺脂质过氧化损伤的保护作用*
姚树桐,商战平,桑 慧,方永奇,于凤秀,王家富
(泰山医学院病理生理学教研室,山东 泰安 271000)
肠缺血再灌注(ischemia/reperfusion,I/R)损伤是严重创伤、休克、心肺功能不全等救治过程中共有的病理过程,不仅导致肠组织本身损伤,而且通过氧化应激、炎症细胞活化等机制对远隔器官尤其是肺的结构和功能产生广泛影响,甚至导致多器官功能障碍综合症(multiple organ dyfunction syndrome,MODS)[1],因此研究肠I/R损伤的发生与防治具有重要临床意义。调动机体内源性保护机制是防治I/R损伤最有效的措施,缺血后处理(ischemic postconditioning, I-post C),即在组织缺血后持续再灌注前多次短暂再灌注/缺血处理,是一种新发现的内源性保护现象,其保护作用已在多种属动物不同器官如心、肝、肺、小肠等I/R损伤模型上得到证实,且因其可在缺血后实施而具有良好的临床应用前景[2]。既往有关I-post C内源性保护及其机制研究主要侧重于其对I/R组织器官本身的保护,但是否可通过调动全身性内源性保护机制对远隔器官发挥保护作用,国内外尚未见报道。本工作在既往已证实肠I-post C可减轻大鼠小肠I/R损伤[3]的基础上,进一步研究肠缺血后处理(intestinal ischemic postconditioning,II-post C)和肢体缺血后处理(limb ischemic postconditioning,LI-post C)对小肠I/R大鼠肺组织损伤的影响,并初步探讨其保护机制。
1 材料与方法
1.1实验动物
清洁级成年健康雄性Wistar大鼠32只,体重230~280 g,由山东中医药大学实验动物中心提供,许可证号为SCXK(鲁)2008-0019。
1.2主要试剂
超氧化物歧化酶(superoxide dismutase,SOD) 和丙二醛(malondialdehyde,MDA)测定试剂盒均为南京建成生物工程研究所产品,其余化学试剂为国产分析纯产品。
1.3动物模型制备
术前禁食12 h,自由饮水,以20%乌拉坦(1.6 g/kg)腹腔注射麻醉,常规消毒,右侧腹股沟区分离股动脉,并按照既往报道的方法[3]复制小肠I/R损伤模型,即取腹正中切口,钝性游离肠系膜上动脉(super mesenteric artery,SAM),在其根部以无创伤动脉夹夹闭阻断血流45 min造成小肠缺血,然后打开动脉夹恢复血流灌注120 min。
1.4实验分组
32只大鼠随机分为4组(n=8),①假手术(Sham)组:仅游离右股动脉和SAM,不做I/R处理;②缺血/再灌注(I/R)组:方法见模型制备;③肠缺血后处理(II-post C)组:夹闭SAM 45 min后即刻行3轮1 min灌注/1 min缺血,再灌注120 min结束实验;④肢体缺血后处理(LI-post C)组:夹闭SAM 39 min,然后用动脉夹夹闭右股动脉1 min,松开1 min,反复3个循环,最后小肠再灌注120 min结束实验。
1.5检测指标
1.5.1肺功能测定 于实验结束时经腹主动脉取血(与空气隔离),进行动脉血气分析(丹麦雷度ABL-700血气分析仪)测定动脉血氧分压(PaO2)和二氧化碳分压(PaCO2)。
1.5.2肺系数(lung index,LI)测定 迅速取出肺脏,于气管分叉处上1 cm处剪断,称重,计算肺系数(LI=肺湿重/体重×100)。
1.5.3肺病理学检查 取右肺上叶相同部位约1 cm×1 cm×1 cm大小组织块,10%甲醛固定,常规制备石蜡切片,HE染色,光镜下观察形态学改变。
1.5.4血浆MDA和SOD测定 经腹主动脉取血约3 ml,肝素抗凝,2500 r/min 离心10 min,收集血浆,分别采用硫代巴比妥酸法和黄嘌呤氧化酶法(羟胺法)检测血浆MDA含量和SOD活性,具体操作按照试剂盒说明进行。
1.5.5肺组织MDA和SOD测定 取右肺下叶相同部位肺组织约500 mg,冰浴条件下制备组织匀浆,3000 r/min离心10 min,收集上清,Bradford法蛋白定量,按照试剂盒说明测定肺组织MDA含量和SOD活性。
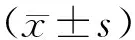
2 结 果
2.1血气指标PaO2和PaCO2变化
与Sham组比较,I/R组PaO2显著降低,PaCO2明显升高,分别为Sham组的59.6%(P<0.01)和134.2%(P<0.01);II-post C和LI-post C均明显改善肺功能,其PaO2分别较I/R组升高33.8% (P<0.01)和22.3% (P<0.05),PaCO2分别降低16.3% (P<0.05)和12.6% (P>0.05),见表1。
2.2肺系数变化
I/R组肺系数明显增高,为Sham组的1.5倍(P<0.01);II-post C组和LI-post C组肺系数分别较I/R组减小20.7%(P<0.01)和16.1%(P<0.01),但仍明显高于Sham组(P<0.05),见表1。
2.3肺组织病理学改变
Sham组肺泡大小均匀,结构完整,壁薄,未见出血、水肿及炎性细胞浸润。I/R组可见肺泡大小不均,完整性破坏,肺泡腔有蛋白样渗出物,肺泡壁增厚,间隔增宽,肺间质和肺泡水肿,大量炎细胞浸润,充血、出血明显。II-post C和LI-post C均减轻上述病理变化,肺泡腔内蛋白渗出减少,肺泡壁增厚、炎细胞浸润减轻。见图1。
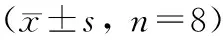
表1 血气指标和肺系数变化
注:与sham组比较,△P<0.05,△△P<0.01;与I/R组比较,*P<0.05,**P<0.01
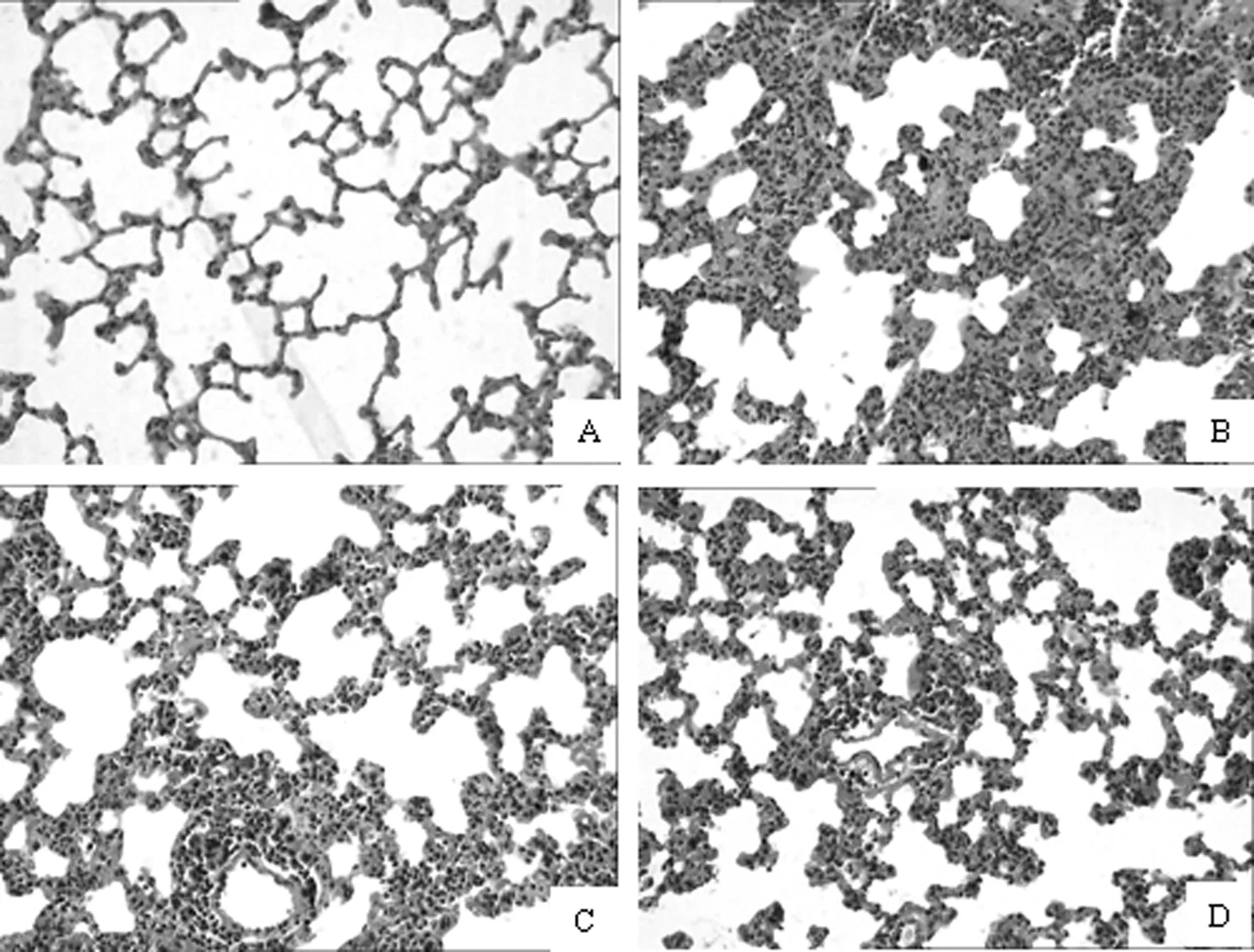
图1 肺组织病理学改变(HE染色,×200)
2.4肺组织和血浆超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量变化
I/R组大鼠肺组织和血浆SOD活性明显降低,而MDA含量增加,与Sham组比较有统计学意义(P<0.01);与I/R组比较,II-post C组和LI-post C组肺组织和血浆SOD活性升高,而MDA含量降低,差异具有统计学意义(P<0.05或P<0.01),见表2。
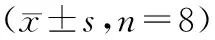
表2 肺组织和血浆SOD、MDA变化
注:与sham组比较,△P<0.05,△△P<0.01;与I/R组比较,*P<0.05,**P<0.01
3 讨 论
肠是体内代谢活跃、具有独特免疫功能的器官,是体内最大的致病菌库,被认为是MODS 的“启动器官”,而肠I/R损伤是其主要原因之一[1]。肠I/R后不仅导致肠组织本身损害,而且对远隔器官结构和功能产生广泛影响,其中最常见的是肺损伤,且往往出现较早[4]。本实验结果显示,肠缺血45 min再灌注2 h后,肺组织明显水肿、出血及炎性细胞浸润,肺泡结构破坏,肺系数增大,且肺功能受损,表明肠I/R可导致严重肺损伤,与文献[4]报道一致。
I-post C作为一种新发现的内源性保护现象,具有重要的理论与临床实用价值。既往大量研究证实I-post C对心[5]、脑[6]、小肠[3]等I/R器官尤其是I/R器官本身具有保护作用,但是其对于I/R所致远隔器官损伤是否仍具有保护作用尚未见报道。本工作在大鼠小肠I/R损伤模型上证实,无论是肠I-post C还是肠外器官(肢体)I-post C均显著改善肠I/R所致肺功能障碍,减轻肺组织病理学改变和肺水肿程度,表明I-post C不仅可减轻I/R组织本身损伤,而且通过调动全身性内源性保护机制对远隔器官也具有保护作用。
氧自由基在再灌注损伤中起重要作用,介导整个损伤过程,其对组织细胞的主要损害是造成脂质过氧化。MDA 和SOD 是反映脂质过氧化程度的一对指标。MDA 是脂质过氧化的代谢产物,是氧自由基攻击生物膜中多不饱和脂肪酸引发脂质过氧化所形成的,其含量变化可反映组织氧化损伤的程度;而SOD 是超氧阴离子清除剂,其活力高低可反映机体清除自由基的能力。本实验结果显示,大鼠肠I/R后,血浆和肺组织MDA含量较假手术组明显升高,而SOD活性显著降低,表明脂质过氧化是导致肠I/R大鼠肺损伤的基本机制;于缺血后再灌注前实施的肠I-post C和肢体I-post C均显著上调血浆和肺组织SOD活性、减少MDA生成,提示I-post C可调动内源性保护机制减轻脂质过氧化所介导的肠I/R大鼠肺损伤,其细胞分子机制正在研究中。
[1] Mallick IH, Yang W, Winslet MC, et al. Ischemia-reperfusion injury of the intestine and protective strategies against injury[J]. Dig Dis Sci, 2004, 49(9) :1359-1377.
[2] 祝筱梅, 刘秀华. 缺血-再灌注损伤防治的新方法——缺血后处理的研究现状[J]. 生理科学进展, 2007, 38(3): 261-265.
[3] 姚树桐, 赵秀梅, 刘秀华. 细胞间黏附分子-1抑制参与大鼠小肠缺血后处理的保护作用[J]. 中国微循环, 2008, 12(2):69-72.
[4] Moraes LB, Murakami AH, Fontes B, et al. Gut ischemia/reperfusion induced acute lung injury is an alveolar macrophage dependent event[J]. J Trauma, 2008, 64(5): 1196-1200.
[5] 姚树桐, 刘秀华, 赵秀梅, 等. 钙调神经磷酸酶的抑制参与大鼠心脏缺血后处理的保护作用[J]. 中国病理生理杂志, 2008, 24 (12):2289-2294.
[6] Zhao H, Sapolsky RM, Steinberg GK. Interrupting reperfusion as a stroke therapy: ischemic postconditioning reduces infarct size after focal ischemia in rats[J]. J Cereb Blood Flow Metab, 2006, 26(9):1114-1121.

