肺炎嗜衣原体临床株的分离鉴定与小鼠接种的初步观察*
徐 磊,吴移谋,刘良专,周 洲,陈超群,唐国芳,赵飞骏
肺炎嗜衣原体(Chlamydophila pneumoniae,Cpn)为1989年正式命名的一种严格真核细胞内寄生的原核细胞型微生物,常引起急慢性呼吸道疾病,同时还与动脉粥样硬化、心肌梗死、冠心病及脑血管疾病等密切相关[1]。目前用于Cpn感染诊断的方法主要有血清学诊断、分子生物学诊断和细胞培养法等。血清学诊断因其简便、快速的优点而成为Cpn感染的常规检测方法[2],但该方法多为回顾性,且常因在重复感染者中IgM的缺乏而影响诊断价值;分子生物学方法能快速诊断Cpn感染,但也存在假阳性或假阴性的问题;传统细胞培养法也有耗时长,技术复杂等缺陷,但该法为病原学检测保留了有机体的生物特征,出现假阳性的机率很小,因此细胞培养法可作为Cpn感染的“金标准”[3]。本研究采用优化后的细胞培养法从临床标本中分离培养Cpn,并对分离出的菌株进行了初步毒力试验。
1 材料与方法
1.1 材料
1.1.1 标本 2009年1月-5月在南华大学附属医院就诊的260例患者的咽拭子和32例肺泡灌洗液,其中男186例,女106例,年龄4~78岁;所有患者均有急性呼吸道感染症状,采样前2w内未服用过大环内酯类药物。
1.1.2 Hep-2细胞(人喉癌细胞) 由南华大学病原生物学研究所细胞培养室保存。
1.1.3 主要试剂和仪器 DMEM培养基购自Hyclone公司;胎牛血清购自Gibco公司;TagDNA聚合酶购自Promega公司;细菌全基因组DNA提取试剂盒购自北京天根公司;抗生素均购自Sigma公司;Cpn鼠单克隆抗体购自Abcam公司;FITC标记羊抗小鼠IgG抗体购自北京博奥森公司。生物安全柜购自Haier公司;高速冷冻离心机AvantiTMJ-25购自 Beckman公司;CO2培养箱购自Sanyo公司。
1.1.4 培养基的配制生长培养基 加入10%胎牛血清的DMEM培养基;维持培养基:DMEM培养基中加入10%胎牛血清和放线菌酮、两性霉素B、链霉素、万古霉素(终浓度分别 0.8μ g/mL、10μ g/mL、10μ g/mL、100μ g/mL);转运培养基(SPG):将蔗糖75.0g,KH2PO40.52g,Na2HPO41.22g,L–谷氨酸0.72g溶于800mL去离子水中,调pH值至7.4,用去离子水定容至1L,0.2μ m滤器抽滤除菌,分装后4℃或-20℃保存。
1.2 标本的采集与处理 标本的采集与处理按以下方法进行:①每100mLSPG培养基加入无菌胎牛血清10mL和两性霉素B、链霉素、万古霉素(终浓度分别为 10μ g/mL、10μ g/mL、100μ g/mL);②用聚酯纤维棉签采集患者咽拭子标本,拭子置于盛有SPG培养基的Eppendorf管中(2mL);肺泡灌洗液与SPG培养基按1:2比例收集于Eppendorf管中(10mL);③转运:标本于4℃快速运送至实验室;④标本如不能及时接种应冻存于-70℃。
1.3 分离培养
1.3.1 PCR扩增初筛 每份标本取0.5mL提取全基因组DNA作为模板(具体操作按天根公司说明书)。16SrDNA扩增引物参照Campbell[4]等公布的一对引物序列,即H L-1:5'-GT TGT TCATGAAGGCCTACT-3'和H R-1:5'-TGCATAACCTACGGTGTGTT-3'。反应体系:总体积 25μL,其中 ddH2O 13μL、5 ×buffer 5μL、50μ m dNTP 2μL、10mM 引物各 1μL、Taq 酶 1μL ﹑ DNA 模板2μL。循 环参数:94℃ 5min;94℃ 1min,55℃1min,72℃1min,循环 40次;72℃7min。PCR产物用1.5%琼脂糖凝胶电泳检测。
1.3.2 单层细胞的制备 取处于对数生长期的Hep-2细胞,调整细胞密度至3×105/mL;将悬液加入细胞培养瓶或24孔板(内置13mm灭菌圆盖玻片,每孔加 1mL)中,置37℃,5%CO2培养箱中培养12~24h。
1.3.3 Cpn的培养:取 PCR初筛阳性的标本50HZ超声裂解10s,800r/min离心5min;单层细胞上加入少量含有 DEAE(终浓度 30μ g/mL)的DMEM培养基,37℃温箱孵育10min;取超声裂解后的标本上清加入细胞培养瓶或24孔板后2 000r/min,25℃离心30min;弃上清后加入维持培养基,置35℃,5%CO2培养箱培养72h。
1.4 菌株的鉴定
1.4.1 Giemsa染色 按 1∶9比例取Giemsa母液和Sorensen缓冲液(pH6.98)混合配成工作液;50%丙酮固定细胞后用Giemsa染液染色15min;倒置显微镜下观察结果,计数包涵体形成单位(inclusion forming units,IFU)。
1.4.2 间接免疫荧光(IF)染色:50%丙酮固定细胞后加入稀释后的一抗(Cpn鼠单克隆抗体),37℃孵育1h;洗板后加入稀释后的二抗(FITC标记羊抗鼠IgG),37℃避光孵育1h,洗板后荧光显微镜下观察结果,计数IFU。
1.4.3 16SrDNA序列测定与系统发育分析 取少量接种后72h的细胞,提取DNA模板后进行PCR扩增(方法同初筛),将扩增产物送上海生工测序。将测定所获得的16SrDNA序列输入GenBank,用Blast程序与数据库中的序列进行比较分析;经ClustalX程序进行多重序列比对后,用MEGA4.1软件构建系统发育树。
1.5 Cpn的连续传代
1.5.1 包涵体数目﹥5个按以下方法进行传代①弃去生长培养基,加入150μL SPG培养基;②刮取单层细胞移至细胞瓶和24孔板后按上述方法培养72h;③取24孔板单层细胞计数IFU。
1.5.2 包涵体数目为1~5个按以下方法进行传代①弃去生长培养基,加入150μL SPG培养基;②刮取单层细胞移至细胞瓶后按前述方法培养72h;③盲传若干代后将单层细胞接种到24孔板计数IFU。
1.5.3 未观察到包涵体的细胞应盲传若干代后进行包涵体计数,如仍未观察到包涵体则放弃传代,如观察到包涵体则按上述方法进行传代。
1.6 毒力实验
1.6.1 实验动物 远系交配鼠龄6w左右的BALB/c雄性小鼠30只,体重18~25 g。接种菌株组按接种的方法不同分为鼻饲接种组(9只)和静脉接种组(9只);根据不同的处死时间(天数)各分为3个小组,分别为第3、7、15d组,每个小组3只小鼠。对照组按接种的方法不同分为鼻饲接种组(6只)和静脉接种组(6只),根据不同的处死时间各分为3个小组,分别为第3、7和15d组,每个小组2只小鼠。
1.6.2 接种方法 用Cpn悬液以鼻饲和静脉途径接种实验组小鼠,鼻饲接种组先用乙醚吸入诱导小鼠过度通气,每只小鼠于吸气相时向鼻孔内滴入50μL接种物。静脉接种组将小鼠固定后通过尾静脉注射接种物50μL。鼻饲接种组的每只小鼠给予约3×106IFU/mL的 Cpn悬液,静脉接种组的每只小鼠给予约4×106IFU/mL的Cpn悬液。对照组每只小鼠均接种50μL PBS。
1.6.3 接种后每天观察小鼠的活动及进食等情况。至预定实验结束时间,小鼠在乙醚麻醉下用眼球摘除方法处死。取左侧肺用10%中性甲醛固定,再用石蜡包埋,切片和苏木素-伊红(HE)染色;光镜下观察病理变化特征。
2 结 果
2.1 标本初筛 PCR产物片段大小为474bp左右视为初筛阳性。从292例标本中共筛出阳性标本15例,均用于Cpn分离培养。
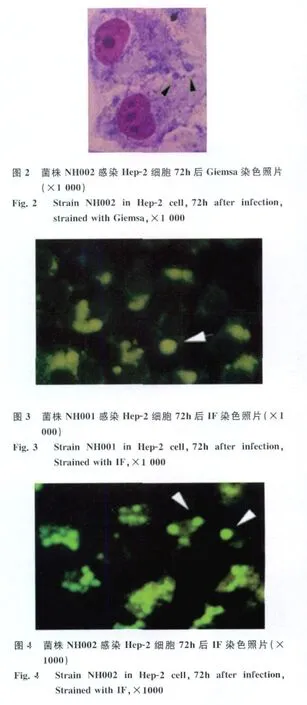
2.2 Giemsa染色鉴定 用Giemsa染色法对接种后标本进行鉴定,结果两份标本为阳性,分离出的菌株分别命名为NH001和NH002。光学显微镜(×1000)下可见圆形或卵圆形、与细胞核相距较远、着色较深的包涵体(图1-2箭头所示),经3次传代后计数 IFU分别为3.8×104和4.8×104。

图1 菌株 NH001感染Hep-2细胞72h后Giemsa染色照片(×1 000)Fig.1 Strain NH001 in Hep-2 cell,72h after infection,Strained with Giemsa,×1 000.
2.3 IF染色鉴定 用IF染色法对接种后标本进行鉴定,结果与 Giemsa染色鉴定结果一致,即NH001和NH002为阳性。荧光显微镜(×1000)下可见散布的果绿色荧光,其中呈圆形、位于细胞轮廓内侧的为包涵体(图3-4箭头所示)。经3次传代后计数IFU分别为2.2×104和2.6×104。
2.4 16SrDNA序列分析与系统发育分析 分别以NH001和NH002菌株基因组DNA为模板,用引物H L-2和H R-1对其进行扩增,得到大小约474bp的产物。测序结果通过NCBI BLAST数据库与已知序列进行比对,结果显示NH001和NH002菌株与多个Cpn种同源性分别达96%和93%以上。通过MEGA4.1软件计算分析,构建 NH001和NH002的系统发育树。结果显示菌株NH001和NH002均与Cpn形成一个簇群(图5、6)。结合Giema和IF染色鉴定结果,将其鉴定为Cpn。

图5 基于16SrDNA序列同源性构建的系统发育树(NH001)Fig.5 Phylogenetic tree of strain NH001 based on 16S rDNA sequences homology.Evolutionary distances showed in the figure were calculated by MEGA4.1;Bootstrap=1000.Bar,0.001 substitution per nucleotide.
2.5 Cpn感染后小鼠的一般情况 接种后小鼠全部存活,对照组小鼠进食﹑活动均无异常表现。接种NH001和NH002菌株组均在接种后8h左右开始出现竖毛、寒战等症状,活动度降低,进食减少;第1~6d上述症状进一步加重;第7d开始逐渐缓解,至12d上述症状消失。鼻饲接种组症状均较静脉接种组重,接种NH001和NH002菌株后小鼠的症状未见明显差异。第15d称取小鼠重量,接种菌株组比对照组轻约1/4~1/3。

图6 基于16SrDNA序列同源性构建的系统发育树(NH002)Fig.6 Phylogenetic tree of strain NH002 based on 16S rDNA sequences homology.Evolutionary distances showed in the figure were calculated by MEGA4.1;Bootstrap=1000.Bar,0.001 substitution per nucleotide.
2.6 病理改变 小鼠肺组织切片:HE染色后镜下观察结果:对照组小鼠肺部均未出现明显病理改变(图7.1)。接种NH001和NH002菌株组都出现肺泡间隔明显增厚,淋巴细胞和单核细胞浸润,为明显“间质性肺炎”改变;其中均以鼻饲接种7d组病理改变(图7.2、7.3)最为严重,病变范围达2~3个肺叶,管腔内有少量渗出。其中1只鼻饲接种NH002菌株的小鼠还合并有支气管壁充血、中性粒细胞浸润,管腔内充满渗出物等病变,为“支气管化脓性”改变(图7.4)。

图7 小鼠肺组织切片(HE染色,×200)7.1鼻饲接种PBS后7d;7.2鼻饲接种NH001菌株后7d;7.3、7.4鼻饲接种 NH002菌株后7d。Fig.7 Micrographs of the lung tissues in the mice(HE staining,×200)。7.1 M ouse lung sections 7 day after intranasal inoculation with PBS.7.2 Mouse lung sections 7 day after intranasal inoculation with NH001.7.3、7.4 Mouse lung sections 7 day after intranasal inoculation with NH002
3 讨 论
迄今为止,人们对Cpn的生物学、遗传学了解甚少[5],Cpn是公认对生长条件较苛刻的微生物之一,难以从初始标本中分离培养成功。我们参照国外经验,通过对培养条件的不断优化,目前已能较稳定的进行Cpn分离培养。
Cpn能否从临床标本中成功分离在很大程度上取决于标本的质量。目前临床上常用的一些抗生素如大环内酯类能杀灭Cpn,因此2w内使用过大环内酯类药物的患者标本不宜用于Cpn培养。由于藻酸钙拭子、棉拭子和木棒等能抑制Cpn的生长,因此采集鼻咽部或口腔标本时最好使用涤纶拭子、铝棒或塑料棒。在采集咽拭子标本过程中应尽量避免混合痰液,这是由于痰对单层细胞有毒性作用而影响Cpn的培养。衣原体的生物活性在蔗糖和谷氨酸中保持较好,故标本应用衣原体转运培养基收集并在4℃转运。最常用的转运培养基有蔗糖-磷酸盐-谷氨酸缓冲液(SPG)和2蔗糖-磷酸盐缓冲液(2SP)。标本获得后应立即用于接种。研究表明:Cpn放置1d,在室温下损失99%的传染性滴度;放置4℃损失30%;直接于-75℃冻存,滴度损失近61%;-75℃冻存前放置4℃0.5~4h,其传染性滴度减少约23%[6]。
Cpn为专性细胞内寄生,因此选择敏感的细胞系非常重要。HeLa、BHK-21、McCoy、HL 和 Hep-2细胞均能用于Cpn接种,但目前大多数学者认为HL和Hep-2细胞在敏感性和稳定性方面是最适合培养Cpn的细胞系[7-8]。接种时单层细胞密度过大对于Cpn接触细胞表面不利,同时会造成营养物质的抢夺,从而影响Cpn的生长;细胞密度过小容易造成标本的丢失。根据我们的经验,Hep-2细胞在接种前细胞融合达70%~80%较为合适。
Cpn是通过吞噬作用进入宿主体内的,感染性原体吸附到宿主细胞表面是Cpn感染的第一步。研究发现DEAE预处理单层细胞能增加衣原体与宿主细胞之间的相互作用,同时也可增强衣原体在细胞膜上的穿透作用。本研究采用的DEAE工作浓度为30μ g/mL,在此浓度下 IFU显著增加。对宿主细胞代谢的选择性抑制是Cpn在宿主细胞生长的先决条件,其机理可能是使宿主细胞代谢减低,从而为Cpn提供更多的营养成分[3]。本研究采用的是具有动物蛋白合成抑制功能的放线菌酮,工作浓度为0.8μ g/mL。离心也是分离培养Cpn的必要条件,其机制可能是由于离心力促进Cpn与单层宿主细胞接触,从而有利于Cpn进入细胞膜,本研究选用2 000r/min,25℃离心30min。另有报道[9]以下方法能提高Cpn在Hep-2细胞中的生长效率:单层细胞用7%聚乙二醇(Polyethylene glycol,PEG)预处理;延长培养时间至7d;分别在第3d﹑4d﹑5d对细胞进行离心。这些措施单独使用时分别使IFU增长了2、5和69倍,而联合使用可使IFU增长300倍以上。
本研究通过建立Cpn感染的小鼠模型,证实了BALB/c小鼠接种NH001和NH002菌株后可产生自限性间质性肺炎,尤其以鼻饲接种组更为明显,这与人类感染Cpn的途径相似。1例NH002鼻饲接种组小鼠出现支气管化脓性,我们考虑这是由于Cpn感染引起小鼠免疫力下降,从而合并其他致病菌所致,其具体机制尚待进一步研究。
我们在实验过程中也遇到一些困难,比如在292份标本中仅检出PCR阳性标本15例,阳性比例比以往报道的小,这可能是由于:①抗生素的广泛使用使得临床上Cpn近期感染人数下降;②在标本采集与转运中一些不确定因素影响了标本的质量。在分离培养的过程中也出现了接种标本后宿主细胞污染,从而导致培养失败的教训。本研究采用了加大抗生素用量和加入其它抗生素等方法,经试验发现4倍浓度的链霉素和两性霉素B作用6h效果较好,部分标本可排除污染;其它一些抗生素如头孢类亦可控制部分标本的污染。
〔1〕Hermann C,G raf K,Groh A,et al.Comparison of eleven commercial tests for Chlamydia pneumoniae-specific immunoglobulin G in asymptomatic healthy individuals〔J〕.J Clin Microbiol,2002,40(5):1603-1609.
〔2〕陈丽丽,吴移谋,雷达,等.泌尿生殖道沙眼衣原体omp1基因多态性研究〔J〕.微生物学报,2006,46(2):214-218.
〔3〕Maass M,Harig U.Evaluation of culture conditions used for isolation of Chlamydia pneumoniae〔J〕.J Clin Pathol,1995,103(2):141-148.
〔4〕Campbell LA,Perez MM,Hamilton D J,et al.Detection of Chlamy dia pneumoniae by polymerase chain reaction〔J〕.J Clin Microbiol,1992,30(2):434-439.
〔5〕胡旃,陈虹亮,吴移谋,等.肺炎嗜衣原体基因组学研究进展〔J〕.中国人兽共患病学报,2009,25(3):276-278.
〔6〕Campbell LA,Kuo CC.Cultivation and laboratory maintenance of Chlamy dia pneumoniae〔J〕.Curr Protoc Microbiol,2009,Chapter 11:Unit11B.1.
〔7〕Cles LD,Stamm WE.U se of HL cells for improved isolation and passage of Chlamy dia pneumoniae〔J〕.J Clin Microbiol,1990,28(5):938-940.
〔8〕Roblin P M,Dumornay W,Hammerschlag M R.Use of Hep-2 cells for improved isolation and passage of Chlamy dia pneumoniae〔J〕.J Clin Microbiol,1992,30(8):1968-1971.
〔9〕T jhie J H,Roosendaal R,MacLaren DM,et al.Improvement of growth of Chlamy dia pneumoniae on Hep-2 cells by pretreatment with polyethylene g lycol in combination with additional centrifugation and extension of culture time〔J〕.Clin Microbiol,1997,35(7):1883-1884.

