从废旧锂离子电池中回收制备 LiCoO2
谷 芳,李俊生
(1.哈尔滨商业大学食品工程学院化学中心,哈尔滨 150076;2.哈尔滨商业大学环境工程系,哈尔滨 150076)
1990年日本 SONY公司开发研制出锂离子电池 .此后,锂离子二次电池得到了迅猛的发展.锂离子电池由于高能量密度,质量轻,寿命长,无记忆效应等优点受到日益广泛的应用.作为“绿色能源”的锂离子二次电池有一定的寿命,一般为 3 a左右,所以锂离子二次电池将成为未来固体废物中不可忽视的部分.由于锂离子二次电池中含有一定量的钴,而钴又是稀缺资源,对环境还有一定程度的危害.如何妥善处理它们,将是人们面临的一大环保问题.
在国外,SONY[1]等公司已提出了从废旧锂离子二次电池中回收钴化合物的方案.此外国外的许多研究者[2-6]也进行了相关方面的研究,提出了回收废旧锂离子电池中钴和锂的不同方案.吴芳[7]通过碱溶解 -酸寖等一系列方法回收废旧锂离子二次电池中的钴和锂.秦毅红[8]等人研究了通过有机溶剂分离法处理废旧锂离子二次电池.提取出的钴和锂以离子或者化合物的形式存在,但大多数是合成了不能再应用于锂离子二次电池的材料Churl[9]等人通过机械分离 -煅烧 -酸寖 -溶胶 -凝胶法合成了锂离子二次电池的活性物质 Li CoO2,并可以继续应用于锂离子二次电池,但过程过于复杂,不适合大规模回收.本文用比较简单的工艺对废旧锂离子二次电池进行了回收处理,并合成了LiCoO2.
1 实验部分
1.1 废旧锂离子电池中正极材料的分离
除去电池的外包装和金属外壳,得到卷式结构电芯,电芯由负极、正极、隔膜和电解液组成.正极由铝箔和负载于其上的正极活性物质(钴酸锂)、导电剂和黏合剂组成.剥离正极上的物质并研磨成粉末,置于马弗炉中煅烧,除去正极材料中的导电剂和黏合剂.
1.2 正极材料中钴和锂的回收
将煅烧后的粉末在硝酸中进行溶解,在硝酸的作用下,钴酸锂电极中的钴和锂发生还原反应溶解在溶液中,反应过程中加入过氧化氢不断补充氢离子.其浸出反应如下:
6HNO3+2LiCoO2+2H2O2=2LiNO3+2Co(NO3)2+5H2O+4O2↑
1.3 钴酸锂粉末的合成
在最佳滤取条件下得到含有钴和锂的滤液,加入适量氨水和 LiOH·H2O,搅拌静止 30m in后,褐色浑浊沉淀产生,过滤烘干称重,得到前驱体.将前驱体置于马弗炉中煅烧得到 LiCoO2黑色粉末.用XRD检测黑色粉末的主要成分.
2 实验结果
2.1 最佳溶解条件的确定
钴酸锂电极粉末在硝酸溶液中进行溶解,其主要影响因素包括:硝酸浓度、溶解温度、溶解时间、质量浓度、过氧化氢用量.
2.1.1 硝酸浓度的确定
取 1g钴酸锂粉末分别溶于 50 m L 0.1、0.3、0.5、1、2mol/L的硝酸溶液中,加入 8mL过氧化氢在 75℃的水浴锅中加热 1 h,滤去残渣,烘干后测取残渣质量,计算容积率.溶解率随硝酸浓度变化如图1所示.
由图1可以看出钴酸锂的溶解率在 0.1mol/L时溶解度较小,在硝酸浓度超过 1mol/L以后溶解率变化不大,根据实际经济情况选择 1mol/L的硝酸为最佳的浓度.
2.1.2 适宜温度的确定
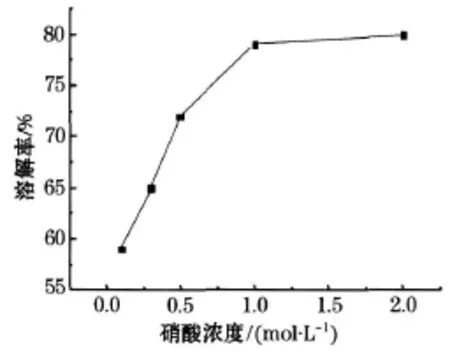
图1 溶解率随硝酸浓度变化曲线
LiCoO2在硝酸溶液中的溶解过程是一个在固液非均相体系中进行的还原分解的化学反应过程.取 1 g钴酸锂粉末溶于 50mL、1mol/L的硝酸溶液中,再加入 8 mL过氧化氢分别于 25、40、50、75、85、95℃的温度下反应 1 h后滤出残渣,烘干称重后计算出溶解率,溶解率随加热温度变化如图2所示.
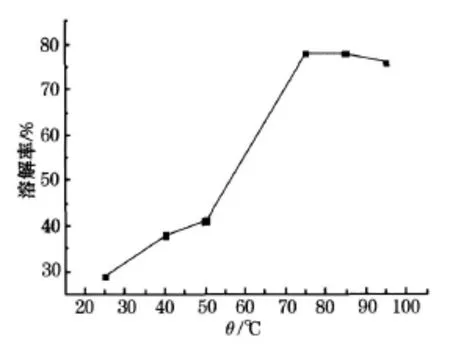
图2 溶解率随加热温度变化曲线
由图2可看出钴酸锂在 25℃时溶解率过低,在75℃后开始增大.随着温度的升高,浸取时间明显缩短,而浸取反应速率逐渐增大,但在 95℃后溶解率变化不明显,所以选择最佳溶解温度为 75℃
2.1.3 适宜固液比的确定
固液比是钴酸锂粉末的质量与硝酸体积的比值,单位:g/L.分别取 0.5、1、2、4、5 g的钴酸锂粉末与 1 mol/L的硝酸 100 m L,16 mL过氧化氢,在75℃的水浴锅中加热 1h,滤去残渣计算出溶解率溶解率随固液比的变化如图3所示 .
由图3可以看出:固液比为 50 g/L的时候钴和锂的溶解率过低,从 20 g/L时开始增大,在达到5 g/L后溶解率达到最大值.所以选则最佳固液比为5 g/L.
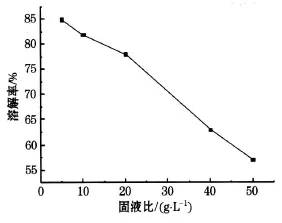
图3 溶解率随质量浓度变化曲线
2.1.4 适宜溶解时间的确定
将 1 mol/L的硝酸 100mL,16 mL过氧化氢与1 g的钴酸锂粉末在 75℃的恒温水浴锅中分别反应 10、30、60、90、120 min,将残渣滤出后计算出溶解率,溶解率随溶解时间的变化如图4所示.
由图4可以看出,10min时钴酸锂的溶解率较小,在 30 min后平稳升高,60min后平稳不变,因为固体颗粒表面的氢离子浓度迅速降低,氢离子向固体颗粒表面的扩散程度比不上反应速度,溶解反应转换为由扩散步骤控制,当达到一定程度后反应趋于平缓[4].所以选择最佳加热时间为 60min.
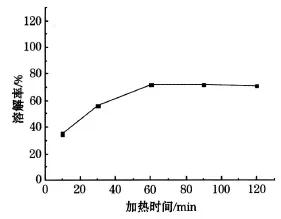
图4 溶解率随加热时间变化曲线
2.1.5 适宜过氧化氢量的确定(H2O2/HNO3)
由于 LiCoO2的溶解是电化学溶解.在没有加入过氧化氢的时候钴酸锂溶解与酸性溶液中,自身可能发生氧化还原反应,随着反应的进行溶液中的H+浓度降低,不变化条件下溶液中达到一种平衡状态,溶解率停止增加,而加入过氧化氢后,溶解反应速度与程度明显提高,这表明过氧化氢对反应起到了促进作用.
将 1 mol/L的硝酸 100mL与 1 g的钴酸锂粉末在 75℃的恒温水浴锅中反应,分别加入与硝酸体积比为 0.02、0.04、0.08、0.12、0.16、0.20的过氧化氢反应 1 h.将残渣滤去后计算出溶解率,溶解率随过氧化氢与硝酸体积比的变化如图5所示.
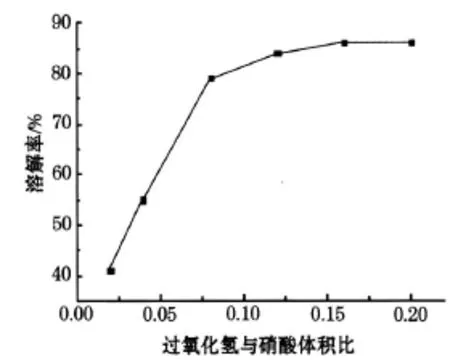
图5 溶解率随过氧化氢与硝酸体积比变化曲线
由图5可以看出 H2O2/HNO3为 0.02时溶解率过小,当达到 0.12时溶解率平稳升高,到0.16时达到最大值,所以选择最佳 H2O2/HNO3比为 0 16.
综上最佳溶解条件为:1 mol/L的硝酸,在75℃中加热 60 min,固液比的值为 5(g/L),过氧化氢与硝酸的体积比(H2O2/HNO3)为 16.
2.2 钴酸锂材料的合成
在最佳溶解条件下溶解废旧电池的正极材料,向得到的滤液中加入不同体积的氨水及 0.2 LiOH·H2O,得到的滤出固体质量见表1.
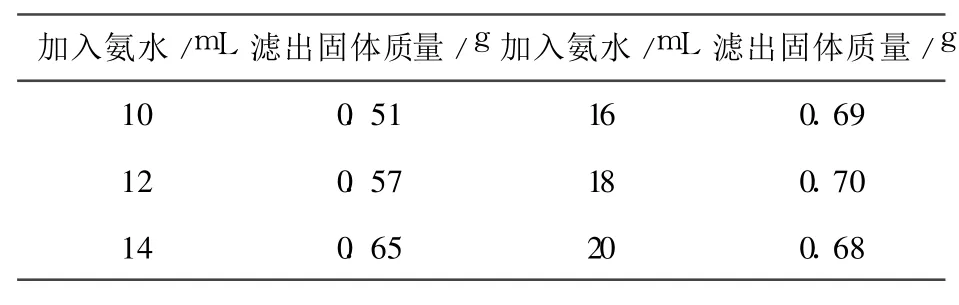
表1 氨水体积对析出固体质量的影响表
由表1可看出在最佳实验条件下获取的滤液在加入18mL氨水后能最大程度的反应,即获得了最大质量的固体.说明该条件可将滤液中的钴和锂最大限度地沉淀出来.
将过滤后获得的固体粉末,置于坩埚中在马福炉内 900℃高温煅烧 1 h,得到黑色粉末,为了检验合成的正极活性物质的成分,将实验得到的正极活性材料粉末用 X-射线衍射的方法检测其成分.X-射线衍射图谱如图6.
由图6可以看出:滤液中加入 LiOH·H2O后,经过干燥,煅烧得到的粉末物质经过 X-射线衍射测试后,主要的峰是 LiCoO2,可知经过上述方法制备的物质主要成分是 LiCoO2.
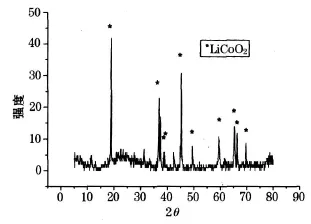
图6 煅烧后黑色粉末的 XRD图谱
3 结 语
将废旧锂离子电池的正极材料在硝酸中进行溶解,主要目的是将钴和锂以离子形式转移到溶液中,将钴酸锂中的杂质进行分离.最佳溶解条件为:硝酸的浓度 1 mol/L,质量浓度 5 g/L,反应温度 75℃,反应时间 1 h,H2O2/HNO3为 0.16.1 g正极活性材料实验最后获得的最佳溶解率为 78.4%.向得到的滤液中加入 18 mL氨水,1.1倍所含离子质量的氢氧化锂,生成前驱体,将前驱体过滤后与900℃下煅烧,得黑色粉末,经 XRD检测主要成分为钴酸锂.
目前手机等各种便携设备的电源主要以锂离子电池为主,而且电源的使用是有一定年限的.所以随着手机及各种便携设备使用的普及,废旧锂离子电池的数量越来越多,商品化锂离子电池中的正极材料主要是 LiCoO2,其中的钴不仅价格昂贵而且污染环境.通过对废旧锂离子电池中的有价值金属离子钴和锂进行回收,不仅可以缓解废旧电池带来的环境污染问题,同时再生的钴酸锂还可以进行利用,所以废旧锂离子电池的回收具有一定的经济和社会效益.
[1] LAIN M J.Recycling of lithium ion cellsand batteries[J].Power Sources,2001(97-98):736-738.
[2] FREITASM B,GARCIA EM.Electrochemical recycling of cobalt from cathodes of spent lithium-ion batteries[J].Powe Sources,2007(171):953-959.
[3] LUIPC,ASQUALIM P,DELLERA A.Nickel and cobalt recycling from lithium-ion batteries by electrochem ical processe[J].Waste Management,2005(25):215-220.
[4] XU JQ,THOMASH R,ROBW F,et al.A review of processe and tecnologies for the recycling of lithium-ion secondary batteries[J].Power Sources,2008(177):512-527.
[5] RA D I,HAN K S.Used lithium ion rechargeable battery recycling using Etoile-Rebatt technology[J].Power Sources,2006,163:284-288.
[6] CARLA L P,MAURO T P.Electrolytic nickel recovery from lithium ion batteries[J].Minerals Engineering,2003(16):537-542.
[7] 吴 芳.从废旧锂离子二次电池中回收钴和锂[J].中国有色金属学报,2004,14(4):697-701.
[8] 秦毅红,齐 申.有机溶剂分离法处理废旧锂离子电池[J]有色金属(冶炼部分),2006(1):13-16.
[9] CHURL K L,RHEE K I.Preparation of LiCoO2from spent lithium-ion batteries[J].Power Sources,2002,109:17-21.

