复元胶囊对硝普钠诱导的软骨细胞凋亡与细胞周期作用的实验研究
周小莉,李荣亨(重庆医科大学附属第一医院中西医结合科,重庆市 400016)
复元胶囊对硝普钠诱导的软骨细胞凋亡与细胞周期作用的实验研究
周小莉*,李荣亨#(重庆医科大学附属第一医院中西医结合科,重庆市 400016)
目的:研究复元胶囊含药血清对硝普钠(SNP)诱导的软骨细胞凋亡与细胞周期的作用。方法:雄性3周龄SD大鼠,用于分离培养软骨细胞;雄性成年SD大鼠,用于制备含药血清。将第2代的软骨细胞进行分组实验。透射电镜观察软骨细胞凋亡的超微结构,流式细胞仪检测细胞周期百分率及细胞凋亡率,硝酸还原酶法检测培养液中NO含量。结果:复元胶囊含药血清可使SNP诱导的软骨细胞处于G0/G1期的百分比减少,S期及G2/M期的百分比增加(P<0.05,P<0.01);可使细胞凋亡率显著降低(P<0.05或P<0.01),培养上清中NO含量显著降低(P<0.05)。结论:复元胶囊含药血清能显著降低SNP诱导的软骨细胞凋亡率,促进细胞增殖,并降低培养液中NO的含量,这可能是复元胶囊防治骨性关节炎的作用机制之一。
复元胶囊;软骨细胞;中药;细胞凋亡;细胞周期;一氧化氮
关节软骨退行性病变是骨关节炎(Osteoarthritis,OA)发病的中心环节,近年研究表明,随着增龄,关节软骨细胞凋亡增加,细胞密度显著降低,软骨变性、丢失,继之邻近软骨增生、骨化而形成骨关节病变,故软骨细胞凋亡在关节软骨退行性改变过程中起着重要作用[1,2]。复元胶囊是临床上长期用于治疗OA有明显疗效的中药复方医院制剂,由人参、淫羊藿、鹿茸、黄芪、川芎、当归、枸杞子等组成,具有补益肝肾、益气活血之功效,对气虚血瘀证患者症状、血液流变学有改善作用,可缓解疼痛,改善OA关节功能[3],但其作用机制尚不十分清楚。本研究采用透射电镜、流式细胞仪及硝酸还原酶法观察复元胶囊含药血清对硝普钠(Sodium nitroprusside,SNP)诱导的体外培养的软骨细胞凋亡、细胞周期以及培养上清中一氧化氮(Nitric oxide,NO)水平的影响,探讨其防治OA的作用机制。
1 仪器与材料
1.1 仪器
SW-CJ-2A型净化工作台(重庆汇诚空调净化设备制造公司);2001-13型二氧化碳培养箱(上海常思工贸有限公司);IX-700型倒置相差显微镜(日本Olympus公司);FACS Calibur流式细胞分析仪(美国Becton Dickinson公司);HITACHI-7500型透射电镜(日本Hitachi公司);生物分光光度计(德国Eppendorf公司)。
1.2 试药
复元胶囊委托重庆希尔安药业有限责任公司制成胶囊,仅供实验使用(批号:090312);SNP(北京双鹤现代医药技术有限责任公司,批号:H111021635);DMEM/F12 1∶1培养基(FD培养基)、胎牛血清(美国Hyclone公司);Ⅱ型胶原酶(美国Sigma公司);胰蛋白酶(美国Gibico公司);PBS缓冲液(北京中杉金桥生物技术有限公司);碘化丙锭(PI)染色剂(深圳晶美生物工程有限公司);NO硝酸还原酶法试剂盒(南京建成生物工程研究所)。
1.3 动物
3周龄SD大鼠10只,♂,体质量40~60 g;成年SD大鼠30只,♂,体质量200~250 g,均由重庆医科大学实验动物中心提供(动物生产许可证号:SYXK(渝)2002007)。
2 方法
2.1 软骨细胞的分离、培养及传代[4]
将3周龄SD大鼠断颈处死后,无菌条件下分离出股骨头软骨,尽量剔除周围组织,浸入含青霉素和链霉素的双抗水中漂洗3次,浸入FD培养基中漂洗3次,再次清除软骨周围附带组织,将软骨剪成1 mm3大小,移入0.25%胰蛋白酶中,放入37℃水浴箱中消化30 min,胎牛血清终止消化,PBS缓冲液清洗2遍,再加入0.2%Ⅱ型胶原酶中,放入37℃水浴箱消化4 h成絮状,其间每30 min轻轻摇荡1次,1 000 r·min-1离心5 min,弃上清,PBS缓冲液清洗2遍,加入含15%胎牛血清FD培养基制成细胞悬液,用200目不锈钢筛网过滤后接种于培养瓶中,置于37℃、5%CO2培养箱进行原代培养。原代细胞长满80%后传代培养。用于实验的软骨细胞为第2代的传代细胞。
2.2 含药血清的制备
成年SD大鼠30只,随机分成2组,即复元胶囊组(20只)、空白组(10只)。复元胶囊组按Meeh-Rubner公式给予等效剂量10倍量药物,充分溶于生理盐水;空白组给予等剂量的生理盐水,ig给药,每天2次,连续3 d。末次ig后2 h腹主动脉取血,4 ℃静置过夜,3 000 r·min-1离心20 min,取上清,经0.22µm抽滤器除菌后,分装,-20℃贮藏,备用。
2.3 分组
选用第2代软骨细胞种植于培养瓶中培养24 h,待细胞贴壁后,用不含血清的FD培养基“饥饿”培养24 h,使细胞同步化。分为空白组(FD培养基培养)、模型组(2 mmol·L-1SNP+FD培养基培养)、10%空白血清组(2 mmol·L-1SNP+10%空白血清+FD培养基培养)、5%复元胶囊血清组(2 mmol·L-1SNP+5%复元胶囊含药血清+FD培养基培养)、10%复元胶囊血清组(2 mmol·L-1SNP+10%复元胶囊含药血清+FD培养基培养)、20%复元胶囊血清组(2 mmol·L-1SNP+20%复元胶囊含药血清+FD培养基培养)。
2.4 透射电镜观察软骨细胞凋亡的超微结构
按“2.3”项下进行分组,继续培养48 h后,收集培养上清,用胰酶将细胞消化后收集于离心管。在4℃条件下以2 000 r·min-1离心成细胞团块,用2.5%戊二醛固定2 h,1%四氧化锇再固定1.5 h,经梯度丙酮脱水,环氧树脂浸透包埋,超薄切片机切片,电子染色,透射电镜下观察。
2.5 流式细胞仪分析细胞周期
收集细胞(酶消化法),PBS洗涤1遍,加70%乙醇,振荡(4℃贮藏)。上机前离心去除固定液,PBS洗2遍,加1 mL PBS重悬细胞,加20 μL RNAse(10 mg·mL-1)使之终浓度为200 μg·mL-1,37 ℃放置30 min以上。加入碘化丙啶,使其终浓度为50 μg·mL-1,避光30 min;300目尼龙网过滤,于流式细胞仪检测,计数10 000个细胞,分析细胞周期。
2.6 流式细胞分析法检测软骨细胞凋亡
用胰酶将细胞消化后,收集于离心管。在4℃条件下以2 000 r·min-1离心成细胞团块,按AnnexinV-FITC/PI试剂盒说明书进行操作,采用FACS Aria流式细胞分析仪检测,每个样本检测计数的细胞数量均固定为10 000个,应用CEL LQuest软件获取、分析输出实验数据。
2.7 硝酸还原酶法检测培养血清中NO浓度
收集各组培养液,采用硝酸还原酶法检测血清中NO浓度,操作按说明书进行,并按照试剂盒说明书推荐的公式计算NO含量。
2.8 统计学方法
3 结果
3.1 原代培养软骨细胞形态
原代软骨细胞接种时为圆形悬浮状态。48 h后,细胞大部分贴壁,呈圆形或椭圆形,体积较小。经Ⅱ型胶原细胞免疫组化鉴定为软骨细胞。软骨细胞形态见图1。

图1 软骨细胞形态A.倒置显微镜(×100);B.SP染色(×200)Fig 1 Morphology of chondrocyteA.inverted microscope(×100);B.SP(×200)
3.2 透射电镜下对软骨细胞超微结构的观察
正常软骨细胞核完整,核膜清晰,核内染色质均匀分布,粗面内质网呈层状排列,线粒体散在分布,细胞表面有许多微绒毛突起。早期凋亡细胞体积缩小,细胞膜完整,细胞表面的微绒毛明显减少,甚至消失,细胞浆致密,细胞器完整,核染色质浓缩,集聚于核膜下;中晚期凋亡细胞体积明显缩小,核膜发生皱褶,胞质密度增高,有典型的凋亡小体,内有细胞器,细胞周围可见脱落的凋亡小体;坏死细胞肿胀,不完整,细胞质内可见水泡,甚至细胞溶解,无完整的细胞器。模型组软骨细胞主要为凋亡细胞和坏死细胞,可见少量正常细胞;中药组以正常细胞和早期凋亡细胞为主。
3.3 复元胶囊含药血清对软骨细胞周期的影响
与模型组和空白组血清比较,复元胶囊血清处理后的细胞处于G0/G1期的百分比减少,S及G2/M期的百分比增加,增殖指数(PI)显著增加,差异有统计学意义(P<0.05或P<0.01)。3个浓度复元胶囊血清,以10%的复原胶囊血清作用最显著。复元胶囊含药血清对软骨细胞周期的影响见表1。

图2 软骨细胞超微结构(TEM×6 000)A.正常细胞;B.早期凋亡细胞;C.中晚期凋亡细胞;D.坏死细胞Fig 2 The ultrastructure of chondrocyte(TEM×6 000)A.normal cells;B.apoptosis cells in the early stage;C.apoptosis cells in advanced stage;D.necrotic cells
表1 复元胶囊含药血清对软骨细胞周期的影响(±s)Tab 1 Effects of serum containing Fuyuan capsule on cell cycle progression of chondrocyte(±s)

表1 复元胶囊含药血清对软骨细胞周期的影响(±s)Tab 1 Effects of serum containing Fuyuan capsule on cell cycle progression of chondrocyte(±s)
与空白组比较:*P<0.05,**P<0.01;与模型组比较:#P<0.05,##P<0.01vs.blank group:*P<0.05,**P<0.01;vs.model group:#P<0.05,##P<0.01
组别空白组模型组10%空白血清组5%复元胶囊血清组10%复元胶囊血清组20%复元胶囊血清组PI/%15.81±1.51 6.62±1.14*20.95±1.40#22.61±1.23**#29.20±1.70*#23.10±0.74*#n 5 5 5 5 5 5 G0/G1/%85.18±1.58 93.40±1.14*80.05±0.71#77.39±1.23**#70.60±1.38*#76.50±1.21*##S/%5.30±0.63 3.50±0.35**10.30±0.75#11.57±0.96#17.42±0.42*#14.21±1.10*#G2/M/%9.70±0.15 3.31±0.17**9.90±0.65#11.20±0.84#11.74±1.38*#9.10±0.39*#
3.4 复元胶囊含药血清对SNP诱导的软骨细胞凋亡及培养液中NO含量的影响
与模型组血清比较,复元胶囊含药血清组细胞凋亡率显著降低,培养液中NO含量显著减少(P<0.05或P<0.01)。3个浓度复元胶囊血清,以10%、20%的血清作用最显著,但两者之间差异无统计学意义(P>0.05)。复元胶囊含药血清对软骨细胞凋亡及培养液中NO含量的影响见表2。
4 讨论
OA在祖国医学属于“痹证”、“骨痹”范畴,肾元亏虚、肝血不足、气虚血瘀是导致本病的根本内因。中医药治疗OA有着悠久的历史,因其效果显著、副作用小、适合长期治疗而独具优势。复元胶囊是临床上长期用于治疗OA有明显疗效的中药复方制剂,笔者前期工作发现,复元胶囊含药血清可促进正常软骨细胞的增殖、DNA及Ⅱ型胶原合成[5]。本实验从复元胶囊对软骨细胞凋亡的角度进一步探讨其作用机制。
OA是以关节软骨基质降解为特征的退行性关节疾病,软骨细胞过度凋亡在其发病过程中起着重要作用。本研究结果表明,经SNP诱导的软骨细胞在透射电镜下可观察到典型的凋亡形态,包括细胞体积缩小、染色质凝聚、核碎片、细胞皱缩、凋亡小体等。流式细胞仪检测发现,复元胶囊含药血清能降低软骨细胞凋亡率,与模型组及空白血清组比较,差异有统计学意义。复元胶囊含药血清能抑制软骨细胞的过度凋亡,可能是复元胶囊治疗骨关节炎的重要机制之一。
表2 复元胶囊含药血清对软骨细胞凋亡及培养液中NO含量的影响(±s)Tab 2 Effects of serum containing Fuyuan capsule on the SNP-induced apoptosis of chondrocytes and NO in the culture supernatant(±s)
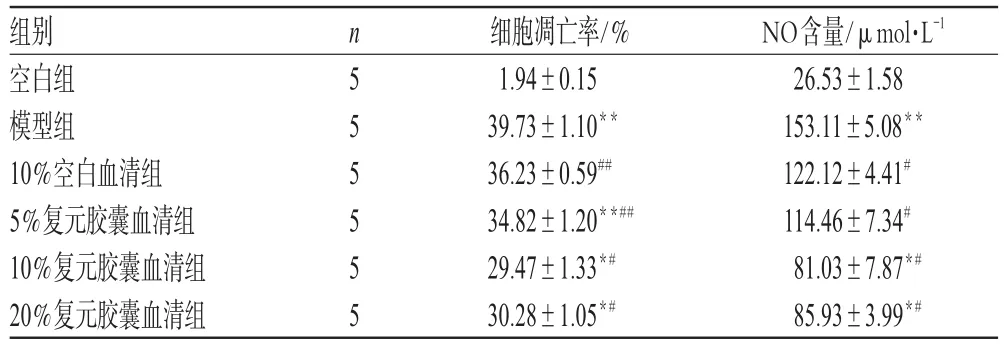
表2 复元胶囊含药血清对软骨细胞凋亡及培养液中NO含量的影响(±s)Tab 2 Effects of serum containing Fuyuan capsule on the SNP-induced apoptosis of chondrocytes and NO in the culture supernatant(±s)
与空白组比较:*P<0.05,**P<0.01;与模型组比较:#P<0.05,##P<0.01vs.blank group:*P<0.05,**P<0.01;vs.model group:#P<0.05,##P<0.01
组别空白组模型组10%空白血清组5%复元胶囊血清组10%复元胶囊血清组20%复元胶囊血清组n 5 5 5 5 5 5细胞凋亡率/%1.94±0.15 39.73±1.10**36.23±0.59##34.82±1.20**##29.47±1.33*#30.28±1.05*#NO含量/μmol·L-1 26.53±1.58 153.11±5.08**122.12±4.41#114.46±7.34#81.03±7.87*#85.93±3.99*#
细胞周期与细胞中DNA含量密切相关,DNA含量随着细胞周期的各期而发生变化。细胞的周期分布能够反映细胞增殖的具体过程。PI是S期与G2期DNA含量之和同S期、G2期及G1期DNA含量之和的比值,它与S期百分比是反映细胞增殖的重要指标[6]。本研究结果显示,复元胶囊血清处理后的细胞处于G0/G1期的百分比减少,S期及G2/M期的百分比增加,PI明显增加,表明复元胶囊能调节细胞周期分布,促进细胞增殖。
用NO供体SNP诱导建立软骨细胞凋亡模型已成为一种常用的实验手段[7]。研究发现SNP诱导细胞凋亡可能存在以下关系:低浓度时抑制细胞凋亡,高浓度时引起细胞凋亡,过高浓度时引起细胞坏死[8]。而OA关节中NO抑制软骨细胞增殖,促进软骨细胞凋亡,使关节软骨中细胞数量减少,关节修复功能下降[9]。所以,通过抑制NO的产生来抑制软骨细胞的过度凋亡可能是一条治疗OA的途径。本研究结果显示,2 mmol·L-1浓度的SNP作用于软骨细胞48 h能诱导软骨细胞凋亡率升高,伴随有培养液中NO浓度增加。当笔者用复元胶囊含药血清干预后,软骨细胞凋亡率明显降低并伴有培养液中NO含量降低,提示复元胶囊可能通过降低NO含量而抑制软骨细胞过度凋亡。
本研究初步揭示了复元胶囊含药血清抑制软骨细胞凋亡、调节凋亡细胞周期的作用,但只是在细胞水平上的阐述。至于其有效成分是如何抑制细胞凋亡,它作用于细胞膜上的何种受体,以及信号如何在细胞内进行传导,是需要进一步研究的问题。
[1]Kim DY,Taylor HW,Moore RM.Articular chondrocyte apoptosis in equine osteoarthritis[J].Vet J,2003,166(1):52.
[2]Kimura T.Progress of research for osteoarthritis,An ov-erview of the recent knowledge on osteoarthritis:pathogenesis,evaluation and therapies[J].Clin Calcium,2009,19(11):1 565.
[3]王晚霞,胡文兴,李荣亨.复元胶囊对气虚血瘀患者症状、血液流变学及心功能的影响[J].重庆医科大学学报,33(11):1 320.
[4]司徒镇强,吴军正.细胞培养[M].第1版.西安:世界图书出版公司,2004:61.
[5]胡文兴,周小莉,李荣亨.复元胶囊含药血清对软骨细胞增殖与合成代谢的影响[J].中国中医基础医学杂志,2008,14(4):32.
[6]陈鸿雁,王 驰,舒 艳,等.苦参碱与3种抗肿瘤药物联合作用对KBV200耐药细胞株细胞周期的影响[J].中国药房,2006,17(7):500.
[7]张 梅,李 平,汪 健,等.马钱子对三种软骨细胞凋亡模型的影响[J].中国骨伤,2005,18(7):410.
[8]Kim HA,Lee KB,Bae S.The mechanism of low-concentration sodium nitro prusside mediated protection of chondrocyte death[J].Arthritis Reseach&Therapy,2005,7:R526.
[9]Vuoheenaho K,Moilanen T,Knowles RG,et al.The role of nitric oxide in osteoarthritis[J].J Rheumatol,2007,36(4):247.
Effects of Fuyuan Capsule on SNP-induced Apoptosis of Chondrocyte and Cell Cycle Progression
ZHOU Xiao-li,LI Rong-heng(Dept.of Integrated Traditional and Western Medicine,The First Affiliated Hospital of Chongqing Medical University,Chongqing 400016,China)
OBJECTIVE:To study the effects of the serum containing Fuyuan capsule on sodium nitroprusside(SNP)-induced apoptosis of chondrocyte in vitro and cell cycle progression.METHODS:The chondrocyte of 3-week-old male SD rats were separated and cultivated.Male SD rats were included in the preparation of serum containing Fuyuan capsule.The second generation of chondrocyte was involved in experiment.TEM and flow cytometer were adopted to observe ultrastructure of apoptotic chondrocyte and detect cell cycle progression and apoptosis rate.NO examination adopted nitrare reductase method.RESULTS:The serum containing Fuyan capsule could significantly decrease the percentage of SNP-induced apoptosis in G0/G1phase and increase percentage in S phase and G2/M phase(P<0.05,P<0.01).The apoptosis of chondrocyte was decreased significantly(P<0.05,P<0.01).The concentration of NO in the culture supernatants was reduces significantly(P<0.05).CONCLUSION:The serum containing Fuyuan capsule could promote proliferation of chondrocyte,inhibit SNP-induced apoptosis of chondrocyte,and reduce the concentration of NO in the culture supernatants.It is an important mechanism of Fuyuan capsule preventing osteoarthritis.
Fuyuan capsule;Chondrocyte;Traditional Chinese medicine;Apoptosis;Cell cycle;NO
R285.5;R97
A
1001-0408(2010)39-3661-04
2009-12-05
2010-04-12)

