牛支原体双重PCR检测方法的建立
刘 洋,李 媛,董 惠,张美晶,姜海芳,陈 维,辛九庆*
(1.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/动物细菌病研究室/国家牛传染性胸膜肺炎指定检测实验室,黑龙江哈尔滨 150001;2.东北农业大学动物医学学院,黑龙江哈尔滨 150001)
牛支原体双重PCR检测方法的建立
刘 洋1#,李 媛1#,董 惠2,张美晶1,姜海芳1,陈 维2,辛九庆1*
(1.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/动物细菌病研究室/国家牛传染性胸膜肺炎指定检测实验室,黑龙江哈尔滨 150001;2.东北农业大学动物医学学院,黑龙江哈尔滨 150001)
为鉴别牛支原体(Mycoplasma bovis)与丝状支原体丝状亚种SC(M.mycoidessubsp.mycoides SC),本实验通过优化M.bovis特异性引物pMB81-1/pMB81-2s和MmmSC特异性引物SC1/SC2的退火温度,建立了鉴别M.bovis和MmmSC的双重PCR检测方法。该方法能够分别由M.bovis和MmmSC扩增得到528 bp和270 bp片段。敏感性试验结果显示该方法检测M.bovis和MmmSC培养物的最低浓度分别为106cfu/mL和105cfu/mL。特异性试验结果显示,该方法对无乳支原体代表株PG2、丝状支原体丝状亚种LC型代表株Y-goat、山羊支原体山羊肺炎亚种Mccp、绵羊支原体Y-98、猪鼻支原体BST-7、巴氏杆菌以及结核分枝杆菌扩增结果均为阴性。应用该方法对临床病料的检测结果与培养鉴定结果的符合率为100%,表明该方法具有良好的特异性和敏感性,可以应用于临床检测。
牛支原体;丝状支原体丝状亚种SC;双重PCR
#共同第一作者:刘 洋(1983-),男,黑龙江齐齐哈尔人,硕士研究生,主要从事动物支原体病研究;
李 媛(1972-),女,山东海阳人,助理研究员,主要从事动物分子流行病学与诊断学研究.
*通信作者:E-mail:xinjiuqing2001@sohu.com
牛支原体(Mycoplasma bovis)属支原体科支原体属,可引起犊牛肺炎、乳腺炎、角膜炎和关节炎,是危害犊牛的重要病原体[1]。牛传染性胸膜肺炎(Contagious bovine pleuropneumonia)简称牛肺疫,是由与M.bovis同属的丝状支原体丝状亚种SC型(M.mycoidessubsp.mycoides SC)引起的烈性传染病,被世界动物卫生组织(OIE)列为必须呈报疾病。1961年Hale在美国首次从一例患乳腺炎的牛乳中分离出M.bovis[2]。目前,M.bovis已呈全球流行,给养牛业造成严重损失[3,7]。2008年4月,我国南方爆发了以发热、咳嗽及呼吸困难为主要特征的牛肺炎样传染病疫情,经鉴定病原体为M.bovis,而不是MmmSC[4]。自2008年以来,本实验室在内蒙古等北方地区分离到M.bovis,表明该病已在我国流行。
M.bovis所导致的牛呼吸道相关疾病的临床症状及病理特征与牛肺疫极为相似,严重干扰了我国无牛肺疫认证进程[3-4]。因此,需要一种可以快速鉴别诊断M.bovis与牛肺疫的检测方法。本实验通过优化退火温度等条件建立了可以同时鉴别检测M.bovis和MmmSC的双重PCR方法,为我国无牛肺疫认证以及M.bovis相关疾病诊断提供技术支持。
1 材料和方法
1.1 菌 株M.bovis湖北分离株(HB)由本实验室分离并鉴定[4]。MmmSC标准株PG1、丝状支原体丝状亚种LC型(M.mycoidessubsp.mycoides LC)Y-goat株、绵羊肺炎支原体(M.ovipneumonia)Y-98株及无乳支原体(M.agalactiae)PG2株均购自中国兽医药品监察所;临床病料均来自于各地方送检牛肺脏病料,由本实验室培养鉴定为M.bovis阳性;多杀性巴氏杆菌(P.multocida,PM)、猪鼻支原体(BST-7)和山羊肺炎支原体(M.capricolumsubsp.Capripneumoniae,Mccp)由本实验室保存;牛结核分枝杆菌(Mycobacterium bovis,MB)基因组DNA由中国农业科学院哈尔滨兽医研究所细菌室刘思国研究员提供。
1.2 主要试剂 组织/细胞DNA(小量)抽提试剂盒购自上海华舜生物技术公司;rTaq酶购自宝生物工程(大连)有限公司。
1.3 引物设计 选用MmmSC的公开引物SC1/SC2[5]和文献[6]中M.bovis的上游引物 pMB81-1,参考GenBank中登录的M.bovisp81基因序列,设计下游引物 pMB81-2s(表 1)。

表1 引物序列Table 1 Primers sequences of PCR
1.4 菌体培养与基因组提取 将PG1和HB株接种含10%马血清的马丁肉汤培养基中,37℃培养至108cfu/mL~109cfu/mL。分别取纯培养物按组织/细胞DNA(小量)抽提试剂盒说明书提取基因组DNA。
1.5 最佳退火温度选择 以HB和PG1株等比例混合的基因组DNA为模板,退火温度分别设置为47℃、52℃和57℃,进行PCR反应。20 μL体系:混 合 模 板 1 μL,SC1/SC2、 pMB81-1/pMB81-2S 各0.002 pmol, dNTP Mixture 0.004 μmol, 10 ×PCR Buffer 2 μL,灭菌去离子水 13.6 μL,rTaq酶 1 U。反应条件:94℃5 min;94℃ 45 s、退火温度下40 s、72℃1 min,35个循环;72℃10 min。
1.6 特异性试验 按优化的PCR条件,分别对各菌种基因组DNA(HB、PG1、PM、PG2、BST-7、Y-goat、Mccp、MB和BST-7)进行双重PCR扩增,琼脂糖凝胶电泳观察结果。
1.7 敏感性试验 将纯培养物稀释至浓度为108cfu/mL、107cfu/mL、106cfu/mL和105cfu/mL,分别进行双重PCR扩增,凝胶电泳观察结果。将PG1和HB株的基因组DNA等比例混合加入体系中,检测混合感染情况下该方法的敏感性。
1.8 临床病料样品检测 提取病原培养鉴定为M.bovis阳性病料的基因组DNA,用本实验建立的双重PCR方法进行检测并与培养鉴定结果进行比较分析。
2 结果
2.1 退火温度的优化 将退火温度分别设为47℃、52℃和57℃进行双重PCR扩增。当退火温度为47℃和57℃时,在240 bp左右处扩增出一条非特异性片段。退火温度为52℃时,针对M.bovis的528 bp片段和针对MmmSC的270 bp片段扩增效率较高且无杂带。因此,最佳退火温度确定为52℃(图1)。

2.2 特异性试验 以优化的退火温度检测该方法对PM、PG2、BST-7、Y-goat、Mccp、MB、Y-98的特异性。结果显示:PG1和HB均扩增出特异性片段,PM、PG2、BST-7、Y-goat、Mccp、MB、Y-98均无扩增片段。表明该方法对MmmSC和M.bovis特异性良好,与其它病原无交叉反应(图2)。

2.3 敏感性试验 单一模板情况下,该方法可以检测出HB株基因组DNA和PG1株基因组DNA最低浓度分别为106cfu/mL和105cfu/mL;混合模板情况下,可以检出最低浓度分别为106cfu/mL的各基因组 DNA(图 3)。
2.4 临床病料的检测 应用本方法检测临床病料样品,并将检测结果与培养鉴定结果相比较。结果显示,该双重PCR鉴定结果与病原培养鉴定结果符合率为100%(表2)。证明本方法可以准确地检测出病料中的M.bovis和MmmSC,可代替病原培养鉴定应用于临床样品检测。
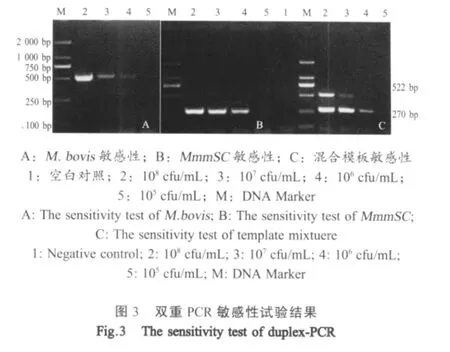

表2 双重PCR与病原培养符合试验Table 2 The coincidence test of duplex-PCR and culture tests
3 讨论
M.bovis常与其它病原体混合感染,但实验室做常规病原学诊断时,由于M.bovis需要特殊培养基,如果不做特殊要求,一般不检测M.bovis,这可能是M.bovis流行病学调查数据与实际发病情况不符的原因。M.bovis可引起犊牛肺炎、乳腺炎、角膜炎和关节炎[7-8],临床症状及病理变化与牛肺疫相似[3]。两者存在血清学交叉反应,这给无牛肺疫认证进程造成严重干扰。因此,需要建立一种高特异性、高敏感性的快捷鉴别检测方法。
多重PCR具有高效、快捷、经济、简便等优点,已广泛应用于病原学诊断[9-10]。Foddai等建立了检测无乳支原体和M.bovis的多重PCR方法,证明多重PCR方法可以被应用于M.bovis的检测[11]。因此,逐步建立可同时检测多种病原的多重PCR方法是牛呼吸道相关传染病病原鉴别诊断的发展方向之一。本实验建立了可同时鉴别检测M.bovis和MmmSC的双重PCR方法,敏感性试验结果表明该方法敏感性较高,而且可以在PG1和M.bovis混合感染时检测出最低菌体拷贝数为106cfu/mL的培养物。本方法与MmmLC、Mccp代表株、结核杆菌、无乳支原体和巴氏杆菌均无交叉反应,证明该方法的特异性良好。PCR检测临床病料试验结果与病料培养鉴定结果完全符合,表明该方法能够准确鉴别检测M.bovis和MmmSC,可应用于临床诊断。本研究建立的双重PCR方法能够缩短病原诊断周期,提高临床检测的工作效率,为我国M.bovis病诊断和无牛肺疫认证提供技术支持。
[1]Pfutzner H,Sachse K.Mycoplasma bovisas an agent of mastitis,pneumonia,arthritis and genital disorders in cattle[J].Rev Sci Tech,1996,15(4):1477-1494.
[2]Hale H H,Helmboldt C F,Plastridge W N,et al.Bovine mastitis caused by aMycoplasmaspecies[J].Cornell Vet,1962,52:582-591.
[3]Maunsell F P,Donovan G A.Mycoplasma bovisinfections in young calves[J].Vet Clin Food Anim,2009,25:139-177.
[4]辛九庆,李媛,郭丹,等.国内首次从患肺炎的犊牛肺脏中分离到牛支原体[J].中国预防兽医学报,2008,30(9):661-664.
[5]Dedieu L,Mady V,Lefever P C.Development of a selective polymerase chain reaction assay for the detection ofMycoplasma mycoidessubsp.mycoides SC(contagious bovine pleuropneumonia agent)[J].Vet Microbiol,1994,42:327-339.
[6]李媛,董惠,辛九庆,等.牛霉形体PCR检测方法的建立[J].中国兽医科学,2009,39(05):416-420.
[7]Nicholas R A J,Ayling R D.Mycoplasma bovis:disease,diagnosis,and control[J].Res Vet Sci,2003,74:105-112.
[8]Walz P H,Mullaney T P,Render J A,et al.Otitis media in preweaned Holstein dairy calves in Michigan due toMycoplasma bovsi[J].J Vet Diagn Invest,1997,27:117-122.
[9]Markoulatos P,Georgopoulou A,Siafakas N,et al.Laboratory diagnosis of common herpesvirus infections of the central nervous system by a M-PCR assay[J].J Clin Microbiol,2001,39:4426-4432.
[10]朱吕昌.猪胸膜肺炎放线杆菌、多杀性巴氏杆菌、副猪嗜血杆菌复合PCR检测方法以及猪胸膜肺炎放线杆菌PCR-ELISA检测方法的建立[D].硕士论文,江苏:扬州大学,2009.
[11]Foddai A,Idini G,Fusco M,et al.Rapid differential diagnosis ofMycoplasma agalactiaeandMycoplasma bovisbased on a multiplex-PCR and a PCR-RFLP[J].Mol Cell Probes,2005,19:207-212.
Establishment of a duplex-PCR assay for detecttion ofMycoplasma bovis
LIU Yang1#,LI Yuan1#,DONG Hui2,ZHANG Mei-jing1,JIANG Hai-fang1,CHEN Wei2,XIN Jiu-qing1*
(1.State Contagious Bovine Pleuropneumonia Designated Detection Laboratory,Division of Bacterial Diseases,State Key Laboratory of Veterinary Biotechnology,Harbin Veterinary Research Institute,Chinese Academy of Agricultural Sciences,Harbin 150001,China;2.College of Veterinary Medicine,Northeast Agricultural University,Harbin 150001,China)
Mycoplasma bovisis a primary agent of respiratory disease which has similar sydromes and pathology characters to the contagious bovine pleuropneumonia caused byM.mycoidessubsp.mycoides SC(MmmSC).In this study,a duplex-PCR assay was established for the differential detection ofM.bovisandMmmSCusing primers specific toM.bovisandMmmSC,repectively.The duplex-PCR had a detection limit of 106cfu/mL forM.bovisand 105cfu/mL forMmmSC.It specifically amplified a DNA fragment of 528 bp from theM.bovisand 270 bp from theMmmSCtype strain PG1,and no PCR products were amplified from theMycoplasma agalactiaetype strain PG2,Mycoplasma mycoidessubsp.mycoides LCtype strain Y-goat,M.capricolumsubsp.Capripneumoniae,M.ovipneumoniatype strain Y-98,M.hyorhinis,Pasteurella multocidaandMycobacterium.The method was applied to detect clinical samples and the results showed 100%consistence with those of the bactera culture test.
Mycoplasma bovis;Mycoplasma mycoidessubsp.mycoidesSC;duplex-PCR
S852.6
A
1008-0589(2010)08-0599-04
10.3969/j.issn.1008-0589.2010.08.05
*Correspondingauthor;#Equal contributors
2009-12-07
兽医生物技术国家重点实验室基本科研业务费(NKLVBP200809)
(本文编辑:张朝霞、杨朋欣)

