牙鲆dmrt1基因的克隆及其与P450arom基因的组织表达分析
文爱韵, 尤 锋 孙 鹏 徐冬冬 吴志昊 马得友 李 军张培军
(1. 中国科学院 海洋研究所 中国科学院实验海洋生物学重点实验室, 山东 青岛 266071; 2. 中国科学院 研究生院, 北京 100039)
牙鲆dmrt1基因的克隆及其与P450arom基因的组织表达分析
文爱韵1,2, 尤 锋1, 孙 鹏1, 徐冬冬1, 吴志昊1, 马得友1, 李 军1,张培军1
(1. 中国科学院 海洋研究所 中国科学院实验海洋生物学重点实验室, 山东 青岛 266071; 2. 中国科学院 研究生院, 北京 100039)
通过基因组步移和3’RACE获得了牙鲆 (Paralichthys olivaceus)dmrt1的cDNA全序列, 该基因开放阅读框全长 909bp, 其编码的蛋白具有高度保守的 DM 结构域, 5’UTR区含有性别相关转录因子Sox9和Sox5的结合位点。牙鲆dmrt1基因只在牙鲆的性腺中表达, 且在精巢中的表达明显高于卵巢,表明牙鲆的dmrt1可能是一种性别相关基因。同时, 对牙鲆的另一性别相关基因P450arom在成体各组织的表达分析结果表明, 该基因除在牙鲆的性腺中有表达外, 在肾脏、脾脏、鳃和脑等其他组织中也有不同程度的表达。牙鲆P450arom基因在性腺中的表达也存在两性差异, 其表达模式与dmrt1的正好相反, 在卵巢中的表达量明显高于精巢。
牙鲆(Paralichthys olivaceus);dmrt1;P450arom; 两性差异表达
dmrt(doublesexandmab-3-related transcription factor) 基因家族含有一个高度保守的锌指样 DNA结合基序 DM 结构域, 一些成员在脊椎动物和非脊椎动物的许多物种中都参与了性别决定[1]。其中,dmrt1是目前发现从果蝇(Drosophila melanogaster)、线虫(Caenorhabditis elegans)到小鼠(Mus musculus)、人(Homo sapiens)唯一保守的性别相关基因, 可能是动物性别决定与性腺发育的主效基因之一[2]。dmrt1基因已经在很多鱼类如斑马鱼(Danio rerio)和罗非鱼(Oreochromis niloticus)等中进行了克隆和表达研究, 发现其位于常染色体上, 仅在性腺中表达, 且大多数都呈两性差异表达, 在精巢中的表达量高于卵巢, 表明该基因可能与精巢发育相关[3,4]。但在海水鱼类中, 有关dmrt1基因的报道比较少, 仅见到在石斑鱼(Epinephelus merra)和黑鲷(Acanthopagrus schlegeli)等中的相关研究, 结果也显示出精巢表达强于卵巢的两性差异[5~7]。P450arom基因属于细胞色素氧化酶基因的一种, 其编码产物芳香化酶是催化雄激素向雌激素转化的一个关键酶, 能够催化某些雄激素(如睾酮和雄烯二酮)转化为雌激素。鱼类中有关P450arom基因的克隆和表达研究也已在青 (Oryzias latipes)、罗非鱼和石斑鱼等中进行了报道, 其表达谱显示出与雌性性腺的相关性, 即在卵巢强表达, 而在精巢中的表达较弱[8~10]。
牙鲆(Paralichthys olivaceus)是中国主要的海水鱼类养殖品种, 雌鱼比相应的雄鱼大[11], 培育单一雌性群体, 可以大大提高单位面积的产量, 因而相关的性别决定及性腺发育分子机制的研究也备受重视。有关牙鲆性别相关基因的克隆和表达只见于日本学者的有关P450arom[12]、foxl2[13]和amh[14]这 3个基因的报道。其他鲆鲽鱼性别相关基因的报道则主要有半滑舌鳎(Cynoglossus semilaevis)的dmrt1[15]和P450arom[16]基因以及南方牙鲆(Paralichthys lethostigma)[17]和大西洋鲽(Hippoglossus hippoglossus)[18]的P450arom基因的克隆和初步表达研究。而作为唯一在不同物种间保守的雄性性别相关基因,dmrt1基因在牙鲆中还没有见到研究报道。本研究在克隆得到牙鲆dmrt1基因的基础上, 对该基因和P450arom基因在牙鲆成鱼各组织的差异表达进行研究, 并比较它们在性腺中的两性表达差异, 明确其与牙鲆雌雄性别的相关性, 为牙鲆等鲆鲽鱼类的性别决定机制的研究奠定基础。
1 材料和方法
1.1 牙鲆组织样品的获得
成熟牙鲆雌雄各3尾(全长30 cm±5 cm)购于山东省青岛市南山水产市场, 在中科院海洋所水族培育楼暂养, 然后解剖成鱼腹部, 取出各组织, 立即储存于液氮用于RNA的提取。
1.2 基因的克隆与分析
运用基因组步移和 3’RACE的方法进行牙鲆dmrt1基因的克隆。第一次基因组步移用接头引物(1,2见表1)和兼并引物(3,4见表1)通过巢式PCR的方法从基因组文库中得到的基因片段, 将其连接到PGM-T载体上进行测序, 序列经 NCBI序列比对(http://www.ncbi.nlm.nih.gov/tblastx), 确定为dmrt1基因片段; 再根据得到的基因片段设计基因特异性引物(5~10见表 1), 通过多次基因组步移和一次 3’RACE的巢式PCR扩增, 得到的基因片段拼接起来, 经序列比对分析, 最终获得牙鲆dmrt1基因的cDNA全序列。巢式PCR条件: (1)94℃ 25 s, 72℃ 3 min; 94℃ 25 s,67℃ 3 min, 32 个循环; 67℃ 7 min; (2) 94℃ 25 s,72℃ 3 min, 5个循环; 94℃ 25 s, 67℃ 3 min, 20个循环; 67℃ 7 min。基因启动子区转录因子结合位点通过网上的预测工具 MATCH PROGRAM(www.gene-regulation.com/pub/programs.html#match)中的TRANSFAC 6.0数据库进行预测。
根据得到的牙鲆dmrt1基因cDNA序列, 运用网上翻译工具获得了牙鲆Dmrt1蛋白序列(www.expasy.ch)。用 CLUSTALW(www.ebi.ac.uk)进行蛋白比对,进化树的构建是采用软件CLUSTAL X和MEGA3对发表在GenBank上的各个物种的Dmrt1蛋白序列和牙鲆 Dmrt1蛋白序列进行比对聚类分析而完成的。分子系统进化分析和进化树构建所用的均为全长蛋白序列, 并应用泊松分布进行进化距离验证。
1.3 RT-PCR表达研究
RNA 的提取: 取 100 mg组织样品, 加 1 mL Trizol(购自美国Invitrogen公司), 用研磨棒研碎后再用加样枪反复吹打, 充分破碎样品; 加200 μL氯仿,用力混匀, 室温放置 3 min, 12 000 相对离心力,4℃离心 15 min; 取上清, 缓慢加等体积异丙醇, 室温放置10 min, 12 000 相对离心力, 4℃离心10 min;除去上清, 加1 mL 70%的乙醇洗涤沉淀, 7 500 相对离心力, 4℃离心 5 min; 除去上清, 室温干燥, 加DEPC水溶解RNA; 用RNase free DNase(购自大连Takara公司)消化总RNA中的DNA, 37℃水浴30 min,然后65℃水浴10 min, 终止反应; 电泳检测RNA的纯度。

表1 Genome walking、3’RACE和RT-PCR所用引物Tab. 1 Primers used in genome walking, 3’RACE, and RT-PCR
cDNA第一链的合成: 在 1.5 mL 的 PCR 管中依次加入 1 μL Oligo dT(10 mmol/L), 4 μL DNase 处理的RNA(1 μg/μL), 用Nuclease-free water(购自上海生工公司)补至 13 μL; 70 ℃热变性 5 min, 冰浴 2 min后, 稍离心; 再加入5 μL 5×M-MLV 反应缓冲液,5.0 μL 无RNase的dNTP(dATP、dTTP、dCTP和dGTP各 2.5 mmol/L), 1 μL RNase 抑制剂(40 U/μL, 购自大连 Takara 公司), 1 μL M-MLV 反转录酶(200 U/μL,购自美国 Promega公司); 轻弹管壁, 稍离心; 42 ℃反转录1 h。
RT-PCR: 根据作者得到的dmrt1和已发表的P450arom(GenBank accession No. AB017182)的cDNA序列设计了两对基因特异性引物 Dm1rtF和Dm1rtR, 以及 P45rtF和 P45rtR(11~14见表 1), 以反转录得到的成鱼组织cDNA为模板, 检测了dmrt1和P450arom在牙鲆成鱼不同组织的表达。β-actin作为内参对照(15,16见表1)。PCR反应条件是: 94℃ 5 min; 94℃ 30 s, 58℃ 30 s, 72℃ 3 min, 35个循环;72℃ 10 min。
2 实验结果
2.1 牙鲆dmrt1基因的结构
牙鲆dmrt1基因cDNA全序列3373bp(GenBank accession No. EU490514), 其5’UTR中含有与性别相关的转录因子Sox9和Sox5的结合位点, 开放阅读框为 909bp(图 1)。编码的 Dmrt1蛋白序列(GenBank accession No. ACD62474)全长 303aa, 其中 28-87aa为高度保守的DM结构域。

图1 牙鲆dmrt1基因cDNA的结构Fig. 1 cDNA structure of flounderdmrt1gene
2.2 Dmrt1蛋白分子系统进化树
根据GenBank上发表的脊椎动物Dmrt1蛋白序列, 构建了邻接分子系统进化树, 箭头所示牙鲆Dmrt1与半滑舌鳎等其他硬骨鱼类的Dmrt1s聚在了一起(图 2)。
所用 Dmrt1蛋白序列包括: 人(NP_068770.2),小鼠(NP_056641.2), 非洲爪蟾(Xenopus laevis, NM_001096500.1), 四线鼠蛇(Elaphe quadrivirgata,BAD99161.1), 泽鳄(Crocodylus palustris, ACD749-14.1), 中国软甲龟(Pelodiscus sinensis, BAD99160.1),鸡(Gallus gallus, XP_001232983.1), 河豚(NP_001-089969.1), 虹鳟(Oncorhynchus mykiss, NP_0011177-41.1), 三刺棘鱼(Gasterosteus aculeatus, AAW6230-4.1), 斑马鱼(NP_991191.1), 青 (Dmy, NP_001098-150.1; Dmrt1, AAL02165.1), 沼泽鳗(Monopterus albus, AAP80398.1), 北非鲶鱼(Clarias gariepinus,AAQ04554.1), 半滑舌鳎(ABS31368.1), 吕宋青
(Oryzias luzonensis, BAH05021.1), 曼谷青 (Oryzias mekongensis, AAS91464.1), 绿鳍豚(Tetraodon nigroviridis, AAN74844.1), 白鲟(Acipenser transmontanus, AAL18252.1), 蜂巢石斑鱼(Epinephelus merra,ACD62372.1), 银汉鱼(Odontesthes hatcheri, ACG69-835.1), 大西洋鳕鱼(Gadus morhua, ACB97630.1),南方大口鲇(Silurus meridionalis, ABM54575.1), 橙点石斑鱼(Epinephelus coioides, ABK15558.1), 大鳞副泥鳅(Paramisgurnus dabryanus, ABK88911.1), 红树林溪 (Kryptolebias marmoratus, ABG89135.1),弓背青 (Oryzias curvinotus, BAC65996.1), 斑剑尾鱼(Xiphophorus maculatus, AAN65377.1)。
2.3 dmrt1和P450arom基因在牙鲆组织的表达
RT-PCR表达研究结果显示, 牙鲆dmrt1基因仅在性腺中表达, 并且在精巢中的表达明显强于卵巢中的表达。牙鲆P450arom基因在性腺中的表达与
dmrt1基因的表达图式正好相反, 在卵巢中表达很强,
在精巢中的表达极弱。但是, 牙鲆P450arom基因的表达不仅限于性腺, 在肾脏、脾脏、鳃和脑等其他组织中也有不同程度的表达, 具有较广的表达谱(图3)。
3 讨论
dmrt基因家族作为一个保守的性别相关基因家族, 先后在哺乳类、鸟类、爬行类、两栖类和鱼类等脊椎动物中发现。在小鼠、鸡和海龟中的相关研究表明, 该基因家族成员之一dmrt1基因, 是继sry、sox9之后发现的又一重要的雄性性别和精巢发育相关基因[1]。Matsuda等[19]发现了一个只限于在青 精巢中表达的位于 Y染色体上的雄性性别决定基因dmy(double sex/mab-3Domain of Y Chromosome), 它也属于dmrt基因家族, 是dmrt1基因的一个拷贝, 是青 中调控雄性发育的主效基因。在其他鱼类中的初步研究表明,dmrt1基因也参与了雄性性腺的发育。
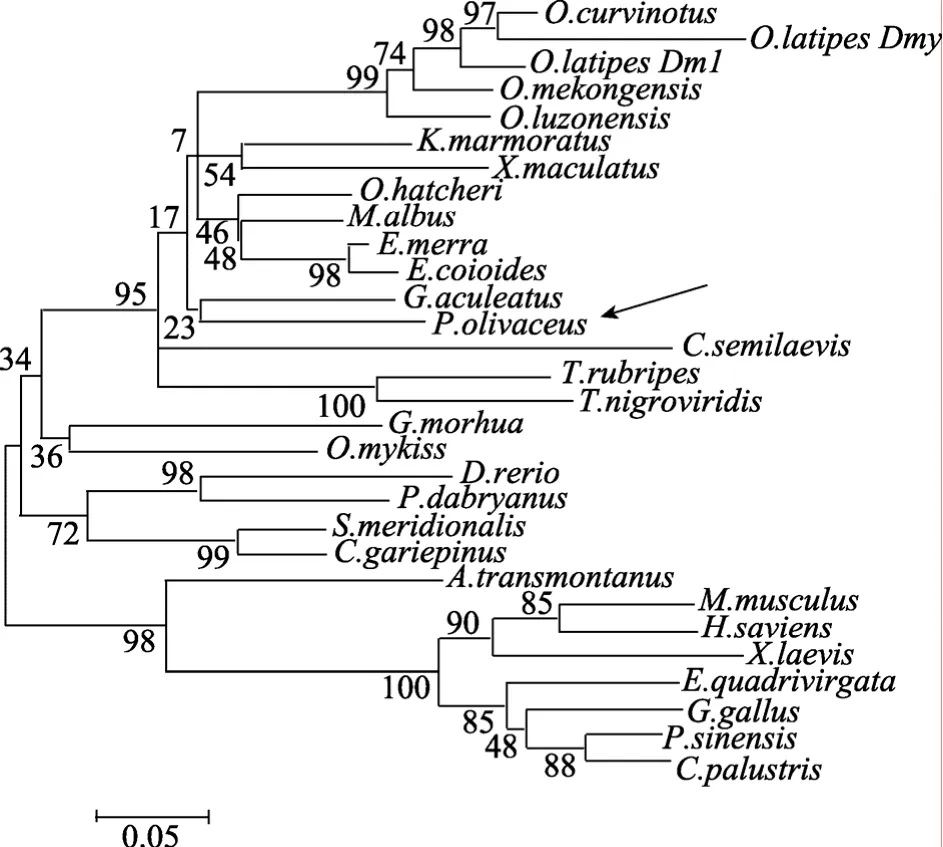
图2 牙鲆Dmrt1蛋白的分子系统进化分析Fig. 2 Phylogenetic analysis of flounder Dmrt1 protein

图 3 牙鲆dmrt1和P450arom基因在成鱼各组织的差异表达Fig. 3 Gene expression patterns of flounderdmrt1andP450aromin tissues
作者克隆得到的牙鲆dmrt1基因cDNA全长为3373bp, 分析发现, 其 5’UTR中含有转录因子 Sox9和Sox5的结合位点, 这些转录因子由性别相关基因编码, 参与了性腺特别是精巢的发育, 因此, 牙鲆dmrt1基因也可能与雄性性别相关。由该基因编码的蛋白也含有dmrt基因家族共有的高度保守的结构域DM域, 该保守结构域与半滑舌鳎、河豚和三刺棘鱼等其他几种硬骨鱼类Dmrt1蛋白的DM结构域的同源性均在95%以上[5,15]。根据包括牙鲆在内的多种脊椎动物 Dmrt1蛋白序列构建的邻接分子系统进化树看出, 牙鲆 Dmrt1蛋白与半滑舌鳎等硬骨鱼类的Dmrt1蛋白聚在了一簇。这些结果说明性别相关转录因子 Dmrt1含有的与所调控的基因启动子区结合的DM结构域, 在鱼类中是高度保守的, 这是该转录因子蛋白发挥其生物学功能所必需的。
在一些鱼类中已经克隆得到了dmrt1基因, 并对该基因在性腺组织中的表达进行了研究。在斑马鱼[3]、罗非鱼[4]、河豚[5]、青[20]、虹鳟[21]等鱼中的研究发现,dmrt1基因均呈现两性差异表达, 在精巢中的表达较强。在海水鱼类中, 也开展了有关dmrt1基因的两性差异表达研究, 蜂斑石斑鱼[6]、黑鲷[7]和半滑舌鳎[15]中的研究表明,dmrt1基因也都局限于性腺中表达, 且精巢中表达强于卵巢。本研究结果显示,牙鲆dmrt1基因也是性腺特异表达的, 并且在两性性腺中的表达程度不同, 其在精巢中的表达远远强于卵巢中的表达。这与其他鱼类中有关dmrt1基因的两性差异表达的研究结果是相似的。说明在鱼类中,dmrt1基因的功能是比较保守的, 参与了性腺特别是精巢的发育过程。
牙鲆P450arom基因也存在两性差异表达, 与dmrt1基因表达的图式正好相反, 卵巢中的表达很强,而精巢中的表达极弱。这一结果与日本学者[13]的报道是一致的, 他们的研究也发现牙鲆P450arom基因在卵巢中强表达, 在精巢中弱表达, 并且在由高温诱导雌核发育群体获得的性反转雄性牙鲆性腺中,该基因的表达也比较弱。其他鱼类如青[8]、尼罗罗非鱼(Oreochromis niloticus)[9]、赤点石斑鱼(Epinephelus akaara)[10]、欧洲海鲈(Dicentrarchus labrax)[22]和黑鲷[23]等的P450arom基因的表达也是类似的, 均存在两性差异表达, 即在卵巢的表达显著强于精巢的表达。在其他鲆鲽鱼类中, 有关P450arom基因的研究也显示了该基因的两性差异表达模式, 在半滑舌鳎[18]、南方牙鲆[19]和大西洋鲽[20]中, 该基因在卵巢的表达明显强于精巢的表达。另外,牙鲆P450arom基因, 与有些鱼如半滑舌鳎和石斑鱼等类似, 是广谱表达的, 也就是其表达不仅限于性腺, 在脾脏和脑等其他组织中也有不同程度的表达[12,18]。这些研究结果说明, 芳香化酶P450arom基因作为一种细胞色素氧化酶基因, 不仅参与了性腺特别是卵巢的发育, 而且在其他一些组织的发育过程中也发挥了作用[8]。
[1] Koopman P. The genetics and biology of vertebrate sex determination [J]. Cell, 2001, 105: 843-847.
[2] Tilmann C, Capel B. Cellular and molecular pathways regulating mammalian sex determination [J]. Recent Progress in Hormone Research, 2002, 57: 1-18.
[3] Jorgensen A, Morthorst J E, Andersen O,et al. Expression profiles for six zebrafish genes during gonadal sex differentiation[J]. Reproductive Biology and Endocrinology, 2008, 6: 25.
[4] Kobayashi T, Kajiura-Kobayashi H, Guan G,et al.Sexual dimorphic expression ofdmrt1andsox9aduring gonadal differentiation and hormone-induced sex reversal in the teleost fish Nile tilapia (Oreochromis niloticus) [J]. Developmental Dynamics, 2008, 237:297-306.
[5] Yamaguchi A, Lee K H, Fujimoto H,et al. Expression of thedmrtgene and its roles in early gonadal development of the Japanese puffer fishTakifugu rubripes[J]. Comparative Biochemistry and Physiology-Part D: Genomics and Proteomics, 2006, 1: 59-68.
[6] Alam M A, Kobayashi Y, Horiguchi R. Molecular cloning and quantitative expression of sexually dimorphic markersDmrt1andFoxl2during female-to-male sex change inEpinephelus merra[J]. General and Comparative Endocrinology, 2008, 157: 75-85.
[7] Shin H S, An K W, Park M S,et al. Quantitative mRNA expression ofsox3andDMRT1during sex reversal, and expression profiles after GnRHa administration in black porgy,Acanthopagrus schlegeli[J]. Comparative Biochemistry and Physiology-Part B: Biochemistry& Molecular Biology, 2009, 154: 150-156.
[8] Zhou L Y, Wang D S, Shibata Y,et al. Characterization,expression and transcriptional regulation ofP450c17-Iand-IIin the medaka,Oryzias latipes[J]. Biochemical and Biophysical Research Communications, 2007,362: 619-625.
[9] Sudhakumari C C, Kobayashi T, Kajiura-Kobayashi H,et al. Ontogenic expression patterns of several nuclear receptors and cytochrome P450 aromatases in brain and gonads of the Nile tilapiaOreochromis niloticussuggests their involvement in sex differentiation[J]. Fish Physiology and Biochemistry, 2005, 31: 129-135.
[10] Huang W, Zhou L, Li Z,et al. Expression pattern, cellular localization and promoter activity analysis of ovarian aromatase (Cyp19a1a) in protogynous hermaphrodite red-spotted grouper[J]. Molecular and Cellular Endocrinology, 2009, 307: 224-236.
[11] Xu JH, You F, Sun W,et al.Induction of diploid gynogenesis in turbotScophthalmus maximuswith left-eyed flounderParalichthys olivaceussperm[J]. Aquaculture International, 2008, 16: 6.
[12] Kitano T, Takamune K, Obayashi T K,et al. Suppression of P450 aromatase gene expression in sex-reversed males produced by rearing genetically female larvae at a high water temperature during a period of sex differentiation in the Japanese flounder (Paralichthys olivaceus)[J]. Journal of Molecular Endocrinology, 1999,23: 167-176.
[13] Yamaguchi T, Yamaguchi S, Hirai T,et al. Follicle-stimulating hormone signaling andfoxl2are involved in transcriptional regulation of aromatase gene during gonadal sex differentiation in Japanese flounder,Paralichthys olivaceus[J]. Biochemical and Biophysical Research Communications, 2007, 359:935-940.
[14] Yoshinaga N, Shiraishi E, Yamamoto T,et al. Sexually dimorphic expression of a teleost homologue of Mullerian inhibiting substance during gonadal sex differentiation in Japanese flounder,Paralichthys olivaceus[J].Biochemical and Biophysical Research Communications, 2004, 322: 508-513.
[15] 邓思平, 陈松林. 半滑舌鳎Dmrt1α基因的cDNA克隆及其表达[J].中国水产科学, 2008, 15(4): 577-584.
[16] Deng S P, Chen S L, Xu J Y,et al. Molecular cloning,characterization and expression analysis of gonadal P450 aromatase in the half-smooth tongue-sole,Cynoglossus semilaevis[J]. Aquaculture, 2009, 287:211-218.
[17] Luckenbach J A, Early L W, Rowe A H,et al. Aromatase cytochrome P450: cloning, intron variation, and ontogeny of gene expression in southern flounder(Paralichthys lethostigma) [J]. Journal of Experimental Zoology Part A: Ecological Genetics and Physiology, 2005, 303: 643-656.
[18] Matsuoka M P, Van Nes S, Andersen O,et al. Real-time PCR analysis of ovary- and brain-type aromatase gene expression during Atlantic halibut (Hippoglossus hippoglossus) development [J]. Comparative Biochemistry and Physiology-Part B: Biochemistry & Molecular Biology, 2006, 144: 128-135.
[19] Matsuda M, Nagahama Y, Shinomiya A,et al.DMYis a Y-specific DM-domain gene required for male development in the medaka fish [J]. Nature, 2002, 417: 559-563.
[20] Kobayashi T, Matsuda M, Kajiura-Kobayashi H,et al.Two DM domain genes,dmyanddmrt1, involved in testicular differentiation and development in the medaka,Oryzias latipes[J]. Developmental Dynamics,2004, 231: 518-526.
[21] Marchand O, Gororoun M, D'Cotta H,et al.DMRTIexpression during gonadal differentiation and spermatogenesis in the rainbow trout,Oncorchynchus[J]. Biochimica et Biophysica Acta, 2000, 1493:180-187.
[22] Blazquez M, Gonzalez A, Papadaki M,et al.Sex-related changes in estrogen receptors and aromatase gene expression and enzymatic activity during early development and sex differentiation in the European sea bass (Dicentrarchus labrax) [J]. General and Comparative Endocrinology, 2008, 158: 95-101.
[23] Wu G C, Tomy S, Nakamura M,et al. Dual roles ofcyp19a1ain gonadal sex differentiation and development in the protandrous black porgy,Acanthopagrus schlegeli[J]. Biology of Reproduction, 2008, 79: 1 111-1 120.
Received: Apr., 6, 2010
Key words:Paralichthys olivaceus;dmrt1;P450arom; sexual dimorphic expression
Abstract:Whole cDNA sequence of olive flounder (Paralichthys olivaceus) dmrt1 gene was obtained using genome walking and 3’RACE methods. The open reading frame of flounder dmrt1 was found to span 909 bp.Sex-related transcriptional factors Sox9 and Sox5 binding sites were identified in its 5’UTR. Flounder Dmrt1 protein had a high conserved DM domain. Expressions of dmrt1 and P450arom genes in flounder tissues were also studied by RT-PCR. The results showed that both genes were sex-related genes. The dmrt1 gene was gonad-specific, and was sexual dimorphic with much higher expression in testis and much lower expression in ovary. The expression of P450arom in gonads was totally opposite to that of dmrt1. It was higher expressed in ovary and lower expressed in testis. Moreover, flounder P450arom had a broad-spectrum expression pattern,being differentially expressed in some other tissues, such as kidney, spleen, gill and brain.
(本文编辑:谭雪静)
Cloning of dmrt1 gene and its tissue expression analyses compared with that of P450arom gene in olive flounder(Paralichthys olivaceus)
WEN Ai-yun1,2, YOU Feng1, SUN Peng1, XU Dong-dong1, WU Zhi-hao1, MA De-you1, LI Jun1, ZHANG Pei-jun1
(1. Key Laboratory of Experimental Marine Biology, Institute of Oceanology, Chinese Academy of Sciences,Qingdao 266071, China; 2. Graduate School, Chinese Academy of Sciences, Beijing 100039, China)
Q75
A
1000-3096(2010)11-0097-06
2010-04-06;
2010-07-16
国家 973项目(2010CB126304); 国家 863计划资助项目(2006AA10A404)
文爱韵(1984-), 女, 四川成都人, 博士, 研究方向为海水鱼类的分子遗传学研究, E-mail: waybio@yahoo.cn

