农杆菌介导的甜瓜蔓枯病菌遗传转化体系的建立
任海英,方丽,李岗,茹水江,王汉荣
1 浙江省农业科学院 植物保护与微生物研究所,杭州 310021
2 浙江省农业科学院 农产品质量标准研究所,杭州 310021
生物技术与方法
农杆菌介导的甜瓜蔓枯病菌遗传转化体系的建立
任海英1,方丽1,李岗2,茹水江1,王汉荣1
1 浙江省农业科学院 植物保护与微生物研究所,杭州 310021
2 浙江省农业科学院 农产品质量标准研究所,杭州 310021
甜瓜蔓枯病是当前危害瓜类的主要病害,严重影响甜瓜的产量和品质,但是蔓枯病菌Didymella bryoniae病原学研究还非常落后,关于该菌功能基因的研究还未见报道。本研究以携带潮霉素 B磷酸转移酶基因(hph) 的pBIG2RHPH2作为转化载体,根癌农杆菌C58C1作为转化介体,转化甜瓜蔓枯病菌的强致病菌株DB11。研究发现,甜瓜蔓枯病菌的最优转化体系为:甜瓜蔓枯病菌的分生孢子悬浮液浓度为1×106个孢子/mL,农杆菌悬浮液OD600为0.15,共培养时间48 h,诱导培养基中添加200 µg/mL乙酰丁香酮,选择培养基添加100 µg/mL潮霉素B、200 µg/mL头孢噻肟钠、200 µg/mL氨苄青霉素和200 µg/mL四环素。1×105个蔓枯病菌分生孢子可以产生45个左右的转化子,随机挑取3个转化子进行PCR和RT-PCR检测发现,在不含潮霉素B的PDA培养基平板上转化子连续培养5代后,hph基因仍能稳定存在和转录,Southern blotting检测发现,T-DNA都是单拷贝插入3个转化子的染色体内。本研究建立的甜瓜蔓枯病菌的转化体系将为该病菌的功能基因研究和寄主与病原菌的互作研究提供重要技术支撑。
甜瓜蔓枯病菌,根癌农杆菌介导的转化,T-DNA插入突变
Abstract:Gummy stem blight, a plant disease caused byDidymella bryoniae,is one of the major diseases in melon. The disease can seriously reduce melon yield and quality. However, little information is available on the genetics and functional genomics of the fungal pathogen. In this study, we developed anAgrobacterium-mediated transformation system forD. bryoniaeby using a universal pathogenic isolate DB11 and theAgrobacterium tumefaciensstrain C58C1 carriing plasmid pBIG2RHPH2 harboring the hygromycin B phosphotransferase gene (hph). Total 45 transformants could be obtained per 1×105spores when 1×106spores per milliliter ofD. bryoniaespore suspension were cocultivated withAgrobacteriumcells atOD600=0.15 for 48 h in the presence of induction medium (pH 5.2) containing acetosyringone at 200 µg/mL and selection medium contained 100 µg/mL of hygromycin B and 200 µg/mL of cefotaxime sodium, ampicillin and tetracycline, respectively. The transformants were stable when grown on PDA medium without hygromycin B for five times and were verified by PCR amplification with thehphprimers and by Southern blot analysis with thehphprobe. The transformation system will be useful for further studies of functional genes inD. bryoniae.
Keywords:Didymella bryoniae,Agrobacteriummediated transformation, T-DNA insertional mutagenesis
甜瓜是我国重要的经济作物,瓜类蔓枯病是当前瓜类生产的主要病害,严重影响甜瓜的产量和品质,在甜瓜的幼苗期至采收期均可发生,侵染植株的地上各部,生育前期易发病,生殖生长盛期最严重[1]。无论是在冬春日光温室,还是早春和秋后大棚栽培均有发生,其危害程度远高于甜瓜枯萎病和甜瓜疫病,在生产上若不及早防治,植株死亡率可达 30%~40%,造成严重减产,是一种严重的全球性真菌病害,侵染黄瓜、西瓜、甜瓜、南瓜和西葫芦等[2],对寄主植物造成不同程度的损害。瓜类蔓枯病菌的有性世代是子囊菌瓜黑腐小球壳菌Mycosphaerella melonis(Passerini) Chiu et Walker,无性态Ascochyta cucumisFautr. et Roum属半知菌瓜叶单隔胞菌[3]。由于该菌器孢子变异大,学名迄今仍未统一,有记载的有Didymella bryoniae、Ascochyta cucumis、A. citrullina、A. melonis、A. cucumeris、Phyllosticta citrullina、P. orbicularia、Sphaerella citrullina、S. melonis、Didymella melonis、Didymospaeria melonis等[3]。但是最近几年的文献以使用D. bryoniae[1,4-5]学名的较多。病菌以子囊壳、分生孢子器、菌丝体潜伏在病残组织上留在土壤中越冬,翌年产生孢子进行初侵染。植物染病后释放出的分生孢子借风雨传播,进行再侵染。7月中旬气温20℃~25℃,潜育期3~5 d,病斑出现4~5 d后,病部即产生小黑粒点。分生孢子在株间传播距离为6~8 m[3]。甜瓜品种间抗病性差异明显:一般薄皮脆瓜属抗病体系,而厚皮甜瓜较感病[3]。蔓枯病菌病原学研究还比较落后。国内外对该病的研究主要集中在菌体培养、产孢、抗性品种筛选、防治药剂筛选以及基于分子标记的分类等[1-8],关于该菌的功能基因以及与寄主的互作研究未见报道。建立一种简单、快速、高效的甜瓜蔓枯病菌转化体系是研究该菌功能基因以及甜瓜-蔓枯病菌互作的必需工具。
传统的真菌遗传转化方法是采用原生质体转化,这种方法费时费力,效率低下。而根癌农杆菌介导的遗传转化最初主要在植物上使用,例如水稻[9]、大豆[10]、高粱[11]等都成功得到农杆菌的转化株系,后来这种方法在真菌上进行尝试,效果也比较好[12-13],一般106个孢子能产生300~500个转化子[14],105个孢子能产生53个转化子[15]、104个孢子能产生156个转化子[16]。产生的转化子在没有选择压力的情况下连续培养5代,89%~98%转化子有丝分裂稳定[15,17-18]。T-DNA单拷贝插入的几率比较高,而且T-DNA插入位置的旁侧序列很容易通过TAIL-PCR扩增得到[14,19-20],农杆菌转化产生的真菌转化子很容易发生表型以及致病性的突变,而且表型与T-DNA共分离的几率比较高,这为研究真菌的功能基因提供了可能,农杆菌介导的植物病原真菌的转化方法现在成为植物病理学研究的重要技术手段。
甜瓜蔓枯病菌遗传转化体系的建立是在分子水平上研究病原菌致病机制的前提,同时有效地转化系统可以用来导入有益的外源基因,获得带有目的性状的工程菌,而后者可能直接用于生产实践,为病害防治提供一种新的办法。但是,遗传转化的效率极大地影响着真菌功能基因组学研究的开展和深入。本研究以一种农杆菌C58C1及携带潮霉素抗性的质粒 pBIG2RHPH2为介导,以强致病力菌株D.bryoniaeDB11为出发菌株,产生甜瓜蔓枯病菌的T-DNA插入转化子,旨在建立一种简单、快速、高效的甜瓜蔓枯病菌的转化体系,为甜瓜蔓枯病菌功能基因组的研究打下良好的基础。
1 材料和方法
1.1 供试菌株
甜瓜蔓枯病菌D. bryoniaeDB11,浙江省农业科学院经济作物病害研究室保存。
根癌农杆菌A. tumefaceins菌株 C58C1::pBIG2RHPH2由日本京都府立大学Kubo教授惠赠,在YEB培养基 (含25 µg/mL新霉素) 上生长48 h备用。
1.2 培养基
YEB培养基:牛肉浸膏 5 g/L,酵母膏 1 g/L,蛋白胨 5 g/L,蔗糖 5 g/L,MgSO4·7H2O 4 g/L,琼脂15 g/L,pH 7.4,121℃灭菌15 min备用。
马铃薯葡萄糖培养基 (PDA):去皮马铃薯200 g,加1 L水煮沸20 min,过滤,弃薯块取滤液,加入葡萄糖20 g,琼脂15 g,定容至1 L,121℃灭菌15 min备用。
MM培养基:葡萄糖 5 g/L,FeSO4·7H2O 2.5 mg/L,CaCl210 mg/L,KCl 0.15 g/L,MgSO4·7H2O 0.3 g/L,NH4Cl 1 g/L,NaH2PO41 g/L,K2HPO43 g/L。
IM培养基:10 mL MM,50%甘油 0.1 mL,1 mol/L脂肪酸甲酯磺酸盐 (MES) (not pH’d)0.4 mL,筛选浓度的乙酰丁香酮,20%葡萄糖0.1 mL。
1.3 甜瓜蔓枯病菌分生孢子悬浮液的制备
甜瓜蔓枯病菌分生孢子的产生根据本实验室以前发表的方法[21]。使用0.01%的吐温收集5~7个真菌平板的分生孢子。灭菌的miracoth过滤真菌孢子至50 mL的离心管内。5 000 r/min离心10 min,弃上清。10 mL 灭菌的ddH2O重新悬浮孢子,然后5 000 r/min离心10 min,弃上清,1 mL ddH2O悬浮分生孢子,血细胞计数器观察孢子浓度。用 ddH2O调整孢子浓度至1×106个孢子/mL。
1.4 抗生素对供试蔓枯病菌和农杆菌的影响测定
1.4.1平板法测定不同浓度潮霉素B对甜瓜蔓枯病菌孢子萌发和菌丝生长的抑制
配制含潮霉素 B浓度梯度 (0、25、50、100、150、200和250 µg/mL) 的PDA培养基平板,将上述1.3中制备的孢子悬浮液稀释1 000倍,取10 µL蔓枯病菌孢子悬浮液的稀释液均匀涂布平板,每培养皿平均50个分生孢子,28℃培养4 d观察菌落生长情况。打孔器取同等菌龄和直径的菌碟放置到平板中心,28℃培养7 d观察菌落生长情况。每个处理重复3次。
1.4.2头孢噻肟钠、氨苄青霉素和四环素在IM培养基上对农杆菌生长的抑制
配制含200 µg/mL氨苄青霉素+200 µg/mL头孢噻肟钠+200 µg/mL四环素的共培养培养基 (IM) 平板,取10 µL C58C1::pBIG2RHPH2菌液均匀涂布到固体平板上,待培养基吸收菌液后,28℃倒置培养4 d观察菌落生长情况,没有任何抗生素的共培养培养基 (IM+AS+琼脂15 g/L) 的平板培养农杆菌作对照。每个处理重复3次。
1.5 转化与筛选
1.5.1转化用农杆菌菌液的准备
A. tumefaceins菌株 C58C1::pBIG2RHPH2和C58C1在YEB培养基平板 (含25 µg/mL新霉素或者 0 µg/mL新霉素) 上涂布活化,30℃过夜培养,挑取单克隆接种于10 mL MM液体培养基 (含25 µg/mL 新霉素或者 0 µg/mL 新霉素),28℃、200 r/min培养1~2 d,得到培养液,然后用IM 液体培养基 (添加设计浓度的AS,见表1) 稀释10倍,200 r/min培养4~6 h,测定OD600,并调整OD600至设计浓度 (表1)。

表1 不同条件下甜瓜蔓枯病菌的转化效率Table 1 Ratio of transformant ofD. bryoniaeconidia in the different conditions
1.5.2共培养和筛选
上述1.3中制备好的6管孢子悬浮液 (100 µL/管),其中5管加入100 µL C58C1:: pBIG2RHPH2菌液,第6管加入100 µL C58C1菌液。先在共培养培养基(IM+AS+琼脂 15 g/L) 上平铺硝酸纤维素滤膜 (孔径 0.45 µm、直径 45 mm) (Whatman,Hillsboro,OR公司产品),将6个离心管内的混合液分别均匀涂布于滤膜上,封口膜封好,22℃~25℃培养至设计时间 (表1),滤膜含菌面朝上转移至MM培养基 (含100 µg/mL潮霉素+200 µg/mL头孢噻肟钠+200 µg/mL 氨苄青霉素+琼脂15 g/L) 平板上,25℃继续培养2 d,挑取单个转化子接种到新的PDA平板(含100 µg/mL潮霉素B)上,25℃暗培养4 d,接着紫外灯照射7 d (12 h黑暗+12 h紫外照射) 直至分生孢子产生,新生的分生孢子用无菌水悬浮后,涂布接种到PDA平板 (含100 µg/mL潮霉素B) 上,25℃培养48 h,挑取萌发的单孢子菌落接种到PDA平板(含100 µg/mL潮霉素) 上,25℃继续培养7 d,保存菌种,备用。
1.5.3影响农杆菌转化效果的因素
分别进行农杆菌浓度OD600(0.12、0.15、0.18)、共培养的筛选时间 (24 h、48 h、36 h)、AS浓度(100、200、300 µg/mL) 不同组合方式下对农杆菌转化效果的影响试验,统计每100 µL甜瓜蔓枯病菌分生孢子悬浮液转化产生的转化子数目。每处理重复6次,取平均值。采用SAS (9.1) 的Duncan法三因素完全随机实验进行多重比较,P<0.05水平上分析各处理间转化效率的显著性差异。
1.6 转化子的筛选鉴定
为测定hph基因在转化子基因组中的遗传稳定性,随机选取 3个蔓枯病菌转化子接种到不含潮霉素B的PDA培养基上连续培养5代,然后接种于PDA液体培养基 (含100 µg/mL潮霉素B) 中,25℃振荡培养4 d,备用。
分别提取甜瓜蔓枯病菌基因组DNA和RNA,制备cDNA,以DNA或者cDNA为模板,引物Up primer:5′-GCATGAAAAAGCCTGAACTCACCGC-3′,Down primer:5′-CGCTATTTCTTTGCCCTCGGACG AG-3′,进行hph基因的PCR和RT-PCR扩增,检测hph的整合和转录。PCR程序如下:95 ℃ 5 min ;95℃60s,60℃60s,72℃60s,30个循环;72 ℃ 5 min 。
将转基因株系的基因组DNA进行EcoR I单酶切后,进行琼脂糖电泳分析。以地高辛探针标记和检测试剂盒 (Roche公司产品) 标记hph的PCR产物为探针,Southern blotting检测T-DNA的插入拷贝数。
2 结果与分析
2.1 抗生素对供试蔓枯病菌和农杆菌的影响测定
2.1.1平板法测定不同潮霉素B浓度对甜瓜蔓枯病菌分生孢子萌发和菌丝生长的影响
0~25 µg/mL潮霉素B对甜瓜蔓枯病菌的分生孢子萌发基本没有抑制作用,50 µg/mL潮霉素B对孢子的萌发抑制作用较强,但是少数孢子仍能萌发,100 µg/mL潮霉素B条件下分生孢子完全不能萌发(图1A)。与分生孢子相比,菌丝对潮霉素B更加敏感,25 µg/mL潮霉素B强烈抑制菌丝的生长。所以本转化实验就选择100 µg/mL潮霉素B筛选阳性转化子 (图 1B)。

图1 甜瓜蔓枯病菌在含有不同浓度潮霉素B的PDA平板上的分生孢子萌发 (A) 和菌丝生长 (B) 情况Fig.1 Conidia germination (A) and hyphae growth (B) ofDidymella bryoniaeon PDA media with different concentrations of hygromycin B (0, 25, 50, 100, 150, 200, 250 µg/mL).
2.1.2头孢噻肟钠、氨苄青霉素和四环素在共培养培养基上对农杆菌的抑制作用
C58C1::pBIG2RHPH2在不含任何抗生素以及含 200 µg/mL氨苄青霉素+200 µg/mL头孢噻肟钠+200 µg/mL四环素的共培养培养基 (同IM+AS+琼脂 15 g/L) 上都不能生长。为了抑制农杆菌以及其他杂菌的生长,共培养蔓枯病菌分生孢子和C58C1::pBIG2RHPH2时,培养基内添加200 µg/mL氨苄青霉素+200 µg/mL头孢噻肟钠+200 µg/mL四环素。
2.2 转化条件的优化组合
对农杆菌悬浮液浓度、共培养时间和 AS浓度进行优化,结果发现当农杆菌悬浮液的OD600为 0.15、共培养时间 48 h (或 36 h)、AS浓度为200 µmol/L (或 300 µmol/L) 时甜瓜蔓枯病菌分生孢子的转化效率最高,1×105个孢子中能产生45~52个转化子,4个处理之间没有显著性差异 (表1)。从3个因素的结果分析发现,农杆菌的菌量对分生孢子的转化效率影响最大,菌量太低 (OD600为 0.12),转化效率也较低,但是农杆菌达到一定菌量后(OD600为 0.15),浓度再增大 (OD600为 0.18),转化效率反而总体有下降趋势,这说明菌量太大对分生孢子的转化是不利的。在农杆菌OD600为0.15时,随着共培养时间的延长,转化效率有所提高,同样的共培养时间,AS的浓度升高,转化效率也有所增大,但是共培养的时间48 h和36 h以及AS的浓度是200 µmol/L或300 µmol/L时转化的效率没有显著性差异。这与前人的研究结果是相似的[12-16]。为了节省工作时间和节省AS,我们选择当甜瓜蔓枯病菌分生孢子悬浮液浓度1×106个孢子/mL时,确定甜瓜蔓枯病菌的最优转化体系为:农杆菌悬浮液OD600为0.15、共培养时间为48 h、诱导培养基中添加200 µmol/L AS。
2.3 转化子遗传稳定性的检测
2.3.1hph基因在甜瓜蔓枯病菌的转化子内稳定复制和转录
研究结果发现3个转化子的hph基因都有扩增条带,这表明T-DNA已经插入到甜瓜蔓枯病菌的染色体上,表现出hph基因在复制和转录水平上的遗传稳定性 (图 2),与前人的报道是吻合的[15,17-18]。这将为农杆菌成为甜瓜蔓枯病菌功能基因研究的重要工具提供了可能。
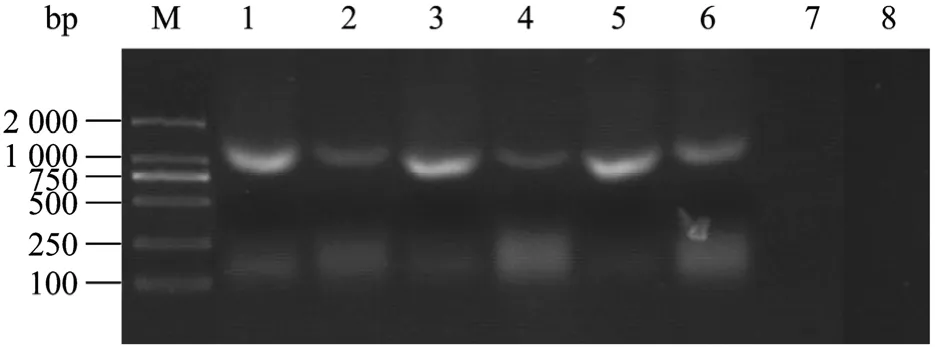
图2 PCR和RT-PCR验证连续继代5次的甜瓜蔓枯病菌转化子的潮霉素B磷酸转移酶基因 (hph) 的稳定性Fig.2 Verificaton by PCR and RT-PCR for hygromycin B phosphotransferase gene (hph) in three transformant ofD.bryoniaeafter 5 times of subculture. M: DNA marker; 1, 3, 5:PCR products of the transformants; 2, 4, 6: RT-PCR products of the transformants; 7, 8: the PCR and RT-PCR products of the wild type, respectively.
2.3.2T-DNA单拷贝插入转化子的几率较高
Southern blotting研究结果发现每个转化子都只有一条杂交条带,说明T-DNA都以单拷贝形式插入蔓枯病菌转化子的染色体 (图 3),这与前人的研究结果相似[14,19-20]。这说明农杆菌转化甜瓜蔓枯病菌分生孢子建立该病菌的突变体库以及进行该病菌的功能基因研究是可行的。
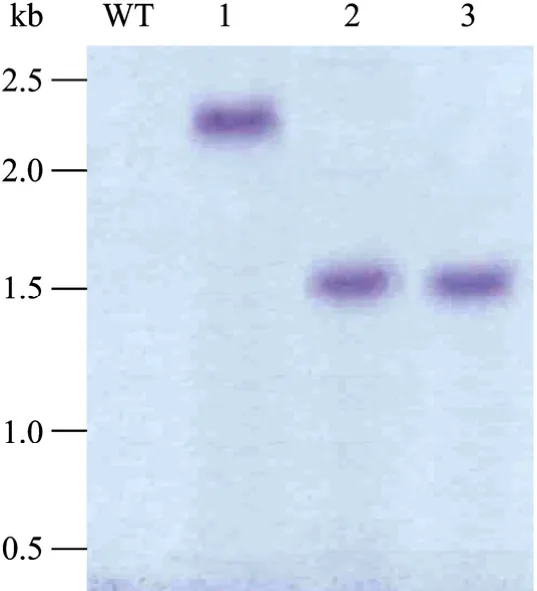
图3 Southern blotting验证连续继代5次的甜瓜蔓枯病菌转化子的潮霉素B磷酸转移酶基因 (hph) 的稳定性Fig.3 Verificaton by Southern blotting for hygromycin B phosphotransferase gene (hph) in three transformant ofD.bryoniaeafter 5 times of subculture. WT: wild type ofD.bryoniae; 1, 2, 3: the transformants.
3 讨论
与其他转化方法相比,农杆菌转化真菌具有 4个优点:1) 农杆菌可以转化完整的细胞,如分生孢子、菌丝、子实体等,这就免去了制备原生质体的麻烦;2) 农杆菌转化系统转化效率高,研究表明农杆菌介导的每 107个丝状真菌细胞一般能产生 300~7 200个转化子,比其他真菌转化方法高100~1 000倍;3) 产生的突变体大部分为单拷贝插入突变体,因此标签基因的分离相对容易;4) 该方法产生的转化子稳定,农杆菌可以转化各种形式的受体,因此当采用具有单核的分生孢子为转化受体时可以得到后代不分离的转化子,避免了真菌菌丝多核所造成的转化子不稳定的难题[22]。参考其他真菌的转化方法[14-16],本研究对甜瓜蔓枯病菌的转化条件进行了探索,筛选出最优转化条件,1×105个分生孢子能得到45个左右的转化子,这与农杆菌转化其他真菌的效率[14-16]相比转化效率较高,这将为甜瓜蔓枯病菌的遗传学以及功能基因的研究提供良好的基础。利用该转化体系我们可以从以下几个方面对甜瓜蔓枯病菌进行研究:第一,建立甜瓜蔓枯病菌的T-DNA插入突变体库。筛选突变体库,从突变体菌株的形态、生物学特性以及致病性等方面筛选目标突变体,克隆甜瓜蔓枯病菌的功能基因。第二,构建携带异源序列的质粒转化甜瓜蔓枯病菌,产生插入失活的突变体,高效快速克隆功能确定的蔓枯病菌的基因。第三,甜瓜蔓枯病菌的基因功能验证。将目标基因的部分序列克隆至T-DNA左右边界内侧,然后进行转化就可以实现目标基因以同源重组的方式敲除,可根据表型确定该基因的功能。第四,改造甜瓜蔓枯病菌,利用携带有某一特定基因的外源质粒转化受体菌株,使其成为植物的“疫苗”,在葫芦科植物蔓枯病的防治中发挥重要的作用。
致谢:在此特别感谢Shaobin Zhong博士 (Department of Plant Pathology,North Dakota State University,USA) 给予实验方法的指导和对英文的润饰。
REFERENCES
[1] Li W, Zhang AX, Jiang J,et al. Identification of muskmelon gummy stem blight pathogen and its biological characters.Jiangsu J Agri Sci,2008, 24(2):148–152.
李伟, 张爱香, 江蛟, 等. 甜瓜蔓枯病病原鉴定及其生物学特性. 江苏农业学报, 2008, 24(2): 148–152.
[2] Zhang CF, Gu LS, Shen F. Integrated control techniques of “Haimi melon”.Shanghai Agri Teconol, 2001, 6: 64–65.
张乘风, 顾立生, 沈飞. “海蜜甜瓜”蔓枯病综防技术. 上海农业科技, 2001, 6: 64–65.
[3] Lü PK, Liu WZ, Duan BS,et al. The Continuation of Atlas of Insect Pests and Diseases of Vegetable Crops in China. Huhhot: Yuan Fang Publishing Company, 1996:86–87.
吕佩珂, 刘文珍, 段半锁, 等. 中国蔬菜病虫原色图谱续集. 呼和浩特: 远方出版社, 1996: 86–87.
[4] Somai BM, Dean RA, Farnham MW,et al. Internal transcribed spacer region 1 and 2 and random amplified polymorphic DNA analysis ofDidymella bryoniaeand relatedPhomaspecies is solated from cucurbits.Phytopathology, 2002, 92(9): 997–1004.
[5] Kothera RT, Keinath AP, Dean RA,et al. AFLP analysis of a worldwide collection ofDidymella bryoniae.Mycol Res, 2003, 107(3): 297–304.
[6] Jiang J, Chen HG, Yang XP,et al. Selection for fungicides to control melon stem blight disease.J Changjiang Veget,2007, 11: 48–49.
江蛟, 陈怀谷, 羊杏平, 等. 甜瓜蔓枯病的防治药剂筛选试验. 长江蔬菜, 2007, 11: 48–49.
[7] Frantz JD, Jahn MM. Five independent loci each control monogenic resistance to gummy stem blight in melon(Cucumis meloL.).Theo App Genet, 2004, 108(6):1033–1038.
[8] Zhou XH, Li Y, Zhang YB,et al. Screening and RAPD analysis of gummy stem blight resistance in melon germplasm.Acta Hort Sin, 2007, 34(5): 1201–1206.
周晓慧, 李英, 张永兵, 等. 甜瓜抗蔓枯病种质资源的筛选及RAPD分析. 园艺学报, 2007, 34(5): 1201–1206.
[9] Xiang YB, Liang ZQ, Gao MW,et al.Agrobacteriummediated transformation of insecticidalBacillus thuringiensiscryIA (b) and cryIA (c) genes and their expression in rice.Chin J Biotech, 1999,15(4): 494–500.
项友斌, 梁竹青, 高明尉, 等. 农杆菌介导的苏云金杆菌抗虫基因 cryIA (b) 和 cryIA (c) 在水稻中的遗传转化及蛋白表达. 生物工程学报, 1999, 15(4): 494–500.
[10] Lin SZ, Cao YP, Wei ZM. Genetic transformation of soybean mediated byAgrobacterium tumefaciens.Chin J Biotech,2004, 20(6): 817–820.
林树柱, 曹越平, 卫志明. 根癌农杆菌介导的大豆遗传转化. 生物工程学报, 2004, 20(6): 817–820.
[11] Zhang MZ, Tang Q, Chen ZL,et al. Genetic transformation ofBtgene into sorghum (Sorghum bicolorL.) mediated byAgrobacterium tumefaciens. Chin JBiotech,2009, 25(3): 418–423.
张明洲, 唐乔, 陈宗伦, 等. 农杆菌介导Bt基因遗传转化高粱. 生物工程学报, 2009, 25(3): 418–423.
[12] Talhinhas P, Muthumeenakshi S, Neves-Martins J,et al.Agrobacterium-mediated transformation and insertional mutagenesis inColletotrichum acutatumfor investigating varied pathogenicity lifestyles.Mol Biotechnol, 2008, 39(1):57–67.
[13] Wu YX, Fan CM, Zhou HP,et al. A genetic of transformation ofMagnaporthe griseabyAgrobacterium tumefaciens.Acta Phytophyl Sin, 2008, 35(5): 421–426.
吴毅歆, 范成明, 周惠萍, 等. 一种农杆菌介导稻瘟病菌的遗传转化. 植物保护学报, 2008, 35(5): 421–426.
[14] Mullins ED, Chen X, Romaine P,et al.Agrobacteriummediated transformation ofFusarium oxysporum: an efficient tool for insertional mutagenesis and gene transfer.Phytopathology, 2001, 91(2): 173–180.
[15] Duarte RT, Staats CC, Fungaro MH,et al. Development of a simple and rapidAgrobacterium tumefaciens-mediated transformation system for the entomopathogenic fungusMetarhizium anisopliaevar.acridum.Lett Appl Microbiol,2007, 44(3): 248–254.
[16] Choi J, Park J, Jeon J,et al. Genome-wide analysis of T-DNA integration into the chromosomes ofMagnaporthe oryzae.Mol Microbiol, 2007, 66: 371–382.
[17] Fang W, Pei Y, Bidochka MJ. Transformation ofMetarhizium anisopliaemediated byAgrobacterium tumefaciens.Can J Microbiol, 2006, 52(7): 623–626.
[18] Yang YJ, Lee I.Agrobactrium tumefaciens-mediated transformation ofMonascus ruber.J Microbiol Biotechnol, 2008, 18(4): 754–758.
[19] Mata MM, Taniwaki MH, Iamanaka BT,et al.Agrobacterium-mediated insertional mutagenesis of the ochratoxigenic fungusAspergillus westerdijkiae.Can J Microbiol, 2007, 53(1): 148–151.
[20] Maruthachalam K, Nair V, Rho HS,et al.Agrobacterium tumefaciens-mediated transformation inColletotrichum falcatumandC. acutatum.J Microbiol Biotechnol, 2008,18(2): 234–241.
[21] Ren HY, Fang L, Ru SJ,et al. A preliminary investigation of a mutant melon plantedr2on resistance to gummy stem blight.Sci Agri Sin, 2009, 42(9): 3131–3138.
任海英, 方丽, 茹水江, 等. 抗蔓枯病甜瓜突变体edr2抗病现象的初步研究. 中国农业科学, 2009, 42(9):3131–3138.
[22] Huang YL, Ye J, Jiang XL,et al. Advance in genetic transformation system of fungi.Microbiol China, 2007,34(6): 1213–1217.
黄亚丽, 叶婧, 蒋细良, 等. 真菌遗传转化系统的研究进展. 微生物学通报, 2007, 34(6): 1213–1217.
Transformation ofDidymella bryoniaemediated byAgrobacterium tumefaciens
Haiying Ren1, Li Fang1, Gang Li2, Shuijiang Ru1, and Hanrong Wang1
1Institute of Plant Protection and Microbe,Zhejiang Academy of Agricultural Sciences,Hangzhou310021,China
2Institute of Quality Standards for Agricultural Products,Zhejiang Academy of Agricultural Sciences,Hangzhou310021,China
Received:January 7, 2010;Accepted:April 9, 2010
Supported by:Doctor Startup and International Cooperation Foundation of Zhejiang Academy of Agricultural Sciences.
Corresponding author:Hanrong Wang. Tel: +86-571-86404224; Fax: +86-571-86404225; E-mail: wanghrg@yahoo.com.cn
浙江省农业科学院博士启动经费和国际合作项目资助。

