水产动物致病性副溶血弧菌双重PCR检测方法的研究
张晓君, 梁利国, 阎斌伦, 秦 蕾, 戚耀之
(淮海工学院 海洋学院, 江苏省海洋生物技术重点建设实验室, 江苏 连云港 222005)
水产动物致病性副溶血弧菌双重PCR检测方法的研究
张晓君, 梁利国, 阎斌伦, 秦 蕾, 戚耀之
(淮海工学院 海洋学院, 江苏省海洋生物技术重点建设实验室, 江苏 连云港 222005)
副溶血弧菌(Vibrio parahaemolyticus)是多种水产养殖动物的主要病原菌, 尤其是可引起凡纳滨对虾幼虾呈毁灭性死亡。本研究基于gyrB和toxR两种基因序列设计2对特异性引物, 建立一种副溶血弧菌快速、准确的双重PCR检测方法, 扩增目的片段大小分别为285 bp和368 bp。结果表明在同一PCR反应体系中副溶血弧菌可同时扩增大小分别为285 bp和368 bp的2种基因片段, 两种引物对4种其他水产动物病原菌无交叉反应; 敏感性检测结果显示, 该双重 PCR最低能检测 8.867 2×103CFU/mL菌体浓度的副溶血弧菌, 对副溶血弧菌模板DNA的检出极限为0.029 3 mg/L; 对发病中国对虾糠虾幼体、水产品及虾池养殖用水进行双重PCR检测, 呈阳性反应的样品可分离出优势生长的副溶血弧菌。该实验所建立的基于gyrB和toxR两种基因的双重PCR检测方法可用于副溶血弧菌引起的水产动物疾病的快速诊断及分子流行病学的调查研究。
副溶血弧菌(Vibrio parahaemolyticus); gyrB基因; toxR基因; 双重PCR
副溶血弧菌(Vibrio parahaemolyticus)广泛存在于世界各地近海岸的海水、海底沉积物及海生动物中, 该菌最早是于1950年藤野从日本大阪市发生的食物中毒病例分离, 之后世界许多国家如日本、中国、澳大利亚、印度、美国、越南、泰国、多哥、马来西亚、新加坡、俄罗斯、巴拿马、新西兰、罗马尼亚、墨西哥等均陆续报告了副溶血弧菌食物中毒或肠炎, 以日本和我国分布最广、发病率最高, 该菌主要通过食物传播, 最主要的是生食海产品, 此外, 该菌可引起多种水产动物(鱼、虾、蟹、贝等)的感染发病, 是一种人与水产养殖动物共染的病原菌。副溶血弧菌尤其是对凡纳滨对虾(Litopenaeus vannamei)危害严重[1~3], 近年来多次引起江苏赣榆县养殖凡纳滨对虾幼虾发生毁灭性死亡[4]。
副溶血弧菌传统的检验方法包括形态学检测、生理生化特征检测和血清学鉴定等, 这些检测手段不仅工作量大, 而且耗时长, 已远远不能满足水产养殖生产上的诊断要求。因此选择合适的分子靶标, 研究开发灵敏度高、特异性强的病原副溶血弧菌快速检测方法已十分重要, 在水产养殖动物处于带菌状态或大规模爆发细菌性疾病之前能进行准确的检测, 这是传统方法无法比拟的。尤其是多种不同基因综合检测以进一步提高其准确性和特异性, 将为副溶血弧菌引起的水产动物疾病的监测及其控制奠定良好的基础。gyrB基因编码的是唯一一种能诱导 DNA负超螺旋的拓扑异构酶—DNA促旋酶的 B亚单位蛋白, Yamamoto等1995年设计出通用引物可从许多革兰氏阳性和革兰氏阴性细菌成功扩增出gyrB基因, 特别适合作为分子靶标进行细菌种间鉴别[5], gyrB 基因是副溶血弧菌DNA复制所必需的, 具有副溶血弧菌种特异性, 而且为单拷贝基因, 具设计 PCR引物的保守区域[6]。toxR基因广泛分布于弧菌科细菌, 该基因最先是在霍乱弧菌中发现[7], 由它编码的跨膜转录调控蛋白 toxR参与调控霍乱弧菌的一些主要毒力基因和外膜蛋白的表达[8]。目前 toxR基因已在副溶血弧菌[9]、创伤弧菌(Vibrio vulnificus)[10]、鳗弧菌(Vibrio anguillarum)[11]等很多弧菌中发现, 同时异种之间的toxR基因核苷酸序列相似性较低, 是弧菌科种间鉴定的良好分子靶标, toxR基因可在种的水平上检测副溶血弧菌。作者报告了以编码gyrB和编码toxR的两种基因为靶基因建立了快速检测病原副溶血弧菌的双重PCR方法, 通过特异性试验、敏感度试验、应用性试验证实该方法特异性好、灵敏度高、稳定性好、检测耗时短, 是快速检测副溶血弧菌的有效方法, 以期为相应疾病的诊断及流行病学研究奠定基础。
1 材料与方法
1.1 供试菌株来源
供试副溶血弧菌分离自江苏连云港赣榆县发病凡纳滨对虾幼虾, 供试对照鳗弧菌(Vibrio anguil-larum)、哈氏弧菌(Vibrio harveyi)、美人鱼发光杆菌即美人鱼弧菌(Vibrio damsela)及爱德华氏菌(Edwardsiella tarda)均分离自海水鱼, 已通过表型及分子鉴定[12~15], 本实验室保存供用, 菌株编号及在GenBank 登录号见表1。

表1 供试菌株及其来源Tab. 1 Origin and species of tested bacteria
1.2 细菌模板DNA的制备
试验所需细菌模板DNA按细菌基因组DNA抽提试剂盒及煮沸两种方法提取。细菌基因组DNA抽提试剂盒法: 取纯培养菌分别接种于含盐 1%的 LB肉汤中28℃培养16 h, 按上海赛百盛基因技术有限公司生产的小量细菌基因组DNA抽提试剂盒所述方法提取DNA, 作为PCR模板。煮沸法: 取1 mL菌液离心1 min(12 000 r/min), 弃上清, 将菌体悬浮于100 μL的灭菌蒸馏水中, 100℃煮沸10 min, 冰浴中冷却后离心10 min(12 000 r/min), 取上清作为PCR模板。
1.3 引物设计与合成
以gyrB基因为靶基因设计副溶血弧菌的特异性检测引物: VP-1: CGGCGTGGGTGTTTCGGTAGT;VP-2r: TCCGCTTCGCGCTCATCAATA[6]。以toxR基因为靶基因设计副溶血弧菌的特异性检测引物:vp-toxR-F: GTCTTCTGACGCAATCGTTG; vp-toxRR: ATACGAGTGGTTGCTGTCATG[16]。两对引物均由上海生物工程技术公司合成。
1.4 PCR各反应条件的优化及电泳分析
以gyrB和toxR两种基因设计的引物分别对模板进行单一扩增; 在同一次 PCR反应中, 应用同一个PCR反应程序, 用上述两种引物同步对模板进行扩增。对PCR各循环参数和各引物浓度等进行优化, 筛选出单一PCR及双重PCR反应中最佳反应模式。
PCR扩增后的产物, 用1.2%琼脂糖凝胶在80V电压下电泳 45 min, 用凝胶成像系统观察并拍照记录。
1.5 双重PCR反应的特异性检测
以鳗弧菌、哈氏弧菌、美人鱼弧菌及爱德华氏菌为对照菌株, 按上述优化的反应条件进行 PCR扩增, 分别进行上述2对引物双重PCR的特异性检验。对阳性结果进行不加模板和不加引物的阴性对照检测。
1.6 PCR反应的灵敏性检测
分别从菌液稀释以及模板DNA稀释两方面来检测方法的灵敏性。
菌液稀释: 将浓度约为 4.54×108CFU/mL 的副溶血弧菌培养物, 用灭菌双蒸水进行系列稀释(前 3管为10倍稀释, 第4至第13管为2倍稀释), 菌液稀释为(保留小数点后 4 位): 4.54×108、4.54×107、4.54×106、2.27×106, 1.135×106, 5.675×105, 2.837 5×105, 1.418 8×105, 7.093 8×104, 3.546 9×104, 1.773 4×104, 8.867 2×103, 4.433 6×103CFU/mL, 共 13 个稀释倍数, 按1.2所述煮沸法, 取1 mL菌液提取DNA作为PCR模板进行检测。同时进行不加模板和不加引物的阴性对照检测。
模板DNA稀释: 小量细菌基因组DNA抽提试剂盒提取的副溶血弧菌基因组DNA, 从60 mg/L起2倍连续稀释为: 60、30、15、7.5、3.75、1.875、0.937 5、0.468 8、0.234 4、0.117 2、0.058 6、0.029 3、0.014 6 mg/L, 共 13个稀释倍数, 按上述方法进行 PCR检测。同时进行不加模板和不加引物的阴性对照检测。
1.7 双重PCR检测的应用
取连云港赣榆县育苗场发病中国对虾糠虾幼体及养殖用水, 采取市场水产品(扇贝、杂色蛤、缢蛏、中国对虾、玉螺、毛蚶)并匀浆, 均用营养肉汤增菌培养6 h, 增菌液煮沸法提取DNA并进行PCR扩增。PCR检测阳性样品按常规方法进行细菌分离及表型与分子检测。
2 结果
2.1 单一及双重PCR检测方法的确定
通过对不同反应条件下 DNA扩增结果的比较,确定了副溶血弧菌的最佳PCR模式。
以gyrB基因为靶基因检测 PCR反应条件为:94℃预变性3 min, 接 94℃变性 20 s、52℃复性 20 s、72℃延伸15 s、35个循环, 然后72℃温育5 min; 在20 µL 反应体系中含有: 水 13.4 µL, 10×PCR 缓冲液2 µL, MgCl2(25 mmol/L)1.6 µL, 4×dNTP 混合物0.4 µL, 引物各 0.2 µL, Taq DNA 聚合酶(5 U/µL)0.2 µL, 模板 DNA 2 µL。
以toxR基因为靶基因检测 PCR反应条件为:94℃预变性 3 min, 接 94℃变性 1 min、58℃复性1 min、72℃延伸1 min、30个循环, 然后72℃温育7 min; 在20 µL反应体系中含有: 水 13.4 µL, 10×PCR缓冲液 2 µL, MgCl2(25 mmol/L)1.6 µL, 4×dNTP 混合物 0.4 µL, 引物各 0.2 µL, Taq DNA 聚合酶(5 U/µL)0.2 µL, 模板 DNA 2 µL。
以gyrB和toxR基因为靶基因同步检测的PCR反应条件为: 94℃预变性3 min, 接94℃变性1 min、57℃复性1 min、72℃延伸1 min、30个循环, 然后72℃温育 7 min。在 40 µL反应体系中含有: 水 28.6 µL,10×PCR 缓冲液 4 µL, MgCl2(25 mmol/L)3.2 µL,4×dNTP 混合物 0.8 µL, 引物各 0.5 µL, Taq DNA 聚合酶(5 U/µL)0.4 µL, 模板 DNA 2 µL。
2.2 单一及双重PCR特异性扩增结果
应用上述程序对副溶血弧菌和其他海水鱼类病原菌基因组DNA(细菌基因组DNA抽提试剂盒提取)分别进行单一及双重 PCR 扩增, 结果以gyrB基因为靶基因扩增, 副溶血弧菌株只扩增出285 bp一条带; 以toxR基因为靶基因扩增, 副溶血弧菌株只扩增出368 bp一条带; 以gyrB和toxR基因为靶基因同步扩增, 副溶血弧菌株扩增出285 bp和368 bp二条带, 而其他4种海水鱼类病原菌(鳗弧菌、哈氏弧菌、美人鱼弧菌及爱德华氏菌)均未出现任何扩增条带(图1)。表明本实验建立的副溶血弧菌PCR检测方法具有很强的特异性。

图1 副溶血弧菌单一及双重PCR特异性试验检测结果Fig. 1 Specificity of single-dulplex PCR for detection of V.parahaemolyticusM. DL2000; 1.gyrB基因扩增片段; 2.toxR基因扩增片段; 3. gyrB和toxR基因同步扩增片段; 4~7. 4种病原弧菌对照M. DL2000; 1. amplified fragment of gyrB; 2. amplified fragment of toxR; 3. simultaneous amplified fragments of gyrB and toxR; 4~7.control of four pathogenic Vibrio sp.
2.3 菌液稀释双重PCR检测的灵敏度
10倍系列稀释菌液按 1.2所述方法煮沸提取DNA, 按2.1优化出的双重PCR反应条件进行检测,结果表明在40 µL反应体系中, 模板DNA加入2 µL,菌 体 浓 度 自 4.54×108CFU/mL 至 1.773 4×104CFU/mL均可扩增出清晰条带, 菌体浓度为8.867 2×103CFU/mL扩增条带较暗, 菌体浓度为4.433 6×103CFU/mL未扩增出条带(图 2), 表明本实验建立的双重PCR方法检测副溶血弧菌菌体灵敏度为8.867 2×103CFU/mL。
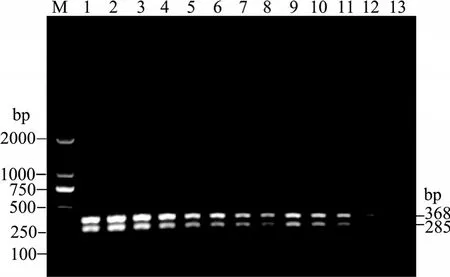
图2 副溶血弧菌菌液稀释法双重PCR敏感性检测结果Fig. 2 Sensitivity of dulplex PCR for detection of V. parahaemolyticus dilutionM.DL2000; 1~13.双重 PCR 扩增片段(菌液系列稀释: 依次为4.54×108~4.4336×103CFU/mL)M. DL2000; 1~13. amplified fragments of dulplex PCR (V. parahaemolyticus serially diluted from 4.54×108~4.4336×103 CFU/mL)
2.4 模板 DNA稀释双重 PCR检测的灵敏度
细菌基因组DNA抽提试剂盒提取的DNA 2倍系列稀释后作模板, 按2.1优化出的双重PCR反应条件进行检测, 结果表明在 40 µL反应体系中, 模板DNA 加入 2 µL(质量浓度 60~0.014 6 mg/ L), 副溶血弧菌基因组DNA质量浓度在60~0.1172 mg/L 的范围均可扩增出明亮条带, 基因组 DNA质量浓度在0.058 6 mg/L 和0.029 3 mg/L 扩增条带较暗淡, 基因组DNA质量浓度在0.014 6 mg/L 无扩增条带(图3), 表明本实验建立的双重 PCR方法对副溶血弧菌模板DNA的检出灵敏度为0.029 3 mg/L 。

图3 副溶血弧菌模板DNA稀释法双重PCR敏感性检测结果Fig. 3 Sensitivity of dulplex PCR for detection of V. parahaemolyticus dilutionM. DL2000; 1~13.双重PCR扩增片段(模板DNA 2倍系列稀释:依次为60~0.014 6 mg/L)M. DL2000; 1~13. amplified fragments of dulplex PCR (purified chromosomal DNA of V. parahaemolyticus serially diluted 2-fold from 60~0.014 6 mg/L)
2.5 双重PCR检测病虾及水产品的实验结果
对发病中国对虾糠虾幼体、水产品及虾池养殖用水进行副溶血弧菌双重 PCR检测, 共 8份样品,其中发病中国对虾糠虾幼体检测结果为阳性, 其余均为阴性(图 4)。阳性样品(发病中国对虾糠虾幼体)经细菌分离、形态及理化特性等表型生物学特性、16S rRNA与gyrB基因的分子检测, 表明分离自发病中国对虾糠虾幼体的优势生长菌为弧菌属的副溶血弧菌。
3 讨论
传统的副溶血弧菌检测方法需做分离培养、形态学及多项生理生化特征检验, 方法繁琐、耗时长,不能满足快速、准确检测的现实需要。由于副溶血弧菌具有多种表型、血清型[17]和产毒型菌株[18,19],因此针对溶血素设计的引物和探针不能同时检测所有的致病性菌株[20,21], 本试验是根据副溶血弧菌的gyrB和toxR两种基因序列设计2对特异性引物, 通过进行双重 PCR反应体系及反应条件优化, 双重PCR的特异性和敏感性实验, 建立了一种副溶血弧菌快速、准确的双重 PCR检测方法, 以进一步提高检测的准确性和特异性。
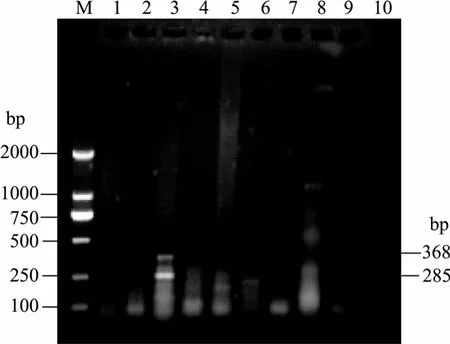
图4 糠虾幼体及水产品的双重PCR检测结果Fig. 4 Results of dulplex PCR for detection of V. parahaemolyticus from diseased shrimps and aquatic productsM.DL2000; 1.毛蚶; 2.扇贝; 3.糠虾幼体; 4.杂色蛤; 5.缢蛏; 6.中国对虾; 7.玉螺; 8.养殖用水; 9.未增菌糠虾幼体M.DL2000; 1. Scapharca subcrenata; 2. Argopectens irradias;3. mysis; 4. Ruditapes philippinarum; 5. Sinonovacula constricta;6. Fenneropenaeus chinensis; 7. Neverita; 8. agricultural water;9. bacterial no-enrichment mysis
多重PCR的反应条件将显著影响反应的可行性,在该双重 PCR反应体系中, 两个 PCR片段分别为285bp和368bp, 通过对引物用量和PCR扩增条件优化, 二种引物的最佳工作浓度为0.125 mmol/L, 最佳退火温度为57℃。说明了要使多重PCR反应体系中每一目的片段都得到最佳扩增结果, 适当的引物浓度是十分重要的, PCR最重要的循环参数是退火温度, 退火温度即使有轻微的变化也会影响多重 PCR反应的效果, 本实验在退火温度为58℃时, 285 bp条带扩增不出, 退火温度为56.5℃时, 368 bp条带扩增不出, 退火温度为57℃时, 2条目的基因扩增条带均较为清晰,多重PCR扩增效率最佳。
单一及双重 PCR的特异性试验结果表明, 仅对所检测的副溶血弧菌可扩增出大小分别为285 bp和368 bp的 2个基因片段, 对水产动物其他病原细菌(鳗弧菌、哈氏弧菌、美人鱼弧菌及爱德华氏菌)的检测均呈阴性反应, 说明设计的引物对病原副溶血弧菌具有良好的特异性, 该方法可用于副溶血弧菌引起的疾病的诊断及分子流行病学调查。
本实验从菌体浓度及DNA浓度两方面进行了双重 PCR灵敏度检测, 结果显示, 该试验所设计的 2对特异性引物及PCR检测方法对病原副溶血弧菌的菌体浓度检出极限为 8.867 2×103CFU/mL, 对模板DNA的检测灵敏度为0.029 3 mg/L, 结果显示两方面的检测结果有一定差异, 可能原因是, 菌体浓度计算采用菌落计数方法, 该方法菌体计数具有一定误差。有关水产动物病原细菌PCR灵敏度检测已多有记述, 余俊红等[22]报道用PCR方法检测花鲈感染鳗弧菌的灵敏度为5×10-4mg/L, 张凤萍等[23]报道用PCR方法检测刺参腐皮综合征病原灿烂的灵敏度为0.5 μg/L, 绕静静等[24]报道用多重 PCR检测致病性嗜水气单胞菌灵敏度为 10 mg/L , 本试验建立的双重 PCR方法, 其灵敏度能够满足临床副溶血弧菌株检测的需要。
[1] 周永灿, 张木, 陈学芬, 等. 养殖对虾细菌性红体病的初步研究[J]. 海洋科学, 2003, 27 (5): 61-65.
[2] 樊景凤, 宋立超, 王斌, 等. 一株引起凡纳滨对虾红体病的病原菌—副溶血弧菌的初步研究[J]. 海洋科学, 2006, 30(4): 40-44.
[3] 沈文英, 阳会军, 尹军霞. 南美白对虾的病害及防治研究现状[J]. 水利渔业, 2004, 24 (1): 58-60.
[4] 张晓君, 陈翠珍, 阎斌伦, 等. 凡纳滨对虾病原副溶血弧菌的表型及分子特征[J]. 海洋与湖沼, 2009,40(5): 654-661.
[5] Yamamoto S, Harayama S. PCR amplification and direct sequencing of gyrB genes with universal primers and their application to the detection and taxomonic analysis of Pseudomonas putida strains[J]. Applied and Environmental Microbiology, 1995, 61(3):1 104-1 109.
[6] Venkateswaran K, Dohmoto N, Harayama S. Cloning and nucleotide sequence of the gyrB gene of Vibrio parahaemolyticus and its application in detection of this pathogen in shrimp[J]. Applied and Environmental Microbiology, 1998, 64(2): 681-687.
[7] Miller V L, Mekalanos J J. Synthesis of cholera toxin is positively regulated at the transcriptional level by toxR[J]. Proceedings of the National Academy of Sciences, 1984, 81 (11): 3 471-3 475.
[8] Miller V L, Mekalanos J J. A novel suicide vector and its use in construction of insertion mutations: osmoregulation of outer membrane proteins and virulence determinants in Vibrio cholerae requires toxR[J].Journal of Bacteriology, 1988, 170 (6): 2 575-2 583.
[9] Lin Z, Kumagai K, Baba K, et al. Vibrio parahaemolyticus has a homolog of the Vibrio cholerae toxRS operon that mediates environmentally induced regulation of the thermostable direct hemolysin gene[J]. Journal of Bacteriology, 1993, 175 (12): 3 844-3 855.
[10] Lee S E, Shin S H, Kim S Y, et al. Vibrio vulnificus has the transmembrane transcription activator toxRS stimulating the expression of the hemolysin gene vvhA[J].Journal of Bacteriology, 2000, 182 (12): 3 405-3 415.
[11] Okuda J, Nakai T, Chang P S, et al. The toxR gene of Vibrio (Listonella) anguillarum controls expression of the major outer membrane proteins but not virulence in a natural host model[J]. Infection and Immunity, 2001,69 (10): 6 091-6 101.
[12] 张晓君, 秦国民, 阎斌伦, 等. 半滑舌鳎病原鳗利斯顿氏菌表型及分子特征研究[J]. 海洋学报, 2009,31(5): 1-11.
[13] 张晓君, 秦国民, 陈翠珍, 等. 龙胆石斑鱼源美人鱼发光杆菌的生物学特性与系统发育学分析[J].渔业科学进展, 2009, 30(3): 38-43.
[14] 张晓君, 房海, 陈翠珍, 等. 致病性哈氏弧菌生物学及分子特征[J]. 中国兽医学报, 2009, 29(9): 1 120-1 124.
[15] 陈翠珍, 房海, 张晓君, 等. 牙鲆与大菱鲆病原迟钝爱德华氏菌生物学特性及系统发育分析[J]. 高技术通讯, 2005, 15(10): 82-88.
[16] Kim Y B, Okuda J, Matsumoto C, et al. Identification of Vibrio parahaemolyticus strains at the species level by PCR targeted to the toxR gene[J]. Jonurnal of Clinical Microbiology, 1999, 37, 1 173-1 177.
[17] Venkateswaran K, Kurusu T, Satake M, et al. Comparison of a fluorogenic assay with a conventional method for rapid detection of Vibrio parahaemolyticus in seafoods[J]. Applied and Environmental Microbiology, 1996, 62: 3 516-3 520.
[18] Baba K, Shirai H, Terai A, et al. Analysis of the tdh gene cloned from a tdh gene- and trh gene-positive strain of Vibrio parahaemolyticus[J]. Microbiology and Immunology, 1991, 35: 253-258.
[19] Honda T, Iida T. The pathogenicity of Vibrio parahaemolyticus and the role of the thermostable direct hemolysin and related hemolysins[J]. Reviews in Medical Microbiology, 1993, 4:106-113.
[20] Nishibuchi M, Doke S, Toizumi S, et al. Isolation from a coastal fish of Vibrio hollisae capable of producing a hemolysin similar to the thermostable direct hemolysin of Vibrio parahaemolyticus[J]. Applied and Environmental Microbiology, 1988, 54: 2 144-2 146.
[21] Nishibuchi M, Khaemomanee V I, Honda T, et al. Comparative analysis of the hemolysin genes Vibrio cholerae non-O1, Vibrio mimicus, and Vibrio hollisae are similar to the tdh gene of Vibrio parahaemolyticus[J]. FEMS Microbiology Letters, 1990, 55: 251-256.
[22] 余俊红, 陈吉祥, 厉 云, 等. 聚合酶链反应(PCR)检测花鲈鳗弧菌感染[J]. 黄渤海海洋, 2002, 20(2):60-64.
[23] 张凤萍, 王印庚, 李胜忠, 等. 应用PCR方法检测刺参腐皮综合征病原-灿烂弧菌[J]. 海洋水产研究,2008, 29(5): 100-106.
[24] 绕静静, 李寿菘, 黄克和, 等.致病性嗜水气单胞菌多重 PCR检测方法的建立[J]. 中国水产科学, 2007,14(5): 749-755.
Detection of pathogenic Vibrio parahaemolyticus isolated from aquatic animals by dulplex PCR
ZHANG Xiao-jun, LIANG Li-guo, YAN Bin-lun, QIN Lei, QI Yao-zhi
(College of Ocean, Key Laboratory of Oceanic Biotechnology of Jiangsu, Huaihai Institute of Technology,Lianyungang 222005, China)
Dec., 4, 2009
Vibrio parahaemolyticus; gyrB gene; toxR gene; dulplex PCR
V. parahaemolyticus is a significant pathogen for the aquaculture industry, particularly devastating impact on cultivated Litopenaeus vannamei. In this study, two pair of specific primers was designed that allowed amplification of 285 bp and 368bp gene fragments based on gyrB and toxR genes. A simple dulplex polymerase chain reaction (PCR) that will detect V. parahaemolyticus were established. Consequently, two PCR primers could simultaneously amplify 285 bp and 368bp gene fragments from chromosomal DNA of V. parahaemolyticus in one PCR reaction, and no cross reaction was detected in 4 other pathogenic Vibrio species tested. The results of sensitivity of dulplex PCR showed that the two primers could detect V. parahaemolyticus at a level of as few as 8.8672×103CFU/mL, and detect purified chromosomal DNA at a level of as few as 0.0293 mg/L . Dominant V.parahaemolyticus could be isolated from the positive sample of dulplex PCR through detecting mysis, aquatic products and tank water samples. The PCR protocol amplifying gyrB and toxR gene fragments of the V. parahaemolyticus was established and could be useful in the specific and rapid diagnose of the disease caused by V.parahaemolyticus.
S941
A
1000-3096(2010)10-0007-06
2009-12-04;
2010-01-11
江苏省水产三项工程项目(PJ2010-58); 江苏省自然科学基金项目(BK2009163); 淮海工学院江苏省海洋生物技术重点建设实验室研究基金项目(2008HS016)
张晓君(1969-), 河北秦皇岛人, 教授, 博士, 电话:0518-85895251, E-mail: zxj9307@163.com
(本文编辑: 梁德海)

