3-吡咯烷基苯并蒽酮的电子结构和光谱性质
陈 奔 何荣幸 李 明
(西南大学化学化工学院,重庆 400715)
3-吡咯烷基苯并蒽酮的电子结构和光谱性质
陈 奔 何荣幸 李 明*
(西南大学化学化工学院,重庆 400715)
苯并蒽酮衍生物在新型荧光材料、非线性光学材料和液晶显示材料等领域有较大的应用前景.本文采用量子化学方法优化了3-吡咯烷基苯并蒽酮的基态几何结构和第一单重激发态的几何结构,并与X射线晶体衍射实验值进行了对比.利用含时密度泛函理论(TD-DFT)的不同泛函,计算了3-吡咯烷基苯并蒽酮在气相和溶剂中的吸收和发射光谱,考察了它的电子结构和光谱特征,并分析了不同泛函、基组以及溶剂效应对吸收和发射光谱的影响.计算结果表明:3-吡咯烷基苯并蒽酮的最强吸收和发射光谱都是具有π→π*跃迁特征的电荷转移(CT)态;泛函B3LYP能较好地重现实验吸收能;而对于具有分子内电荷转移特征的激发态,泛函MPWK能较好地重现实验发射能.溶剂效应的计算表明,不同极性的溶剂对3-吡咯烷基苯并蒽酮的吸收光谱和发射光谱的影响较小.理论预测的光谱与实验结果一致.
密度泛函理论; 吸收和发射光谱; 激发态; 分子内电荷转移; 溶剂效应
有机化合物的分子内电荷转移(ICT)是许多材料科学、化学、物理学和生物过程中最基本的过程,研究表明这些化合物一般都包含有电子供体(D)和电子受体(A)[1-5].若电子供体和电子受体之间有高度离域的π结构相连,则这种化合物很可能作为光敏材料在分子电子学、非线性光学(NLO)材料、太阳能电池、生物化学、荧光探针等领域有着潜在的应用前景[6-8].
苯并蒽酮衍生物由于具有高效荧光性质、高耐热和耐光性,在过去几十年已经被广泛地应用于纺织品和聚合物的分散染色剂、荧光涂料和激光染料[9-10].近年来的一些研究表明,它的3-氮取代衍生物具有特殊的光学性质,有望应用于新型荧光材料、非线性光学材料和液晶显示材料等领域,因此很多科学家对此进行了广泛研究[11-14].最近,Kirilova等[15]合成了一种新型的激发态分子内电荷转移化合物—3-吡咯烷基苯并蒽酮,并应用X射线晶体衍射实验表征了它的结构,研究了它的吸收和发射光谱性质,根据它的荧光谱带定性指出3-吡咯烷基苯并蒽酮存在强烈的激发态分子内电荷转移(CT)现象. Nepra"等[16]通过PPP-MO方法研究了苯并蒽酮衍生物的激发能和第一吸收光谱带,并分析了基态和激发态电子密度分布与光谱性质的联系.Kosower等[17]的理论研究认为,苯并蒽酮衍生物的激发态是由一个平面的CT态衰减而来,并解释了极性溶剂中荧光量子产率急剧减少的原因.作为一种重要的激发态分子内电荷转移化合物,研究3-吡咯烷基苯并蒽酮基态和激发态的电子结构、吸收和发射光谱的性质、溶剂极性对光谱的影响等具有重要的理论和实际意义.
本文选取图1所示的3-吡咯烷基苯并蒽酮作为研究对象,采用含时密度泛函理论(TD-DFT)(所用泛函为B3LYP,B3P86,MPWK,BHandHLYP)和只考虑单激发的组态相互作用(CIS)方法,研究它的电子结构和光谱性质,分析不同泛函和基组对吸收和发射光谱的影响,并讨论溶剂效应的影响.

图1 3-吡咯烷基苯并蒽酮的结构及原子编号Fig.1 Structure and atomic number of 3-pyrrolidinobenzanthrone
1 计算方法
采用密度泛函理论(DFT)[18-19]的 B3LYP[20-21]、B3P86[21-22]和MPWK[23-24]三个泛函和HF方法,在6-311++g**基组水平上对分子的基态几何结构进行了全优化;第一单重激发态的几何结构采用CIS方法在相同基组水平进行了优化,并通过频率分析确认了其优化结构都处于势能面的极小点.利用获得的优化结构,采用含时密度泛函理论的不同泛函计算了分子的吸收和发射光谱.对于溶剂效应,使用极化连续介质模型(the polarzable continuum model, PCM)[25]来计算.全部计算均用Gaussian 03程序包[26]完成.
在TD-DFT的计算中,我们采用了B3LYP, B3P86,BHandHLYP[26]和MPWK四种泛函以及6-31+g*,6-311++g**两个基组.之所以选择这四个泛函是因为它们广泛的适用性,特别是B3LYP几乎变成了结构优化的一个标准泛函,而MPWK则是计算电子激发能常用的近似交换相关泛函之一.和B3LYP相比,MPWK杂化泛函对于很多激发态,包括低的Rydberg态的计算结果和实验值都吻合得更好[23-24,27].另外,用B3P86和BHandHLYP泛函计算了研究对象的吸收与发射光谱,考察不同泛函对本文研究对象的适用情况.
2 基态及激发态的几何结构
基态结构的优化采用B3LYP,B3P86,MPWK和HF方法在6-311++g**基组水平完成.表1给出了3-吡咯烷基苯并蒽酮在各种理论水平下,基态和激发态结构参数与X射线晶体衍射实验值的比较.结果显示,基态苯并蒽酮环上的C—C键长在0.137-0.145 nm之间,介于标准C═C双键(约0.134 nm)和C—C单键(0.153 nm)之间,显示苯并蒽酮环上的电子分布是离域的.B3LYP/6-311++g**理论水平给出优化结构的二面角D(C15C16C12C13)=0.6° (0.2°,HF),D(C3C17C15C14)=178.3°(179.0°,HF),说明苯并蒽酮环有良好的共平面性,但由于C3位上的吡咯烷基团的取代,造成了与之相邻的苯环共面性下降.泛函B3P86、MPWK也给出了相似的结果.
进一步比较基态和激发态的结构参数可以看出,和基态的结构参数相比,激发态的结构参数发生了较大的变化.二面角D(C15C16C12C13)由基态时的0.2°(HF)变为激发态时的2.3°(CIS),二面角D(C3C17C15C14)由基态时的179.0°(HF)(178.3°, B3LYP)变为激发态时的177.6°(CIS),说明激发态时的苯并蒽酮环平面发生一定扭曲,共面性下降,电子离域程度减小.C7═O23键长由基态时的0.1226 nm(B3LYP)缩短为激发态时的0.1208 nm(CIS),说明激发态时苯并蒽酮环上羰基的电子云密度较基态时有所增加.基态时C3—N18键长为0.1411 nm(HF),介于标准C═N双键(约0.136 nm)以及C—N单键(0.1475 nm)之间,二面角D(C19N18C3C22)=128.3° (130.1°,B3LYP),说明C3—N18有一定程度的离域,而激发态时C3—N18键长缩小为0.1375 nm,二面角D(C19N18C3C22)为137.8°,C3—N18键长缩小和氨基共面性的增加说明了激发态时的N18能更好地参与电子离域,后文讨论中前线轨道的分析也表明,分子激发态时发生由N18到苯并蒽酮环上羰基的电荷转移,使得N18原子带有部分正电荷,因而导致了氨基平面性的增加,从而使得N18的π电子能更好地参与电子离域.

表1 3-吡咯烷基苯并蒽酮基态和激发态结构参数与X射线晶体衍射实验值Table 1 Calculated structural parameters for the ground and the first excited states of 3-pyrrolidinobenzanthrone and the experimental data
3 吸收光谱
3.1 气相吸收光谱
在密度泛函方法B3LYP、B3P86和MPWK三个泛函以及HF方法优化的基态构型的基础上,利用含时密度泛函理论计算3-吡咯烷基苯并蒽酮的吸收光谱.为了考察不同泛函对于计算结果的影响,采用B3LYP、B3P86和MPWK三个泛函分别在6-31+g*、6-311++g**两个基组水平下,计算了3-吡咯烷基苯并蒽酮的气相吸收光谱.TD-DFT能够给出可靠的低激发态的性质[28-29],但是对于较高激发态的结果误差较大,所以我们计算了前10个激发态(表2中仅列出了谐振强度最大的前两个).
从表2中发现,不同理论水平优化的基态构型在相同TD-DFT泛函B3LYP下给出的理论结果基本一致,其谐振强度最大的跃迁态均为S1态,相应的垂直激发能分别为:2.74 eV(DFT-B3LYP优化的几何优化结构),2.75 eV(DFT-B3P86优化的几何结构),2.75 eV(DFT-MPWK优化的几何结构)以及2.93 eV(HF优化的几何结构).显然HF方法优化的基态几何结构计算的S1态的垂直跃迁能明显比其他的高,原因在于HF方法没有考虑电子的动态相关,其优化的基态结构与真实值相差更大,这可以从表1中看到.
为了考察不同泛函在TD-DFT垂直激发能计算中的结果,我们采用了B3LYP,B3P86和MPWK三个泛函的平行计算.计算结果表明,B3LYP和B3P86两个泛函给出的计算结果几乎相同,而泛函MPWK给出了较低的垂直发射能.

表2 不同计算水平下3-吡咯烷基苯并蒽酮气相吸收光谱的相关参数Table 2 Selected gas-phase absorption spectral parameters of 3-pyrrolidinobenzanthrone with different theoretical levels
为了考察基组对计算结果的影响,在TDB3LYP/6-31+g*和TD-B3LYP/6-311++g**两个水平下对3-吡咯烷基苯并蒽酮S1态的垂直激发能进行了重复计算.分析表2中的计算结果,可以发现增大基组对于计算结果影响很小,这意味着使用中等大小的基组(6-31+g*)基本可以满足本文所研究的体系.
为了分析激发态的电子结构,我们得到了不同理论计算水平下3-吡咯烷基苯并蒽酮的前线分子轨道.由于不同计算水平都给出了相近的前线分子轨道图,这里只给出TD-B3LYP/6-311++g**理论水平下3-吡咯烷基苯并蒽酮的前线分子轨道,结果示于图2.对于第一激发态S1,电子跃迁发生在最高占据分子轨道(HOMO)与最低空分子轨道(LUMO)之间(表2).如图2所示,HOMO轨道是主要定域于N18原子上(还有部分在苯并蒽酮环平面的苯环上)的π型轨道,LUMO轨道则主要是定域于苯并蒽酮环平面蒽醌基团的π*型轨道,显然S1态是一个具有π→π*特征的电荷转移(CT)态.这表明3-吡咯烷基苯并蒽酮在经光激发之后,将直接生成电荷分离的激发态,与实验结果一致[15].第二激发态S2对应于HOMO-1到LUMO的电子跃迁,HOMO-1轨道是位于羰基(C═O)上的n型轨道,因此S2态对应的是n→π*的电子跃迁,计算的谐振强度f表明,S2态的谐振强度几乎为0,这意味着S0→S2对应的电子跃迁是禁阻的.

图2 3-吡咯烷基苯并蒽酮的前线分子轨道图Fig.2 Frontier molecular orbitals of 3-pyrrolidinobenzanthrone
3.2 液相吸收光谱
由于实验[15]是在溶剂中进行的,因此为了更好地与实验结果比较,需要考虑溶剂效应对光谱的影响.实验中所用溶剂分别是乙醇、氯仿和苯,相应的介电常数分别为24.55、4.90和2.25.选取B3LYP/6-311++g**和B3P86/6-311++g**优化的基态结构,利用泛函B3LYP、B3P86和MPWK,在6-311++g**和6-31+g*基组水平下,分别计算了3-吡咯烷基苯并蒽酮在苯、氯仿和乙醇中的吸收光谱,计算结果见表3.溶剂效应采用PCM模型计算.
从表3可以看到,液相中谐振强度最大的激发态均为S1态,对应于HOMO→LUMO跃迁,与气相结果一致.但是第二激发态,S2的轨道跃迁顺序发生了变化,它对应于HOMO-2到LUMO的跃迁. HOMO-2轨道是定域于苯并蒽酮环平面苯环与N18原子上的π型轨道,因此在这种情况下S2态是一个π→π*的电子跃迁,与气相结果的S3态一致,这是介质的改变引起的.计算结果表明,S2态的谐振强度几乎为0,这意味着S0→S2对应的电子跃迁也几乎是跃迁禁阻的.
考察溶剂效应的计算结果,以TD-B3LYP/6-311++g**的计算结果为例,3-吡咯烷基苯并蒽酮在苯、氯仿和乙醇中的S1态对应的垂直激发能分别为2.62、2.57和2.53 eV,而实验给出的最大吸收波长分别为488 nm(2.54 eV)、495 nm(2.50 eV)和509 nm (2.46 eV),计算给出的跃迁能与实验值[15]非常吻合,说明吸收光谱的计算是可信的.理论计算的结果表明,增大溶剂的极性,S1态对应的垂直激发能和谐振强度的变化都很小,说明溶剂极性的改变对于吸收峰位置与电子结构的影响很小,即溶剂效应较小,这与实验给出的苯→氯仿→乙醇的吸收光谱7-14 nm的轻微红移,吸收光谱的溶剂效应较小[15]相一致.泛函B3P86也给出相似的计算结果.另一方面,泛函MPWK给出的垂直激发能明显偏低,在溶剂苯、氯仿和乙醇中,S1态对应的垂直激发能分别为2.01、2.05和2.01 eV.
考察了几何优化构型对垂直激发能的影响.同样以3-吡咯烷基苯并蒽酮在苯中的吸收光谱为例,如表3所示,对于DFT-B3LYP和DFT-B3P86优化的两种不同的几何构型,TD-B3LYP/6-311++g**给出的S1态垂直跃迁能均为2.62 eV,这说明同属于密度泛函方法优化的几何优化构型对于TD-DFT垂直跃迁能的计算结果没有较大影响.分析极性更大的乙醇、氯仿的计算数据可以获得相同的结论.
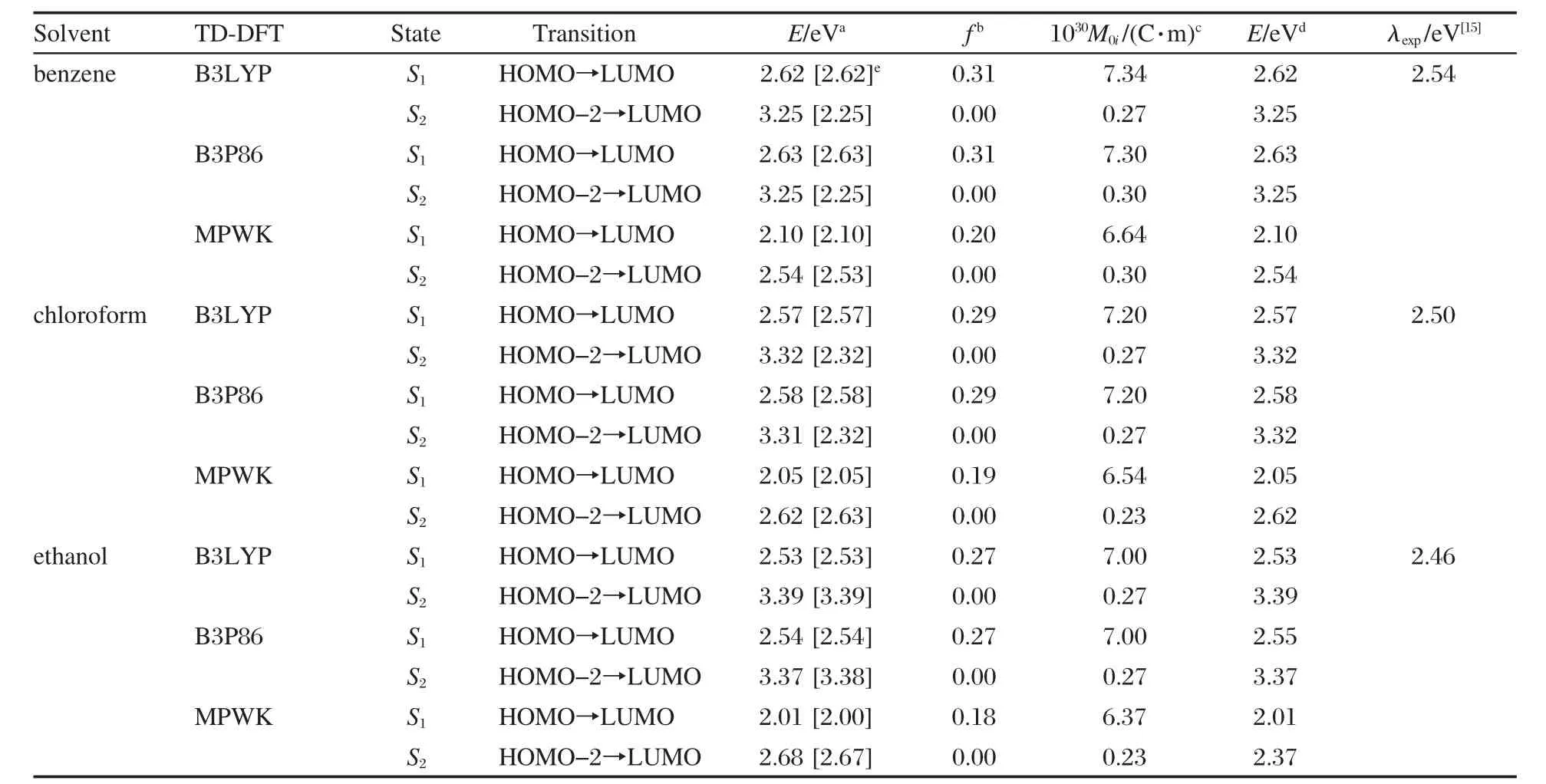
表3 不同计算水平下的3-吡咯烷基苯并蒽酮在乙醇、氯仿和苯中的吸收光谱参数Table 3 Selected absorption spectral parameters of 3-pyrrolidinobenzanthrone in ethanol,chloroform,and benzene with different calculated levels
从TD-B3LYP/6-31+g*与TD-B3LYP/6-311++g**的计算结果我们看到,基组大小的改变,并没有对计算结果产生较大的影响,以3-吡咯烷基苯并蒽酮在苯中的吸收光谱计算为例,两者给出的S1态对应的垂直激发能几乎一致.
为了更形象地比较不同溶剂中的吸收光谱计算结果,我们利用高斯函数和理论计算得到的各个激发态的跃迁能、谐振强度来模拟吸收光谱图:
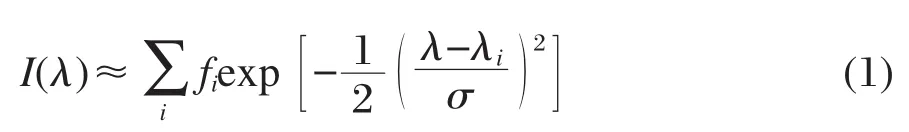
其中,i代表第i个激发态;λi是计算得到的吸收波长(nm);fi指第i个激发态的计算谐振强度;λ和I(λ)分别为方程的自变量和因变量,其物理意义分别表示波长和振子强度;σ是以第i个激发态的吸收峰为中心的高斯半宽[28-29].将计算得到的三种溶剂中的激发态相应物理量带入公式(1)中,就得到如图3所示的吸收光谱.很明显,3-吡咯烷基苯并蒽酮在不同极性溶剂中的最强吸收峰位于470-500 nm之间,并且随着溶剂极性的增强有着轻微的红移.这与实验结果[15]相一致.
4 发射光谱
4.1 气相发射光谱
为了进一步研究激发态的性质和发射光谱,在CIS/6-311++g**水平下优化得到的激发态结构的基础上,利用含时密度泛函理论计算3-吡咯烷基苯并蒽酮的发射光谱.为了考察不同泛函对于计算结果的影响,我们采用B3LYP、B3P86、MPWK和 BHandHLYP四个泛函分别在6-31+g*和6-311++g**两个基组水平下,计算了3-吡咯烷基苯并蒽酮的气相垂直发射光谱,结果列于表4.
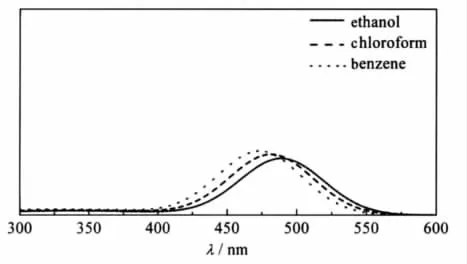
图3 3-吡咯烷基苯并蒽酮在乙醇、氯仿和苯中的理论吸收光谱图Fig.3 Calculated absorption spectra of 3-pyrrolidinobenzanthrone in ethanol, chloroform,and benzene
在TD-MPWK/6-311++g**水平下,3-吡咯烷基苯并蒽酮的垂直发射能约为2.13 eV,谐振强度为0.16,对应的电子跃迁发生在LUMO与HOMO之间.从表4中发现,不同泛函给出的理论垂直发射能相差较大.在6-311++g**基组水平下,泛函B3LYP和B3P86给出的S1态垂直发射能为2.45 eV,而泛函 BHandHLYP给出的垂直发射能为 2.84 eV. B3LYP和B3P86这两个泛函给出的计算结果几乎相同,和泛函BHandHLYP一样,垂直发射能都明显偏高,而泛函MPWK给出了与实验值较符的结果.需要注意的是,在吸收光谱的计算中,泛函MPWK给出的计算结果与实验值吻合得并不好,原因还有待进一步了解.
为了考察不同基组对于垂直发射能理论计算的影响,我们采用了6-31+g*基组重复上述计算.结果表明TD-MPWK/6-31+g*给出的气相垂直发射能为2.16 eV,与TD-MPWK/6-311++g**的计算结果相比增大了0.03 eV,而后者的计算结果更为接近实验值,说明在3-吡咯烷基苯并蒽酮的气相垂直发射能的计算中加大基组对于理论值有一定改善.
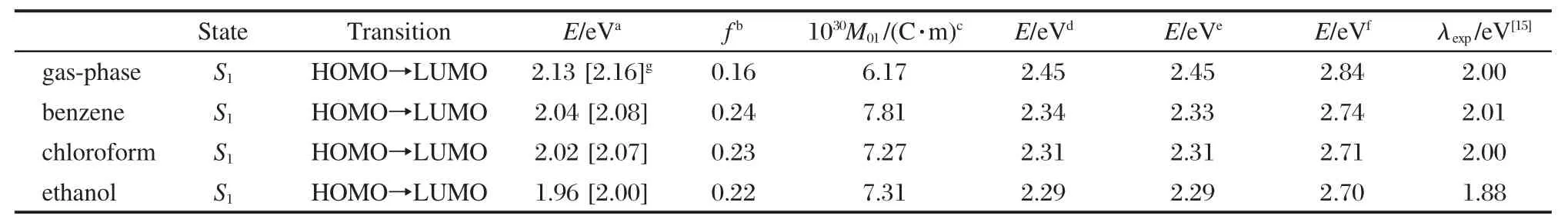
表4 不同计算水平下3-吡咯烷基苯并蒽酮在气相及乙醇、氯仿和苯中的发射光谱参数Table 4 Selected emission spectral parameters of 3-pyrrolidinobenzanthrone in gas-phase,ethanol,chloroform, and benzene at different calculated levels
4.2 液相发射光谱
同吸收光谱一样,发射光谱的溶剂效应也需要考虑.在CIS/6-311++g**水平下优化得到的第一单重激发态结构的基础上,利用含时密度泛函理论的B3LYP、B3P86、MPWK和BHandHLYP四个泛函,在6-311++g**基组水平下,采用PCM溶剂模型,计算了3-吡咯烷基苯并蒽酮在液相中的发射光谱,结果见表4.
从表4可以看到,液相中理论发射光谱的跃迁能级类型和能级顺序与气相中的完全相同,电子从LUMO轨道跃迁到HOMO轨道.与气相发射光谱计算结果相似,在三种溶剂中,泛函MPWK给出的垂直发射能分别为2.04 eV(苯)、2.02 eV(氯仿)和1.96 eV(乙醇),与实验值[15]吻合较好;泛函B3LYP, B3P86和BHandHLYP给出的垂直发射能计算值明显偏高.
相比于气相发射光谱,液相发射光谱发生了较大的红移.在TD-MPWK/6-311++g**理论水平下, 3-吡咯烷基苯并蒽酮在苯、氯仿和乙醇中的垂直发射能相较于气相垂直发射能都大约红移了0.1 eV.在上述三种溶剂中,实验[15]给出的最大发射波长分别为617 nm(2.01 eV)、627 nm(2.00 eV)和661 nm (1.88 eV),与计算值非常吻合,误差仅为0.02-0.08 eV,说明发射光谱的计算是可信的.以TD-MPWK/ 6-311++g**的计算结果为例考察溶剂效应的计算结果,我们发现3-吡咯烷基苯并蒽酮在苯、氯仿和乙醇中,对应的垂直激发能均发生了大约0.08 eV的红移(溶剂从苯→氯仿→乙醇),这与实验[15]给出的溶剂效应相一致.另外,对比溶剂相中的发射光谱和吸收光谱计算的计算结果,可以发现光谱发生了较大的Stocks位移,并且随着溶剂极性的增加而增加(从苯→氯仿→乙醇分别为 133.25、133.09和 143.03 nm),这也与实验结果[15]一致.
为了考察不同基组对于3-吡咯烷基苯并蒽酮液相中垂直发射能理论计算的影响,我们采用泛函MPWK在基组6-31+g*水平上做了重复计算,结果列于表4.计算结果表明增大基组对于发射光谱的理论值有所改善,但是并不明显.

图4 3-吡咯烷基苯并蒽酮的发射光谱Fig.4 Emission spectra of 3-pyrrolidinobenzanthrone(a)experimental emission spectrum(solid state)[15];(b)the calculated emission spectra in ethanol,chloroform,and benzene
采用与模拟吸收光谱图一样的公式,利用计算结果我们模拟了不同溶剂下的发射光谱图,其结果与实验光谱图一起示于图4.显然,3-吡咯烷基苯并蒽酮在三种溶剂中的发射峰比较平坦,最强发射波长大约在600-640 nm之间,并随着溶剂极性的增加而发生微小的红移.分析图4可以发现,除了最强发射峰的位置稍微不同而外,理论模拟的发射光谱图与实验基本一致.
5 结 论
采用含时密度泛函理论(TD-DFT)的不同泛函以及不同基组,计算了3-吡咯烷基苯并蒽酮在气相和溶剂相中的吸收和发射光谱,考察了它的电子结构和光谱特征,并分析了不同泛函在计算垂直激发能和垂直发射能中的适用范围以及不同基组对于计算结果的影响,讨论了溶剂效应对于吸收和发射光谱的影响.具体结论如下:
(1)不同理论水平下优化的几何构型对于垂直跃迁能的影响较小,而不同泛函对于垂直跃迁能的计算值有很大影响.
(2)泛函B3LYP和B3P86能较好地重现实验吸收能;而在发射光谱计算中,对于具有激发态分子内电荷转移特征的3-吡咯烷基苯并蒽酮,泛函MPWK给出的计算结果与实验值更吻合.而增大基组对吸收光谱的计算影响较小,但对垂直发射能有一定改善.
(3)通过对前线分子轨道的分析,发现3-吡咯烷基苯并蒽酮的最强吸收和发射光谱都是具有π→π*跃迁特征的电荷转移(CT)态,这从理论上说明3-吡咯烷基苯并蒽酮在新型荧光材料、非线性光学材料等领域具有潜在的应用价值.
(4)溶剂效应对于吸收和发射光谱的影响较小, Stocks位移较小.理论预测的光谱与实验结果一致.
1 Pourtois,G.;Beljonne,D.;Cornil,J.;Ratner,M.A.;Bredas,J.L. J.Am.Chem.Soc.,2002,124:4436
2 Zerza,G.;Sharber,M.C.;Brabec,C.J.;Sariciftci,N.S.;Gomez, R.;Segura,J.N.;Martin,N.;Srdanov,V.I.J.Phys.Chem.A, 2000,104:8315
3 Flouzat,C.;Besson,Y.;Mattio,A.;Bonnet,J.;Guillaumet,G. J.Med.Chem.,1993,36:497
4 Sobolewski,A.L.;Domecke,W.Chem.Phys.Lett.,1996,250: 428
5 Grabowski,Z.R.;Rotkiewicz,K.;Rettig,W.Chem.Rev.,2003, 103:3899
6 Bella,S.D.;Fragalá,I.L.;Ratner,M.A.;Marks,T.J.J.Am. Chem.Soc.,1993,115:682
7 Coe,B.J.;Harris,J.A.;Brunschwig,B.S.;Garin,J.;Orduna,J.; Coles,S.J.;Hursthouse,M.B.J.Am.Chem.Soc.,2004,126: 10418
8 Jiao,G.S.;Thoresen,L.H.;Burgess,K.J.Am.Chem.Soc.,2003, 125:14668
9 Krasovitskii,B.M.;Bolotin,B.M.Organic luminescent materials. New York:VCH Publishers,1988
10 Bunz,U.H.F.Chem.Rev.,2000,100:1605.
11 Hughes,G.;Bryce,M.R.J.Mater.Chem.,2005,15:94.
12 Kelley,T.W.;Baude,P.F.;Gerlach,C.;Ender,D.E.;Muyres,D.; Haase,M.A.;Vogel,D.E.;Theiss,S.D.Chem.Mater.,2004,16: 4413
13 Shirota,Y.;Kageyama,H.Chem.Rev.,2007,107:953
14 Logothetidis,S.Mater.Sci.Eng.B,2008,152:96
15 Kirilova,E.M.;Sergey,V.B.;Kirilov,G.K.;Kalnina,I.; Gerbreder,V.J.Lumin.,2009,129:1827
16 Nepra#,M.;Machalický,O.;Šeps,M.;Hrdina,R.;Kapusta,P.; Fidler,V.Dye and Pigments,1997,35:31
17 Kosower,E.M.;Dodiuk,H.J.Am.Chem.Soc.,1975,97:2167
18 Hohenberg,P.;Kohn,W.Phys.Rev.B,1964,136:864
19 Kohn,W.;Sham,L.J.Phys.Rev.A,1965,140:1133
20 Lee,C.;Yang,W.;Parr,R.G.Phys.Rev.B,1988,37:785
21 Becke,A.D.Phys.Rev.A,1988,38:3098
22 Perdew,J.P.Phys.Rev.B,1986,33:8822
23 Lynch,B.J.;Fast,P.L.;Harris,M.;Thruhlar,D.G.J.Phys.Chem. A,2000,104:4811
24 Lynch,B.J.;Zhao,Y.;Truhlar,D.G.J.Phys.Chem.A,2003, 107:1384
25 Cramer,C.J.;Truhlar,D.G.Chem.Rev.,1999,99:2161
26 Frisch,M.J.;Trucks,G.W.;Schlegel,H.B.;et al.Gaussian 03. Revision A.01.Pittsburgh,PA:Gaussian Inc.,2003
27 Wang,Y.L.;Wu,G.S.Acta Phys.-Chim.Sin.,2008,24:552 [王溢磊,吴国是.物理化学学报,2008,24:552]
28 He,R.X.;Duan,X.H.;Li,X.Y.J.Phys.Chem.A,2005,109: 4154
29 He,R.X.;Li,X.Y.Chem.Phys.,2007,332:325
Electronic Structures and Spectral Properties of 3-Pyrrolidinobenzanthrone
CHEN Ben HE Rong-Xing LI Ming*
(College of Chemistry and Chemical Engineering,Southwest University,Chongqing 400715,P.R.China)
Benzanthrone derivatives show great potential for use as new luminescent,nonlinear optical,and liquid crystalline materials.The geometries of the ground and the first excited states of 3-pyrrolidinobenzanthrone were optimized using quantum chemistry methods and the obtained structural parameters were compared with experimental data.The time-dependent density functional theory(TD-DFT)calculations were performed to estimate the absorption and emission spectra of 3-pyrrolidinobenzanthrone both in gas-phase and in solutions.In addition,the effects of different exchange correlation functionals,basis sets,and solvents on the absorption and emission spectra were analyzed in detail.We found that the strongest absorption and emission bands of 3-pyrrolidinobenzanthrone could be assigned to a charge transfer(CT)state with a π→π*character.The result of the B3LYP functional reproduces the experimental absorption spectrum very well and the MPWK functional accurately predicts the emission energy of the first excited state with an intramolecular charge transfer(ICT)feature.The calculated results indicate that solvent effects do not greatly influence the absorption and emission spectra.The theoretical results are in agreement with experimental observations.
Density functional theory; Absorption and emission spectrum; Excited state; Intramolecular charge transfer; Solvent effect
O641
Received:March 19,2010;Revised:April 23,2010;Published on Web:July 5,2010.
*Corresponding author.Email:liming@swu.edu.cn;Tel:+86-23-68253023.
The project was supported by the Natural Science Foundation of Chongqing,China(2009BB6002).
重庆市自然科学基金(2009BB6002)资助项目
ⒸEditorial office of Acta Physico-Chimica Sinica

